文档内容
绝密★考试结束前
2024学年第一学期期中杭州地区(含周边)重点中学
高一年级化学学科试题
考生须知:
1.本卷满分100分,考试时间90分钟;
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3.所有答案必须写在答题卷上,写在试卷上无效;
4.考试结束后,只需上交答题卷。
5.可能用到的相对原子质量:H1 C12 N14 016 Na23 S32 Cl35.5 Fe56
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是
符合题目要求的,不选、多选、错选均不得分)
1.下列消毒剂的有效成分属于盐的是
A.氯水 B.臭氧 C.漂白粉 D.酒精
2.在“加碘食盐”“含氟牙膏”“补铁剂”中,“碘、氟、铁”是指
A.元素 B.单质 C.氧化物 D.物质
3.下列化学教材演示实验中,必须要用到玻璃棒的是
A.制备Fe(OH)?胶体 B.焰色试验
C.配制一定物质的量浓度的溶液 D. KNO?溶液的导电性实验
4.我国科学家以CCl?和金属钠为原料,在 700℃时反应制得纳米级金刚石粉末和 NaCl,该成果被
评价为“稻草变黄金”。下列说法正确的是
A.纳米级金刚石粉末是胶体 B. NaCI是电解质
C. CCl?在该反应中表现出还原性 D. Na 也能从 TiCl4溶液中置换出 Ti
5.下列变化中,需要加入氧化剂才能实现的是
A. Cl?→ClO- B. Fe3+→Fe2+ C. CO?-→CO? D. Na?O→Na?O?
6. NaCl在固体、熔融状态、溶于水三种状态下的导电实验,如图所示。下列说法正确的是
x x
X_ O+ Y
Y
0
图a 图b 图c
A.图a代表固体 NaCI不能导电,因为固体NaCl中不存在离子
B. NaCl在通电情况下才能电离
C.图b中的X是与电源负极相连的电极
D.8
表示水合氯离子
高一化学试题卷 第 1 页 共8 页7.利用物质间的转化可以制备人们所需要的物质。下列转化不能通过一步化合反应完成的是
A. CuO→Cu(OH)? B. CO?→H?CO?
C. Fe(OH)?→Fe(OH)? D. Cl?→FeCl?
8.下列说法不正确的是
A.石墨和C?是碳元素的同素异形体
B.在水中能电离生成氢离子(H+)的化合物一定是酸
C.大多数非金属氧化物属于酸性氧化物,大多数金属氧化物则属于碱性氧化物
D. 豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
9.下列有关化学史的说法中,正确的是
A.我国化学工作者第一次人工合成结晶牛胰岛素,它是一种结构复杂的氨基酸
B.侯德榜发明联合制碱法是将制取小苏打和合成氨联合起来
C. 门捷列夫发现元素周期律,使化学的研究变得有规律可循
D.瑞典化学家舍勒在实验室发现并命名为氯气,开启了氯气研究的序幕
10.以下除杂方法正确的是(括号内为杂质)
A. CO?(HCl):通过饱和碳酸钠溶液
B. KNO?溶液(KOH):加入FeCl?溶液,并过滤
C. Na?CO?溶液(NaOH):加入过量CO?气体
D. FeSO?溶液(CuSO?):加入过量铁粉,并过滤
11.实验室中下列做法错误的是
A.实验中未用完的钠需放回原试剂瓶
B.用泡沫灭火器扑灭金属钠的燃烧
C.坩埚可用酒精灯直接加热
D.如果有少量酸滴到实验桌上,应立即用湿抹布擦净,然后用水冲洗抹布
12.下列说法正确的是
A. 1mol任何粒子的质量以克为单位时,其数值都与该粒子的相对原子量或相对分子质量相等
B.阿伏加德罗常数是个纯粹的数值,约为6.02×1023,没有单位
C.各种气体的气体摩尔体积都约为22.4 L mol-1
D.200ml 1 mol-L-1CaCl?溶液中Cl的物质的量和100ml2 mol-L-1KCl溶液中Cl的物质的量相等
13.下列实验装置及操作能达到实验目的的是
氯水 水 NaOH
溶液
pH试纸
植物油
FeSO?
1.0g NaOH
溶液
A.测定新制氯水 pH B.配制NaOH 溶液 C.灼烧金属钠 D.制备 Fe(OH)?
A. A B. B C. C D. D
高一化学试题卷 第 2 页 共8 页14.实验室需配制离子浓度均为1mol/L的澄清透明溶液。含下列离子的溶液中,能配制成功的是
A. K+、Na+、OH-、CO? B. Mg2+、NH4、SO2、NO?
C. Ba2+、OH-、Na+、HCO?- D. Fe3+、SCN-、H+、Cl-
15.下列有关物质的性质与用途不具有对应关系的是
A.铁粉能与O?反应,可用作食品保存的吸氧剂
B. 金属钠导热性好,可用作传热介质
C. NaClO溶液呈碱性,可用作消毒剂
D. CO具有还原性,可用于炼铁
16. NA为阿伏伽德罗常数的值,下列说法正确的是
A.常温常压下,1.5mol-L'的Na?CO?溶液中含有的Na+数目为1.5N
B.4.6gNa与0.1L1mol ·L-1盐酸充分反应,产生气体分子数目为0.5NA
C.将22.4L氯气通入水中,溶液中Cl-、ClO-、HCIO的数目之和为2NA
D.一定条件下,71g的氯气与足量的铁粉反应,转移电子数为2NA
17.电解质在溶液中的反应实质上是离子之间的反应。下列离子方程式正确的是
A.向澄清石灰水中滴加过量Ca(HCO?)2溶液:Ca2++OH+HCO?=CaCO?↓+H?O
B.物质的量浓度相同的NH?HSO?溶液与NaOH 溶液等体积混合:NH4+OH~=NH?·H?O
C.向CaCl?溶液中通入少量CO?:Ca2++CO?+H?O=CaCO?↓+2H+
D.氧化亚铁与稀盐酸反应:FeO+2H*=Fe3?+H?O
18.下列“类比”结果正确的是
A.铁能与 FeCl?溶液反应,则Zn 也能与FeCl?溶液反应
B. H?在空气中燃烧,火焰为淡蓝色,则H?在氯气中燃烧,火焰也为淡蓝色
C.向Na?CO?固体中加入少量水放出热量,则向 NaHCO?固体中加入少量水也放出热量
D. Na?O是碱性氧化物,则Na?O?也是碱性氧化物
19.实验室中利用右图装置验证铁与水蒸气反应。下列说法错误的是
A.反应为3Fe+4H?O(g)高温Fe?O?+4H? 湿棉花 铁粉
O 业
B.酒精灯移至湿棉花下方实验效果更好
C.用燃着的火柴点燃肥皂泡检验生成的氢气 O。
o
-4
D.炽热的铁水注入模具之前,模具必须充分干燥
20.下列工业制备流程中涉及的物质转化关系均可实现的是
肥皂液
A.工业制备烧碱:NaCl溶液—电解→ NaOH
第19题图
B.冶炼生铁:FeCl?溶液—过量的酮粉→Fe
C.纯碱工业:NaCl溶液CO→NaHCO?—△→Na?CO?
D.工业制备漂白粉:澄清石灰水—C→漂白粉
21.铁是用途最广泛的金属。五羰基合铁[Fe(CO)?]常温下是黄色液体,易溶于汽油、苯等多种有机
溶剂。可由金属铁粉和一氧化碳在一定条件下直接反应合成,五羰基合铁中C和O的化合价分
别为+2 和-2。利用 Fe(CO)s的生成和分解,可制得适用于做磁铁心和催化剂的高纯细铁粉。下
列有关叙述不正确的是
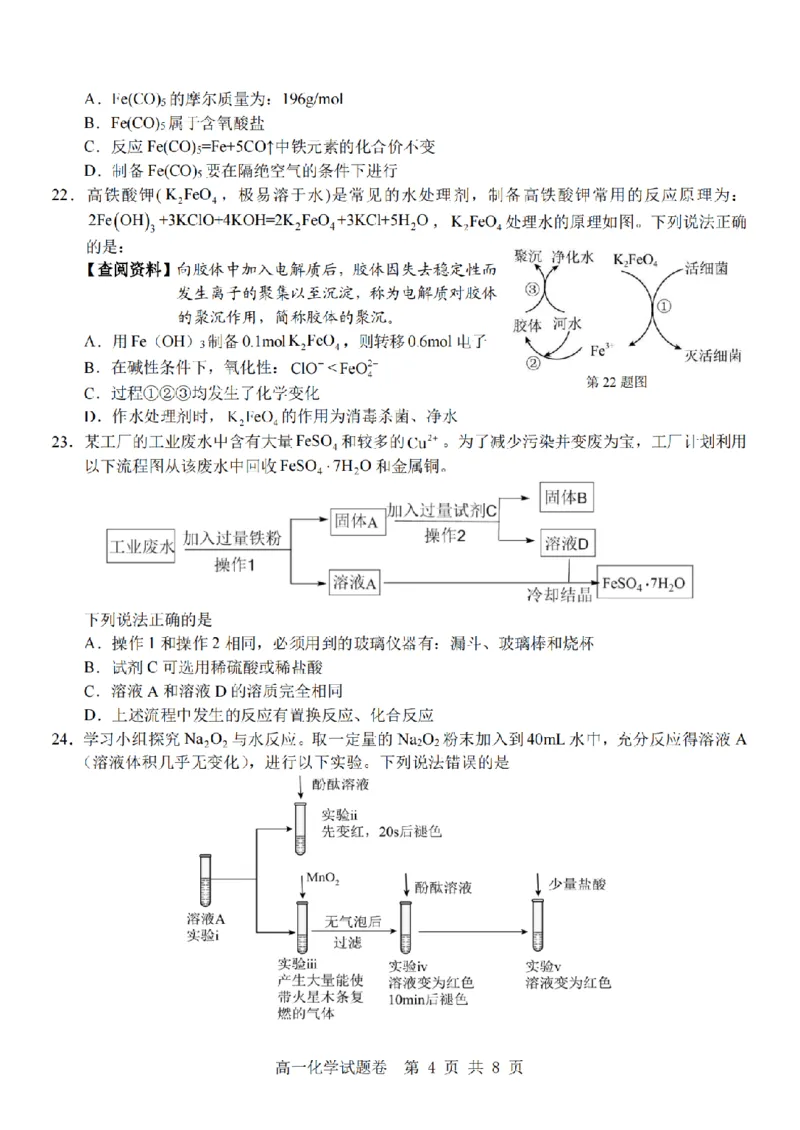
高一化学试题卷 第 3 页 共8页A. Fe(CO)s的摩尔质量为:196g/mol
B. Fe(CO)s属于含氧酸盐
C.反应 Fe(CO)s=Fe+5CO个中铁元素的化合价不变
D.制备Fe(CO)s要在隔绝空气的条件下进行
22.高铁酸钾(K?FeO?,极易溶于水)是常见的水处理剂,制备高铁酸钾常用的反应原理为:
2Fe(OH)?+3KCIO+4KOH=2K?FeO?+3KCl+5H?O,K?FeO?处理水的原理如图。下列说法正确
的是:
聚沉 净化水 K,FeO?
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而 活细菌
发生离子的聚集以至沉淀,称为电解质对胶体 ③
①
的聚沉作用,简称胶体的聚沉。 胶体 河水
A.用Fe(OH)3制备0.1molK?FeO?,则转移0.6mol电子 Fe*
灭活细菌
②
B.在碱性条件下,氧化性:ClO~Feco,烧
FeSO?溶液 铁红
冷却结晶CH,ECSO)-6H0
图1
(2)以 FeSO?为原料可制备碱式硫酸铁[Fe?(OH)?(SO?)?]、铁红、硫酸亚铁铵晶体
。
[(NH?)?Fe(SO?)?6H?O,俗名摩尔盐],转化关系如图1所示。
①制备Fe?(OH)?(SO?)?时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是 ▲
②制备FeCO?时,向 FeSO4溶液中加入过量的NH?HCO?溶液,有气体生成,该反应的离子
。
方程式为 ▲ ;FeCO?在空气中煅烧生成铁红的化学方程式为: ▲
③制备摩尔盐时,将FeSO4溶液和(NH?)?SO?溶液混合,试从溶液中离子反应发生的条件角
度分析:冷却结晶能生成(NH?)?Fe(SO?)?6H?O晶体的原因: ▲
(3)纯度分析。某兴趣小组用比色法测定(NH?)?Fe(SO?)? 6H?O产品中Fe3+杂质含量。比色法:
吸光度与溶液中有色离子的浓度成正比。查阅文献,溶液中的 Fe3+浓度与吸光度的关系如
下图所示:
高一化学试题卷 第 7 页 共8 页0.8
0.7
0.6
吸光度0.5
0.4
0.3
0.2
0.1
0
0 1 2 3 4 5 6 7 8 9 10 。
Fe3+浓度(mg/L)
该兴趣小组取所得产品硫酸亚铁铵晶体m克,配制产品溶液100mL,下图为“溶液配制”的
部分过程,操作a应重复3次,目的是_ ▲ ,定容后还需要的操作为_ ▲
操作a
(4)按文献方法配制并进行测定,产品溶液的吸光度为0.5,则该兴趣小组所得产品含 Fe3的质
量分数为_ ▲ (用含m的代数式表示)
高一化学试题卷 第 8页 共8 页2024学年第一学期期中杭州地区(含周边)重点中学
高一年级化学学科参考答案
一、选择题(本题包括25小题,每题2分,共50分。每小题只有一个选项符合题意)
题号 1 2 3 4 5 6 7 8 9 10
答案 C A C B D D A B C D
题号 1 12 13 14 15 16 17 18 19 20
答案 B A D B C D A A B A
题号 21 22 23 24 25
答案 B D A D D
二、填空题(本大题共4小题,共50分)
26.(共8分)
(1)③⑧⑩(2分)(选对2个1分,其他情况不给分)
(2)2Na+2H?O=2Na++2OH+H?(2分)(没配平1分)
(3)NaHSO?(1分) 酸式盐(1分)
(4)CD(2分)(漏选1分)
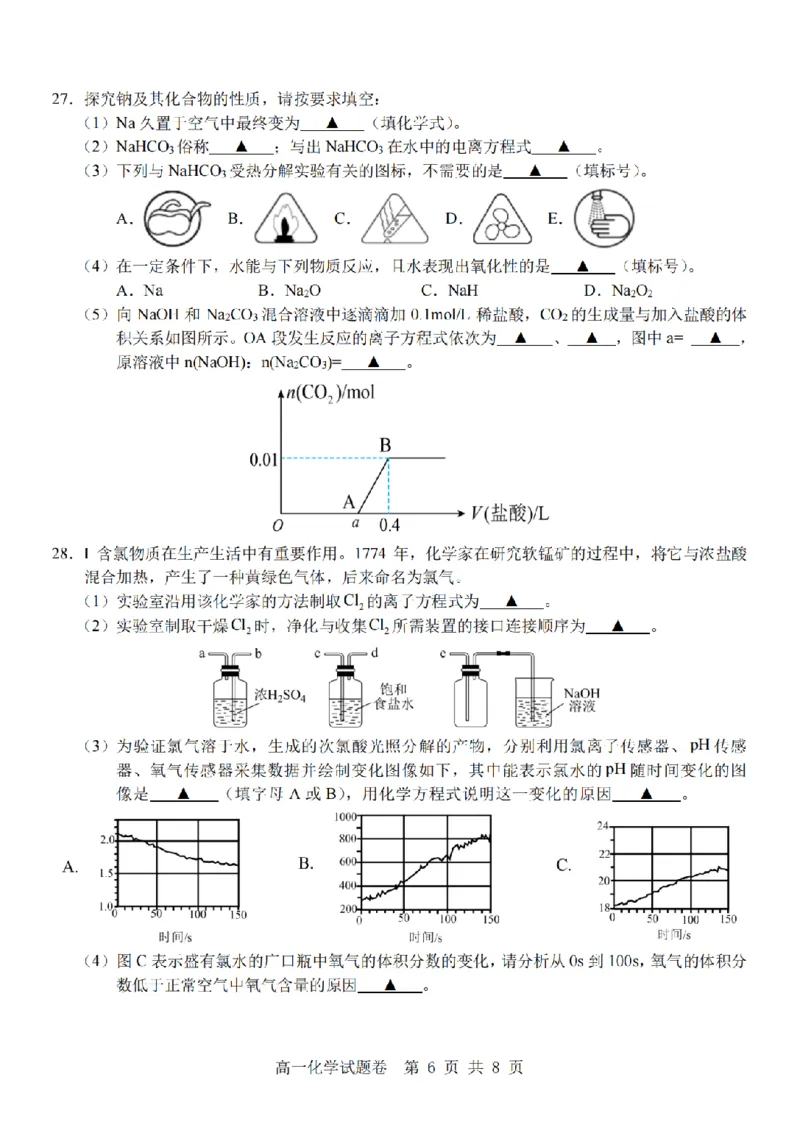
27.(共11分)
(1)Na?CO?(1分) 小苏打(1分)NaHCO?=Na*+HCO?(1分,一步即可)
(3)D(1分) (4)AC(2分)(漏选1分)
(5)H*+OH=H?O(1分) CO?+H+=HCO?(1分)) 0.3(1分) 2:1(2分)
28.(共19分)
I(1))MnO?+4Ht+2CF=Mn2++Cl?f+2H?O(2分)
(2)cdbae(1分)
(3)A(1分) 2HCIO光照2HCl+O?个(1分)
(4)氯水中的氯气挥发,使得氯水液面上方的空气中含有氯气,氧气体积分数降低。(2分)
I(5)Cl?+2OH-=ClO-+Cl-+H?O(2分) 避免生成NaClO?,提高NaClO的产量(2分)
(6)AC(2分)(漏选1分)
(7)过滤 (1分) 洗涤(1分)
(8)2KCO?+So?=2CIO?+K?SO?(2分)(产物1分,单线桥1分)
取少量处理后的
溶液于试管,滴加硝酸酸化过的硝酸银溶液,若有白色沉淀产生,则证明存在Cl,反之
则没有(2分)
高一化学参考答案 第 1 页 共 2 页29.(共12分)
(1)加适量铁粉(1分)
(2)①部分Fe3+转化为Fe(OH)?沉淀(1分)
②Fe2++2HCO?=FeCO?J+CO?T+H?O(2分) 4FeCO?+O2煅烧2Fe?O?+4CO?(2分)
③在相同温度下,(NH?)?Fe(SO?)?6H?O(或者摩尔盐)的溶解度最小,降温结晶,沉淀
析出,符合反应发生的条件(2分)
(3)将溶质全部转移到容量瓶中(1分) 摇匀、(装瓶)(有摇匀就1分)
(4)7×10或者7×10?分)
高一化学参考答案 第 2 页 共 2 页