文档内容
第二章 第一节 第3课时 碳酸钠 碳酸氢钠 焰色试验 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共60分)
1. 关于NaCO 和NaHCO 的说法正确的是( )
2 3 3
A.向两者的溶液中加入BaCl 均生成白色沉淀
2
B.向两者的溶液中逐滴加入稀盐酸,反应现象完全相同
C.NaCO 和NaHCO 两物质之间可以相互转化
2 3 3
D.向饱和的NaCO 溶液中通入足量的CO 气体,观察不到任何实验现象
2 3 2
2. 可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加稀BaCl 溶液有白色沉淀生成
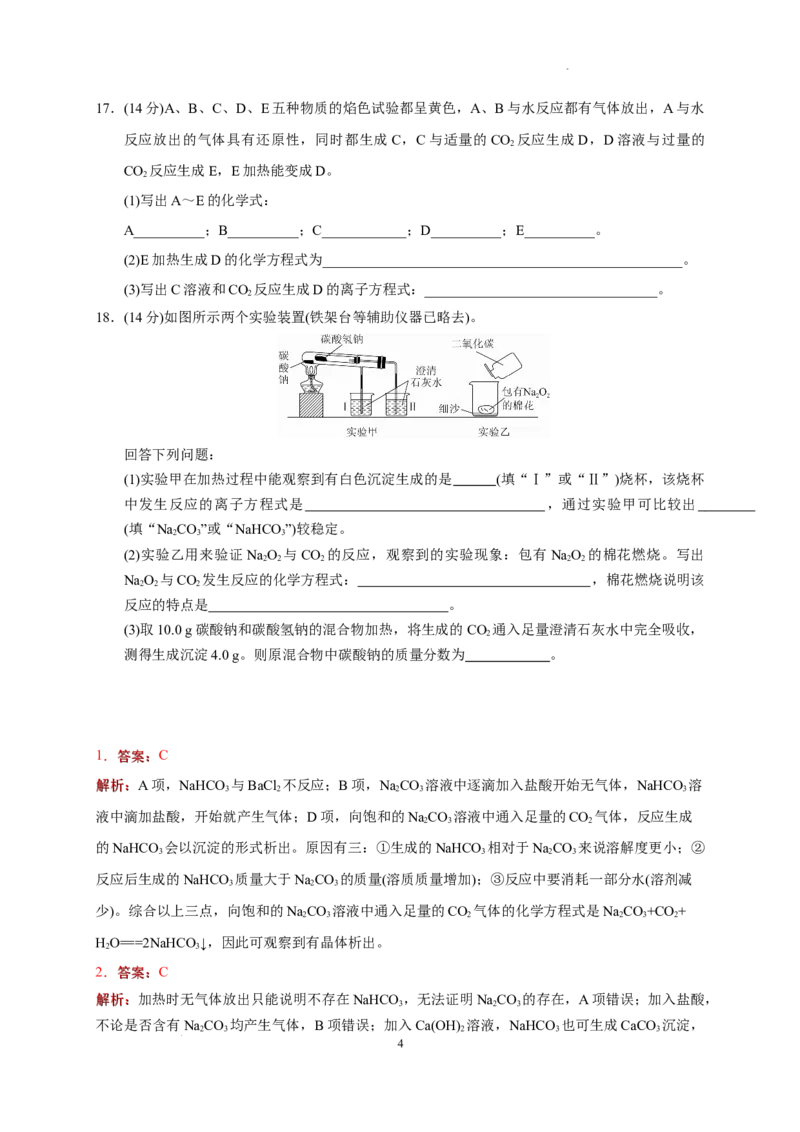
2
D.溶于水后滴加澄清石灰水有白色沉淀生成
3.人们在烟花中加入特定金属元素,使焰火更加绚丽多彩。下列关于焰色试验的说法中正确的是(
)
A.烟花中通常加入铂、铁、钾、钙、铜等特定金属元素作为发色剂,使焰火更加绚丽多彩
B.焰色试验是一种物理变化
C.灼烧某无色溶液,火焰呈黄色,证明原溶液中有Na+,无K+
D.灼烧某物质时,火焰呈黄色,该物质一定是钠的化合物
4. 下列有关NaCO 和NaHCO 的性质比较中,正确的是( )
2 3 3
A.热稳定性:NaCONaHCO ,A错;常温时水溶液中的溶解度:NaCO>NaHCO ,B错;
2 3 3 2 3 3
质量相同时,消耗盐酸的量:NaCO>NaHCO,D错。
2 3 3
5.答答案案::D
解解析析::钠的焰色是黄色,K的焰色是紫色,观察K的焰色时需要透过蓝色钴玻璃,以滤去黄色光的
干扰。该实验中没有透过蓝色钴玻璃观察,说明一定含有Na+,不能确定是否含有K+。
6.答答案案::CC
解解析析::A项,发生的反应分别为NaCO+Ca(OH) ===CaCO ↓+2NaOH,2NaHCO +Ca(OH) ===
2 3 2 3 3 2
CaCO ↓+NaCO+2HO,两者现象相同(产生白色沉淀);B项,滴加等浓度的稀盐酸时,NaHCO
3 2 3 2 3
溶液反应更剧烈;C项,NaCO 与CaCl 发生反应NaCO+CaCl ===CaCO ↓+2NaCl,产生白色沉
2 3 2 2 3 2 3
淀,NaHCO 与CaCl 不反应;D项,逐滴加入等浓度的盐酸时,NaHCO 立即产生气泡,NaCO 开
3 2 3 2 3
始无气泡产生,过一会儿才产生气泡。
7.答答案案::BB
解解析析::硫在空气中燃烧,火焰呈淡蓝色,A错误;因焰色试验是元素的性质,只要含有的金属元素
相同,无论是单质还是化合物,其灼烧时火焰颜色都相同,B正确;只有钾的焰色试验的观察需要
透过蓝色钴玻璃滤去黄光,C错误;并不是所有金属及其化合物灼烧时火焰都有颜色,如铂灼烧时
火焰为无色,D错误。
8.答答案案::DD
解解析析::Ba(OH) +NaSO ===BaSO ↓+2NaOH,虽除去了NaSO ,但又增加了新的杂质NaOH,并
2 2 4 4 2 4
且NaCO 溶液也能与Ba(OH) 溶液反应。
2 3 2
9.答答案案::C
解解析析::取一根铂丝,用盐酸洗净后,放在酒精灯上灼烧至无色,再蘸取被检验物质,进行焰色试验,
故A正确;在观察钾的焰色试验时要透过蓝色钴玻璃片,滤去钠的黄光的干扰,故B正确;为了能
够更加突出被检验试剂的颜色,选用本身颜色较浅的火焰,最大限度减少火焰本身颜色的干扰,故
C错误;洁净的细铁丝放在酒精灯上灼烧至无色,本身无颜色,故可用铁丝进行焰色试验,故D正
确。
10.答答案案::BB
5
学科网(北京)股份有限公司解解析析::本题可以从Na+守恒角度考虑。无论NaHCO 是直接与盐酸反应,还是先加热分解再与盐酸
3
反应,Na+的量不变,生成的NaCl的量相等,则消耗盐酸的量相等。
11.答答案案::AA
解解析析::A项,碳酸钠与酸反应首先会产生碳酸氢钠,然后是碳酸氢钠与酸反应产生醋酸钠、二氧化
碳和水,而碳酸氢钠中加入酸立即放出气体,所以根据反应放出气体的快慢可区分碳酸钠和碳酸氢
钠,正确;B项,纯碱和小苏打都是钠盐,焰色试验的火焰都为黄色,不能区别二者,错误;C项,
二者都能与氢氧化钙溶液发生反应产生碳酸钙白色沉淀,不能区别它们,错误;D项,碳酸钠稳定,
受热不易分解,碳酸氢钠不稳定,受热分解产生碳酸钠、二氧化碳和水,也有固体残留物,所以不
能区分二者,错误。
12.答答案案::B
解解析析::必须通过焰色反应才能鉴别,则阴离子相同,阳离子为不同活泼金属离子,以此来解答。
A.利用盐酸可检验,碳酸钠和盐酸反应产生气体,氯化钾不反应,A错误;B.阴离子相同,只
能利用焰色反应检验,B正确;C.阴离子相同,但可利用碳酸钾或碳酸钠检验,其中氯化钙反应
产生碳酸钙沉淀,氯化钠不反应,C错误;D.利用盐酸可检验,碳酸钾和盐酸反应产生气体,氯
化钙不反应,D错误;答案选B。
13.答答案案::CC
解解析析::A选项中采用差量法,减少的质量为碳酸氢钠分解生成二氧化碳和水的质量,由此可求出碳
酸氢钠的质量,进而求出碳酸钠的质量分数;B选项中b g固体为生成的氯化钠的质量,根据钠原
子守恒和混合物总质量可列式计算出碳酸钠的质量,进而求出碳酸钠的质量分数;C选项中碱石灰
增加的质量为盐与酸反应生成的二氧化碳的质量及溶液中挥发出来的水蒸气的质量,因此不能通过
数据准确计算出碳酸钠的质量分数;D选项中沉淀的质量即为碳酸钡的质量,根据碳酸钡的质量和
混合物总质量可以列式求出碳酸钠的质量,进而求出碳酸钠的质量分数。
14.答答案案::D
解解析析::A项,在大试管中存有一定量的空气,若Na与水的反应是放热反应,放出的热量使空气膨
胀,导致U形管中的红墨水左侧液面下降,右面液面上升,正确;B项,NaO 与HO反应生成的
2 2 2
O 能使带火星的木条复燃,正确;C项,进行焰色试验可以用光洁无锈的铁丝或铂丝蘸待测溶液,
2
然后在酒精灯的火焰上灼烧,若观察到火焰呈黄色,就证明在纯碱中含有钠元素,正确;D项,比
较NaCO 、NaHCO 的热稳定性,应该把NaHCO 放在内管,把NaCO 放在外管,若观察到与内
2 3 3 3 2 3
管连接的澄清石灰水变浑浊,就证明稳定性NaCO>NaHCO,错误。
2 3 3
15.答答案案::A
解解析析::根据NaHCO 受热分解的化学方程式,结合反应前后固体的质量差可列式求解:
3
2NaHCO NaCO+H O↑+CO↑ Δm
3 2 3 2 2
6
学科网(北京)股份有限公司2×84 g 106 g 18 g 44 g 62 g
m(NaHCO ) (w −w ) g
3 1 2
求出m(NaHCO ),即可得出样品的纯度。
3
16.答案: (1)通入足量CO 气体 NaCO+CO+HO===2NaHCO
2 2 3 2 2 3
(2)加入适量盐酸 NaCO+2HCl===2NaCl+CO↑+HO
2 3 2 2
(3)加入适量Ca(OH) 溶液,然后过滤 NaCO+Ca(OH) ===CaCO ↓+2NaOH
2 2 3 2 3
解析:本题考查NaCO 和NaHCO 的化学性质、除杂方法及试剂的选用。除杂时注意不要引入其
2 3 3
他杂质离子。
17.答案: (1)Na NaO NaOH NaCO NaHCO
2 2 2 3 3
(2)2NaHCO Na CO+CO↑+HO
3 2 3 2 2
(3)CO +2OH-===CO 2-+HO
2 3 2
解析:首先根据五种物质的焰色试验都呈黄色,可以推断出五种物质都含有钠元素;A、B与水反应
都有气体放出,可以推断出A和B是过氧化钠和金属钠中的一种,二者生成的气体分别是氧气和氢
气,氢气具有还原性,故A是钠,B是过氧化钠,生成的C则是氢氧化钠;再由题意可以推断出D
是碳酸钠,E是碳酸氢钠。
18.答案: (1) Ⅱ Ca2++2OH-+CO===CaCO ↓+HO NaCO
2 3 2 2 3
(2) 2Na O+2CO===2Na CO+O NaO 与CO 反应放出O 并产生大量的热
2 2 2 2 3 2 2 2 2 2
(3)32.8%
解析: (1)NaHCO 受热易分解产生CO :2NaHCO =====NaCO +CO↑+HO,使澄清石灰水变浑
3 2 3 2 3 2 2
浊;而NaCO 较稳定,受热不分解。(2)Na O 与CO 反应产生O 2NaO +2CO===2Na CO +O ,
2 3 2 2 2 2, 2 2 2 2 3 2
并放出大量的热,故能使棉花燃烧。
(3)NaHCO 与CaCO 存在如下关系:
3 3
2NaHCO ~ CaCO
3 3
168 g 100 g
m(NaHCO ) 4.0 g m(NaHCO )=6.72 g
3 3
则m(Na CO)=10.0 g-6.72 g=3.28 g,其溶质质量分数为×100%=32.8%。
2 3
7
学科网(北京)股份有限公司8
学科网(北京)股份有限公司