文档内容
人教版(2019)高一必修第一册 第二章 海水中的重要元素
第一节 钠及其化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.用焰色试验检验 时的操作有:①蘸取待测液;②置于酒精灯火焰上灼烧;③透过
蓝色钴玻璃观察;④用稀盐酸洗净铂丝。正确的操作顺序为
A.①②③④ B.④②①②③ C.④①② D.①③②④
2.下列关于金属钠的叙述中,正确的是( )
A.Na应保存在煤油中 B.Na在常温下,与空气中氧气不反应,
所以Na不活泼
C.Na硬度大、熔点高 D.Na在空气中燃烧,发出黄色火焰,
产物是NaO
2
3.下列说法正确的是
A.钠长期暴露在空气中的最终产物是
B.金刚石不导电,石墨导电,故二者不互为同素异形体
C.胶体的本质特征是具有丁达尔效应
D.过氧化钠与水反应后的试液中滴入酚酞,试液变红
4.下列关于金属钠的叙述错误的是
A.金属钠可以保存在煤油中
B.钠元素只能以化合物的形式存在于自然界中
C.实验室取用并切割金属钠只需要3种用品
D.钠元素在自然界中主要以NaCl的形式存在
5.下列叙述正确的是
A. 的热稳定性比 强 B.钢铁在潮湿空气中生锈主要是发生了
化学腐蚀
C. 中加入过量的 溶液可以得到 D.高压钠灯可用于道路照明
6.下列实验方法能达到目的是
A.用焰色反应鉴别NaCO 溶液和NaCl溶液
2 3
B.用分液漏斗分离食醋中的乙酸与水
C.用结晶的方法分离氯化钠和硝酸钾的混合物D.用NaOH溶液除去Cl 中混有的少量HCl
2
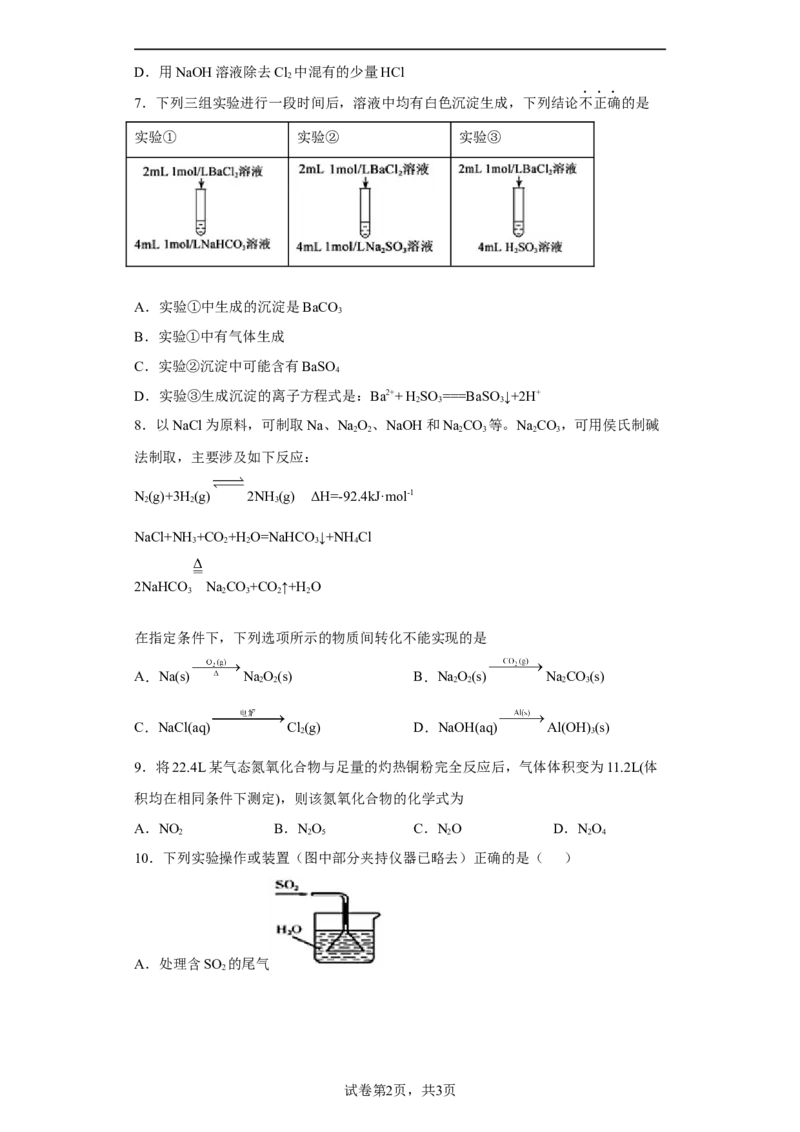
7.下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① 实验② 实验③
A.实验①中生成的沉淀是BaCO
3
B.实验①中有气体生成
C.实验②沉淀中可能含有BaSO
4
D.实验③生成沉淀的离子方程式是:Ba2++ H SO ===BaSO ↓+2H+
2 3 3
8.以NaCl为原料,可制取Na、NaO、NaOH和NaCO 等。NaCO,可用侯氏制碱
2 2 2 3 2 3
法制取,主要涉及如下反应:
N(g)+3H(g) 2NH (g) ΔH=-92.4kJ·mol-1
2 2 3
NaCl+NH +CO +H O=NaHCO ↓+NHCl
3 2 2 3 4
2NaHCO NaCO+CO ↑+H O
3 2 3 2 2
在指定条件下,下列选项所示的物质间转化不能实现的是
A.Na(s) NaO(s) B.NaO(s) NaCO(s)
2 2 2 2 2 3
C.NaCl(aq) Cl(g) D.NaOH(aq) Al(OH) (s)
2 3
9.将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积变为11.2L(体
积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO B.NO C.NO D.NO
2 2 5 2 2 4
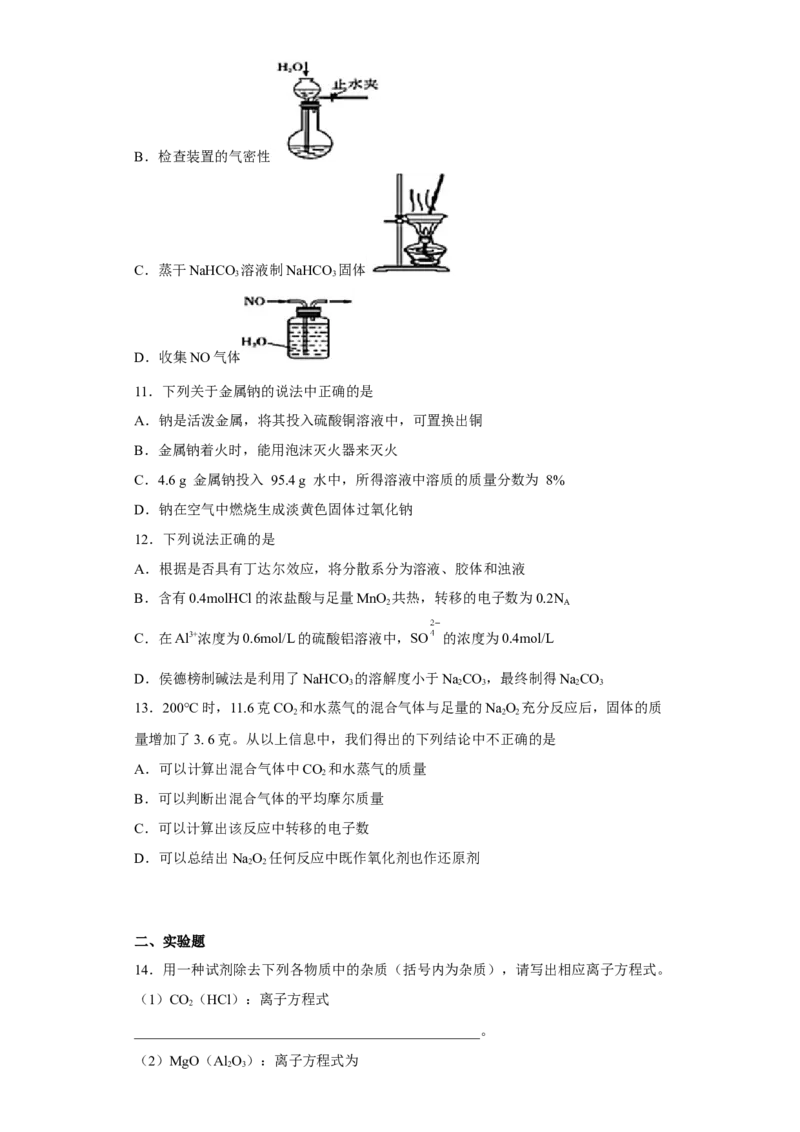
10.下列实验操作或装置(图中部分夹持仪器已略去)正确的是( )
A.处理含SO 的尾气
2
试卷第2页,共3页B.检查装置的气密性
C.蒸干NaHCO 溶液制NaHCO 固体
3 3
D.收集NO气体
11.下列关于金属钠的说法中正确的是
A.钠是活泼金属,将其投入硫酸铜溶液中,可置换出铜
B.金属钠着火时,能用泡沫灭火器来灭火
C.4.6 g 金属钠投入 95.4 g 水中,所得溶液中溶质的质量分数为 8%
D.钠在空气中燃烧生成淡黄色固体过氧化钠
12.下列说法正确的是
A.根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液
B.含有0.4molHCl的浓盐酸与足量MnO 共热,转移的电子数为0.2N
2 A
C.在Al3+浓度为0.6mol/L的硫酸铝溶液中,SO 的浓度为0.4mol/L
D.侯德榜制碱法是利用了NaHCO 的溶解度小于NaCO,最终制得NaCO
3 2 3 2 3
13.200°C时,11.6克CO 和水蒸气的混合气体与足量的NaO 充分反应后,固体的质
2 2 2
量增加了3. 6克。从以上信息中,我们得出的下列结论中不正确的是
A.可以计算出混合气体中CO 和水蒸气的质量
2
B.可以判断出混合气体的平均摩尔质量
C.可以计算出该反应中转移的电子数
D.可以总结出NaO 任何反应中既作氧化剂也作还原剂
2 2
二、实验题
14.用一种试剂除去下列各物质中的杂质(括号内为杂质),请写出相应离子方程式。
(1)CO(HCl):离子方程式
2
_________________________________________________。
(2)MgO(Al O):离子方程式为
2 3______________________________________________。
(3)NaCO 溶液(NaHCO ):离子方程式
2 3 3
________________________________________。
(4)NaHCO 溶液(NaCO):离子方程式
3 2 3
_______________________________________。
15.研究小组探究NaO 与水反应。向1.56gNa O 粉末中加入40mL水,充分反应得溶
2 2 2 2
液A(溶液体积变化忽略不计),进行实验。
实验1:向2mL溶液A中滴入1滴酚酞,溶液变红色,20秒后褪色。
(1)Na O 与HO反应的化学方程式为___。溶液A中NaOH溶液的物质的量浓度为___。
2 2 2
(2)对实验1中溶液红色褪去的原因进行探究。
【查阅资料】
资料:HO 是一种在碱性条件下不稳定、具有漂白性的物质。
2 2
【提出猜想】
猜想1:NaO 与HO反应可能生成了HO
2 2 2 2 2
猜想2:生成的NaOH浓度太大
【设计并进行实验】
①实验2:向2mL溶液A中加入黑色粉末___(填化学式),快速产生了能使带火星木条
复燃的气体。
②实验3:向2mL物质的量浓度为___mol/LNaOH溶液中滴入1滴酚酞,溶液变红色,
10分钟后溶液褪色。向褪色的溶液中加入___,溶液变红色。
【得出结论】
③由以上实验可得出的结论是___。
【反思与评价】
(3)分析实验结果可知,NaO 与HO反应的化学方程式如果分两步书写,应为___、
2 2 2
___,但课本上没有写出中间产物HO,可能的原因是___。
2 2
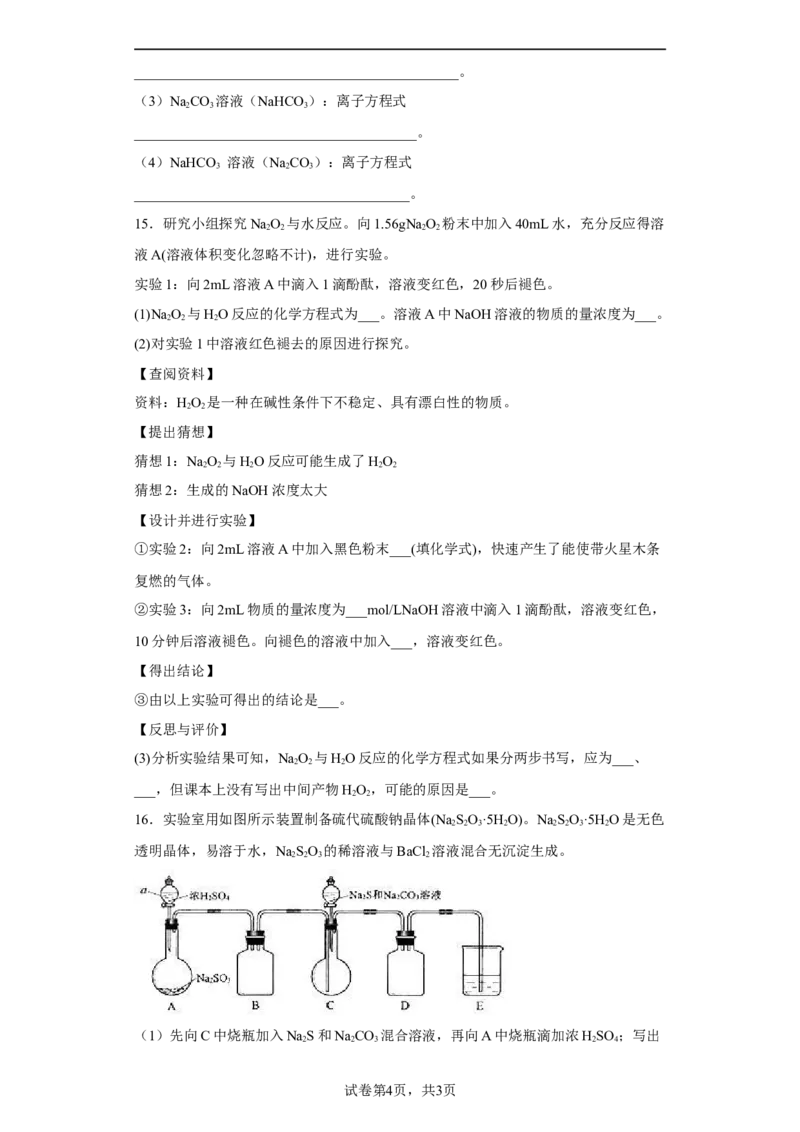
16.实验室用如图所示装置制备硫代硫酸钠晶体(Na SO·5H O)。NaSO·5H O是无色
2 2 3 2 2 2 3 2
透明晶体,易溶于水,NaSO 的稀溶液与BaCl 溶液混合无沉淀生成。
2 2 3 2
(1)先向C中烧瓶加入NaS和NaCO 混合溶液,再向A中烧瓶滴加浓HSO ;写出
2 2 3 2 4
试卷第4页,共3页A中发生反应的化学方程式:______________________。
(2)当NaS和NaCO 完全消耗后,结束反应;过滤C中混合物,滤液经过
2 2 3
__________(填操作名称)、结晶、过滤、洗涤、干燥,得到产品;洗涤晶体的操作方法
是________________________;
(3)为了防止污染环境,E中应加入的试剂为__________(填序号);
A.稀HSO B.NaOH溶液 C.饱和NaHSO 溶液
2 4 3
(4)该法制得的晶体中常混有少量NaSO 和NaSO 的杂质。
2 3 2 4
①取适量产品配成稀溶液,滴加足量BaCl 溶液,有白色沉淀生成,过滤,用蒸馏水洗
2
涤沉淀,________(填写操作步骤和实验现象),则可确定产品中含有NaSO 和
2 3
NaSO 。(所需试剂从稀HNO、稀HSO 、稀HCl、蒸馏水中选择)
2 4 3 2 4
②为减少装置C中生成NaSO 的量,在不改变原有装置的基础上对实验步骤(2)进
2 4
行了改进,改进后的操作是________________;
(5)利用硫代硫酸钠跟I 反应的性质可定量测定硫代硫酸钠样品的纯度。现取Wg硫
2
代硫酸钠样品配制成VmL的溶液,加入指示剂,用含I 为amol/L的碘水进行滴定,
2
耗用碘水bmL。(已知:2NaSO+I =Na SO+2NaI)
2 2 3 2 2 4 6
①滴定过程中指示剂应选用___________溶液;
②样品中硫代硫酸钠(Na SO·5H O)纯度的表达式是________________。
2 2 3 2
17.某兴趣小组进行钠的性质实验。回答下列问题:
I.钠与水反应的实验:将一小块钠投进预先滴有酚酞的水中。
(1)少量的钠保存在_______中,钠着火时应采取的灭火措施是_______。
(2)能说明该反应放热的实验现象有_______。
II.钠与CO 反应的实验:将燃烧的钠迅速伸入到盛有装满CO 的集气瓶中,钠继续燃
2 2
烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(3)对钠在CO 气体中燃烧后生成的白色物质进行了如下探究:
2
[提出假设]
假设1:白色物质是NaO。
2
假设2:白色物质是NaCO
2 3。
假设3:_______。
[方案设计]
实验
实验操作 实验现象 结论
方案
方案 取少量白色物质于试管中,加入适量水,振荡, 溶液变成
_______
1 样品全部溶于水,向其中加入无色酚酞试液 红色
方案 ①取少量白色物质于试管中,加入适量水,振 出现白色 白色物质含有荡,样品全部溶于水,向其中加入过量
沉淀 NaCO
_______。 2 3
2
②静置片刻,取上层清液于试管中,滴加少量 白色物质不含
_______
_______。 有NaO
2
[思考与交流]
(4)根据上述现象与结论推测钠在二氧化碳中燃烧的化学方程式为_______。
三、元素或物质推断题
18.室温下,单质A、单质B,单质C分别为固体、黄绿色气体、无色气体。在一定
条件下,它们之间的转化关系如图所示,已知E溶液是无色的。请回答下列问题:
(1)A是______(填化学式,下同),B是______,C是______。
(2)反应①的化学方程式为______。
(3)反应③的离子方程式为______。
(4)反应④的离子方程式为______。
(5)B与水反应的离子方程式______。
试卷第6页,共3页参考答案:
1.B
【详解】根据焰色试验的操作步骤:洗、烧、蘸、烧、观,所以正确的操作顺序为:用稀
盐酸洗净铂丝,置于酒精灯火焰上灼烧,蘸取待测液,置于酒精灯火焰上灼烧,过蓝色钴
玻璃观察,故选B。
2.A
【详解】A.Na性质活泼,与氧气、水等发生化学反应,保存时要隔绝空气,因此Na应
保存在煤油中,故A正确;
B.钠活泼,常温下,Na与氧气反应生成氧化钠,故B错误;
C.Na是银白色金属、硬度小、熔点低,故C错误;
D..Na在空气中燃烧生成NaO,发出黄色火焰,故D错误;
2 2
故选A。
3.A
【详解】A.钠长期暴露在空气中会生成氧化钠,继续和空气中的水蒸气反应生成氢氧化
钠,再和空气中的二氧化碳反应,最终生成 NaCO,A正确;
2 3
B.金刚石和石墨互为同素异形体,和导电性无关,B错误;
C.胶体的本质特征是其分散系中分散质的颗粒直径在1~100nm,C错误;
D.过氧化钠与水反应后的会生成过氧化氢,过氧化氢具有漂白性,往溶液中滴入酚酞,
溶液先变红后褪色,D错误;
故选A。
4.C
【详解】A.金属钠在空气中会被氧化,由于钠的密度比煤油的大,金属钠可以保存在煤
油中,以隔绝空气,故A正确;
B.金属钠的性质活泼,在自然界中都以化合物的形式存在,故B正确;
C.实验室取用并切割金属钠时,需要用镊子夹取钠,用滤纸吸干钠表面的煤油或液体石
蜡,用小刀切割,用玻璃片或培养皿中切割,所以所需的用品至少有4种,故C错误;
D.钠元素在自然界中主要以NaCl的形式存在,故D正确;
答案选C。
5.D
【详解】A.2NaHCO NaCO+H O+CO↑,而NaCO 不分解,故NaHCO 的热稳定性比
3 2 3 2 2 2 3 3
NaCO 弱,A错误;
2 3B.钢铁在潮湿空气中形成了Fe、C和CO 溶于水形成的电解质溶液,能够形成许多微小
2
的原电池,故生锈主要是发生了电化学腐蚀,B错误;
C.由于铁能与过量的FeCl 溶液,故Mg中加入过量的FeCl 溶液得不到Fe,该反应的离
3 3
子方程式为:Mg+2Fe3+=Mg2++2Fe2+,C错误;
D.高压钠灯产生黄色的光,透雾能力强,故可用于道路照明,D正确;
故答案为:D。
6.C
【详解】A.Na元素的焰色反应为黄色,则焰色反应不能鉴别NaCO 溶液和NaCl溶液,
2 3
故A错误;
B.乙酸与水互溶,则不能利用分液漏斗分离,应选蒸馏法,故B错误;
C.氯化钠和硝酸钾的溶解度受温度影响变化不同,可用结晶的方法分离氯化钠和硝酸钾
的混合物,故C正确;
D.氯气、HCl均与NaOH溶液反应,不能除杂,应选饱和食盐水,故D错误;
答案选C。
7.D
【详解】A. 碳酸氢钠溶液中存在碳酸氢根离子的电离过程,电离生成的碳酸根离子能够与
钡离子反应生成碳酸钡沉淀,故A正确;
B. 实验①中形成沉淀时促进碳酸氢根离子的电离,溶液的酸性逐渐增强,氢离子与碳酸氢
根离子反应放出二氧化碳气体,故B正确;
C. 实验②中亚硫酸钠与氯化钡反应生成亚硫酸钡沉淀,亚硫酸钡被空气中的氧气氧化生成
硫酸钡,故C正确;
D. 实验③中,如果发生Ba2++ H SO ===BaSO ↓+2H+,生成的亚硫酸钡能够被氢离子溶解,
2 3 3
应该是亚硫酸被氧化生成了硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,故D错误;
故选D。
8.D
【详解】A.2Na+O NaO,则Na(s) NaO(s)可以实现,A不合题意;
2 2 2 2 2
B.2NaO+2CO =2Na CO+O ,则NaO(s) NaCO(s)可以实现,B不合题意;
2 2 2 2 3 2 2 2 2 3
答案第2页,共2页C.2NaCl+2H O 2NaOH+Cl ↑+H ↑,则NaCl(aq) Cl(g)可以实现,C不合题
2 2 2 2
意;
D.2Al+2NaOH+2H O=2NaAlO +3H ↑,则NaOH(aq) Al(OH) (s)不能实现,D符合
2 2 2 3
题意;
故答案为:D。
9.A
【详解】假设该气态氮氧化合物的化学为NxOy,则其与灼热的铜粉所发生的反应为
2NxOy+2yCu 2yCuO+xN,相同条件下气体体积之比等于气体物质的量之比,也等于其
2
发生反应的方程式中气体的计量数之比,则气体由22.4L减少到11.2L,则反应后气体体积
为反应前气体体积的一半,2:x=2:1,即可以得到x=1,结合选项应为NO ,即发生
2
4Cu+2NO 4CuO+N,
2 2
答案选A。
10.B
【详解】A.漏斗口应贴近液面,否则不能起到防倒吸的作用,故A错误;
B.利用压强差原理检验气密性,关闭止水夹,如长颈漏斗颈形成一段水柱,如液面不变
化,可说明气密性良好,故B正确;
C.NaHCO 固体易分解,不能直接蒸干,故C错误;
3
D.收集气体,应从短导管进,将液体从长导管排出,故D错误。
故答案为B。
【点睛】考查化学实验方案的评价,把握物质的性质、物质的制备、实验技能为解答的关
键,侧重分析与实验能力的考查,注意实验的评价性分析,易错点是C中容易忽视碳酸氢
钠受热分解,难点是排水集气法时气体的流向,应该是短进长出。
11.D
【详解】A.钠投入硫酸铜溶液中,实质上是钠先与水反应生成氢氧化钠和氢气,氢氧化
钠再与硫酸铜发生复分解反应生成蓝色Cu(OH) 沉淀,不能置换出铜,故A错误;
2B.钠与水反应生成易爆性的氢气,加之钠着火生成的过氧化钠能跟水或二氧化碳反应产
生氧气,使燃烧更加剧烈,故B错误;
C.4.6 g钠与水反应生成溶质氢氧化钠的质量为8 g,氢气的质量为0.2 g,溶液的质量为
4.6 g+95.4 g-0.2 g=99.8 g,故溶液中溶质的质量分数大于8%,故C错误;
D.点燃下、钠与氧气反应生成过氧化钠,则钠在空气中燃烧生成淡黄色固体过氧化钠,
故D正确;
故选D。
12.D
【详解】A.根据是粒子直径大小,将分散系分为溶液、胶体和浊液,A项错误;
B. 只和浓盐酸反应,随着反应的进行浓盐酸变成稀盐酸,反应不能进行完全,B项
错误;
C.在 浓度为 的硫酸铝溶液中, 的浓度为 ,C项错误;
D.侯德榜制碱法其利用了 的溶解度小于 ,最终制得 ,D项正确;
答案选D。
13.D
【详解】A、设COag ,水蒸气bg
2
2CO+ 2Na O = 2Na CO + O m(质量差)
2 2 2 2 3 2
88 56
a x
x=7a/11g
2NaO+2H O =4NaOH+O m(质量差)
2 2 2 2
36 4
b y
y=b/9g
a+b=11.6
7a/11+b/9=3.6
a=4.4g,b=7.2g,
n(CO)=4.4/44=0.1mol,n(H O)=7.2/18=0.4mol,CO 和HO的物质的量比=0.1:0.4=1:4,
2 2 2 2
答案第4页,共2页所以,可以计算出混合气体中CO 和水蒸气的质量分别是4.4g和7.2g,A正确;
2
B、可以判断出混合气体的平均摩尔质量(4.4g+7.2g)÷(0.1mol+0.4mol)=23.2g/mol,故
B正确;
C、可以计算出该反应中转移的电子数0.1mol+0.4mol=0.5mol;
D、NaO 中-1价的氧既可升高,也可降低,但在某些反应中只作氧化剂,在另一些反应中
2 2
只作还原剂,故D错误。
答案选D。
14. HCO - + H+ = CO↑+ H O Al O+2OH- = 2AlO - + H O HCO - + OH- =
3 2 2 2 3 2 2 3
CO2- + H O CO2- + CO+H O = 2HCO -
3 2 3 2 2 3
【分析】(1)利用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢;
(2)根据氧化铝是两性氢氧化物分析解答;
(3)根据碳酸氢钠能与氢氧化钠反应生成碳酸钠和水分析解答;
(4)根据碳酸钠溶液能吸收二氧化碳生成碳酸氢钠分析。
【详解】(1)除去CO 中的HCl,可以用饱和的碳酸氢钠溶液,离子方程式为HCO -
2 3
+H+=CO↑+H O;
2 2
(2)除去MgO中的Al O,可以用氢氧化钠溶液,离子方程式为Al O+2OH-=2AlO-
2 3 2 3 2
+H O;
2
(3)除去NaCO 溶液中的NaHCO ,可以用氢氧化钠溶液,离子方程式为CO-+OH-=
2 3 3 3
CO2-+H O;
3 2
(4)除去NaHCO 溶液中的NaCO,可以向溶液中通入足量的二氧化碳,离子方程式为
3 2 3
CO2-+CO +H O=2HCO -。
3 2 2 3
15.(1) 2NaO+2H O=4NaOH+O ↑ 1mol·L-1
2 2 2 2
(2) MnO 1 一定量的水 HO 与NaOH共同作用使溶液红色褪去,过氧化
2 2 2
氢起主要作用
(3) NaO+2H O=2NaOH+H O 2HO=2H O+O↑ HO 在碱性条件下不稳定,易分
2 2 2 2 2 2 2 2 2 2 2
解,HO 大部分已分解
2 2
【解析】(1)
NaO 与HO反应生成氢氧化钠和氧气,其反应的化学方程式为
2 2 2
2NaO+2H O=4NaOH+O ↑;1.56gNa O 粉末即物质的量为0.02mol,生成0.04molNaOH,
2 2 2 2 2 2则溶液A中NaOH溶液的物质的量浓度为 ;故答案为:
2NaO+2H O=4NaOH+O ↑;1mol·L-1。
2 2 2 2
(2)
①实验2:根据双氧水在二氧化锰作用下分解生成氧气和水,即向2mL溶液A中加入黑色
粉末MnO ,快速产生了能使带火星木条复燃的气体;故答案为:MnO 。
2 2
②原溶液中NaOH的浓度为1mol·L-1,为了验证试验,因此也要用同样浓度的NaOH溶液,
即实验3:向2mL物质的量浓度为1 mol/LNaOH溶液中滴入1滴酚酞,溶液变红色,10分
钟后溶液褪色。可能碱的浓度较大,使酚酞褪色,向褪色的溶液中加入一定量的水,溶液
稀释了,则溶液变红色;故答案为:1;一定量的水。
③双氧水有漂白性,浓的NaOH溶液能漂白酚酞,因此由以上实验可得出的结论是HO 与
2 2
NaOH共同作用使溶液红色褪去,过氧化氢起主要作用;故答案为:HO 与NaOH共同作
2 2
用使溶液红色褪去,过氧化氢起主要作用。
(3)
分析实验结果可知,NaO 与HO反应的化学方程式可以理解为先生成双氧水,再是双氧
2 2 2
水分解生成水和氧气,如果分两步书写,应为NaO+2H O=2NaOH+H O、
2 2 2 2 2
2HO=2H O+O↑,但课本上没有写出中间产物HO,根据HO 是一种在碱性条件下不稳
2 2 2 2 2 2 2 2
定、具有漂白性的物质,即可能的原因是HO 碱性条件下不稳定,易分解,HO 大部分已
2 2 2 2
分解;故答案为:NaO+2H O=2NaOH+H O;2HO=2H O+O↑;HO 碱性条件下不稳定,
2 2 2 2 2 2 2 2 2 2 2
易分解,HO 大部分已分解。
2 2
16. NaSO +H SO (浓)=Na SO +SO↑+H O 蒸发 沿玻璃棒向漏斗中
2 3 2 4 2 4 2 2
加蒸馏水直至浸没晶体,待水自然流完后,重复操作两到三次 B 向沉淀中加
足量稀盐酸,若沉淀未完全(或部分)溶解,并有刺激性气味的气体产生 先向A中
烧瓶滴加浓HSO ,产生的气体将装置中空气排尽后,再向C中烧瓶加入NaS和NaCO
2 4 2 2 3
混合溶液 淀粉
【详解】(1)在A装置中浓硫酸与亚硫酸钠反应生成二氧化硫、硫酸钠和水,反应的化
学方程式为NaSO +H SO =Na SO +SO↑+H O;
2 3 2 4 2 4 2 2
(2)从溶液中制取结晶水合物,应该采用蒸发、结晶、过滤、洗涤、干燥方法;洗涤晶体
的操作方法是:沿玻璃棒向漏斗中加蒸馏水直至浸没晶体,待水自然流完后,重复操作两
答案第6页,共2页到三次;
(3)E装置目的是吸收剩余的二氧化硫,防止污染大气,因为二氧化硫能与氢氧化钠反应,
所以E中试剂为氢氧化钠,故答案为B;
(4)①根据:NaSO·5H O是无色透明晶体,易溶于水,其稀溶液与BaCl 溶液混合无沉
2 2 3 2 2
淀生成;NaSO 易被氧化;BaSO 难溶于水,可溶于稀HCl;BaSO 难溶于水,难溶于稀
2 3 3 4
HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,
滴加足量BaCl 溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀
2
盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有NaSO 和
2 3
NaSO ;
2 4
②因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成NaSO 的量,改进后的操
2 4
作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫
化钠和碳酸钠的混合溶液,防止NaSO 被空气中的氧气氧化;
2 3
(5)①滴定完成后,碘会有剩余,可利用淀粉溶液来检验碘单质,淀粉遇到碘单质变蓝色;
②根据I+2Na SO=Na SO+2NaI,n(I)=amol/L×b×10-3L,知消耗的NaSO 的物质的量
2 2 2 3 2 4 6 2 2 2 3
=2n(I )=2amol/L×b×10-3L,故样品中硫代硫酸钠纯度的表达式为
2
= 。
17.(1) 煤油 用干的沙子盖灭
(2)钠熔成小球
(3) 有可能是NaO和NaCO 的混合物 NaO;NaCO 或者NaO和NaCO 的混
2 2 3 2 2 3 2 2 3
合物 BaCl2溶液 无色酚酞试液 溶液不变红
(4)
【详解】(1)因为钠的密度比煤油大,所以为防止钠被氧化,可将少量的钠保存在煤油中;
钠能与水反应,着火生成过氧化钠,所以钠着火时不能用水或者二氧化碳灭火器,应采取
用干的沙子盖灭的方法灭火;
(2)钠熔化成小球,可说明钠的熔点低,说明该反应是放热反应;
(3)瓶壁上有白色固体,钠燃烧过程产生的白色固体只有NaO或者NaCO,假设1:白
2 2 3色物质是NaO。假设2:白色物质是NaCO。假设3:有可能是NaO和NaCO 的混合物。
2 2 3 2 2 3
方案1取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色
酚酞试液,碳酸钠水溶液中水解显碱性,也可以使酚酞变红,NaO溶于水生成氢氧化钠,
2
溶液也可以变红,该实验结论假设1、2、3都成立,所以结论是白色固体有可能是NaO;
2
NaCO 或者NaO和NaCO 的混合物。
2 3 2 2 3
方案2①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过
量的BaCl 溶液,出现白色沉淀是碳酸钡沉淀,静置片刻,取上层清液于试管中,滴加无
2
色酚酞试液,溶液不变红,说明一定无氧化钠,因为氧化钠溶于水和水反应生成氢氧化钠,
所以证明白色固体是碳酸钠;故答案是:BaCl 溶液;无色酚酞试液;溶液不变红;
2
(4)根据上述现象与结论推测钠在二氧化碳中燃烧产生黑色固体C,白色固体NaCO,
2 3
化学方程式为 ;
18.(1) Fe
(2)
(3)2H++Fe=Fe2++H ↑
2
(4)2Fe2++Cl=2Fe3++2Cl-
2
(5)Cl +H O=Cl-+H++HClO
2 2
【分析】单质B为黄绿色气体,可知B为Cl,C为单质气体,B与C反应生成E,E溶液
2
是无色的,则C为H,E为HCl,A与盐酸生成氢气,A应为金属固体单质,A与盐酸反
2
应后生成F为A的氯化物,F又能与氯气反应生成D,且A与氯气可以直接生成D,可推
知A为Fe,根据转化关系可知,F为FeCl ,D为FeCl ,结合物质的相关性质解答该题。
2 3
【详解】(1)由以上分析可知,A为Fe,B为Cl,C为H;
2 2
(2)反应①为Fe和Cl 的反应,反应的化学方程式为 ;
2
(3)反应③为Fe和HCl的反应,反应的离子方程式为 ;
(4)反应④为FeCl 和Cl 的反应,反应的离子方程式为 ;
2 2
答案第8页,共2页(5)氯气与水反应的离子方程式为Cl+H O=Cl-+H++HClO。
2 2答案第10页,共2页