文档内容
广东实验中学 2023 届高三级第三次阶段考试
化 学
本试卷分选择题和非选择题两部分,共10页,满分100分,考试用时75分钟。
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卷上。
2.选择题每小题选出答案后,用2B铅笔把答题卷上对应题目的答案标号涂黑:如需改动,
用橡皮擦干净后,再选涂其它答案;不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内
的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和
涂改液,不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将答题卷收回。
相对原子质量 H=1 O=16 C1=35.5 Co=59 Zn=65
第一部分 选择题(共44分)
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小
题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.广东人爱“饮茶”,毛泽东有“饮茶粤海未能忘”诗句。下列说法错误的是
A.茶饼浸泡前要掰成小块,可使之更快浸出茶香
B.使用沸水泡茶,可加速茶叶中物质的溶解
C.茶叶封装时常附带一包铁粉,可减慢茶叶的氧化
D.某温度下测得茶水的pH=6.6,则该茶水一定呈酸性
2.化学与生活息息相关。下列叙述错误的是
A.热的碳酸钠溶液可用于去除餐具的油污
B.明矾和二氧化氯均可作净水剂,且净水原理相同
C.硫酸钡可用于胃肠X射线造影检查
D.电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法
3.化学与生活、科技及环境密切相关。下列说法正确的是
A.温室气体是形成酸雨的主要物质
B.过量服用阿司匹林引起酸中毒后,可用静脉注射NaHCO 溶液的方法解毒
3
C.食品袋中放置的CaO可直接防止食品氧化变质
D.太阳能电池阵使用的材料是半导体,其主要成分是SiO
2
4.设N 为阿伏加德罗常数的值。下列说法不正确的是
A
A.标准状况下,22.4 L CCl 中,原子数大于5N
4 A
B.71g Cl 与足量烧碱溶液反应制备漂白液,转移的电子数为N
2 A
1
学科网(北京)股份有限公司C.1 L 0.1 mol/L Na[Ag(CN) ]溶液中CN-的数目为0.2 N
2 A
D.1 mol C HO中含碳氢单键数可能为5N
2 6 A
5.下列方案能达到实验目的是
A.用水萃取CCl 中的溴
4
B.用排饱和石灰水集气法收集Cl
2
C.用丁达尔效应鉴别FeCl 溶液和Fe(OH) 胶体
3 3
D.用饱和的NaCO 溶液除去Cl 中混有的HCl
2 3 2
6.下列反应的离子方程式正确的是
A.Na与水反应:Na+ HO=Na++OH-+ H ↑
2 2
B.硫化钠水解反应:S2-+ H O+ HS-+H O
3 2
C.稀醋酸滴入NaOH溶液中:H++OH-= H O
2
D.氯氧化钠溶液中通入足量二氧化碳:CO+OH-=HCO-。
2 3
7.下列化学用语正确的是
A.Br原子的价电子排布式:3d104S24p5 B.NH H的电子式:
4
C.聚丙烯的结构简式 D.HCIO的结构式:H-O-CI
8.某种由六种元素形成的抗癌药物的结构简式如图所示,其中 W、X、Y、Z是原子序数
依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层
电子数的2倍。下列叙述不正确的是
A.W的最简单氢化物与Z的单质混合后可产生白烟
B.X与W的第一电离能:Xc(A-)>c(HA)>c(H+)
16.常压下羰基化法精炼镍的原理为Ni(s)+ 4CO(g) Ni(CO)(g)。230℃时,该反应的平
4
衡常数
K=2×10−5
。已知:Ni(CO) 的沸点为42.2℃,固体杂质不参与反应。
4
第一阶段:将粗镍与CO反应转化成气态Ni(CO);
4
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.升高温度,该反应的平衡常数减小
B.该反成达到平衡时,v [Ni(CO)]=4v生成(CO)
生成 4
C.第一阶段,在30℃和50℃两者之间选择反应温度,选30℃
D.第二阶段,Ni(CO) 分解率较低
4
第二部分非选择题(56分)
二、解答题(共56分)
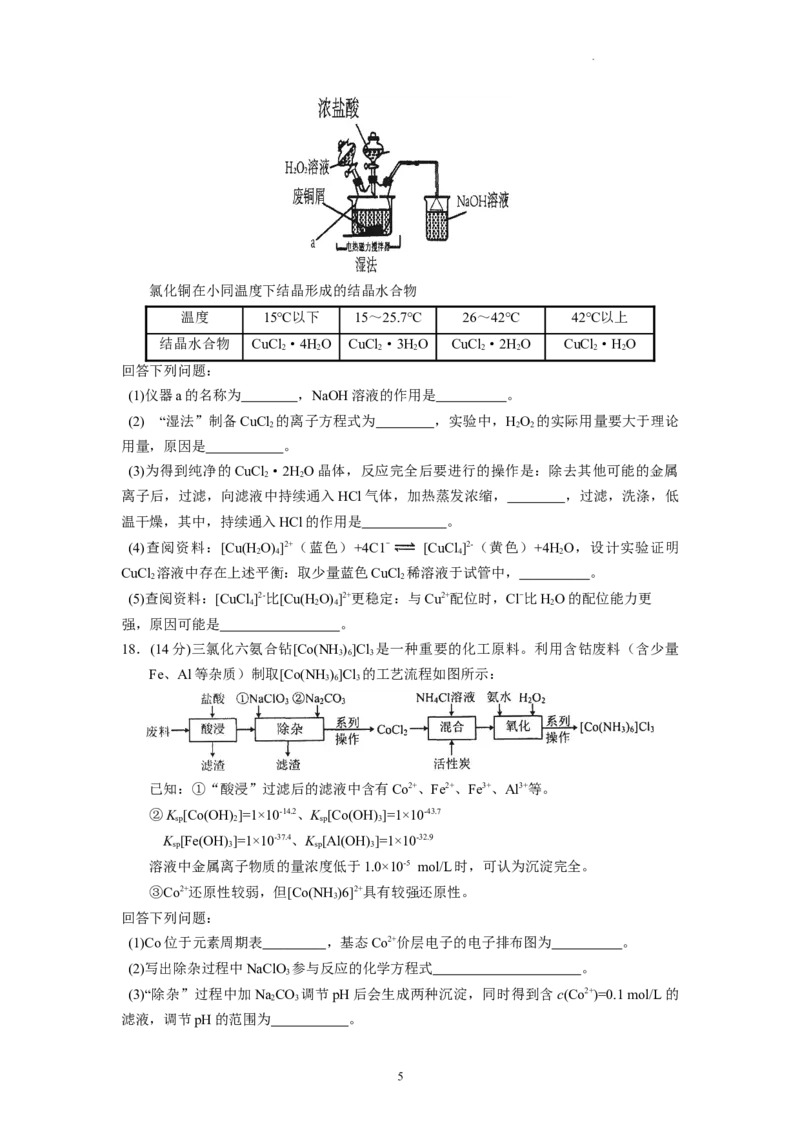
17.(14 分) CuCl 是常见的化学试剂,某学习小组利用废铜屑“湿法”制备
2
CuCl·2HO。
2 2
4
学科网(北京)股份有限公司氯化铜在小同温度下结晶形成的结晶水合物
温度 15℃以下 15~25.7℃ 26~42℃ 42℃以上
结晶水合物 CuCl·4HO CuCl·3HO CuCl·2HO CuCl·HO
2 2 2 2 2 2 2 2
回答下列问题:
(1)仪器a的名称为 ,NaOH溶液的作用是 。
(2) “湿法”制备CuCl 的离子方程式为 ,实验中,HO 的实际用量要大于理论
2 2 2
用量,原因是 。
(3)为得到纯净的CuCl·2HO晶体,反应完全后要进行的操作是:除去其他可能的金属
2 2
离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩, ,过滤,洗涤,低
温干燥,其中,持续通入HCl的作用是 。
(4)查阅资料:[Cu(H O)]2+(蓝色)+4C1- [CuCl]2-(黄色)+4H O,设计实验证明
2 4 4 2
CuCl 溶液中存在上述平衡:取少量蓝色CuCl 稀溶液于试管中, 。
2 2
(5)查阅资料:[CuCl]2-比[Cu(H O)]2+更稳定:与Cu2+配位时,Cl-比HO的配位能力更
4 2 4 2
强,原因可能是 。
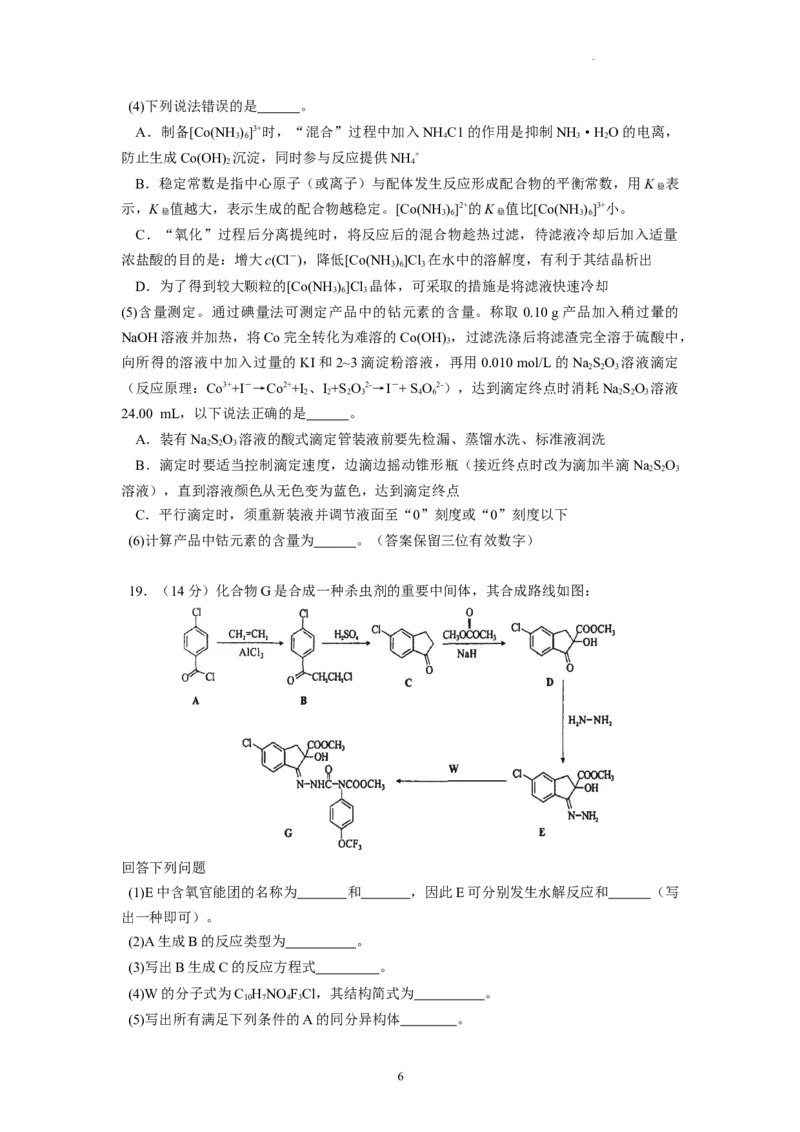
18.(14分)三氯化六氨合钻[Co(NH )]Cl 是一种重要的化工原料。利用含钴废料(含少量
3 6 3
Fe、Al等杂质)制取[Co(NH )]Cl 的工艺流程如图所示:
3 6 3
已知:①“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
②K [Co(OH) ]=1×10-14.2、K [Co(OH) ]=1×10-43.7
sp 2 sp 3
K [Fe(OH) ]=1×10-37.4、K [Al(OH) ]=1×10-32.9
sp 3 sp 3
溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
③Co2+还原性较弱,但[Co(NH )6]2+具有较强还原性。
3
回答下列问题:
(1)Co位于元素周期表 ,基态Co2+价层电子的电子排布图为 。
(2)写出除杂过程中NaClO 参与反应的化学方程式 。
3
(3)“除杂”过程中加NaCO 调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的
2 3
滤液,调节pH的范围为 。
5
学科网(北京)股份有限公司(4)下列说法错误的是 。
A.制备[Co(NH )]3+时,“混合”过程中加入NH C1的作用是抑制NH ·HO的电离,
3 6 4 3 2
防止生成Co(OH) 沉淀,同时参与反应提供NH +
2 4
B.稳定常数是指中心原子(或离子)与配体发生反应形成配合物的平衡常数,用K 表
稳
示,K 值越大,表示生成的配合物越稳定。[Co(NH )]2+的K 值比[Co(NH )]3+小。
稳 3 6 稳 3 6
C.“氧化”过程后分离提纯时,将反应后的混合物趁热过滤,待滤液冷却后加入适量
浓盐酸的目的是:增大c(Cl-),降低[Co(NH )]Cl 在水中的溶解度,有利于其结晶析出
3 6 3
D.为了得到较大颗粒的[Co(NH )]Cl 晶体,可采取的措施是将滤液快速冷却
3 6 3
(5)含量测定。通过碘量法可测定产品中的钻元素的含量。称取 0.10 g产品加入稍过暈的
NaOH溶液并加热,将Co完全转化为难溶的Co(OH) ,过滤洗涤后将滤渣完全溶于硫酸中,
3
向所得的溶液中加入过量的KI和2~3滴淀粉溶液,再用0.010 mol/L的NaSO 溶液滴定
2 2 3
(反应原理:Co3++I-→Co2++I 、I+S O2-→I-+ S O2-),达到滴定终点时消耗NaSO 溶液
2 2 2 3 4 6 2 2 3
24.00 mL,以下说法正确的是 。
A.装有NaSO 溶液的酸式滴定管装液前要先检漏、蒸馏水洗、标准液润洗
2 2 3
B.滴定时要适当控制滴定速度,边滴边摇动锥形瓶(接近终点时改为滴加半滴NaSO
2 2 3
溶液),直到溶液颜色从无色变为蓝色,达到滴定终点
C.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
(6)计算产品中钴元素的含量为 。(答案保留三位有效数字)
19.(14分)化合物G是合成一种杀虫剂的重要中间体,其合成路线如图:
回答下列问题
(1)E中含氧官能团的名称为 和 ,因此E可分别发生水解反应和 (写
出一种即可)。
(2)A生成B的反应类型为 。
(3)写出B生成C的反应方程式 。
(4)W的分子式为C HNOFCl,其结构简式为 。
10 7 4 3
(5)写出所有满足下列条件的A的同分异构体 。
6
学科网(北京)股份有限公司①分子中含有苯环,不含其它环; ②核磁共振氢谱有3组峰。
(6)根据上述信息,写出以 为主要原料制备 合成路线。
(无机试剂任选)
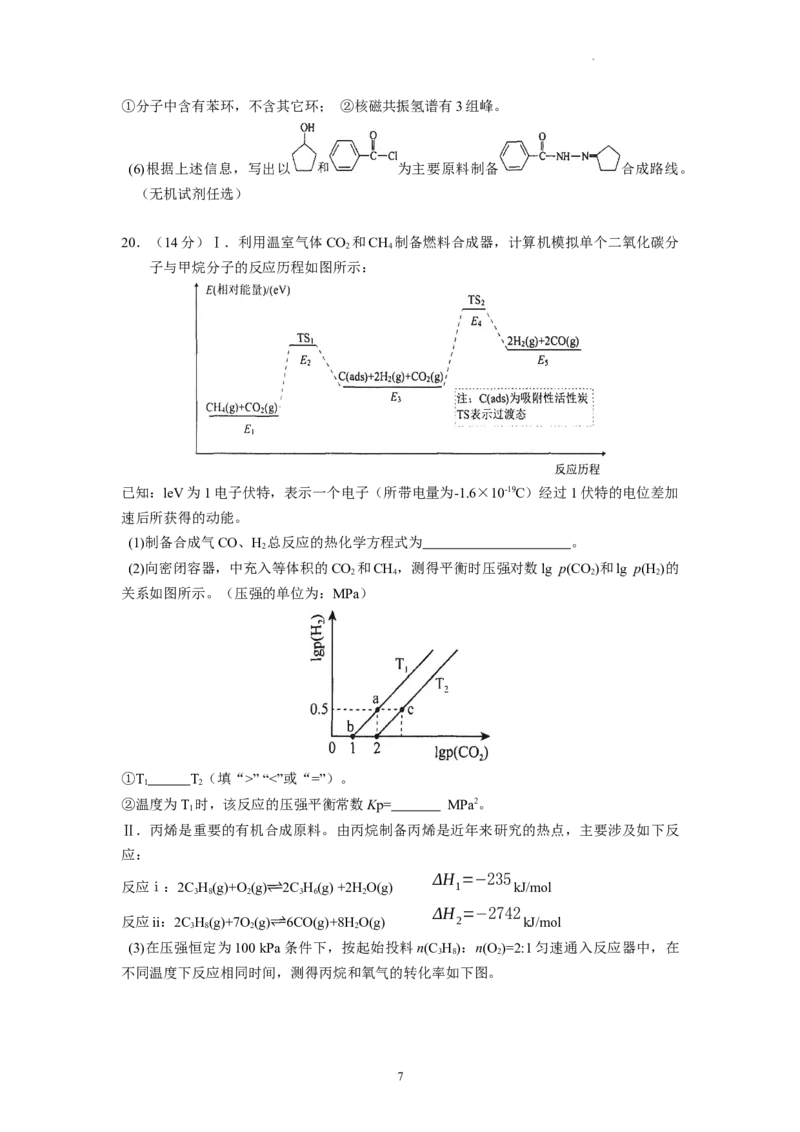
20.(14分)Ⅰ.利用温室气体CO 和CH 制备燃料合成器,计算机模拟单个二氧化碳分
2 4
子与甲烷分子的反应历程如图所示:
已知:leV为1电子伏特,表示一个电子(所带电量为-1.6×10-19C)经过1伏特的电位差加
速后所获得的动能。
(1)制备合成气CO、H 总反应的热化学方程式为 。
2
(2)向密闭容器,中充入等体积的CO 和CH,测得平衡时压强对数lg p(CO)和lg p(H )的
2 4 2 2
关系如图所示。(压强的单位为:MPa)
①T T(填“>” “<”或“=”)。
1 2
②温度为T 时,该反应的压强平衡常数Kp= MPa2。
1
Ⅱ.丙烯是重要的有机合成原料。由丙烷制备丙烯是近年来研究的热点,主要涉及如下反
应:
ΔH =−235
反应ⅰ:2C H(g)+O(g) 2C H(g) +2H O(g) 1 kJ/mol
3 8 2 3 6 2
ΔH =−2742
反应ii:2C H(g)+7O(g) 6CO(g)+8HO(g) 2 kJ/mol
3 8 2 2
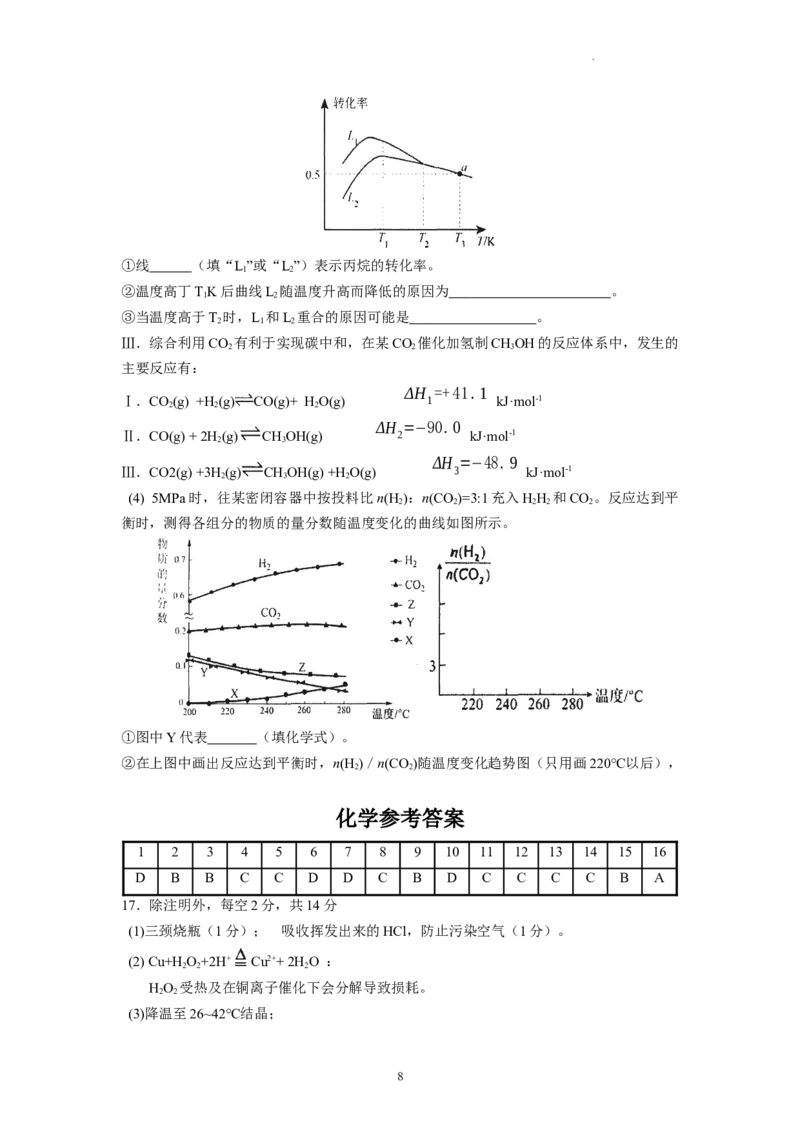
(3)在压强恒定为100 kPa条件下,按起始投料n(C H):n(O)=2:1匀速通入反应器中,在
3 8 2
不同温度下反应相同时间,测得丙烷和氧气的转化率如下图。
7
学科网(北京)股份有限公司①线 (填“L”或“L”)表示丙烷的转化率。
1 2
②温度高丁TK后曲线L 随温度升高而降低的原因为 。
1 2
③当温度高于T 时,L 和L 重合的原因可能是 。
2 1 2
Ⅲ.综合利用CO 有利于实现碳中和,在某CO 催化加氢制CHOH的反应体系中,发生的
2 2 3
主要反应有:
ΔH =+41.1
Ⅰ.CO(g) +H(g) CO(g)+ HO(g) 1 kJ·mol-1
2 2 2
ΔH =−90.0
Ⅱ.CO(g) + 2H (g) CHOH(g) 2 kJ·mol-1
2 3
ΔH =−48.9
Ⅲ.CO2(g) +3H (g) CHOH(g) +H O(g) 3 kJ·mol-1
2 3 2
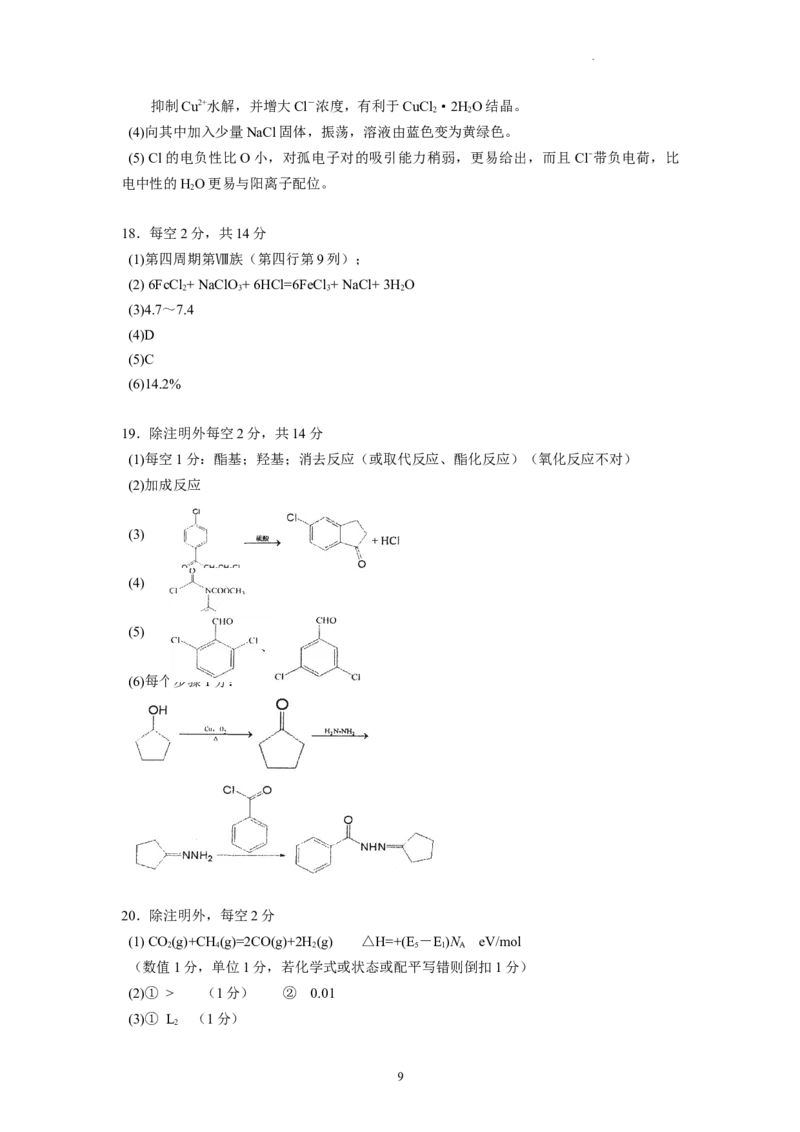
(4) 5MPa时,往某密闭容器中按投料比n(H ):n(CO)=3:1充入HH 和CO 。反应达到平
2 2 2 2 2
衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
①图中Y代表 (填化学式)。
②在上图中画出反应达到平衡时,n(H )/n(CO)随温度变化趋势图(只用画220℃以后),
2 2
化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
D B B C C D D C B D C C C C B A
17.除注明外,每空2分,共14分
(1)三颈烧瓶(1分); 吸收挥发出来的HCl,防止污染空气(1分)。
(2) Cu+H O+2H+ Cu2++ 2H O :
2 2 2
H O 受热及在铜离子催化下会分解导致损耗。
2 2
(3)降温至26~42℃结晶;
8
学科网(北京)股份有限公司抑制Cu2+水解,并增大Cl-浓度,有利于CuCl·2HO结晶。
2 2
(4)向其中加入少量NaCl固体,振荡,溶液由蓝色变为黄绿色。
(5) Cl的电负性比O小,对孤电子对的吸引能力稍弱,更易给出,而且Cl-带负电荷,比
电中性的HO更易与阳离子配位。
2
18.每空2分,共14分
(1)第四周期第Ⅷ族(第四行第9列);
(2) 6FcCl+ NaClO + 6HCl=6FeCl + NaCl+ 3H O
2 3 3 2
(3)4.7~7.4
(4)D
(5)C
(6)14.2%
19.除注明外每空2分,共14分
(1)每空1分:酯基;羟基;消去反应(或取代反应、酯化反应)(氧化反应不对)
(2)加成反应
(3)
(4)
(5)
(6)每个步骤1分:
20.除注明外,每空2分
(1) CO(g)+CH (g)=2CO(g)+2H(g) △H=+(E -E)N eV/mol
2 4 2 5 1 A
(数值1分,单位1分,若化学式或状态或配平写错则倒扣1分)
(2)① > (1分) ② 0.01
(3)① L (1分)
2
9
学科网(北京)股份有限公司②两个反应均为放热反应,温度升高,化学平衡逆向移动,导致丙烷转化率降低
③温度高于T 时,反应 ⅱ 几乎不发生(反应 ⅱ 的平衡常数几乎为0)
2
(4)①CHOH
3
②
10
学科网(北京)股份有限公司