文档内容
第四章 化学反应与电能
第一节 原电池
一、原电池的工作原理
1、原电池的构成条件
(1)定义:能把 转化为 的装置。
(2)实质:利用能自发进行的 反应将化学能转化为电能。
(3)构成条件:①两个 的电极;② 溶液;③形成 回
路;④自发进行的 反应。
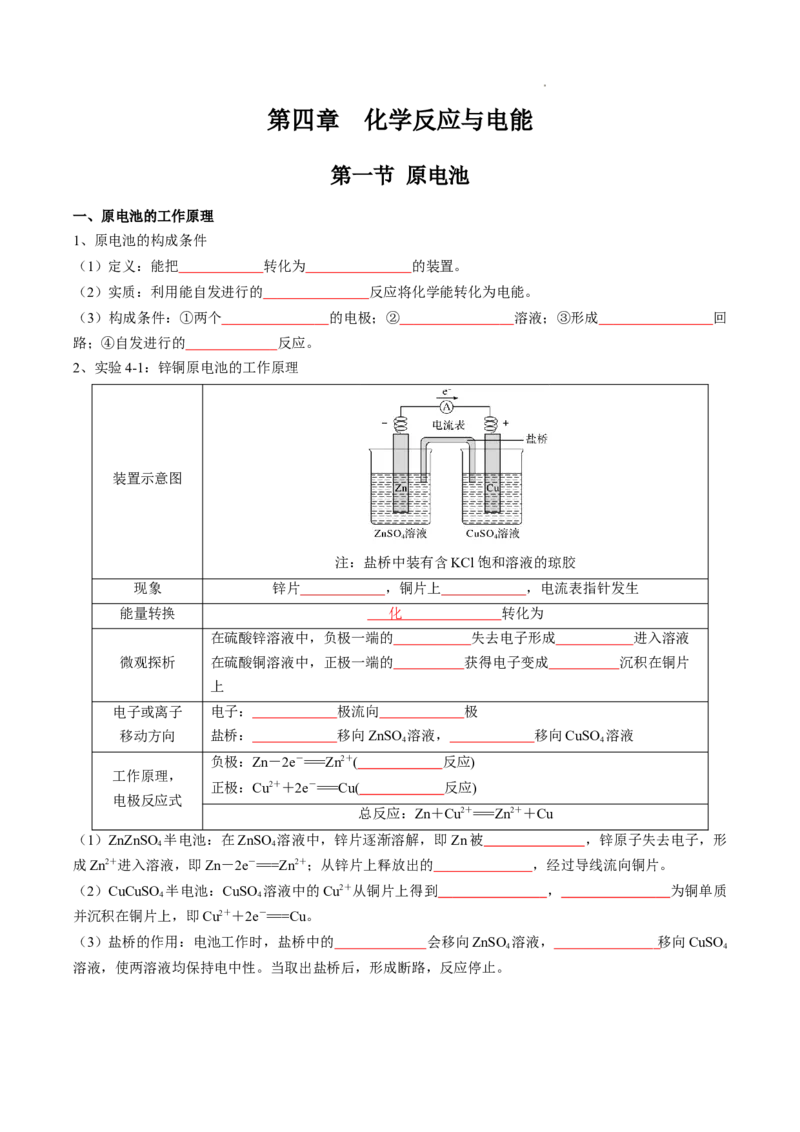
2、实验4-1:锌铜原电池的工作原理
装置示意图
注:盐桥中装有含KCl饱和溶液的琼胶
现象 锌片 ,铜片上 ,电流表指针发生
能量转换 化 转化为
在硫酸锌溶液中,负极一端的 失去电子形成 进入溶液
微观探析 在硫酸铜溶液中,正极一端的 获得电子变成 沉积在铜片
上
电子或离子 电子: 极流向 极
移动方向 盐桥: 移向ZnSO 溶液, 移向CuSO 溶液
4 4
负极:Zn-2e-===Zn2+( 反应)
工作原理,
正极:Cu2++2e-===Cu( 反应)
电极反应式
总反应:Zn+Cu2+===Zn2++Cu
(1)ZnZnSO 半电池:在ZnSO 溶液中,锌片逐渐溶解,即Zn被 ,锌原子失去电子,形
4 4
成Zn2+进入溶液,即Zn-2e-===Zn2+;从锌片上释放出的 ,经过导线流向铜片。
(2)CuCuSO 半电池:CuSO 溶液中的Cu2+从铜片上得到 , 为铜单质
4 4
并沉积在铜片上,即Cu2++2e-===Cu。
(3)盐桥的作用:电池工作时,盐桥中的 会移向ZnSO 溶液, 移向CuSO
4 4
溶液,使两溶液均保持电中性。当取出盐桥后,形成断路,反应停止。
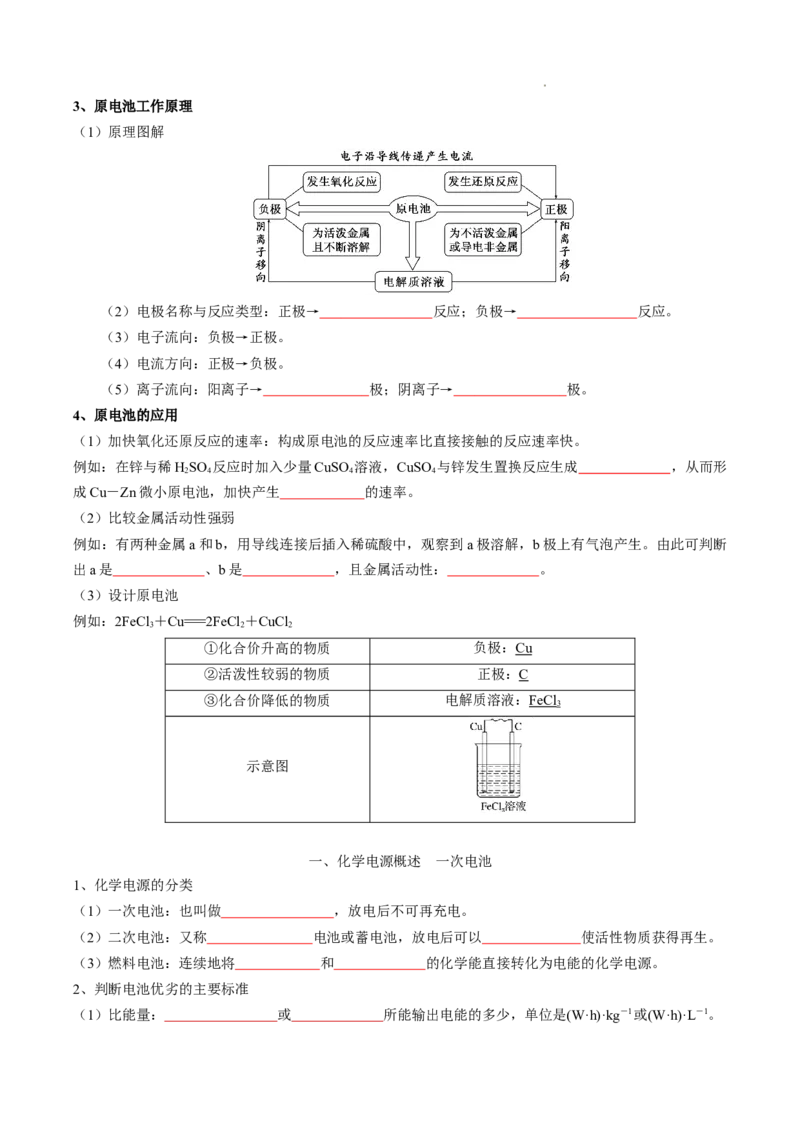
学科网(北京)股份有限公司3、原电池工作原理
(1)原理图解
(2)电极名称与反应类型:正极→ 反应;负极→ 反应。
(3)电子流向:负极→正极。
(4)电流方向:正极→负极。
(5)离子流向:阳离子→ 极;阴离子→ 极。
4、原电池的应用
(1)加快氧化还原反应的速率:构成原电池的反应速率比直接接触的反应速率快。
例如:在锌与稀HSO 反应时加入少量CuSO 溶液,CuSO 与锌发生置换反应生成 ,从而形
2 4 4 4
成Cu-Zn微小原电池,加快产生 的速率。
(2)比较金属活动性强弱
例如:有两种金属a和b,用导线连接后插入稀硫酸中,观察到a极溶解,b极上有气泡产生。由此可判断
出a是 、b是 ,且金属活动性: 。
(3)设计原电池
例如:2FeCl +Cu===2FeCl +CuCl
3 2 2
①化合价升高的物质 负极:Cu
②活泼性较弱的物质 正极:C
③化合价降低的物质 电解质溶液:FeCl
3
示意图
一、化学电源概述 一次电池
1、化学电源的分类
(1)一次电池:也叫做 ,放电后不可再充电。
(2)二次电池:又称 电池或蓄电池,放电后可以 使活性物质获得再生。
(3)燃料电池:连续地将 和 的化学能直接转化为电能的化学电源。
2、判断电池优劣的主要标准
(1)比能量: 或 所能输出电能的多少,单位是(W·h)·kg-1或(W·h)·L-1。
学科网(北京)股份有限公司(2)比功率:单位质量或 所能输出功率的大小,单位是W·kg-1或W·L-1。
(3)电池可储存时间的长短。
3、化学电池的回收利用
使用后的废弃电池中含有大量的 、酸和碱等有害物质,随处丢弃会给土壤、 等
造成严重的污染。 要进行回收利用。
4、化学电源的发展方向
小型化、供电方便、工作寿命长、不需要维护的电池受到人们的青睐。如 电池、
电池等。
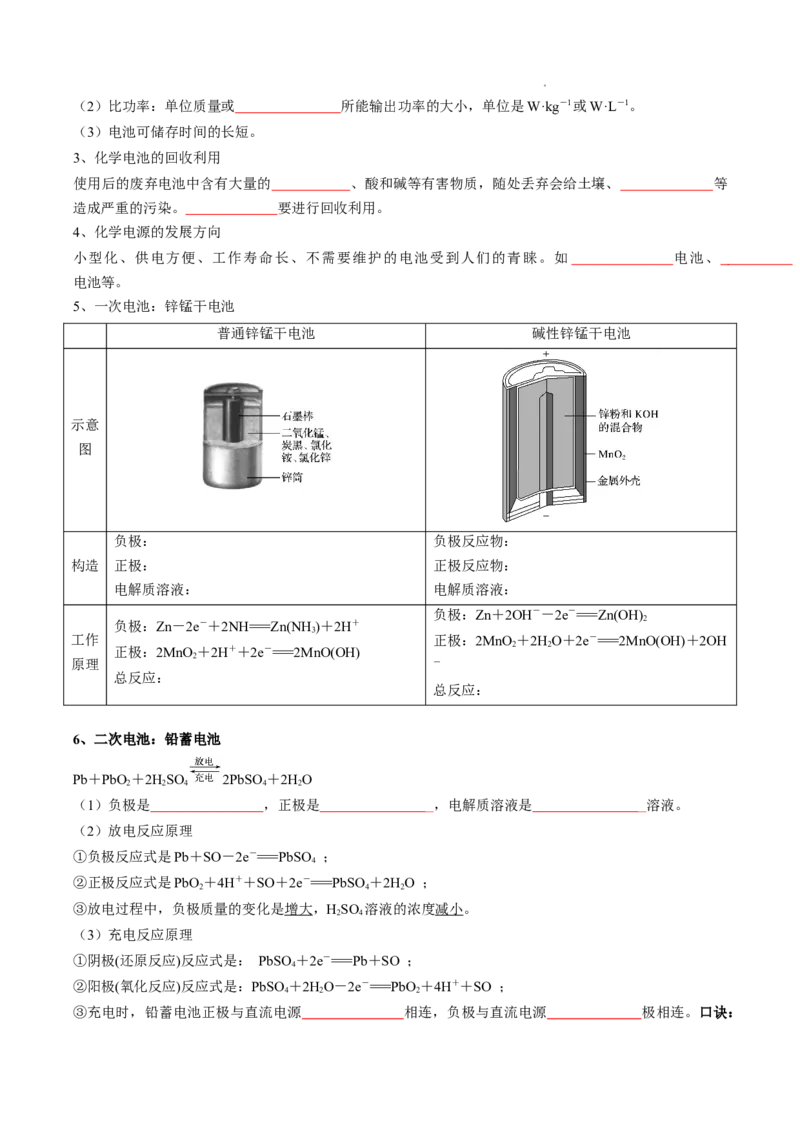
5、一次电池:锌锰干电池
普通锌锰干电池 碱性锌锰干电池
示意
图
负极: 负极反应物:
构造 正极: 正极反应物:
电解质溶液: 电解质溶液:
负极:Zn+2OH--2e-===Zn(OH)
负极:Zn-2e-+2NH===Zn(NH )+2H+ 2
3
工作 正极:2MnO +2HO+2e-===2MnO(OH)+2OH
正极:2MnO +2H++2e-===2MnO(OH) 2 2
2
原理 -
总反应:
总反应:
6、二次电池:铅蓄电池
Pb+PbO +2HSO 2PbSO +2HO
2 2 4 4 2
(1)负极是 ,正极是 ,电解质溶液是 溶液。
(2)放电反应原理
①负极反应式是Pb+SO-2e-===PbSO ;
4
②正极反应式是PbO +4H++SO+2e-===PbSO +2HO ;
2 4 2
③放电过程中,负极质量的变化是增大,HSO 溶液的浓度减小。
2 4
(3)充电反应原理
①阴极(还原反应)反应式是: PbSO +2e-===Pb+SO ;
4
②阳极(氧化反应)反应式是:PbSO +2HO-2e-===PbO +4H++SO ;
4 2 2
③充电时,铅蓄电池正极与直流电源 相连,负极与直流电源 极相连。口诀:
学科网(北京)股份有限公司“负极接负极,正极接正极”。
7、二次电池:锂离子电池
电极 电极反应
负极 嵌锂石墨(LiC):
x y
正极 钴酸锂(LiCoO ):
2
总反应
LiC+Li CoO LiCoO +C
x y 1-x 2 2 y
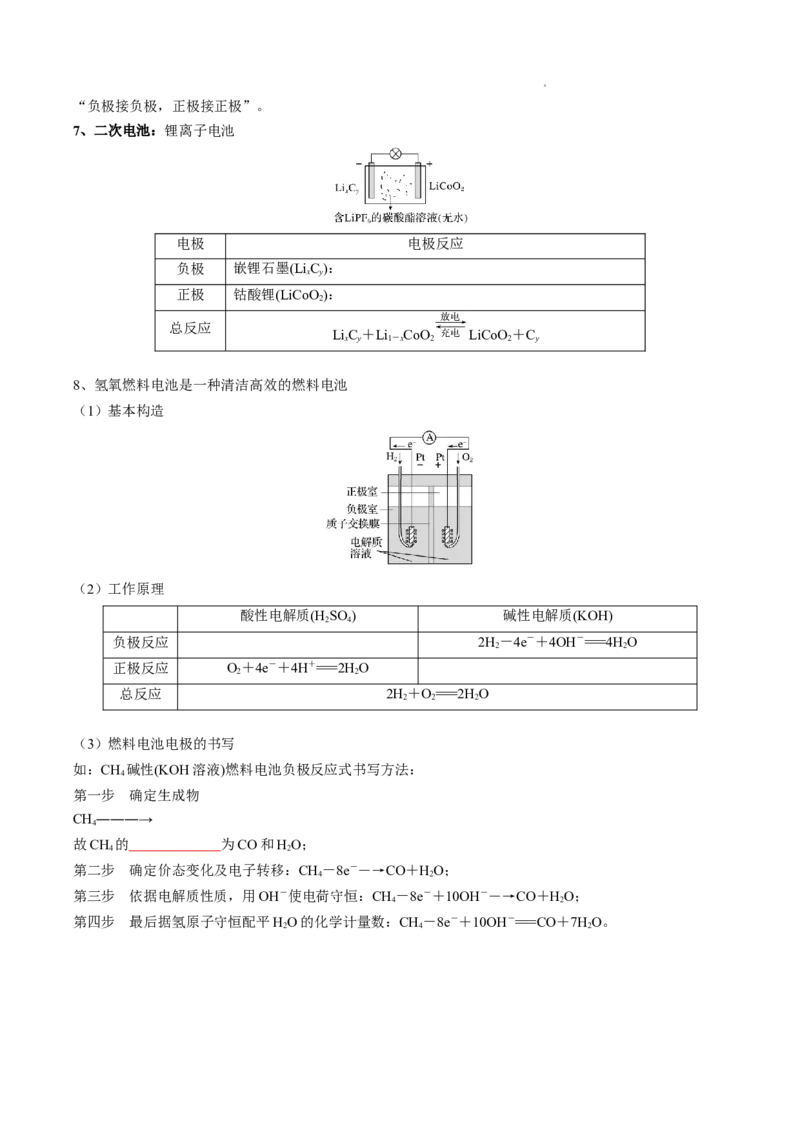
8、氢氧燃料电池是一种清洁高效的燃料电池
(1)基本构造
(2)工作原理
酸性电解质(H SO ) 碱性电解质(KOH)
2 4
负极反应 2H-4e-+4OH-===4HO
2 2
正极反应 O+4e-+4H+===2HO
2 2
总反应 2H+O===2HO
2 2 2
(3)燃料电池电极的书写
如:CH 碱性(KOH溶液)燃料电池负极反应式书写方法:
4
第一步 确定生成物
CH―――→
4
故CH 的 为CO和HO;
4 2
第二步 确定价态变化及电子转移:CH-8e-―→CO+HO;
4 2
第三步 依据电解质性质,用OH-使电荷守恒:CH-8e-+10OH-―→CO+HO;
4 2
第四步 最后据氢原子守恒配平HO的化学计量数:CH-8e-+10OH-===CO+7HO。
2 4 2
学科网(北京)股份有限公司第二节 电解质
一、电解原理
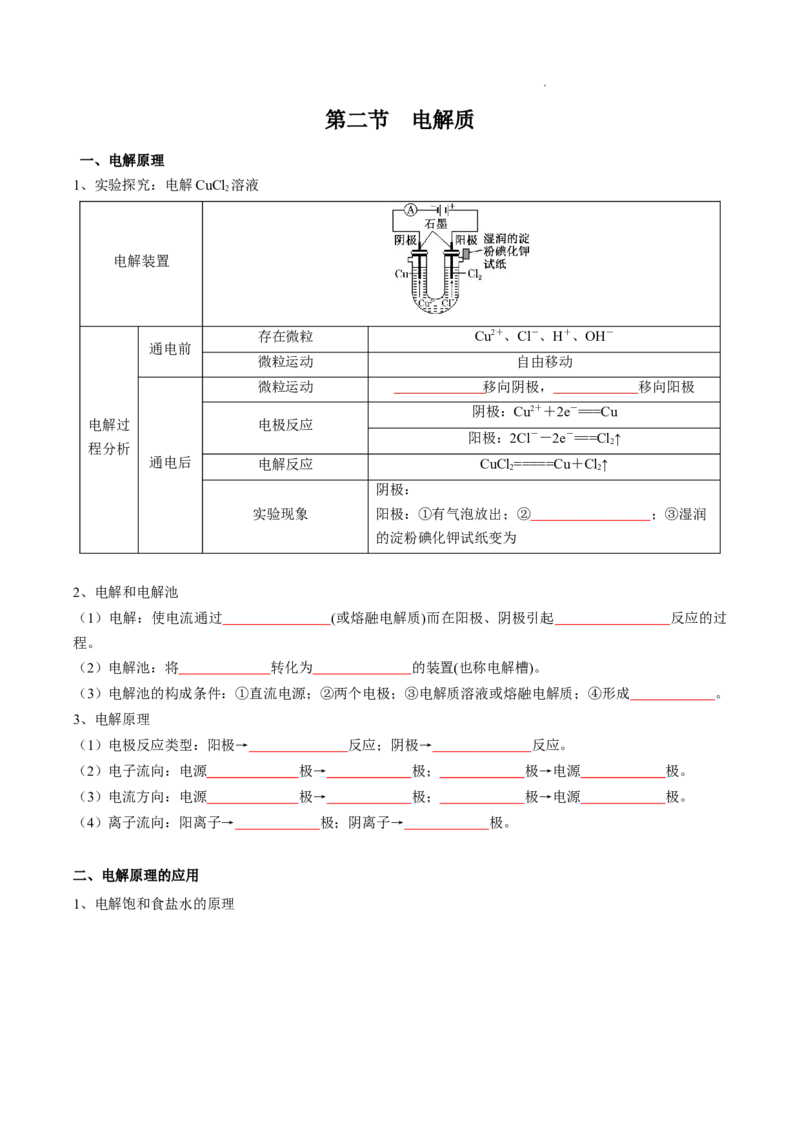
1、实验探究:电解CuCl 溶液
2
电解装置
存在微粒 Cu2+、Cl-、H+、OH-
通电前
微粒运动 自由移动
微粒运动 移向阴极, 移向阳极
阴极:Cu2++2e-===Cu
电解过 电极反应
阳极:2Cl--2e-===Cl↑
2
程分析
通电后 电解反应 CuCl =====Cu+Cl↑
2 2
阴极:
实验现象 阳极:①有气泡放出;② ;③湿润
的淀粉碘化钾试纸变为
2、电解和电解池
(1)电解:使电流通过 (或熔融电解质)而在阳极、阴极引起 反应的过
程。
(2)电解池:将 转化为 的装置(也称电解槽)。
(3)电解池的构成条件:①直流电源;②两个电极;③电解质溶液或熔融电解质;④形成 。
3、电解原理
(1)电极反应类型:阳极→ 反应;阴极→ 反应。
(2)电子流向:电源 极→ 极; 极→电源 极。
(3)电流方向:电源 极→ 极; 极→电源 极。
(4)离子流向:阳离子→ 极;阴离子→ 极。
二、电解原理的应用
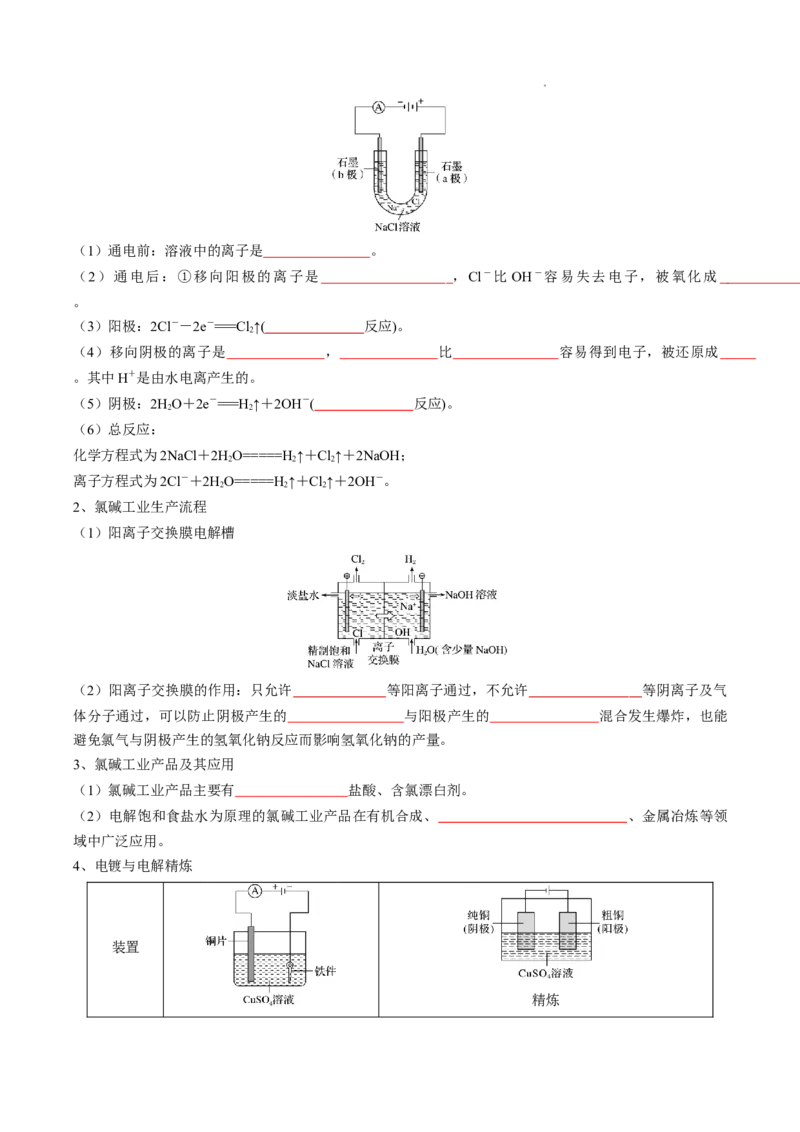
1、电解饱和食盐水的原理
学科网(北京)股份有限公司(1)通电前:溶液中的离子是 。
(2)通电后:①移向阳极的离子是 ,Cl-比 OH-容易失去电子,被氧化成
。
(3)阳极:2Cl--2e-===Cl↑( 反应)。
2
(4)移向阴极的离子是 , 比 容易得到电子,被还原成
。其中H+是由水电离产生的。
(5)阴极:2HO+2e-===H↑+2OH-( 反应)。
2 2
(6)总反应:
化学方程式为2NaCl+2HO=====H↑+Cl↑+2NaOH;
2 2 2
离子方程式为2Cl-+2HO=====H↑+Cl↑+2OH-。
2 2 2
2、氯碱工业生产流程
(1)阳离子交换膜电解槽
(2)阳离子交换膜的作用:只允许 等阳离子通过,不允许 等阴离子及气
体分子通过,可以防止阴极产生的 与阳极产生的 混合发生爆炸,也能
避免氯气与阴极产生的氢氧化钠反应而影响氢氧化钠的产量。
3、氯碱工业产品及其应用
(1)氯碱工业产品主要有 盐酸、含氯漂白剂。
(2)电解饱和食盐水为原理的氯碱工业产品在有机合成、 、金属冶炼等领
域中广泛应用。
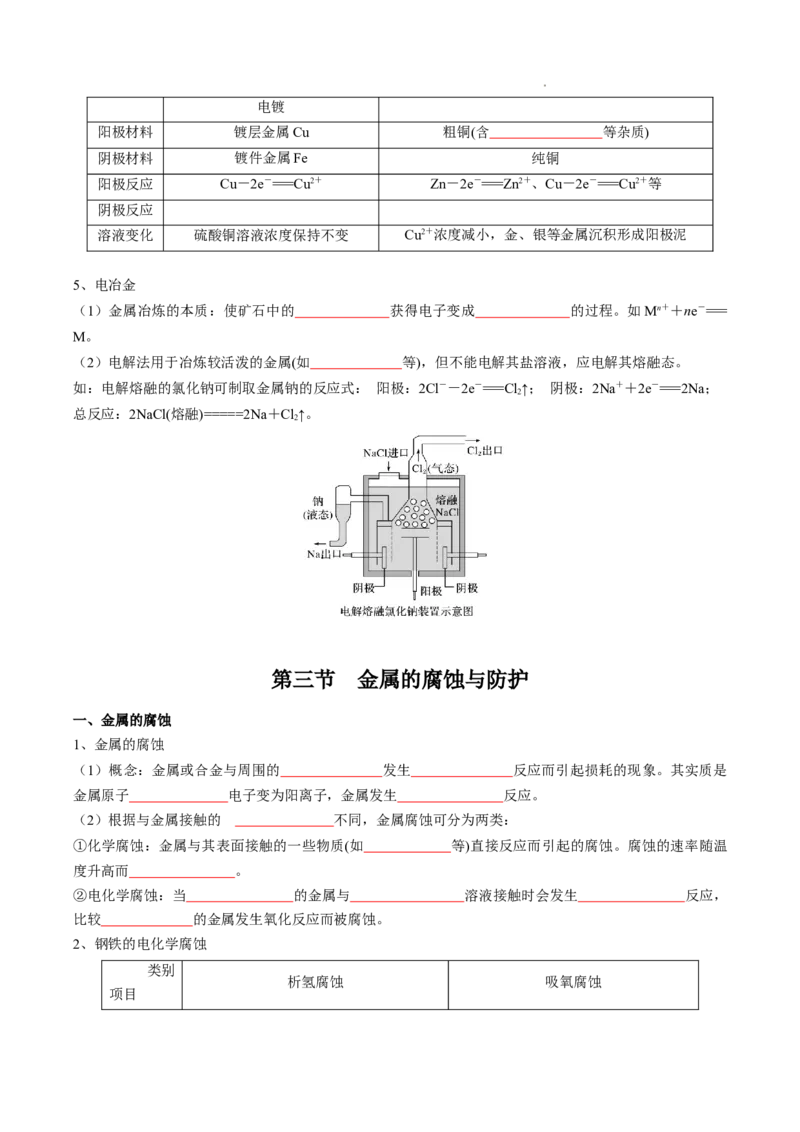
4、电镀与电解精炼
装置
精炼
学科网(北京)股份有限公司电镀
阳极材料 镀层金属Cu 粗铜(含 等杂质)
阴极材料 镀件金属Fe 纯铜
阳极反应 Cu-2e-===Cu2+ Zn-2e-===Zn2+、Cu-2e-===Cu2+等
阴极反应
溶液变化 硫酸铜溶液浓度保持不变 Cu2+浓度减小,金、银等金属沉积形成阳极泥
5、电冶金
(1)金属冶炼的本质:使矿石中的 获得电子变成 的过程。如Mn++ne-===
M。
(2)电解法用于冶炼较活泼的金属(如 等),但不能电解其盐溶液,应电解其熔融态。
如:电解熔融的氯化钠可制取金属钠的反应式: 阳极:2Cl--2e-===Cl↑; 阴极:2Na++2e-===2Na;
2
总反应:2NaCl(熔融)=====2Na+Cl↑。
2
第三节 金属的腐蚀与防护
一、金属的腐蚀
1、金属的腐蚀
(1)概念:金属或合金与周围的 发生 反应而引起损耗的现象。其实质是
金属原子 电子变为阳离子,金属发生 反应。
(2)根据与金属接触的 不同,金属腐蚀可分为两类:
①化学腐蚀:金属与其表面接触的一些物质(如 等)直接反应而引起的腐蚀。腐蚀的速率随温
度升高而 。
②电化学腐蚀:当 的金属与 溶液接触时会发生 反应,
比较 的金属发生氧化反应而被腐蚀。
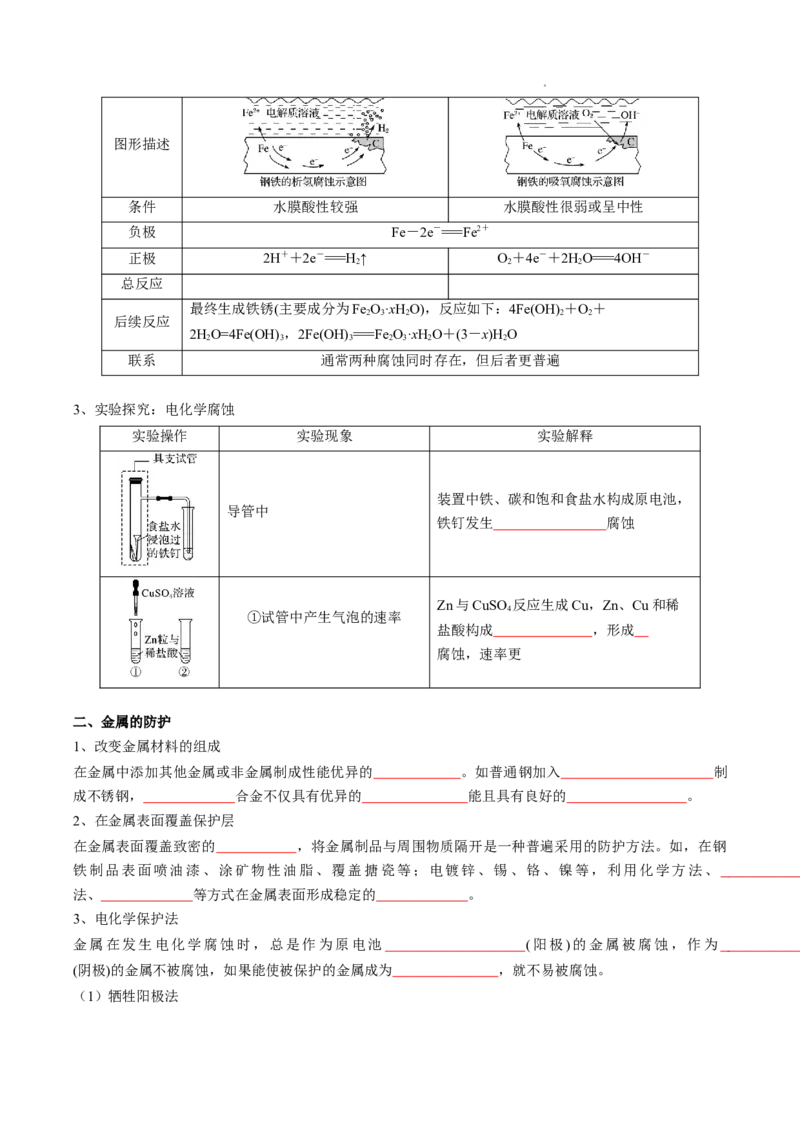
2、钢铁的电化学腐蚀
类别
析氢腐蚀 吸氧腐蚀
项目
学科网(北京)股份有限公司图形描述
条件 水膜酸性较强 水膜酸性很弱或呈中性
负极 Fe-2e-===Fe2+
正极 2H++2e-===H↑ O+4e-+2HO===4OH-
2 2 2
总反应
最终生成铁锈(主要成分为Fe O·xHO),反应如下:4Fe(OH) +O+
2 3 2 2 2
后续反应
2HO=4Fe(OH) ,2Fe(OH) ===Fe O·xHO+(3-x)H O
2 3 3 2 3 2 2
联系 通常两种腐蚀同时存在,但后者更普遍
3、实验探究:电化学腐蚀
实验操作 实验现象 实验解释
装置中铁、碳和饱和食盐水构成原电池,
导管中
铁钉发生 腐蚀
Zn与CuSO 反应生成Cu,Zn、Cu和稀
4
①试管中产生气泡的速率
盐酸构成 ,形成
腐蚀,速率更
二、金属的防护
1、改变金属材料的组成
在金属中添加其他金属或非金属制成性能优异的 。如普通钢加入 制
成不锈钢, 合金不仅具有优异的 能且具有良好的 。
2、在金属表面覆盖保护层
在金属表面覆盖致密的 ,将金属制品与周围物质隔开是一种普遍采用的防护方法。如,在钢
铁制品表面喷油漆、涂矿物性油脂、覆盖搪瓷等;电镀锌、锡、铬、镍等,利用化学方法、
法、 等方式在金属表面形成稳定的 。
3、电化学保护法
金属在发生电化学腐蚀时,总是作为原电池 (阳极)的金属被腐蚀,作为
(阴极)的金属不被腐蚀,如果能使被保护的金属成为 ,就不易被腐蚀。
(1)牺牲阳极法
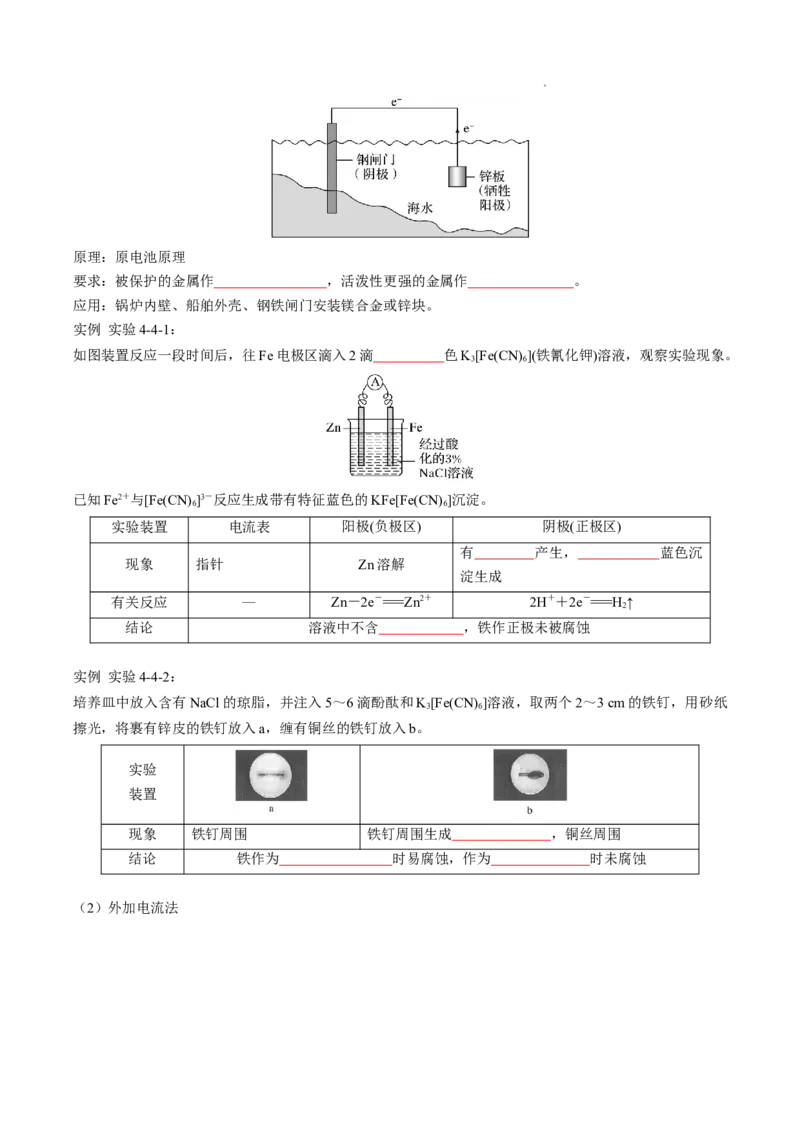
学科网(北京)股份有限公司原理:原电池原理
要求:被保护的金属作 ,活泼性更强的金属作 。
应用:锅炉内壁、船舶外壳、钢铁闸门安装镁合金或锌块。
实例 实验4-4-1:
如图装置反应一段时间后,往Fe电极区滴入2滴 色K[Fe(CN) ](铁氰化钾)溶液,观察实验现象。
3 6
已知Fe2+与[Fe(CN) ]3-反应生成带有特征蓝色的KFe[Fe(CN) ]沉淀。
6 6
实验装置 电流表 阳极(负极区) 阴极(正极区)
有 产生, 蓝色沉
现象 指针 Zn溶解
淀生成
有关反应 — Zn-2e-===Zn2+ 2H++2e-===H↑
2
结论 溶液中不含 ,铁作正极未被腐蚀
实例 实验4-4-2:
培养皿中放入含有NaCl的琼脂,并注入5~6滴酚酞和K[Fe(CN) ]溶液,取两个2~3 cm的铁钉,用砂纸
3 6
擦光,将裹有锌皮的铁钉放入a,缠有铜丝的铁钉放入b。
实验
装置
现象 铁钉周围 铁钉周围生成 ,铜丝周围
结论 铁作为 时易腐蚀,作为 时未腐蚀
(2)外加电流法
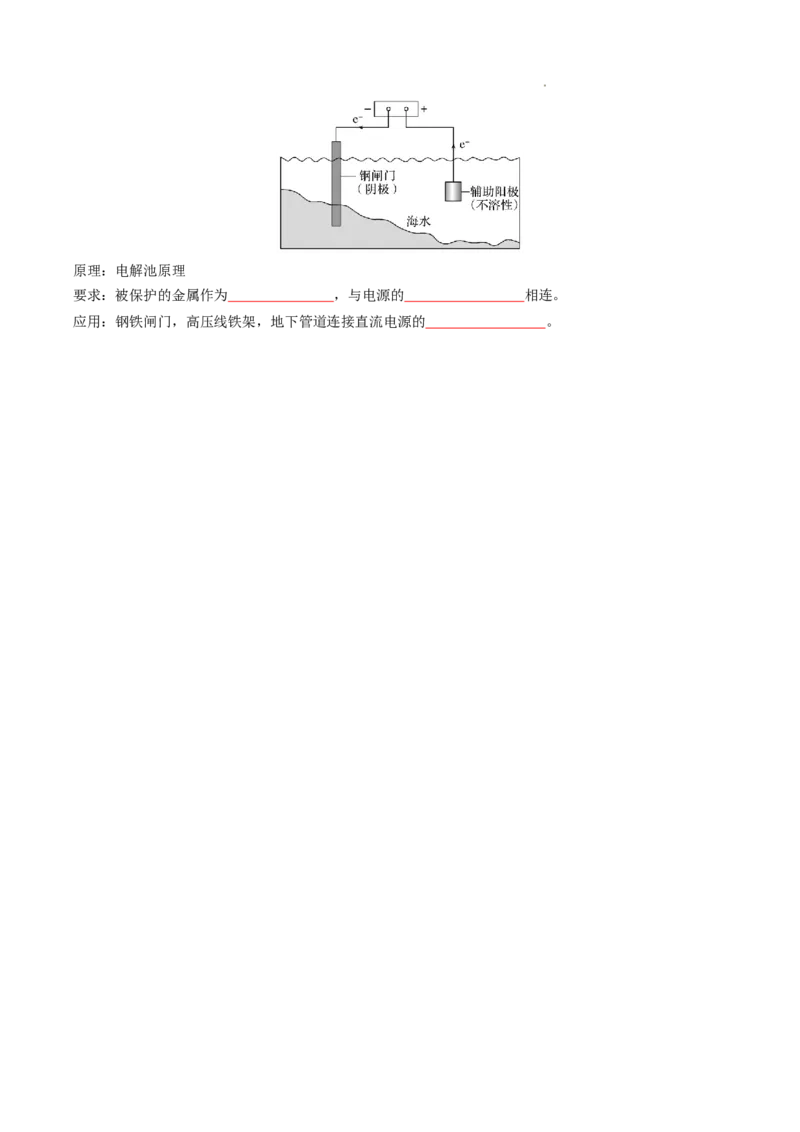
学科网(北京)股份有限公司原理:电解池原理
要求:被保护的金属作为 ,与电源的 相连。
应用:钢铁闸门,高压线铁架,地下管道连接直流电源的 。
学科网(北京)股份有限公司学科网(北京)股份有限公司