文档内容
第四章� 第 3节 化学键课时作业2022-2023学年高中化学
人教版(2019)必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列叙述中,不正确的是
A.含有离子键的化合物不一定是离子化合物
B.HO 的电子式为
2 2
C.CaO和NaCl晶体熔化时要破坏离子键
D.熔融态HSO 不导电
2 4
2.在元素周期表中,有一种元素 ,它作为玻璃添加剂,能吸收紫外线与红外线,
还可降低车内温度,从而节约空调用电,现已被大量应用于汽车玻璃行业。下列对其
元素说法正确的是( )
A.所含的质子数为140 B.所含的质量数是58
C.所含的中子数是82 D.核外电子数是140
3.下列化学用语或图示表达不正确的是
A.N 的结构式:N≡N
2
B.HClO的结构式为H-Cl-O
C.Cl 分子的结构式:Cl-Cl
2
D.NH 的结构式:
3
4.化学科学需要借助化学专用语言描述,下列有关化学用语书写正确的是
A.CO 的电子式
2
B.Cl-的结构示意图
C.HCl的电子式
D.质量数为37的氯原子
5.下列说法正确的是( )A.同一原子中 1s、2s、3s 电子的能量逐渐减小
B.同一原子中 2p、3p、4p 能级的轨道数依次增多
C.C—C,C=C,C≡C 键能之比为 1.00:1.77:2.34,根据以上数据,可知乙烯和乙
炔不容易发生反应
D.共价键的键能越大,共价键越不容易断裂,由此形成的分子越稳定
6.下列哪一组元素的原子间反应可以形成离子键
原 子 a b c d e f g
M层电子数 1 2 3 4 5 6 7
A.a和f B.a和c C.d和g D.c和g
7.正确掌握化学用语是学好化学的基础。下列化学用语正确的是
A.氯化氢的电子式 H+ B.四氯化碳的电子式:
C.CO 的电子式 D.NaCl 的电子式:
2
8.下列描述中,正确的是
A.需要加热才能发生的反应一定是吸热反应
B.稀有气体都不能形成双原子分子
C.形成离子键的阳、阴离子间只存在静电吸引力
D.离子化合物中一定只含有离子键
9.用化学用语表示KClO+6HCl(浓)=KCl+3Cl ↑+3H O中的相关微粒,其中正确的是
3 2 2
A.KClO 中氯元素的化合价为+7 B.氯离子的结构示意图:
3
C.KClO 的电离方程式:KClO=K++Cl-+3O2-D.Cl 的摩尔质量为71
3 3 2
10.下列说法中,正确的是( )
A.两种元素组成的分子中一定只有极性键
B.非金属元素组成的化合物一定是共价化合物
C.干冰升华时,分子内共价键会发生断裂
D.含有阴离子的化合物中一定含有阳离子
11.共价键、离子键、范德华力和氢键都是微观粒子之间的不同作用力。有下列物质:
①NaO ②冰 ③金刚石 ④碘单质 ⑤CaCl ⑥白磷,只含有两种作用力是( )
2 2 2
试卷第2页,共3页A.①④⑥ B.①③⑥ C.②④⑤ D.①②③⑤
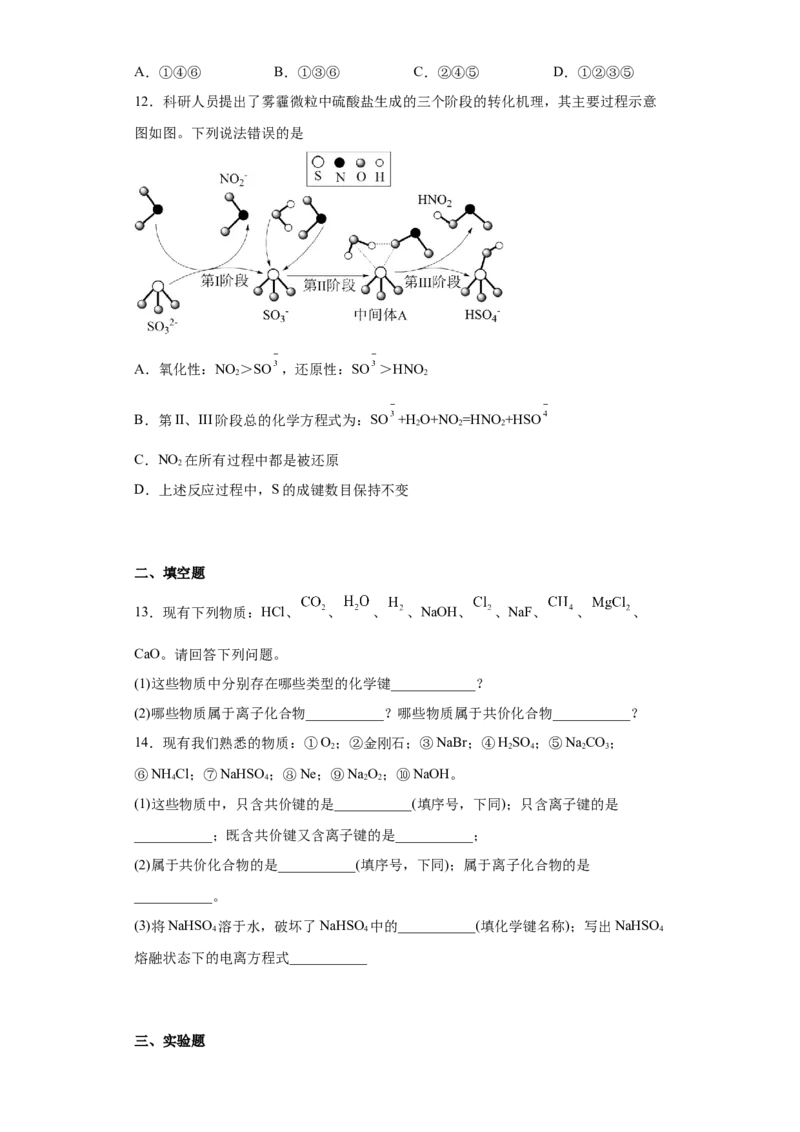
12.科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意
图如图。下列说法错误的是
A.氧化性:NO >SO ,还原性:SO >HNO
2 2
B.第II、III阶段总的化学方程式为:SO +H O+NO =HNO +HSO
2 2 2
C.NO 在所有过程中都是被还原
2
D.上述反应过程中,S的成键数目保持不变
二、填空题
13.现有下列物质:HCl、 、 、 、NaOH、 、NaF、 、 、
CaO。请回答下列问题。
(1)这些物质中分别存在哪些类型的化学键____________?
(2)哪些物质属于离子化合物___________?哪些物质属于共价化合物___________?
14.现有我们熟悉的物质:①O;②金刚石;③NaBr;④HSO ;⑤NaCO;
2 2 4 2 3
⑥NH Cl;⑦NaHSO;⑧Ne;⑨NaO;⑩NaOH。
4 4 2 2
(1)这些物质中,只含共价键的是___________(填序号,下同);只含离子键的是
___________;既含共价键又含离子键的是___________;
(2)属于共价化合物的是___________(填序号,下同);属于离子化合物的是
___________。
(3)将NaHSO 溶于水,破坏了NaHSO 中的___________(填化学键名称);写出NaHSO
4 4 4
熔融状态下的电离方程式___________
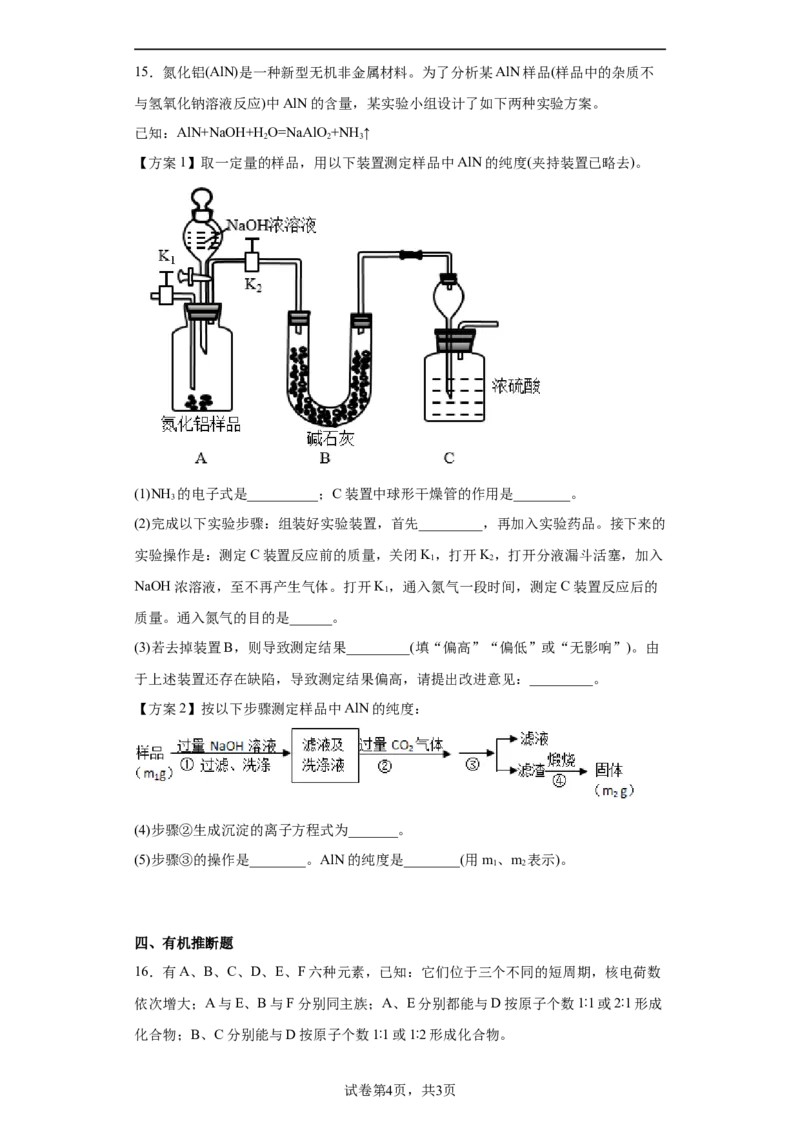
三、实验题15.氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不
与氢氧化钠溶液反应)中AlN的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H O=NaAlO +NH↑
2 2 3
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)NH 的电子式是__________;C装置中球形干燥管的作用是________。
3
(2)完成以下实验步骤:组装好实验装置,首先_________,再加入实验药品。接下来的
实验操作是:测定C装置反应前的质量,关闭K,打开K,打开分液漏斗活塞,加入
1 2
NaOH浓溶液,至不再产生气体。打开K,通入氮气一段时间,测定C装置反应后的
1
质量。通入氮气的目的是______。
(3)若去掉装置B,则导致测定结果_________(填“偏高”“偏低”或“无影响”)。由
于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见:_________。
【方案2】按以下步骤测定样品中AlN的纯度:
(4)步骤②生成沉淀的离子方程式为_______。
(5)步骤③的操作是________。AlN的纯度是________(用m、m 表示)。
1 2
四、有机推断题
16.有A、B、C、D、E、F六种元素,已知:它们位于三个不同的短周期,核电荷数
依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数1∶1或2∶1形成
化合物;B、C分别能与D按原子个数1∶1或1∶2形成化合物。
试卷第4页,共3页(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式______________、
____________。
(2)右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示
__________。E与D按原子个数比1∶1形成的化合物的电子式为
_______________________。
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小
可以衡量化学键的强弱,也可以用于估算化学反应的反应热( H),化学反应的 H
等于反应中断裂旧化学键的键能之和与反应中形成新化学键的△键能之和的差。下表△列
出了上述部分元素形成的化学键的键能:
化学键 F—D F—F B—B F—B B=D D=D
键能/ kJ·mol−1 460 176 347.7 347 745 497.3
①下列三种物质形成的晶体,熔点由高到低的顺序为________(用a、b、c表示)。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试写出F单质晶体的燃烧的热化学方程式:___________________________。参考答案:
1.A
【详解】A.离子化合物即含有离子键的化合物,所以含有离子键的化合物一定是离子化
合物,A错误;
B.HO 为共价化合物,含有过氧键,电子式为 ,B正确;
2 2
C.CaO和NaCl均为离子通过离子键形成的离子化合物,熔化时要破坏离子键,C正确;
D.HSO 为共价化合物,熔融态不能电离出离子,不导电,D正确;
2 4
综上所述答案为A。
2.C
【详解】A.根据原子周围数字表示的意义,可知所含的质子数为58,A说法错误;
B.根据原子周围数字表示的意义,可知所含的质量数是140,B说法错误;
C.根据原子周围数字表示的意义,该元素的原子序数为58,根据原子序数=核电荷数=质
子数=核外电子数,中子数=相对原子质量−质子数=140−58=82,则铈原子中的中子数为
82,C说法正确;
D.根据原子周围数字表示的意义,质子数=原子序数=核外电子数=核电荷数,核外电子数
是58,D说法错误;
故选:C。
3.B
【详解】A.N 分子中N原子间是三键,结构式:N≡N,故A正确;
2
B.Cl最外层7个电子,形成1对共用电子对,O最外层6个电子,形成2对共用电子对,
故HClO的结构式为H-O-Cl,故B错误;
C.Cl 分子中两个Cl原子间形成1对共用电子对,Cl 分子的结构式为Cl-Cl,故C正确;
2 2
D.NH 的结构中N与三个H原子以共价键相连,故D正确;
3
故选B。
4.D
【详解】A. CO 是共价化合物,C与O之间需要共用两对电子,电子式为:
2
,A错误;B. Cl-是Cl原子得一个电子形成,最外层有8个电子,结构示意图为: ,B错
误;
C. HCl是共价化合物,H与Cl之间有一对共用电子对,不能标出所带电荷,电子式为:
,C错误;
D. 质量数为37的氯原子,质量数写在元素符号的左上角,质子数为17,写在元素符号
的左下角,故表示为 ,D正确;
故选D。
5.D
【详解】A. 能级符号相同,能层越大,能量越高,同一原子中,1s、2s、3s电子的能量逐
渐增大,A错误;
B. 同一原子中,2p、3p、4p能级的轨道数相等,都是3个,B错误;
C. C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍,说明乙烯和乙炔中的π
键不牢固,容易被试剂进攻,易发生加成反应,C错误;
D. 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定,D正确;
故答案为:D。
6.A
【详解】由原子a~g的M层电子数可知,M层即为原子的最外层,元素a~g均为第三周
期元素,根据M层电子数,判断出a、b、c、d、e、f、g分别为:Na、Mg、Al、Si、P、
S、Cl,根据活泼的金属与非金属元素原子之间形成的化学键是离子键可知,钠与硫可形成
硫化钠,该物质属于离子化合物;
综上所述,本题正确选项A。
7.B
【详解】A.氯化氢是共价化合物,电子式是 ,故A错误;
答案第2页,共2页B.四氯化碳是共价化合物,电子式是 ,故B正确;
C.CO 是共价化合物,电子式是 ,故C错误;
2
D.NaCl 是离子化合物,电子式是 ,故D错误;
选B。
8.B
【详解】
A.反应焓变与反应条件无关,需要加热才能发生的反应不一定是吸热反应,故A错误;
B.稀有气体是单原子分子,稀有气体都不能形成双原子分子,故B正确;
C.形成离子键的阳、阴离子间存在静电作用力,故C错误;
D.离子化合物中一定含有离子键、可能含有共价键,故D错误;
答案选B。
9.B
【详解】A.KClO 中氯元素的化合价为+5价,A错误;
3
B.氯原子得到一个电子形成氯离子,氯离子的结构示意图: ,B正确;
C.KClO 的电离方程式为KClO=K++ ,C错误;
3 3
D.Cl 的摩尔质量为71g/mol,D错误;
2
故选B。
10.D
【详解】A.两种元素组成的分子中,如为多原子分子,可能存在非极性键,如HC≡CH,
故A错误;
B.非金属元素组成的化合物,可能为离子化合物,如铵盐,故B错误;
C.干冰为分子晶体,升华时破坏范德华力,不破坏共价键,故C错误;
D.化合物整体呈现电中性,因此含有带负电荷的阴离子必含有带正电荷的阳离子,故D
正确;
故选D。
11.A【分析】大多非金属元素之间形成的键是共价键,以共价键结合的物质可能为原子晶体,
也可能为分子晶体,在分子晶体中还存在分子间作用力;活泼金属和活泼的非金属之间形
成的键大多是离子键,离子晶体中含有离子键;金属晶体中含有金属键;电负性很大的元
素(N、O、F)与氢元素形成共价键时,H原子几乎是裸露的质子,不同分子之间存在氢
键,以此来解答。
【详解】①NaO 中钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成
2 2
共价键,含有离子键和共价键两种作用力,故①符合;
②冰属于分子晶体,分子内氧原子与氢原子之间形成共价键,分子之间存在氢键、范德华
力,故②不符合;
③金刚石是原子晶体,只存在共价键,故③不符合;
④碘单质属于分子晶体,分子内碘原子之间形成共价键,分子之间存在范德华力,故④符
合;
⑤氯化钙属于离子晶体,钙离子与氯离子之间形成离子键,只存在离子键,故⑤不符合;
⑥白磷属于分子晶体,白磷分子中磷原子之间形成共价键,分子间存在分子间作用力,故
⑥符合;
答案选A。
【点睛】本题考查化学键和晶体类型,难度不大,注意化学键的形成规律及分子晶体中存
在分子间作用力。
12.D
【详解】A.根据第Ⅰ阶段的方程式 ,NO2为氧化剂,SO 是氧
化产物,所以氧化性 ;第Ⅱ、Ш阶段总的方程式
可得还原性: ,A正确;
B.根据图示可知:在第Ⅱ阶段, 在 存在条件反应产生中间体A。在第Ⅲ阶
段,中间体A转化为 和 ,故第Ⅱ、Ⅲ阶段总的化学方程式为:
答案第4页,共2页,B正确;
C.根据图示的转化过程知该过程中 , , 化合价均降低被还
原C正确;
D.由题图可知由, 最终生成 ,S的成健数目由3变为4,D错误。
故答案选D。
13.(1)分别为:共价键;共价键;共价键;共价键;共价键、离子键;共价键;离子键;
共价键;离子键;离子键;
(2) NaOH,NaF,MgCl ,CaO HCl,CO,HO,CH
2 2 2 4
【解析】(1)
HCl中氢原子和氧原子之间存在共价键,属于共价化合物;
CO 中氧原子和碳原子之间存在共价键,属于共价化合物;
2
HO中氧原子和氢原子之间存在共价键,属于共价化合物;
2
H 中氢原子和氢原子之间存在共价键,属于共价单质;
2
NaOH中钠离子和氢氧根离子之间存在离子键,氢氧根离子中氧原子和氢原子之间存在共
价键,属于离子化合物;
Cl 中氯原子和氯原子之间存在共价键,属于共价单质;
2
NaF中氟离子和钠离子之间存在离子键,属于离子化合物;
CH 中碳原子和氢原子之间存在共价键,属于共价化合物;
4
MgCl 中氯离子和镁离子之间存在离子键,属于离子化合物;
2
CaO中氧离子和钙离子之间存在离子键,属于离子化合物;
存在的化学键分别为:共价键;共价键;共价键;共价键;共价键、离子键;共价键;离
子键;共价键;离子键;离子键;
(2)
属于离子化合物:NaOH,NaF,MgCl ,CaO;属于共价化合物:HCl,CO,HO,CH。
2 2 2 4
14. ①②④ ③ ⑤⑥⑦⑨⑩ ④
③⑤⑥⑦⑨⑩ 离子键、共价键 NaHSO=Na+
4【分析】①O 中O原子之间只存在非极性共价键,为单质;
2
②金刚石中碳原子之间只存在非极性共价键;
③NaBr中钠离子和溴离子之间只存在离子键,为离子化合物;
④H SO 中S原子和O原子、O原子和H原子之间存在极性共价键,为共价化合物;
2 4
⑤Na CO 中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在极性共价键,
2 3
为离子化合物;
⑥NHCl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为
4
离子化合物;
⑦NaHSO 中钠离子和硫酸氢根离子之间存在离子键、S原子、O原子和H原子之间存在共
4
价键,为离子化合物;
⑧Ne中不存在化学键;
⑨Na O 中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,为离子化
2 2
合物;
⑩NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离
子化合物;
【详解】(1)根据分析可知只含有共价键的是①②④;只含有离子键的是③;既含有共价键
又含有离子键的是:⑤⑥⑦⑨⑩;不存在化学键的是⑧;属于共价化合物的是④;属于离
子化合物的是③⑤⑥⑦⑨⑩。
(2)NaHSO 是强酸强碱酸式盐,属强电解质,完全电离,电离出钠离子、氢离子和硫酸根
4
离子,离子方程式为:NaHSO=Na++H++ SO ,所以破坏了NaHSO 中的离子键和共价键,
4 4
NaHSO 在熔融状态下电离,破坏了离子键,电离方程式为:NaHSO=Na++ HSO ,所以答
4 4
案为:离子键、共价键;NaHSO=Na+ 。
4
15. 防止倒吸 检查装置的气密性 把装置中
残留的氨气全部赶入C装置,防止测量结果偏小 偏高 C装置出口处连
接一个干燥装置 CO+AlO +2H O=HCO +Al(OH) ↓ 过滤、洗涤
2 2 3
答案第6页,共2页【分析】方案l测定原理是通过测定AlN与NaOH反应生成的氨气的质量来计算氮化铝的
含量,装置A中进行反应,装置B除水,装置C吸收氨气,干燥管可以防止倒吸;
方案2测定原理是通过测定样品中Al元素的质量来确定AlN的纯度,先用样品和过量
NaOH溶液反应过量洗涤得到含有偏铝酸钠的洗涤液,然后通入过量二氧化碳得到氢氧化
铝成,过滤煅烧后得到氧化铝固体,测定氧化铝的质量来确定AlN的纯度。
【详解】(1)氨气分子中每个氢原子与氮原子共用一对电子,电子式为 ;氨气是与
浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用;
(2)本实验需要测定气体的质量,所以组装好实验装置后首先要检查装置的气密性;通入氮
气可以将装置中残留的氨气全部赶入C装置,防止测量结果偏小;
(3)由于浓硫酸具有吸水性,去掉B装置,浓硫酸还会吸收水蒸气,导致氨气的质量偏大,
测定的结果偏高;该装置浓硫酸可能会吸收空气中的水蒸气,导致测定结果偏高,所以可
以C装置出口处连接一个干燥装置;
(4)步骤②中生成的沉淀为二氧化碳和偏铝酸根反应生成的氢氧化铝,离子方程式为
CO+AlO +2H O=HCO +Al(OH) ↓;
2 2 3
(5)步骤③是要得到氢氧化铝沉淀,所以操作为过滤、洗涤;步骤④灼烧后得到的固体是
Al O,其物质的量为 mol,根据元素守恒可知样品中AlN的物质的量 mol,所以纯
2 3
度为 100%= 。
16. NaHCO CHCOONa 氢键
3 3
a>c>b Si(s) + O(g) = SiO (s); H= −990.7kJ·mol−1
2 2
【分析】A、E分别都能与D按原子个数△1∶1或2∶1形成化合物,且A与E是同主族元素,
可知A为H,E为Na,D为O。B、C分别能与D按原子个数1∶1或1∶2形成化合物,再结
合原子序数,可知B为C,C为N,则F为和C同主族的Si。所以A是H,B是C,C是
N,D是O,E是Na,F是Si。【详解】(1)只含有H、C、O、Na四种元素的两种常见无水盐分别为碳酸氢钠和醋酸钠。
(2)H和O形成的常见化合物是水,水中存在氢键,所以虚线表示氢键。Na和O按原子
个数比1﹕1形成的化合物是过氧化钠,含有离子键和非极性键,电子式为
。
(3)①a是SiC属于原子晶体,b是CO,是分子晶体,c是Si,也是原子晶体。因为Si-
2
C的键能大于Si-Si的键能,所以碳化硅的熔点高于硅的,硅的高于CO 的,即a>c>b。
2
②硅和氧气反应的化学方程式为Si+O=SiO ,因为1个硅原子形成2个Si-Si,在二氧化
2 2
硅晶体中1个硅原子形成4个Si-O,所以该反应的 H=2×176 kJ·mol-1+497.3 kJ·mol-1-
4×460 kJ·mol-1=-990.7 kJ/mol。故答案为:Si(s) + O△(g) = SiO (s); H= −990.7kJ·mol−1。
2 2
△
答案第8页,共2页