文档内容
人教版(2019)必修一第四章第一节 原子结构与元素周期表
测试卷五
学校:___________姓名:___________班级:___________考号:___________
一、推断题
1、A+、B+、C-、D、E 5种微粒(分子或离子),它们分别含10个电子,已知它们有如下转化关
系:①A++C-→D+E;②B++C-→2D。
据此,回答下列问题:
(1)上述含10电子的四核阳离子为_________,含10电子的阴离子为_______。
(2)A+和B+的电子式A+____________、B+____________。
(3)C-、D、E 3种粒子结合质子(H+)的能力由强到弱的顺序是(用粒子的化学式表示)_______
_____;这一顺序可用以下离子方程式加以说明:
①_____________________________________________;
②_____________________________________________。
2、现有部分前四周期元素的性质或原子结构如下表所示:
元素编 元素性质或原子结构
号
位于第三周期,其单质可用作半导体材料
层 电子数比 电子数少1
第三周期主族元素中其第一电离能最大
前四周期元素中其未成对电子数最多
1. 单质分子中,含有__________个 键和__________个 键,元素 的气态氢化物的空间构型为
__________.
2. 单质的熔点__________(填“高于”或“低于) 单质的熔点,其原因是__________.
3.写出元素 基态原子的电子排布式:__________.
3、A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;
已知B、D两元素间可形成DB 和DB 两种化合物,两者相对分子质量相差16;又知A、C两元素原子
2 3
序数之和是B、D两元素原子序数之和的1/2。请回答下列问题:
1.写出由A、B、C三元素形成的化合物的电子式__________,所含化学键的类型有__________。
2.A B与A D的沸点:A B__________(填“高于”或“低于”)A D,其原因是__________。
2 2 2 2
3.由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐
酸反应的离子方程式__________。
二、填空题
4、最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时
间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入
世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下
列内容:
1.铯的原子核外共有__________层电子,最外层电子数为__________,铯的原子序数为
__________。
2.铯单质与水剧烈反应,放出________色气体,同时使紫色石蕊试液显________色,因为
____________________(写出化学方程式)。
3.预测铯单质的还原性比钠单质的还原性__________(填“弱”或“强”)。
5、回答下列问题:
(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是____________。
(2)A元素原子的L层上有6个电子,B元素比A元素原子核外电子层数多1,B元素原子的最外
电子层上只有1个电子。
A、B两元素形成的化合物的化学式是__________,该化合物与 反应的化学方程式是
___________________。
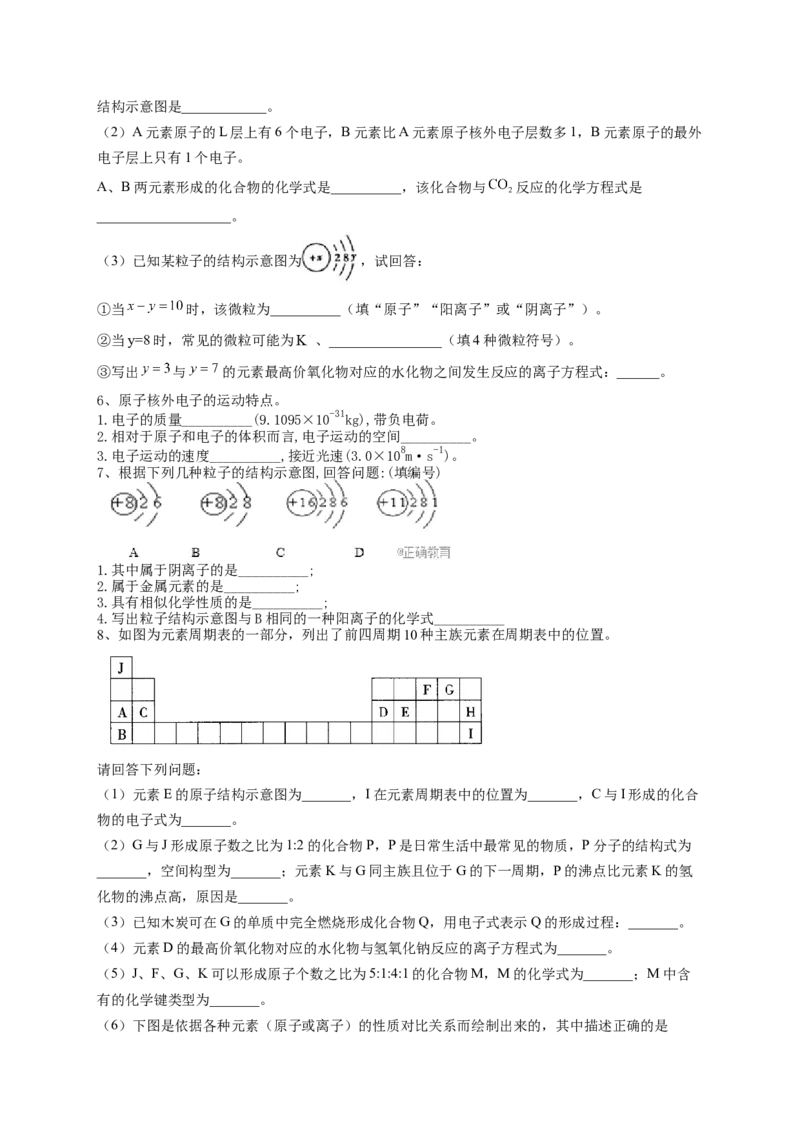
(3)已知某粒子的结构示意图为 ,试回答:
①当 时,该微粒为__________(填“原子”“阳离子”或“阴离子”)。
②当y=8时,常见的微粒可能为 、________________(填4种微粒符号)。
③写出 与 的元素最高价氧化物对应的水化物之间发生反应的离子方程式:______。
6、原子核外电子的运动特点。
-31
1.电子的质量__________(9.1095×10 kg),带负电荷。
2.相对于原子和电子的体积而言,电子运动的空间__________。
8 -1
3.电子运动的速度__________,接近光速(3.0×10 m·s )。
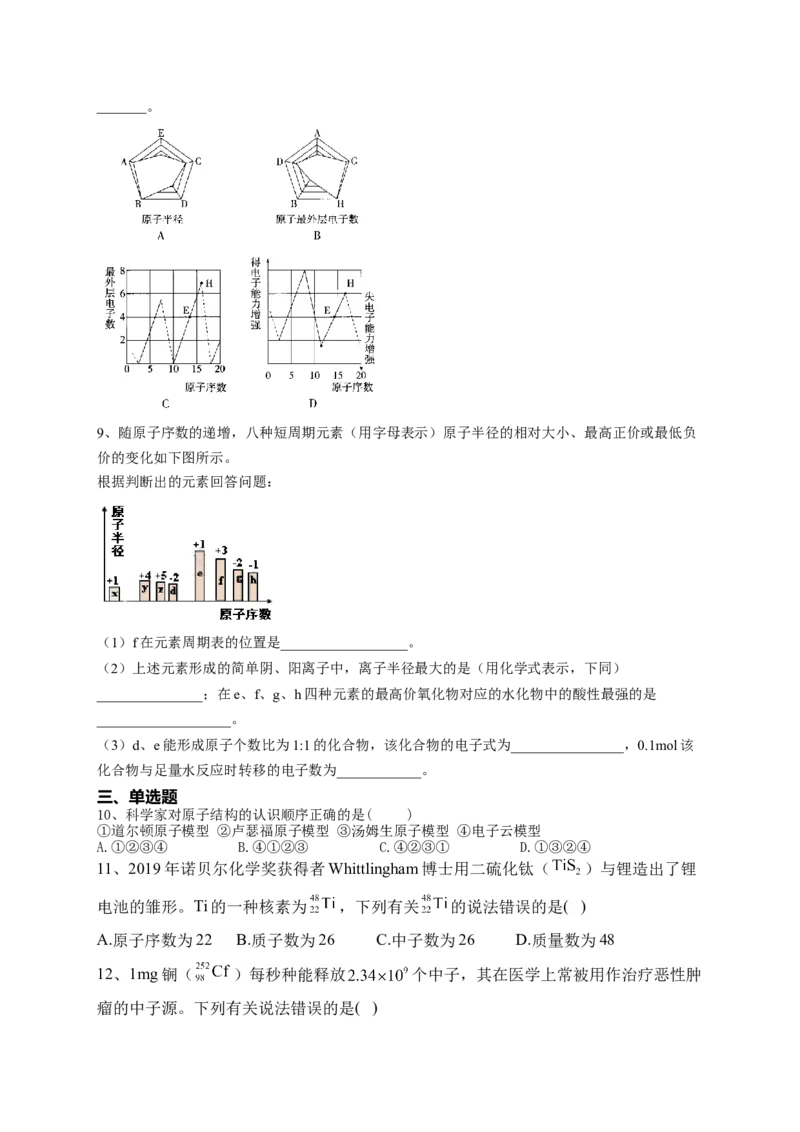
7、根据下列几种粒子的结构示意图,回答问题:(填编号)
1.其中属于阴离子的是__________;
2.属于金属元素的是__________;
3.具有相似化学性质的是__________;
4.写出粒子结构示意图与B相同的一种阳离子的化学式__________
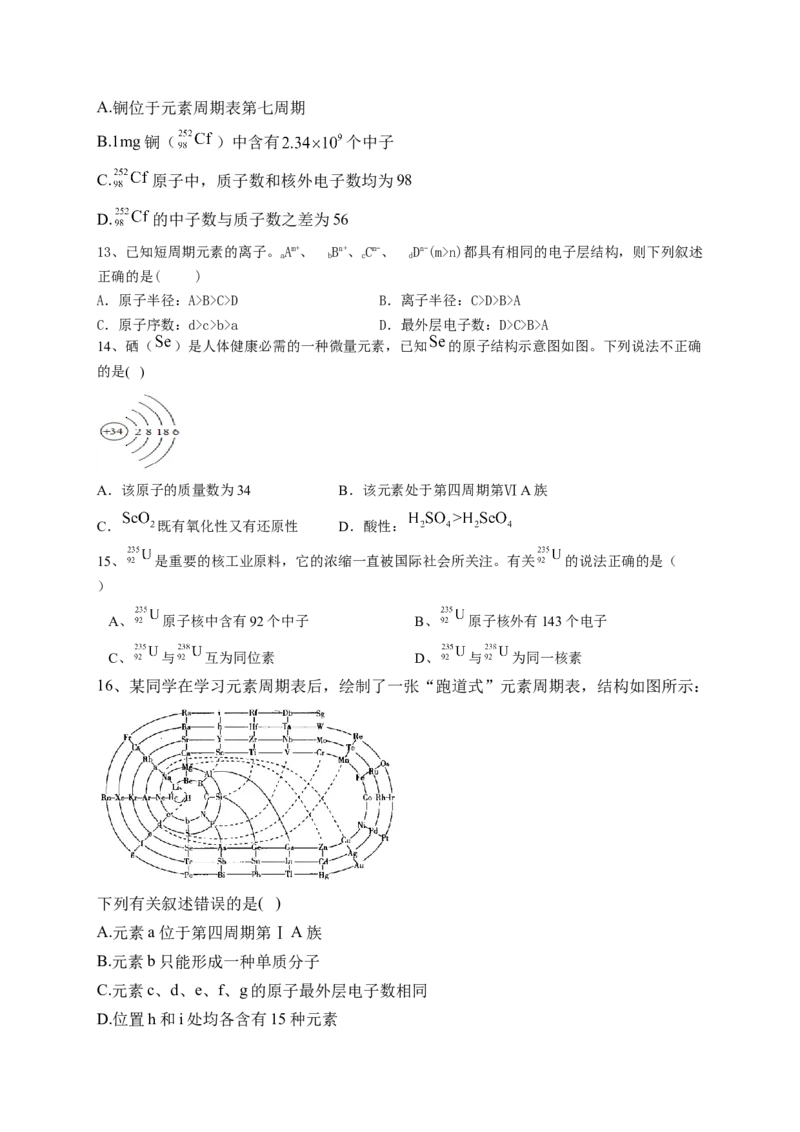
8、如图为元素周期表的一部分,列出了前四周期10种主族元素在周期表中的位置。
请回答下列问题:
(1)元素E的原子结构示意图为_______,I在元素周期表中的位置为_______,C与I形成的化合
物的电子式为_______。
(2)G与J形成原子数之比为1:2的化合物P,P是日常生活中最常见的物质,P分子的结构式为
_______,空间构型为_______;元素K与G同主族且位于G的下一周期,P的沸点比元素K的氢
化物的沸点高,原因是_______。
(3)已知木炭可在G的单质中完全燃烧形成化合物Q,用电子式表示Q的形成过程:_______。
(4)元素D的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式为_______。
(5)J、F、G、K可以形成原子个数之比为5:1:4:1的化合物M,M的化学式为_______;M中含
有的化学键类型为_______。
(6)下图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是_______。
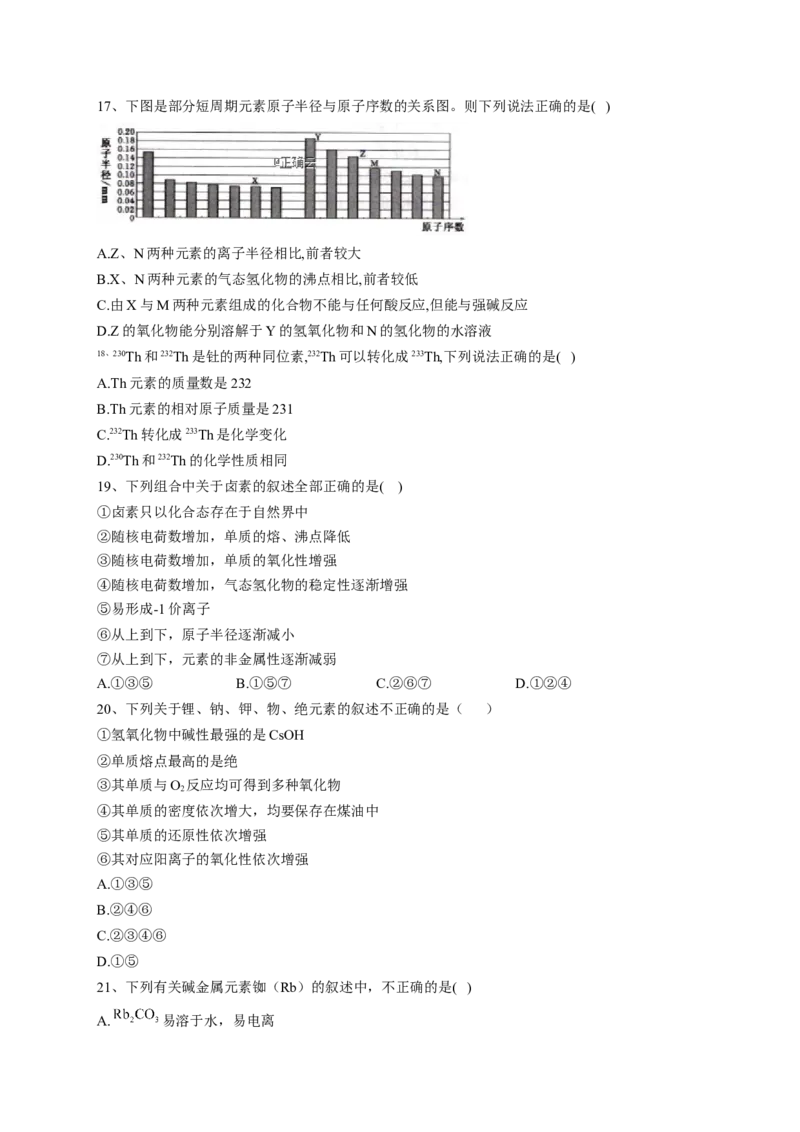
9、随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负
价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________________。
(2)上述元素形成的简单阴、阳离子中,离子半径最大的是(用化学式表示,下同)
_______________;在e、f、g、h四种元素的最高价氧化物对应的水化物中的酸性最强的是
___________________。
(3)d、e能形成原子个数比为1:1的化合物,该化合物的电子式为________________,0.1mol该
化合物与足量水反应时转移的电子数为____________。
三、单选题
10、科学家对原子结构的认识顺序正确的是( )
①道尔顿原子模型 ②卢瑟福原子模型 ③汤姆生原子模型 ④电子云模型
A.①②③④ B.④①②③ C.④②③① D.①③②④
11、2019年诺贝尔化学奖获得者Whittlingham博士用二硫化钛( )与锂造出了锂
电池的雏形。Ti的一种核素为 ,下列有关 的说法错误的是( )
A.原子序数为22 B.质子数为26 C.中子数为26 D.质量数为48
12、1mg锎( )每秒种能释放 个中子,其在医学上常被用作治疗恶性肿
瘤的中子源。下列有关说法错误的是( )A.锎位于元素周期表第七周期
B.1mg锎( )中含有 个中子
C. 原子中,质子数和核外电子数均为98
D. 的中子数与质子数之差为56
13、已知短周期元素的离子。Am+、 Bn+、Cm-、 Dn-(m>n)都具有相同的电子层结构,则下列叙述
a b c d
正确的是( )
A.原子半径:A>B>C>D B.离子半径:C>D>B>A
C.原子序数:d>c>b>a D.最外层电子数:D>C>B>A
14、硒( )是人体健康必需的一种微量元素,已知 的原子结构示意图如图。下列说法不正确
的是( )
A.该原子的质量数为34 B.该元素处于第四周期第ⅥA族
C. 既有氧化性又有还原性 D.酸性:
15、 是重要的核工业原料,它的浓缩一直被国际社会所关注。有关 的说法正确的是(
)
A、 原子核中含有92个中子 B、 原子核外有143个电子
C、 与 互为同位素 D、 与 为同一核素
16、某同学在学习元素周期表后,绘制了一张“跑道式”元素周期表,结构如图所示:
下列有关叙述错误的是( )
A.元素a位于第四周期第ⅠA族
B.元素b只能形成一种单质分子
C.元素c、d、e、f、g的原子最外层电子数相同
D.位置h和i处均各含有15种元素17、下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
18、230Th和232Th是钍的两种同位素,232Th可以转化成233Th,下列说法正确的是( )
A.Th元素的质量数是232
B.Th元素的相对原子质量是231
C.232Th转化成233Th是化学变化
D.230Th和232Th的化学性质相同
19、下列组合中关于卤素的叙述全部正确的是( )
①卤素只以化合态存在于自然界中
②随核电荷数增加,单质的熔、沸点降低
③随核电荷数增加,单质的氧化性增强
④随核电荷数增加,气态氢化物的稳定性逐渐增强
⑤易形成-1价离子
⑥从上到下,原子半径逐渐减小
⑦从上到下,元素的非金属性逐渐减弱
A.①③⑤ B.①⑤⑦ C.②⑥⑦ D.①②④
20、下列关于锂、钠、钾、物、绝元素的叙述不正确的是( )
①氢氧化物中碱性最强的是CsOH
②单质熔点最高的是绝
③其单质与O 反应均可得到多种氧化物
2
④其单质的密度依次增大,均要保存在煤油中
⑤其单质的还原性依次增强
⑥其对应阳离子的氧化性依次增强
A.①③⑤
B.②④⑥
C.②③④⑥
D.①⑤
21、下列有关碱金属元素铷(Rb)的叙述中,不正确的是( )
A. 易溶于水,易电离B.Rb位于周期表第五周期第ⅠA族
C.在钠、钾铷三种单质中,铷的熔点最高
D.氢氧化铷溶液与盐酸反应的离子方程式是
10 11 10
22、已知硼有两种天然核素 B和 B,硼元素的原子量是10.8,则 B的质量分数为( )
5 5 5
A.20% B.小于20% C.大于20% D.80%
23、下列说法正确的是( )
A. 和石墨是具有相同质子数的不同核素
B. 和 互为同系物
C. 和 是同素异形体
D.乙醇和乙醚互为同分异构体参考答案
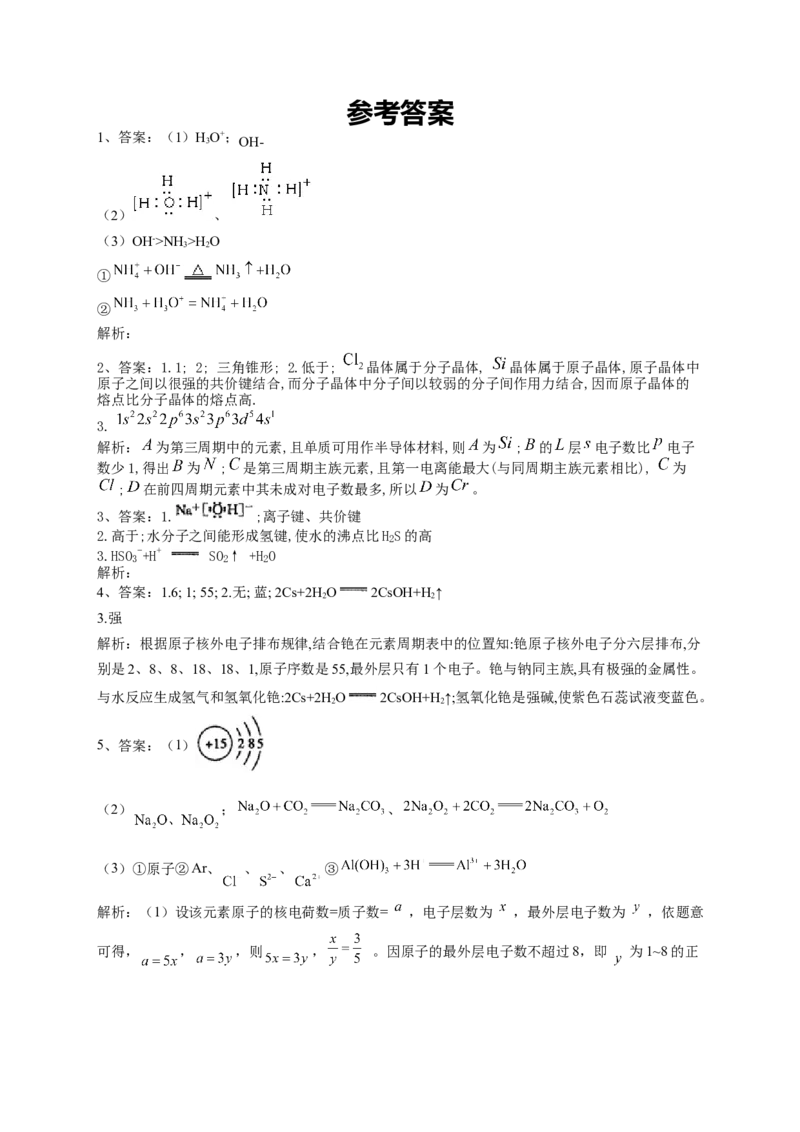
1、答案:(1)HO+;
3 OH-
(2) 、
(3)OH->NH>H O
3 2
①
②
解析:
2、答案:1.1; 2; 三角锥形; 2.低于; 晶体属于分子晶体, 晶体属于原子晶体,原子晶体中
原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的
熔点比分子晶体的熔点高.
3.
解析: 为第三周期中的元素,且单质可用作半导体材料,则 为 ; 的 层 电子数比 电子
数少1,得出 为 ; 是第三周期主族元素,且第一电离能最大(与同周期主族元素相比), 为
; 在前四周期元素中其未成对电子数最多,所以 为 。
3、答案:1. ;离子键、共价键
2.高于;水分子之间能形成氢键,使水的沸点比H S的高
2
- +
3.HSO +H SO ↑ +H O
3 2 2
解析:
4、答案:1.6; 1; 55; 2.无; 蓝; 2Cs+2HO 2CsOH+H ↑
2 2
3.强
解析:根据原子核外电子排布规律,结合铯在元素周期表中的位置知:铯原子核外电子分六层排布,分
别是2、8、8、18、18、1,原子序数是55,最外层只有1个电子。铯与钠同主族,具有极强的金属性。
与水反应生成氢气和氢氧化铯:2Cs+2H O 2CsOH+H ↑;氢氧化铯是强碱,使紫色石蕊试液变蓝色。
2 2
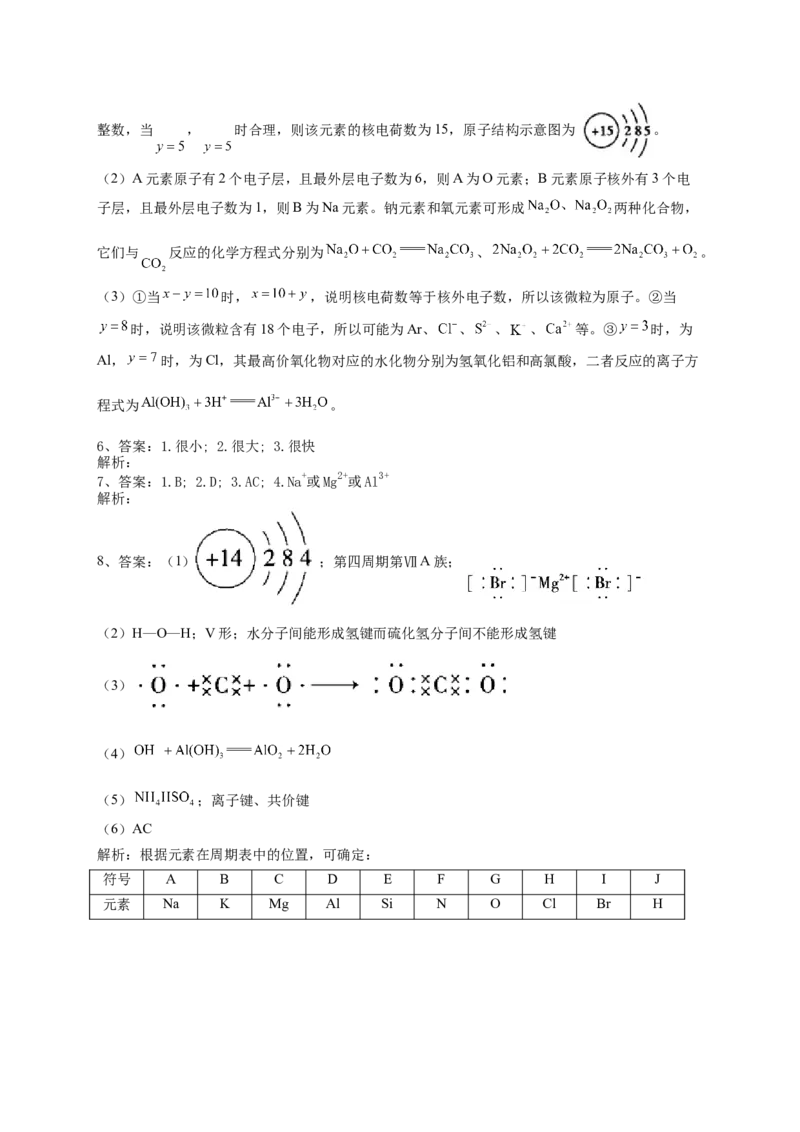
5、答案:(1)
(2) ; 、
(3)①原子②Ar、 、 、 ③
解析:(1)设该元素原子的核电荷数=质子数= ,电子层数为 ,最外层电子数为 ,依题意
可得, , ,则 , 。因原子的最外层电子数不超过8,即 为1~8的正整数,当 , 时合理,则该元素的核电荷数为15,原子结构示意图为 。
(2)A元素原子有2个电子层,且最外层电子数为6,则A为O元素;B元素原子核外有3个电
子层,且最外层电子数为1,则B为Na元素。钠元素和氧元素可形成 两种化合物,
它们与 反应的化学方程式分别为 、 。
(3)①当 时, ,说明核电荷数等于核外电子数,所以该微粒为原子。②当
时,说明该微粒含有18个电子,所以可能为Ar、 、 、 、 等。③ 时,为
Al, 时,为Cl,其最高价氧化物对应的水化物分别为氢氧化铝和高氯酸,二者反应的离子方
程式为 。
6、答案:1.很小; 2.很大; 3.很快
解析:
+ 2+ 3+
7、答案:1.B; 2.D; 3.AC; 4.Na 或Mg 或Al
解析:
8、答案:(1) ;第四周期第ⅦA族;
(2)H—O—H;V形;水分子间能形成氢键而硫化氢分子间不能形成氢键
(3)
(4)
(5) ;离子键、共价键
(6)AC
解析:根据元素在周期表中的位置,可确定:
符号 A B C D E F G H I J
元素 Na K Mg Al Si N O Cl Br H(1)Si原子核外有14个电子,其原子结构示意图为 ;I为Br元素,在元素周期表中的
位置为第四周期第ⅦA族;离子化合物 的电子式为 。
(2)P是 ,其结构式为H—O—H,空间构型为V形;元素K与G(O)同主族且位于G的下
一周期,则K为S元素;由于 分子间存在氢键,而 分子间不存在氢键,故 的沸点比
的要高。
O CO
(3)C和 2完全反应生成 ,用电子式表示 2的形成过程为
。
NaAlO
(4) 与NaOH溶液反应生成 2和水,其离子方程式为
。
(5)H、N、O、S按原子个数比5:1:4:1形成的化合物M为 ,M中含有离子键和共
价键。
(6)A、B、C、D、E分别为Na、K、Mg、Al、Si,原子半径:K>Na>Mg>Al>Si,与图中相符,
A正确;A、B分别为Na、K,最外层电子数相等,而从图中看出A的最外层电子数比B大,B错
误;E为Si元素,H为Cl元素,最外层电子数分别为4和7,与图像相符,C正确;图中信息显示:
失电子能力Cl比Si强,与事实不符,D错误。
9、答案:(1)第3周期,ⅢA族
(2)S2- ; HClO
4
(3) ;6.02×1022或0.1
解析:
10、答案:D
解析:①1803年,英国科学家道尔顿提出了原子论;
②1911年卢瑟福提出原子结构行星模型;
③1904年汤姆生提出的葡萄干面包原子模型;
④1913年玻尔提出轨道式原子模型.
则顺序为①③②④,
故选D.
11、答案:B
解析:A.原子的表示中,左下角表示质子数,根据质子数=核电荷数=原子序数,
的原子序数为22,故A正确;B.原子的表示中,左下角表示质子数, 质子数为22,故B错误;
C. 的质量数为48,质子数为22,则中子数=质量数-质子数=48-22=26,故C正确;
D. 的质量数为48,故D正确;
故选B。
12、答案:B
解析:A.第六周期最后一个元素氡原子序数为86,Cf的质子数为98,原子结构中有7
个电子层,则位于元素周期表中的第七周期,故A正确;
B.1mg锎含中子: ,故B错误;
C.Cf原子中质子数等于电子数为98,故C正确;
D.质子数为98,质量数为252,中子数=质量数-质子数,中子数与质子数之差为154-
98=56,故D正确;
故选B。
13、答案:B
解析:
14、答案:A
解析:
15、答案:C
解析:A、 的中子数为235-92=143,A错误;
B、 原子核中含有92个电子,B错误;
C、 和 属于质子数相同而中子数不同的同一类原子,故互为同位素,C正确;
D、 与 质子数、中子数不全相同,不是同一核素,D错误。
正确答案为C。
16、答案:B
解析:根据编排原则,可知元素a为K元素,在周期表中位于第四周期第ⅠA族,A
项正确;元素b为O元素,可形成 等单质分子,B项错误;元素c、d、e、f、
g分别为F、Cl、Br、I、At,为第ⅦA族元素,其原子最外层均有7个电子,C项正
确;位置h和i分别为镧系和锕系元素,两处均各含有15种元素,D项正确。
17、答案:D
- 3+
解析:根据原子半径的递变规律,X为O,Y为Na,Z为Al,M为Si,N为Cl。离子半径:Cl >Al ,A错
误;沸点:H O>HCl,B错误;SiO 既能与HF反应,也能与NaOH溶液反应,C错误;Al O 是两性氧化物,既
2 2 2 3
可以和NaOH溶液反应,又能与盐酸反应,D正确。
18、答案:D解析:A项,钍的两种核素230Th和232Th,其质量数分别 是230、232,所以错误;B项,元素的相对
原子质量是按各种 天然同位素原子所占的百分比计算出来的平均值,在不知道 各种天然同位素
原子所占的百分比的情况下不能求得其平均 值,所以错误;C项,化学变化是生成新物质的变化,
原子种 类不变,而230Th转换成233U时原子种类发生了变化,所以错 误;D项,同位素的物理性
质不同,但化学性质几乎相同,所 以正确。
19、答案:B
解析:卤素原子最外层有7个电子,极易得到1个电子形成8个电子的稳定结构,所以卤素单质性
质很活泼,极容易和其他物质反应,因此卤素只以化合态存在于自然界中,①正确;随着核电荷
数的增大,卤素单质的状态由气态→液态→固态,单质的熔、沸点升高,②错误;从上到下,卤
素原子的原子半径逐渐增大,原子获得电子的能力逐渐减弱,所以随核电荷数增加,单质的氧化
性逐渐减弱,③错误;从上到下,卤素原子的原子半径逐渐增大,原子获得电子的能力逐渐减弱,
因此与H原子的结合能力逐渐减弱,故随核电荷数增加,气态氢化物的稳定性逐渐减弱,④错误;
卤素原子最外层有7个电子,极易得到1个电子形成8个电子的稳定结构,因此易形成-1价离子,
⑤正确;从上到下,卤素的原子序数逐渐增大,原子核外电子层数逐渐增多,因此原子半径逐渐
增大,⑥错误;卤族元素从上到下,原子半径逐渐增大,原子核对核外电子的吸引力逐渐减弱,
原子失去电子的能力逐渐增强,获得电子的能力逐渐减弱,所以元素的非金属性逐渐减弱,⑦正
确。故正确的说法有①⑤⑦,故选B。
20、答案:C
解析:根据元素周期律可知,Li、Na、K、Rb、Cs的金属性逐渐增强,氢氧化物中碱性最强的为
CsOH,①正确;单质熔点最高的为Li,②错误;Li与O 反应时只生成LiO,③错误;K的密度
2 2
小于Na的,反常,Li的密度小于煤油的,常保存在液态石蜡中,④错误;由于Li、Na、K、Rb、
Cs的金属性依次增强,故其单质的还原性依次增强,对应阳离子的氧化性依次减弱,⑤正确,⑥
错误。
21、答案:C
解析: Rb在元素周期表中位于钾元素的下方,故Rb位于元素周期表第五周期第ⅠA族,且化学
性质与钾元素相似, 易溶于水,易电离,A、B正确;钠、钾、铷熔点依次降低,故铷的
熔点最低,C错误;氢氧化铷是可溶性强碱,故其溶液与盐酸反应的离子方程式是
,D正确。
22、答案:B
解析:
23、答案:B
解析: