文档内容
人教版(2019)必修一第四章第一节 原子结构与元素周期表
课时训练
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1、2016年IUPAC命名117号元素为Ts,其最外层电子数为7,下列说法不正确的是(
)
A.Ts是第七周期第ⅦA族元素 B.Ts的最高化合价为+7价
C.Ts的同位素原子具有相同的质子数 D.Ts在同族元素中非金属性最强
2、通过下列实验可以比较出卤素单质氧化性的强弱。下列说法错误的是( )
A. 起到萃取、富集 的作用
B.a中下层无色,说明转化为
C.步骤Ⅱ中发生反应的离子方程式为
D.依据a、b中现象,可以证明 的氧化性比 强
3、有下列8种化学符号: 、 、 、 、 、 、 、 。下列说法错误的是(
)
A.8种化学符号分别表示6种元素
B.8种化学符号分别表示8种核素
C.8种微粒中只有两种互为同位素
D.8种微粒中只有两种中子数相等,但质子数不相等
4、含铱元素的小行星撞击地球可能是造成恐龙灭绝的原因。铱的密度仅次于锇,化学性质与铂相
似,其有多种天然同位素, 是最稳定的一种放射性同位素。下列有关叙述中正确的是( )
A. 中的质子数比中子数少115
B. 的核外电子数为77
C.铱单质能与稀盐酸反应生成
D.Ir元素的相对原子质量为1925、碱金属元素都是典型的活泼金属,其原因是( )
A.密度小,熔、沸点低 B.最外层只有一个电子,容易失去
C.常温下易液化 D.在自然界中无游离态存在
6、下列关于碱金属元素和卤族元素的说法错误的是( )
A.由于钠和钾的原子结构极为相似,所以它们对应的碱都是强碱
B.通过钠与钾分别与水反应的剧烈程度可知,碱金属原子半径越大,失电子能力越强
C.通过卤素单质与氢气反应所需要的反应条件,可以判断氯的非金属性比溴强
D.卤族元素对应的氢化物的稳定性从强到弱的顺序为HI>HBr>HCl>HF
7、在元素周期表中,同主族元素原子具有相同的( )
A.最外层电子数 B.核电荷数
C.电子层数 D.核外电子数
8、下列各对物质中,互为同位素的是( )
①
②
③
④金刚石、石墨
⑤
⑥
A.①②③ B.①③ C.③④⑤ D.④⑤⑥
9、参阅下列有关元素E两种同位素的资料。
同位
同位素相对原子质量 原子个数的百分率
素
103 20%
105 80%
元素E的相对原子质量是( )
A.103.4 B.103.6 C.104.0 D.104.6
10、根据表中部分短周期元素的原子半径和主要化合价信息,判断以下叙述正确的是( )
元素代号 L M Q R T
0.11
原子半径/nm 0.154 0.099 0.102 0.073
8主要化合价 +1 +3 +7、-1 +6、-2 -2
A.氢化物的沸点:H Tr(T2-)>r(M3+)
11、下列说法正确的是( )
A.所有金属元素都分布在d区和ds区
B.元素周期表ⅢB到ⅡB族10个纵行的元素都是金属元素
C.最外层电子数为2的元素都分布在S区
D.S区均为金属元素
12、元素周期表和元素周期律对其他与化学相关的科学技术有指导作用。下列说法错
误的是( )
A.铝元素位于周期表中金属元素与非金属元素分界处,故金属铝具有氧化性和还原性
B.制造农药的主要元素是在右上方区域的非金属元素
C.作催化剂的主要元素分布在过渡元素区域
D.在周期表中金属元素与非金属元素的分界处,可以找到半导体材料
13、碱金属元素具有相似的化学性质,是由于它们的原子具有相同的( )
A.原子半径 B.电子层数 C.核外电子数 D.最外层电子数
14、核电荷数为16的元素与核电荷数为4的元素的原子相比较,前者的下列数据是后
者的4倍的是( )
A.K层电子数 B.最外层电子数 C.电子层数 D.次外层电子数
15、下列说法中一定错误的是( )
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的质子数与最外层电子数相等
二、填空题
16、汤姆生的“葡萄干面包式”原子结构模型:
英国物理学家汤姆生他在1897年发现了原子中存在________,并用实验方法测出了电
子的质量。他推测这种粒子均匀地嵌在云状的_________中。
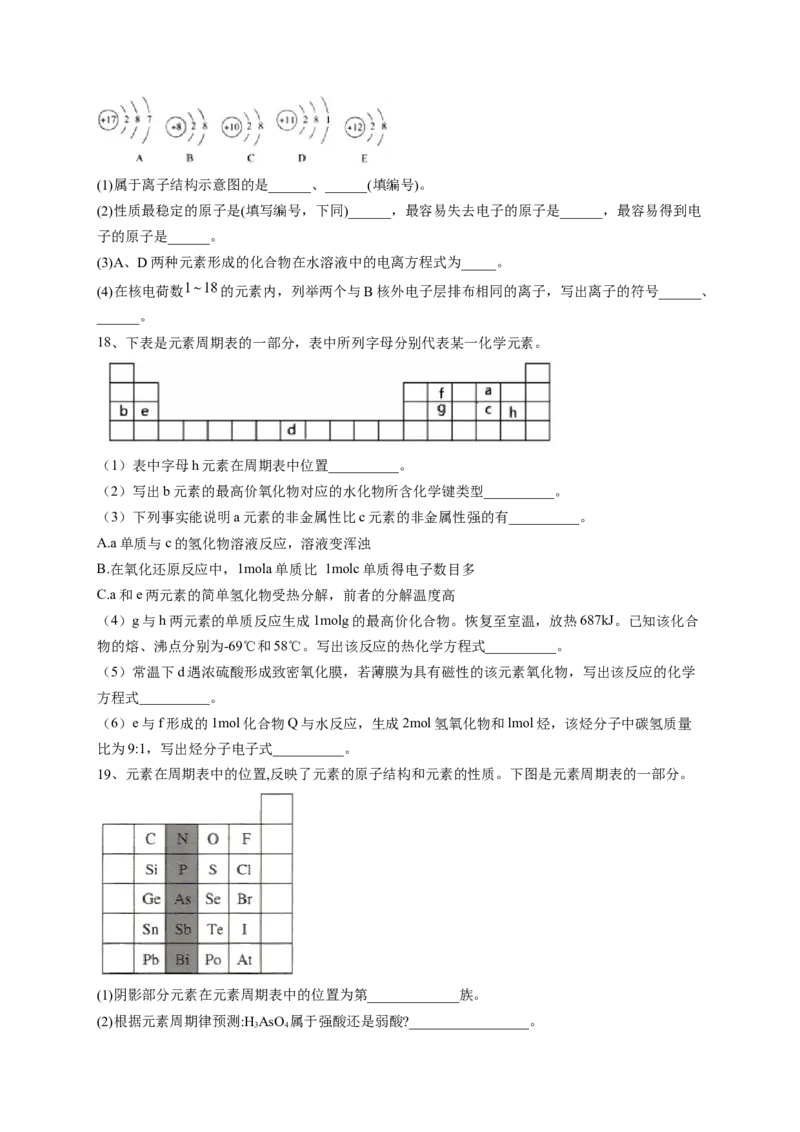
17、观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:(1)属于离子结构示意图的是______、______(填编号)。
(2)性质最稳定的原子是(填写编号,下同)______,最容易失去电子的原子是______,最容易得到电
子的原子是______。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式为_____。
(4)在核电荷数 的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号______、
______。
18、下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
(1)表中字母h元素在周期表中位置__________。
(2)写出b元素的最高价氧化物对应的水化物所含化学键类型__________。
(3)下列事实能说明a元素的非金属性比c元素的非金属性强的有__________。
A.a单质与c的氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mola单质比 1molc单质得电子数目多
C.a和e两元素的简单氢化物受热分解,前者的分解温度高
(4)g与h两元素的单质反应生成1molg的最高价化合物。恢复至室温,放热687kJ。已知该化合
物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式__________。
(5)常温下d遇浓硫酸形成致密氧化膜,若薄膜为具有磁性的该元素氧化物,写出该反应的化学
方程式__________。
(6)e与f形成的1mol化合物Q与水反应,生成2mol氢氧化物和lmol烃,该烃分子中碳氢质量
比为9:1,写出烃分子电子式__________。
19、元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(1)阴影部分元素在元素周期表中的位置为第_____________族。
(2)根据元素周期律预测:H AsO 属于强酸还是弱酸?_________________。
3 4(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,试写出其完全燃烧的化
学方程式:__________________。
(4)试比较S、O、F三种元素的原子半径大小:_________________(填元素符号)。
20、甲元素位于元素周期表的第3周期IIA族,乙元素的原子结构示意图为
1.写乙元素的元素符号:___________。
2.甲元素原子核外有_________个电子层。
3.甲元素的金属性(即原子失电子的能力)比乙元素_________(填“强”或“弱”)。
三、实验题
21、利用下图装置可以验证非金属性的变化规律。
1.仪器A的名称为________,干燥管D的作用是 ______________________。
2.实验室中现有药品NaS、KMnO、浓盐酸、MnO,请选择合适药品设计实验验证氯的非金属性大
2 4 2
于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有
淡黄色沉淀生成,离子方程式为______________。
3.若要证明非金属性:C>Si,则A中加________、B中加NaCO、C中加________,观察到C中溶
2 3
液的现象为__________________________。
22、两个化学兴趣小组拟通过实验探究同主族元素性质的递变规律。
Ⅰ.第一小组同学探究元素Cl、Br、I的非金属性强弱,设计的实验方案如下:
(1)补充下列实验报告中的实验现象和离子方程式
实验步骤 实验现象 实验结论及离子方程式
离子方程式
甲:_______
甲中溶液由无色变成橙色
乙中溶液____ 乙:
结论:卤素单质的氧化性由强
到弱的顺序为
(2)该小组设计的实验方案_________(填“合理”或“不合理”),理由是_________。
Ⅱ.第二小组同学探究元素C、Si的非金属性强弱,设计的实验方案如下:(3)球形干燥管D的作用为_________。
(4)该小组同学用盐酸、 和 溶液,按图装置进行实验,观察到试管C中溶液有白
色沉淀生成,甲同学认为非金属性C>Si。但乙同学认为此方案不合理,理由是_________。
改进措施:在B、C两装置之间接一个盛有_________溶液的洗气瓶。参考答案
1、答案:D
解析:A.Ts的原子序数为117,位于第七周期,其最外层电子数为7,则Ts位于第
ⅦA族,则Ts是第七周期第ⅦA族元素,故A正确;
B.Ts的原子核外最外层电子数是7,因此Ts的最高化合价为+7价,故B正确;
C.同位素具有相同质子数、不同中子数,则Ts的同位素原子具有相同的质子数,故C
正确;
D.同主族从上到下非金属性减弱,因此Ts的非金属性比同主族元素弱,故D错误;
故选D。
2、答案:B
CCl
解析:碘单质易溶于四氯化碳,根据“下层紫红色”可知 4起到莘取、富集 的作用,A项正
确。四氯化碳不溶于水且密度比水大,碘单质在四氯化碳中的溶解度大于在水中的溶解度,四氯
I IO
化碳层为紫红色,上层溶液中的溶质主要是氯化钾,继续滴加氯水后, 2被 氧化成 3,下层
由紫红色变成无色,B项错误。溴单质的氧化性强于碘单质,所有溴单质能将碘离子氧化成碘单质,
故步骤Ⅱ中发生反应的离子反应方程式为 ,C项正确。继续滴加氯水能将碘
IO
单质氧化成无色的 3,而继续滴加溴水,下层仍呈紫红色,说明氯气的氧化性强于溴单质,D项
错误。
3、答案:B
2H
解析:A项,有H、C、Li、Na、N、Mg6种元素,正确;B项, 和1 2属于单质,因此不是核
素,错误;C项,只有 和 互为同位素,正确;D项 , 只 有 和 的中子数相等,
但质子数不相等,正确。
4、答案:B
解析:根据核素的表示方法可知, 的质量数为192,质子数为77,中子数为192-77=115,所
以质子数比中子数少38,A项错误;原子中,核电荷数=质子数=核外电子数=元素的原子序数,所
以 的核外电子数为77,B项正确;铂的性质稳定,与强酸不发生反应,铱单质化学性质与铂
相似,不能与强酸反应,C项错误;元素的相对原子质量取决于各天然同位素在自然界的丰度,Ir
元素有多种天然同位素,其相对原子质量不等于192,D项错误。
5、答案:B
解析:碱金属元素最外层均只有1个电子,在化学反应中极易失去电子,化学性质非
常活泼,即碱金属元素都是典型的活泼金属的原因是最外层只有一个电子,容易失去;
故选B。6、答案:D
解析:钠和钾的原子结构极为相似,NaOH、KOH均为强碱,A正确;碱金属元素原子半径越大,
越易失电子,和水反应越剧烈,B正确;元素非金属性越强,越易与 反应,结合 与
的反应条件可知非金属性:Cl>Br,C正确;卤化氢的稳定性顺序与卤素单质的氧化性顺序一致,
即稳定性:HF>HCl>HBr>HI,D错误。
7、答案:A
解析:在元素周期表中,同主族元素最外层电子数相同,从上到下,核电荷数、电子
层数和核外电子数都逐渐增大,故选A。
8、答案:B
解析:同位素是指质子数相同,而中子数不同的同一元素的不同核素(原子)互为同
位素。
① 是同元素的不同原子,是氢元素的同位数,故正确 ;
② 组成和构成相同,是一种物质不是同位素,故错误;
③ 是同元素的不同原子,是氯元素的同位素,故正确;
④金刚石、石墨是同种元素组成的不同单质,属于同素异形体,故错误;
⑤ 是同种元素组成的不同单质,属于同素异形体,故错误;
⑥ 是氢气,分子; 是氢离子,故错误;
答案选B。
9、答案:D
解析:根据元素相对原子质量的计算公式可知元素E的相对原子质量=103×20%
+105×80%=104.6,故选D。
10、答案:B
解析:由表中信息可知,T最低价为-2、无正合价,则T为O元素:R的最低价也是-2,其原子半
径大于T,所以R为S元素;Q的最低价为-1、最高价为+7,其原子半径比O原子大、比S原子小,
所以Q为Cl元素;由L、M的化合价可以判断它们分别位于第ⅠA、第ⅢA族,由同周期元素原
子半径的变化规律可知,L为Na,M为Al.A.水分子之间可以形成氢键,所以水的沸点高于硫化氢,
A不正确;B.L和Q形成的化合物是氯化钠,其中两种离子最外层均达到8电子稳定结构,B正确:
C.钠的还原性强于铝,C不正确;D.简单离子半径的大小顺序为 ,D不
正确。本题选B。
11、答案:B
解析:A、所有金属元素都分布在s区、d区和ds区;B、元素周期表中ⅢB族到ⅡB
族10个纵行的元素,称为过渡元素全部为金属;C、第ⅡB族最外层电子数为2,在ds区;D、S区均的氢为非金属元素。A、所有金属元素都分布在s区、d区和ds区,
故A错误;B、元素周期表中ⅢB族到ⅡB族10个纵行的元素,称为过渡元素全部为
金属,故B正确;C、第ⅡB族最外层电子数为2,在ds区,故C错误;D、S区均的
氢为非金属元素,故D错误;故选B。
12、答案:A
解析:金属铝只有还原性,没有氧化性,A错误;元素周期表右上方的F、Cl、S、
P、As等非金属元素可用于制造农药,B正确;催化剂多为过渡元素区域的金属元素
的单质或化合物,C正确;一般在金属元素与非金属元素的交界处可寻找半导体材料,
D正确。
13、答案:D
解析:决定元素原子化学性质的主要因素是最外层电子数,碱金属元素的最外层电子
数都是1个,所以化学性质相似,故D正确;
故选D。
14、答案:D
解析:A.核电荷数为16的元素K层电子数为2,核电荷数为4的元素K层电子数为
2,两者相等,故A不符合题意;
B.核电荷数为16的元素最外层电子数为6,核电荷数为4的元素最外层电子数为2,
前者是后者3倍,故B不符合题意;
C.核电荷数为16的元素电子层数为3层,核电荷数为4的元素电子层数为2层,前者
是后者1.5倍,故C不符合题意;
D.核电荷数为16的元素次外层电子数为8,核电荷数为4的元素次外层电子数为2,
前者是后者4倍,故D符合题意。
故选D。
15、答案:B
解析:A项,H原子K层上只有1个电子,正确;B项,存在M层则L层一定有8个电子,M层
最多能容纳18个电子,因此M层上电子数不可能为L层电子数的4倍,错误;C项,该离子可以
是 、 等,正确;D项, 的质子数为8,最外层电子数也为8,正确。
16、答案:电子;正电荷球体
解析:略
17、答案:(1)B;E
(2)C;D;A(3)
(4) ;
解析:根据结构示意图可知A是氯原子,B是氧离子,C是氖原子,D是钠原子,E是镁离子。
(1)结构示意图中质子数与电子数不相等的是离子,故属于离子结构示意图的是B、E。
(2) C原子的最外层已达到8电子的稳定结构,性质最稳定;D的最外层只有1个电子,容易失去
电子,A的最外层有7个电子,容易得到电子。
(3)A、D两种元素形成的化合物为NaCl,在水溶液中电离出钠离子和氯离子,电离方程式为
。
(4)最外层有10个电子的离子有氧离子、氟离子、钠离子镁离子、铝离子等。
18、答案:(1)第三周期,ⅦA族
(2)离子键、(极性)共价键
(3)AC
(4)
(5)
(6)
解析:
19、答案:(1)VA
(2)弱酸
(3)SiH+2O SiO 2HO
4 2 2+ 2
(4)S>O>F
解析:(1)图中阴影部分为氮族元素,即第VA族。
(2)在周期表中,砷元素的非金属性比磷元素弱,磷酸属于中强酸,故HAsO 属于弱酸。
3 4
(3)甲烷(CH)燃烧产生二氧化碳和水,硅烷(SiH)的性质与甲烷相似,它在空气中燃烧的
4 4
产物应该是水和硅的氧化物,即SiH+O SiO+2H O。
4 2 2 2
(4)S与O同主族,原子序数S>O,故原子半径S>O;O与F同周期,原子序数OF,所以原子半径:S>O>F。
20、答案:1.Na
2.3
3.弱
解析:
21、答案:1. 分液漏斗;防止倒吸
2.浓盐酸;KMnO;NaS;S2-+Cl=S↓+2Cl-
4 2 23.硫酸;NaSiO;有白色胶状沉淀产生
2 3
解析:
22、答案:(1)由无色变成黄褐色;
(2)不合理;该实验只能证明 的氧化性强于 和 ,无法判断 和 氧化性强弱关系
(3)防止倒吸
(4)盐酸有挥发性,挥发出的HCl和 溶液反应也会产生白色沉淀;饱和
解析:(1)甲试管中氯水与NaBr发生反应,溶液由无色变为橙色,其离子方程式为
;乙试管中氯水与NaI发生反应,可看到溶液由无色变为黄褐色,离子方
程式为 。
(2)该实验只能证明 的氧化性强于 和 ,无法判断 和 氧化性强弱关系,因此不合理。
(3)球形干燥管D的容积较大,能够防止倒吸,避免C中液体进入锥形瓶中。
(4)B中制得的 中混有盐酸挥发出的HCl,HCl能和 溶液反应生成硅酸沉淀,即无
法证明是 与 溶液反应。为了防止HCl产生干扰,应在B、C装置间连接盛有饱和
溶液的洗气瓶,除去 中的HCl。