文档内容
哈九中 2024 级高一学年上学期期末考试
化学试卷
(考试时间:90分钟 满分:100分 共4页 )
Ⅰ卷(共46分)
可能用到的相对原子质量:C—12 N—14 O—16 S—32 Cl—35.5 Fe—56
一、单项选择题(每小题只有1个选项符合题意,每题2分,共28分)
1.丰富多样的历史文物不仅能彰显文化自信,也蕴含着许多化学知识。下列说法不正确的是
A.《吕氏春秋》中记载“金(铜)柔锡柔,合两柔则为刚”,体现出合金的硬度通常大于各组分金属
B.古代花鸟画中经常使用颜料铜绿,其主要成分是Cu (OH) CO,不与酸和碱发生反应
2 2 3
C.越王勾践剑的主要成分为铜锡合金,千年不腐,说明该合金的抗腐蚀性好
D.许多工艺品是白瓷器,为保证其颜色纯净,生产工艺中必须降低釉料中Fe O 的含量
2 3
2.下列物质中在水溶液或熔融状态下均不导电的是
A.醋酸 B.硫酸钡 C.氯化氢 D.乙醇
3.下列化学用语表示不正确的是
A.用电子式表示K2S形成:
B.中子数为1的氢原子:
C. 和 互为同位素
D.S2-的结构示意图:
4.下列有关物质性质与其应用的对应关系,不正确的是
A.Fe(OH) 胶体具有吸附性,可用于净水
3
B.Al不能在常温下与氧气反应,铝制品可用于制作窗框、门框
C.NaO 能与水和二氧化碳反应生成氧气,可用作呼吸面具的供氧剂
2 2
D.CaO能与水反应,生石灰可作为干燥剂
5.用N 表示阿伏加德罗常数的值,下列说法正确的是
A
A.46g NO 和NO 的混合物中所含氧原子数为N
2 2 4 A
B.1 mol OH-中含有N 个共价键
A
C.22.4 L O 中含有 N 个O 分子
2 A 2
D.2 mol HCl气体中含有2N 个H+
A
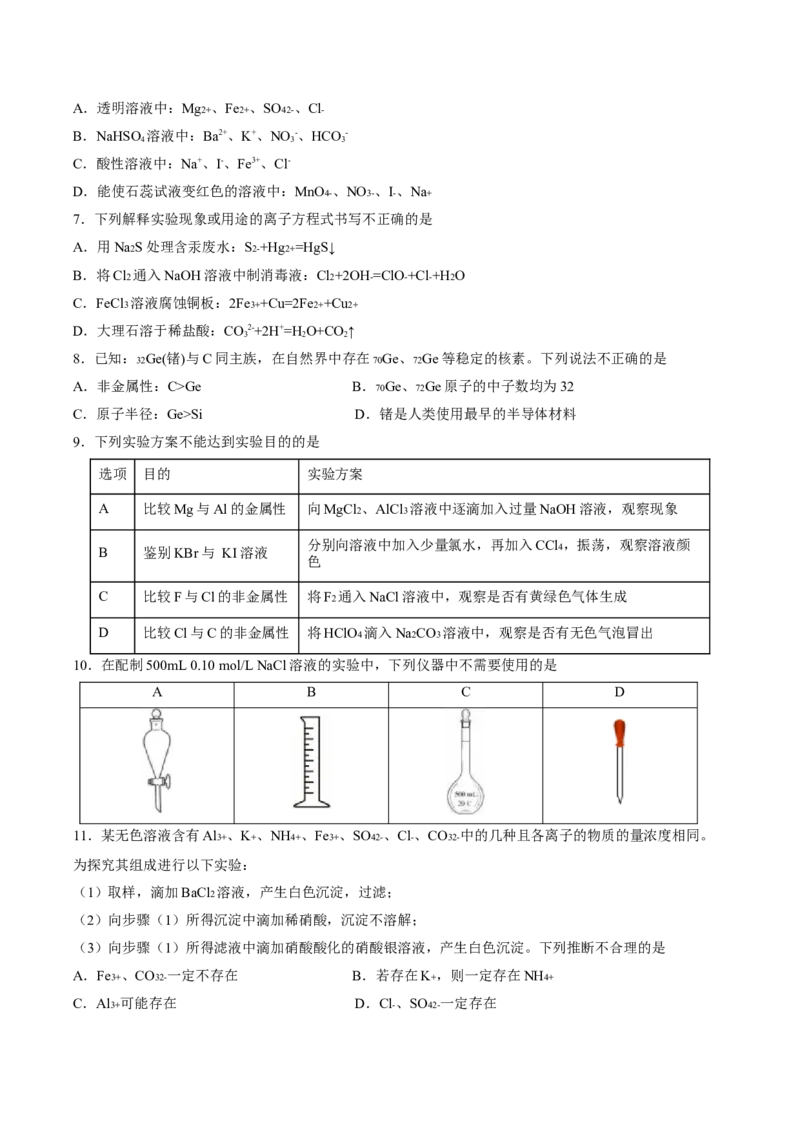
6.下列各组离子在指定溶液中能大量共存的是A.透明溶液中:Mg2+ 、Fe2+ 、SO42- 、Cl-
B.NaHSO 溶液中:Ba2+、K+、NO -、HCO -
4 3 3
C.酸性溶液中:Na+、I-、Fe3+、Cl-
D.能使石蕊试液变红色的溶液中:MnO4- 、NO3- 、I- 、Na+
7.下列解释实验现象或用途的离子方程式书写不正确的是
A.用Na2S处理含汞废水:S2-+Hg2+=HgS↓
B.将Cl2 通入NaOH溶液中制消毒液:Cl2+2OH-=ClO-+Cl-+H2O
C.FeCl3 溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
D.大理石溶于稀盐酸:CO2-+2H+=H O+CO↑
3 2 2
8.已知: 32Ge(锗)与C同主族,在自然界中存在 70Ge、 72Ge等稳定的核素。下列说法不正确的是
A.非金属性:C>Ge B. 70Ge、 72Ge原子的中子数均为32
C.原子半径:Ge>Si D.锗是人类使用最早的半导体材料
9.下列实验方案不能达到实验目的的是
选项 目的 实验方案
A 比较Mg与Al的金属性 向MgCl2 、AlCl3 溶液中逐滴加入过量NaOH溶液,观察现象
B 鉴别KBr与 KI溶液
分别向溶液中加入少量氯水,再加入CCl4 ,振荡,观察溶液颜
色
C 比较F与Cl的非金属性 将F2 通入NaCl溶液中,观察是否有黄绿色气体生成
D 比较Cl与C的非金属性 将HClO4 滴入Na2CO3 溶液中,观察是否有无色气泡冒出
10.在配制500mL 0.10 mol/L NaCl溶液的实验中,下列仪器中不需要使用的是
A B C D
11.某无色溶液含有Al3+ 、K+ 、NH4+ 、Fe3+ 、SO42- 、Cl- 、CO32- 中的几种且各离子的物质的量浓度相同。
为探究其组成进行以下实验:
(1)取样,滴加BaCl2 溶液,产生白色沉淀,过滤;
(2)向步骤(1)所得沉淀中滴加稀硝酸,沉淀不溶解;
(3)向步骤(1)所得滤液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀。下列推断不合理的是
A.Fe3+ 、CO32- 一定不存在 B.若存在K+ ,则一定存在NH4+
C.Al3+ 可能存在 D.Cl- 、SO42- 一定存在12.X、Y、Z、W是原子序数依次增大的短周期主族元素,X与W同主族且质子数之和为12,Y、Z同周
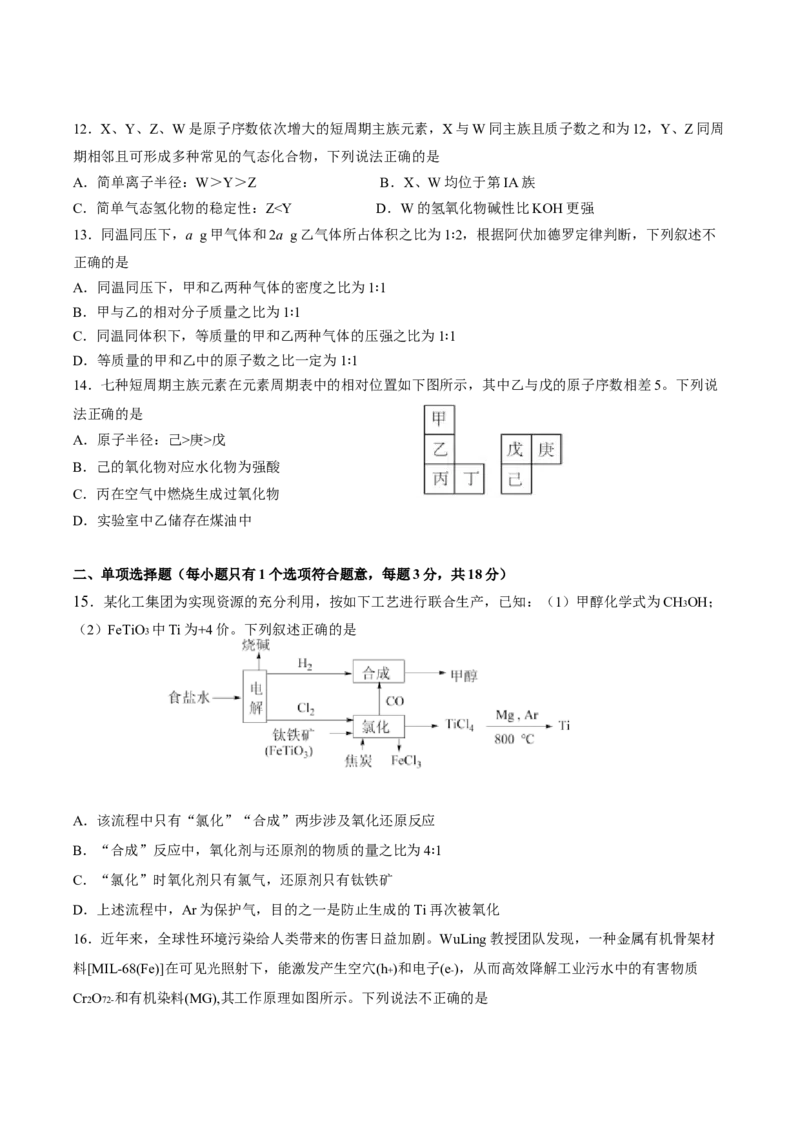
期相邻且可形成多种常见的气态化合物,下列说法正确的是
A.简单离子半径:W>Y>Z B.X、W均位于第IA族
C.简单气态氢化物的稳定性:Z庚>戊
B.己的氧化物对应水化物为强酸
C.丙在空气中燃烧生成过氧化物
D.实验室中乙储存在煤油中
二、单项选择题(每小题只有1个选项符合题意,每题3分,共18分)
15.某化工集团为实现资源的充分利用,按如下工艺进行联合生产,已知:(1)甲醇化学式为CH3OH;
(2)FeTiO3 中Ti为+4价。下列叙述正确的是
A.该流程中只有“氯化”“合成”两步涉及氧化还原反应
B.“合成”反应中,氧化剂与还原剂的物质的量之比为4 1
C.“氯化”时氧化剂只有氯气,还原剂只有钛铁矿 ∶
D.上述流程中,Ar为保护气,目的之一是防止生成的Ti再次被氧化
16.近年来,全球性环境污染给人类带来的伤害日益加剧。WuLing教授团队发现,一种金属有机骨架材
料[MIL-68(Fe)]在可见光照射下,能激发产生空穴(h+)和电子(e-),从而高效降解工业污水中的有害物质
Cr2O72- 和有机染料(MG),其工作原理如图所示。下列说法不正确的是A.该金属有机骨架材料在可见光激发下产生的空穴和电子数量相同
B.光生空穴具有强氧化性,能将有机物(MG)氧化成无毒的CO2 和H2O
C.在该过程中,每生成2 mol Cr3+ ,理论上需要提供3mol电子
D.MIL-68(Fe)处理污水有毒物,是一种温和、绿色的方法
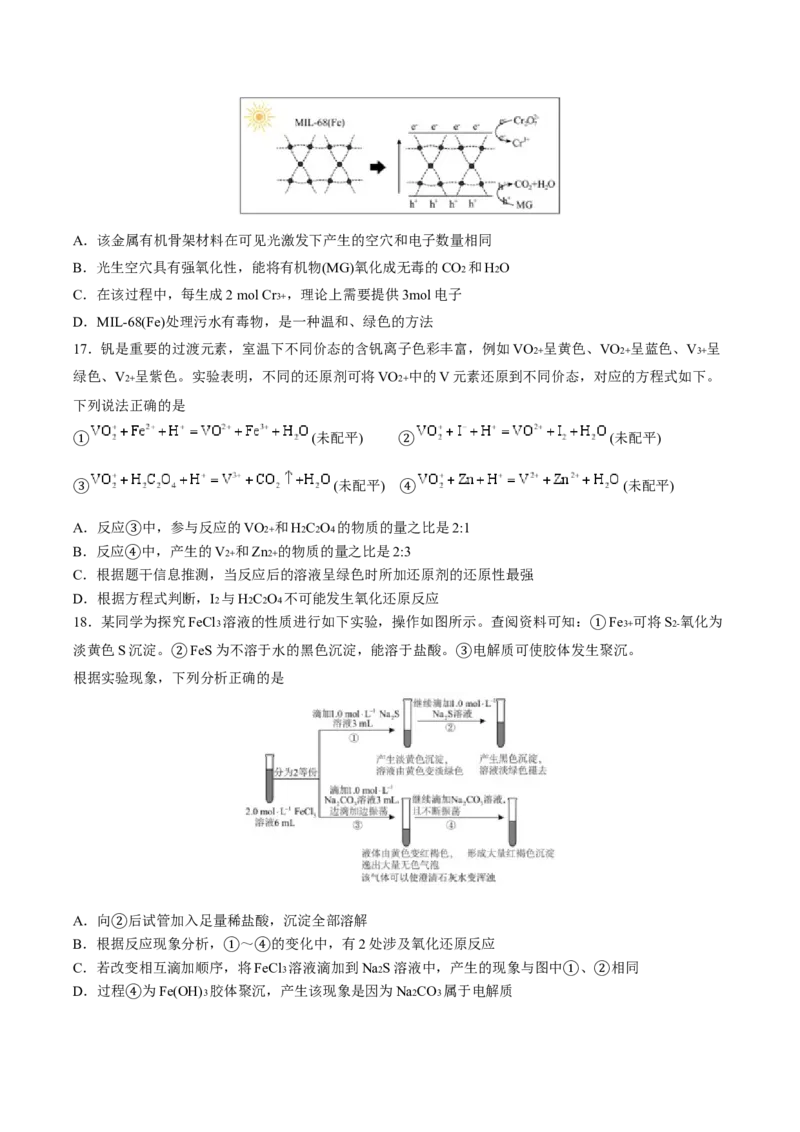
17.钒是重要的过渡元素,室温下不同价态的含钒离子色彩丰富,例如VO2+ 呈黄色、VO2+ 呈蓝色、V3+ 呈
绿色、V2+ 呈紫色。实验表明,不同的还原剂可将VO2+ 中的V元素还原到不同价态,对应的方程式如下。
下列说法正确的是
(未配平) (未配平)
① ②
(未配平) (未配平)
③ ④
A.反应 中,参与反应的VO2+ 和H2C2O4 的物质的量之比是2:1
B.反应 中,产生的V2+ 和Zn2+ 的物质的量之比是2:3
③
C.根据题干信息推测,当反应后的溶液呈绿色时所加还原剂的还原性最强
④
D.根据方程式判断,I2 与H2C2O4 不可能发生氧化还原反应
18.某同学为探究FeCl3 溶液的性质进行如下实验,操作如图所示。查阅资料可知: Fe3+ 可将S2- 氧化为
淡黄色S沉淀。 FeS为不溶于水的黑色沉淀,能溶于盐酸。 电解质可使胶体发生
①
聚沉。
根据实验现象,下列分析正确的是
② ③
A.向 后试管加入足量稀盐酸,沉淀全部溶解
B.根据反应现象分析, ~ 的变化中,有2处涉及氧化还原反应
②
C.若改变相互滴加顺序,将FeCl3 溶液滴加到Na2S溶液中,产生的现象与图中 、 相同
① ④
D.过程 为Fe(OH)3 胶体聚沉,产生该现象是因为Na2CO3 属于电解质
① ②
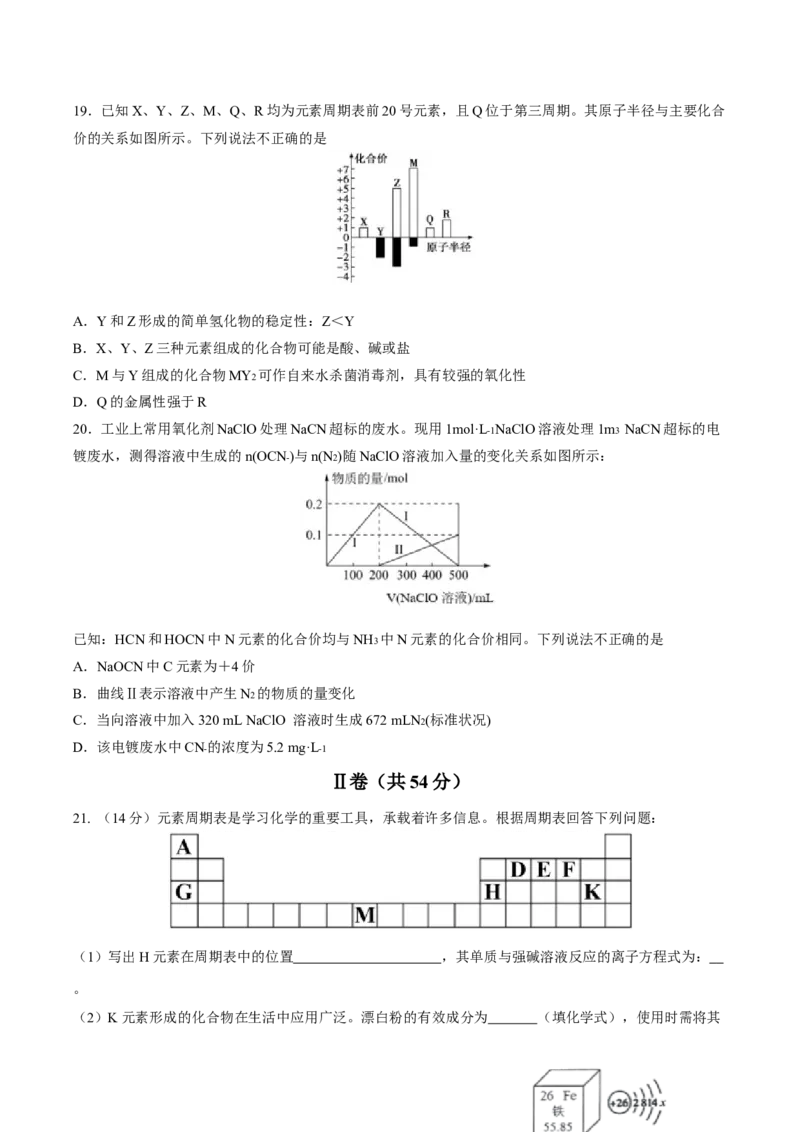
④19.已知X、Y、Z、M、Q、R均为元素周期表前20号元素,且Q位于第三周期。其原子半径与主要化合
价的关系如图所示。下列说法不正确的是
A.Y和Z形成的简单氢化物的稳定性:Z<Y
B.X、Y、Z三种元素组成的化合物可能是酸、碱或盐
C.M与Y组成的化合物MY2 可作自来水杀菌消毒剂,具有较强的氧化性
D.Q的金属性强于R
20.工业上常用氧化剂NaClO处理NaCN超标的废水。现用1mol·L-1NaClO溶液处理1m3 NaCN超标的电
镀废水,测得溶液中生成的n(OCN-)与n(N2)随NaClO溶液加入量的变化关系如图所示:
已知:HCN和HOCN中N元素的化合价均与NH3 中N元素的化合价相同。下列说法不正确的是
A.NaOCN中C元素为+4价
B.曲线Ⅱ表示溶液中产生N2 的物质的量变化
C.当向溶液中加入320 mL NaClO 溶液时生成672 mLN2(标准状况)
D.该电镀废水中CN- 的浓度为5.2 mg·L-1
Ⅱ卷(共54分)
21. (14分)元素周期表是学习化学的重要工具,承载着许多信息。根据周期表回答下列问题:
(1)写出H元素在周期表中的位置 ,其单质与强碱溶液反应的离子方程式为:
。
(2)K元素形成的化合物在生活中应用广泛。漂白粉的有效成分为 (填化学式),使用时需将其溶于水并先在空气中放置一段时间,写出漂白粉起效的化学方程式: 。
(3)已知M元素的信息如下,则原子结构示意图中x的值为 ,
检验某混合溶液中是否含有+3价M离子所需的试剂为 。(填化学式)
(4)EA4K是 (填“离子”或“共价”)化合物,其电子式为 。
(5)以下4种方法中,不能用于鉴别G2DF3 和GADF3 的是 (填字母)。
A. 分别取等浓度的两溶液于试管中,各加入几滴氯化钙溶液,观察有无白色沉淀产生
B. 分别取等浓度的两溶液于试管中,各加入几滴氢氧化钙溶液,观察有无白色沉淀产生
C. 分别加热等质量的两种固体,将生成的气体通入澄清石灰水,观察有无白色浑浊
D. 分别取等浓度的两溶液于试管中,各加入2滴酚酞,观察溶液红色的深浅
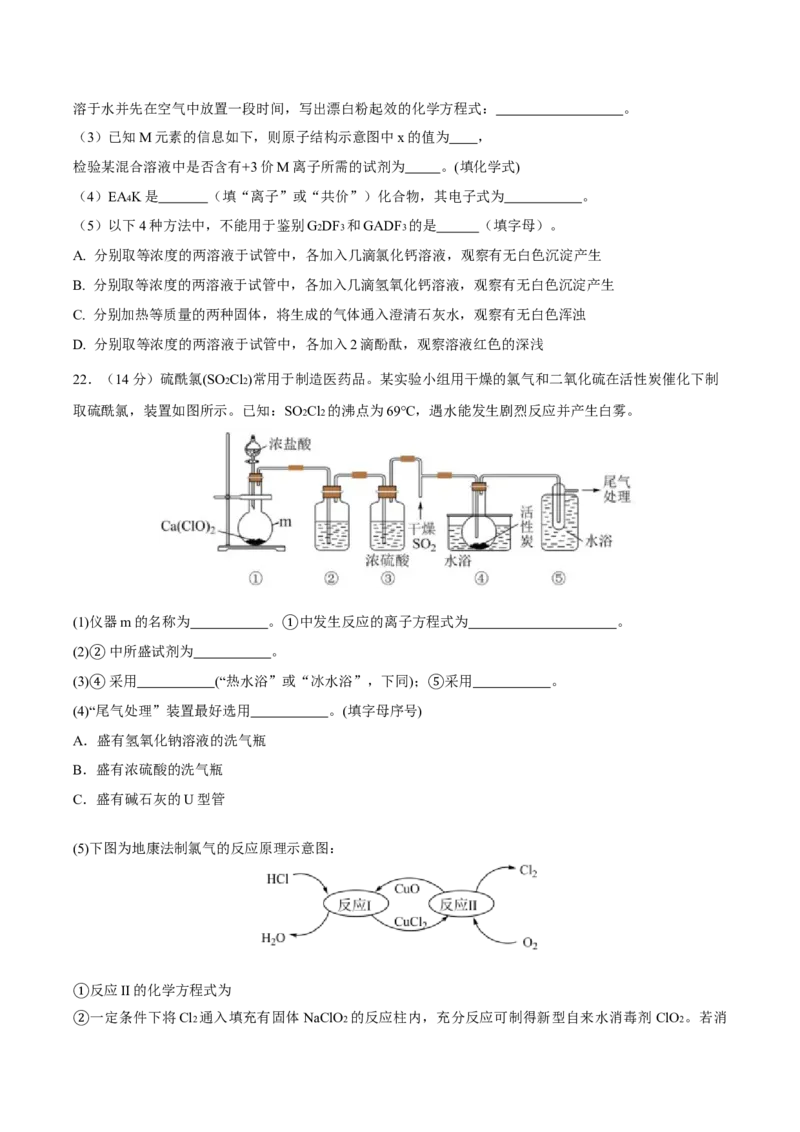
22.(14分)硫酰氯(SO2Cl2)常用于制造医药品。某实验小组用干燥的氯气和二氧化硫在活性炭催化下制
取硫酰氯,装置如图所示。已知:SO2Cl2 的沸点为69℃,遇水能发生剧烈反应并产生白雾。
(1)仪器m的名称为 。 中发生反应的离子方程式为 。
(2) 中所盛试剂为 。①
(3)②采用 (“热水浴”或“冰水浴”,下同); 采用 。
(4)④“尾气处理”装置最好选用 。(填字母序号) ⑤
A.盛有氢氧化钠溶液的洗气瓶
B.盛有浓硫酸的洗气瓶
C.盛有碱石灰的U型管
(5)下图为地康法制氯气的反应原理示意图:
反应II的化学方程式为
①
一定条件下将Cl2 通入填充有固体NaClO2 的反应柱内,充分反应可制得新型自来水消毒剂 ClO2 。若消
②耗标准状况下1.12L Cl2 ,则理论制得ClO2 g。
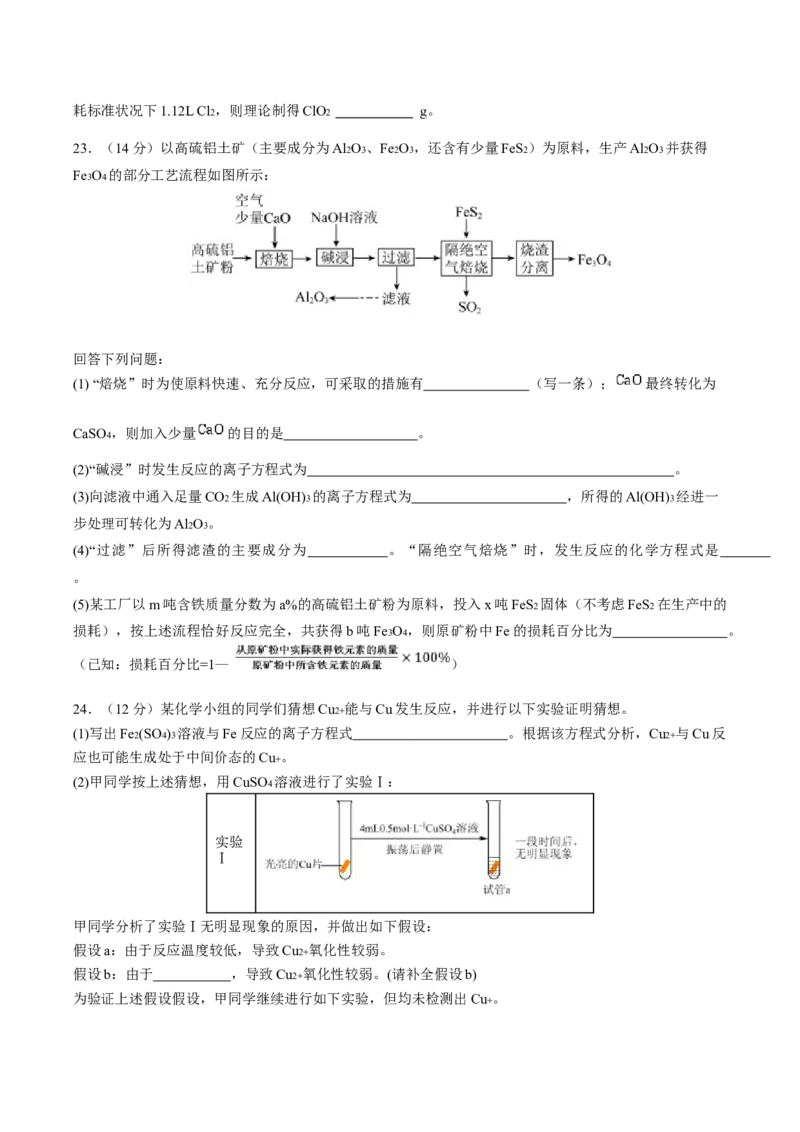
23.(14分)以高硫铝土矿(主要成分为Al2O3 、Fe2O3 ,还含有少量FeS2 )为原料,生产Al2O3 并获得
Fe3O4 的部分工艺流程如图所示:
回答下列问题:
(1) “焙烧”时为使原料快速、充分反应,可采取的措施有 (写一条); 最终转化为
CaSO4 ,则加入少量 的目的是 。
(2)“碱浸”时发生反应的离子方程式为 。
(3)向滤液中通入足量CO2 生成Al(OH)3 的离子方程式为 ,所得的Al(OH)3 经进一
步处理可转化为Al2O3 。
(4)“过滤”后所得滤渣的主要成分为 。“隔绝空气焙烧”时,发生反应的化学方程式是
。
(5)某工厂以m吨含铁质量分数为a%的高硫铝土矿粉为原料,投入x吨FeS2 固体(不考虑FeS2 在生产中的
损耗),按上述流程恰好反应完全,共获得b吨Fe3O4 ,则原矿粉中Fe的损耗百分比为 。
(已知:损耗百分比=1— )
24.(12分)某化学小组的同学们猜想Cu2+ 能与Cu发生反应,并进行以下实验证明猜想。
(1)写出Fe2(SO4)3 溶液与Fe反应的离子方程式 。根据该方程式分析,Cu2+ 与Cu反
应也可能生成处于中间价态的Cu+ 。
(2)甲同学按上述猜想,用CuSO4 溶液进行了实验Ⅰ:
实验
Ⅰ
甲同学分析了实验Ⅰ无明显现象的原因,并做出如下假设:
假设a:由于反应温度较低,导致Cu2+ 氧化性较弱。
假设b:由于 ,导致Cu2+ 氧化性较弱。(请补全假设b)
为验证上述假设假设,甲同学继续进行如下实验,但均未检测出Cu+ 。序号 实验 加入试剂或操作
实验
加热试管
Ⅱ
实验
Ⅲ
加入CuSO4 固体,振荡
(3)乙同学用CuCl2 溶液代替CuSO4 溶液进行实验:
实验Ⅳ
实验Ⅳ中发生的离子反应方程式为 。
(4)乙同学根据上述实验认为Cu2+ 能氧化Cu,并针对实验Ⅰ进行改进,设计并完成实验Ⅴ:向试管a中加
入几滴浓盐酸,一段时间后,溶液蓝色明显变浅,铜片表面产生白色沉淀。
乙同学因此得出结论:Cl− 对Cu2+ 与Cu发生反应有促进作用。
丙同学认为通过实验Ⅴ不能得出乙同学的结论,原因是 。
丙同学继续设计实验:重复实验Ⅰ,向试管中加入几滴 ,一段时间后无明显现象产生,证实了乙
①
同学结论合理。
②
(5)综合上述实验可知,Cu2+ 能否氧化Cu与 有关。2024级高一上学期期末考试化学答案
一、选择题(1-14每题2分,15-20每题3分)
1-5 BDDBB 6-10 ADBCA 11-15 DBDCD 16-20 CBDDC
二、非选择题
21(14分)
(1)第三周期第IIIA族(2分);2Al+2OH-+6H O=2[Al(OH) ]-+3H ↑(2分)
2 4 2
(2)Ca(ClO) (1分)
2
Ca(ClO) +CO +H O=CaCO ↓+2HClO(2分)
2 2 2 3
(3)2(1分);KSCN(1分)
(4)离子(1分); (2分)
(5)B(2分)
22(14分)
(1)圆底烧瓶(2分);ClO-+Cl-+2H+=Cl↑+H O(2分)
2 2
(2)饱和食盐水(2分)
(3)热水浴(1分);冷水浴(1分)
(4)C(2分)
(5) O+2CuCl =2CuO+2Cl (2分)
2 2 2
6.75(2分)
①
②
23(14分)
(1)搅拌、适当升高温度等(2分);脱硫(2分)
(2)Al O+2OH-+3H O=2[Al(OH) ]-(2分)
2 3 2 4
(3)[Al(OH) ]-+CO =Al(OH) +HCO-(2分)
4 2 3 3
(4)Fe O(2分);16Fe O+FeS =2SO+11Fe O(条件:焙烧)(2分)
2 3 2 3 2 2 3 4
(5) (2分)
24(12分)
(1)Fe+2Fe3+=3Fe2+(2分)
(2)Cu2+浓度低(2分)
(3)Cu2++Cu+2Cl-=2CuCl↓(2分)
(4) 也可能是H+对Cu与Cu2+发生反应有促进作用(答出引入H+带来干扰即可)(2分)
稀HSO (2分)
2 4
①
(5)Cl-(2分)
②