文档内容
第一学期期末考试
高一级 化学 试卷
本试卷满分100分,考试用时75分钟。
可能用到的相对原子质量:H -1 C -12 O- 16 Na-23 Cl -35.5 S-32 K-39 Mn-55
一、选择题:本题共20小题,每小题3分,共60分。每小题只有一个选项符合题目要求。
1. 2022年国际冬奥会将在北京举行。短道速滑队员所穿的速滑冰刀可用不锈钢制成,不锈钢含有的主要
元素是
A. 铁 B. 碳 C. 镍 D. 铬
2. 下列有关物质的分类正确的是( )
A. 混合物:空气、矿泉水、水银
B. 碱:Ba(OH)、Cu (OH)CO、NH ·HO
2 2 2 3 3 2
C. 盐:硝酸钠、氯化铵、纯碱
D. 氧化物:HO、CO、CHCHOH
2 3 2
3. 属于离子化合物的是
A. KCl B. HCl C. HO D. N
2 2
4. 化学与生活密切相关,下列物质与其用途不符合是
.
A Ti-Fe合金——储氢材料 B. 纯碱——治疗胃酸过多
C. 次氯酸钠——消毒剂 D. 三氧化二铁——制作红色颜料
5. 五彩缤纷的烟花表演为各种节日增添了许多喜庆的气氛。研究表明,焰火颜色的产生与烟花中含有钠、
钾、钙、钡、铜、锶等金属元素有关。下列有关说法中不正确的是
A. 进行金属元素的焰色试验时不发生化学变化
B. 钠可以保存在煤油中
C. KCl与KNO 灼烧时火焰的颜色不相同
3
D. 进行钾及其化合物的焰色试验需要透过蓝色钴玻璃
6. 设N 表示阿伏加德罗常数,下列叙述正确的是
A
A. 25℃、101kPa时,11.2L H 中含有的原子数为N
2 A
第1页/共8页
学科网(北京)股份有限公司B. 1mol/L Na SO 溶液中离子总数为3N
2 4 A
C. 0℃、101kPa时,22.4L H O中含有的分子数为N
2 A
D. 25 ℃、101k Pa下,64 g SO 中含有的原子数为3N
2 A
7. 下列化学用语表示正确的是
A. 水的电子式:H+[︰ ︰]2-H+ B. NaO 的电子式:
2 2
C. 碳14的原子符号 C D. 铝的原子结构示意图:
8. “分类”是一种思想方法,在化学发展中起到了重要的作用,下列判断合理的是
①硫酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
②能电离出氢离子的化合物都是酸
③根据水溶液是否导电,将物质分为电解质与非电解质
④根据分散系 否是具有丁达尔现象,将分散系分为溶液、胶体和浊液
⑤根据氧化物中是否含有金属元素,可将分为碱性氧化物和酸性氧化物
A. 只有① B. 只有①②⑤ C. 只有④⑤ D. 只有①②④
9. 下列关于离子检验的说法中正确的是
A. 向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO
B. 向某溶液中加入AgNO 溶液,生成白色沉淀,该溶液中一定含有Cl-
3
C. 向某溶液中加入盐酸化的BaCl 溶液,有白色沉淀生成,该溶液中一定含有SO
2
D. 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制的氯水,溶液变为红色,该
溶液中一定含有Fe2+
的
10. 下列有关钠及钠 化合物的说法中,正确的是
A. 一小块钠置于空气中足够时间,最终会变成NaO
2 2
B. 在饱和NaCO 溶液中通入足量CO 有沉淀析出
2 3 2
C. 用洁净的铂丝蘸取溶液放置于酒精灯火焰上灼烧,焰色为黄色;该溶液为钠盐溶液
D. 7.8gNaO 和6.2gNaO分别溶于100g水中,得到溶液的质量分数前者更大
2 2 2
11. 水处理包括水的净化、杀菌消毒、蒸馏等。其中常见的杀菌消毒剂包括氯气、臭氧、漂白粉等。游泳
场馆往往用臭氧、活性炭对游泳池进行消毒和净化。下列说法中正确的是
A. 臭氧、活性炭处理水的原理相同
B. 氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制各种化学试剂
第2页/共8页
学科网(北京)股份有限公司C. 0.1 mol Cl 与足量NaOH溶液反应,转移0.2 mol电子
2
D. 漂白粉长期露置在空气中会失效
12. 用毛笔蘸取少量30% FeCl 溶液在铜片上写一个“Cu”字,放置片刻,用少量水将铜片上的溶液冲到小
3
烧杯中,下列说法正确的是
A. 烧杯中的溶液呈黄色 B. 铜片无任何变化
C. 铜片上有凹陷的“Cu”字 D. 发生了反应:Fe3+ +Cu=Cu2++ Fe2+
13. 下列反应的离子方程式书写正确的是
A. 镁加入盐酸:Mg+H+=Mg2++H ↑
2
B. 浓烧碱溶液中加入铝片:Al+2OH-=AlO +H↑
2
C. 用浓NaOH溶液溶解Al O:OH-+Al O=AlO +HO
2 3 2 3 2
D. 向新制的KI溶液中滴加几滴溴水:2I-+Br =I +2Br-
2 2
14. 除去NaCO 固体中少量的NaHCO 的最佳方法是
2 3 3
A. 加入适量盐酸 B. 加入NaOH溶液
C. 加热分解 D. 制成溶液后通入CO
2
15. 在强酸性溶液中,下列各组离子能大量共存的是
A. 、 、 、K+ B. Na+、Ba2+、Ca2+、
C. Mg2+、 、K+、Cl- D. K+、Ba2+、Na+、
16. 下列有关铁及其化合物的说法中正确的是
A. 铁与水蒸气在高温下的反应产物为Fe O 和H
2 3 2
B. FeSO 溶液加入NaOH溶液可产生白色沉淀,迅速变成灰绿色,最终变成红褐色
4
C. 铁溶于盐酸可得到FeCl 溶液和H
3 2
D. 除去FeCl 溶液中的FeCl 杂质可以向溶液中加入Cu粉,然后过滤
2 3
17. 对I~IV的实验操作现象判断正确的是
第3页/共8页
学科网(北京)股份有限公司A. 实验I:产生红褐色沉淀 B. 实验II:溶液颜色变红
C. 实验III:放出大量气体 D. 实验IV:先出现白色沉淀,后沉淀溶解
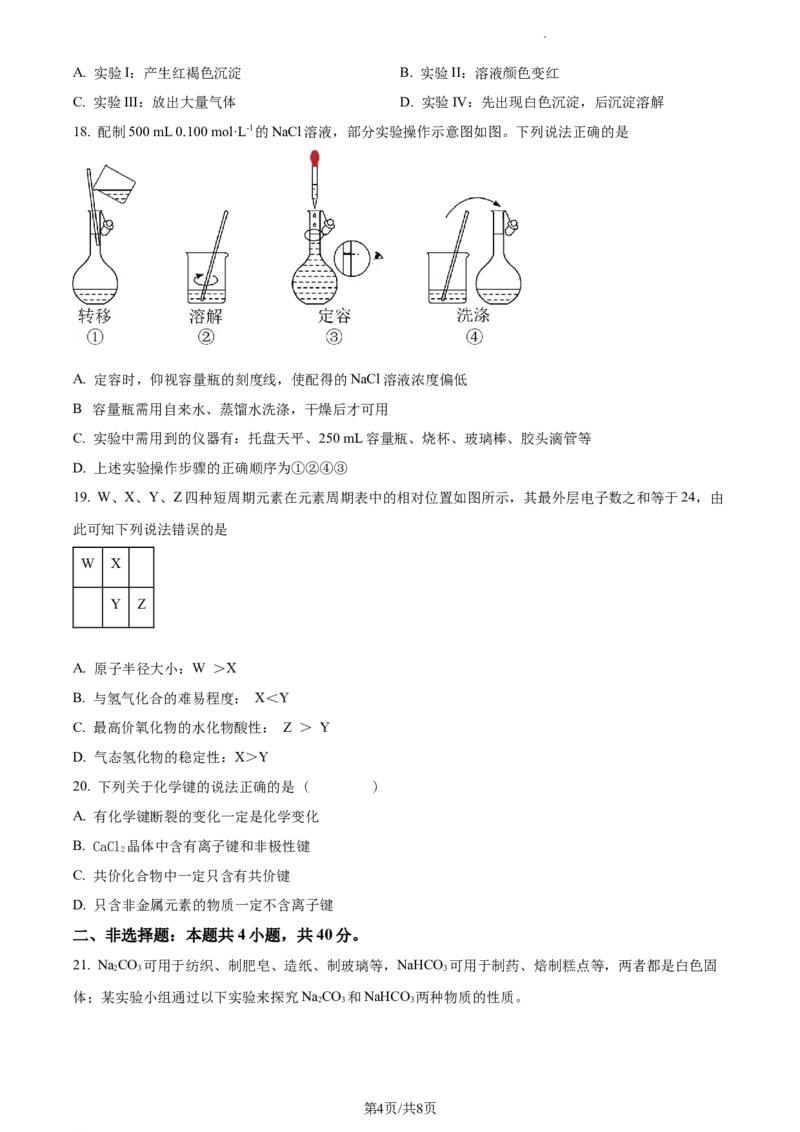
18. 配制500 mL 0.100 mol·L-1的NaCl溶液,部分实验操作示意图如图。下列说法正确的是
A. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
.
B 容量瓶需用自来水、蒸馏水洗涤,干燥后才可用
C. 实验中需用到的仪器有:托盘天平、250 mL容量瓶、烧杯、玻璃棒、胶头滴管等
D. 上述实验操作步骤的正确顺序为①②④③
19. W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由
此可知下列说法错误的是
W X
Y Z
A. 原子半径大小:W >X
B. 与氢气化合的难易程度: X<Y
C. 最高价氧化物的水化物酸性: Z > Y
D. 气态氢化物的稳定性:X>Y
20. 下列关于化学键的说法正确的是 ( )
A. 有化学键断裂的变化一定是化学变化
B. CaCl 晶体中含有离子键和非极性键
2
C. 共价化合物中一定只含有共价键
D. 只含非金属元素的物质一定不含离子键
二、非选择题:本题共4小题,共40分。
21. NaCO 可用于纺织、制肥皂、造纸、制玻璃等,NaHCO 可用于制药、焙制糕点等,两者都是白色固
2 3 3
体;某实验小组通过以下实验来探究NaCO 和NaHCO 两种物质的性质。
2 3 3
第4页/共8页
学科网(北京)股份有限公司(1)称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固
体充分溶解,并恢复至室温后,向所得溶液中各滴加2滴酚酞试液。
①发现NaCO 固体完全溶解,而NaHCO 固体有剩余,由此得到结论_______。
2 3 3
②同学们在两烧杯中还观察到了其它现象。其中盛放NaCO 的烧杯中出现的现象:I溶液温度升高,
2 3
Ⅱ_______(填字母序号)。
a.滴入酚酞后呈无色
b.滴入酚酞后呈红色
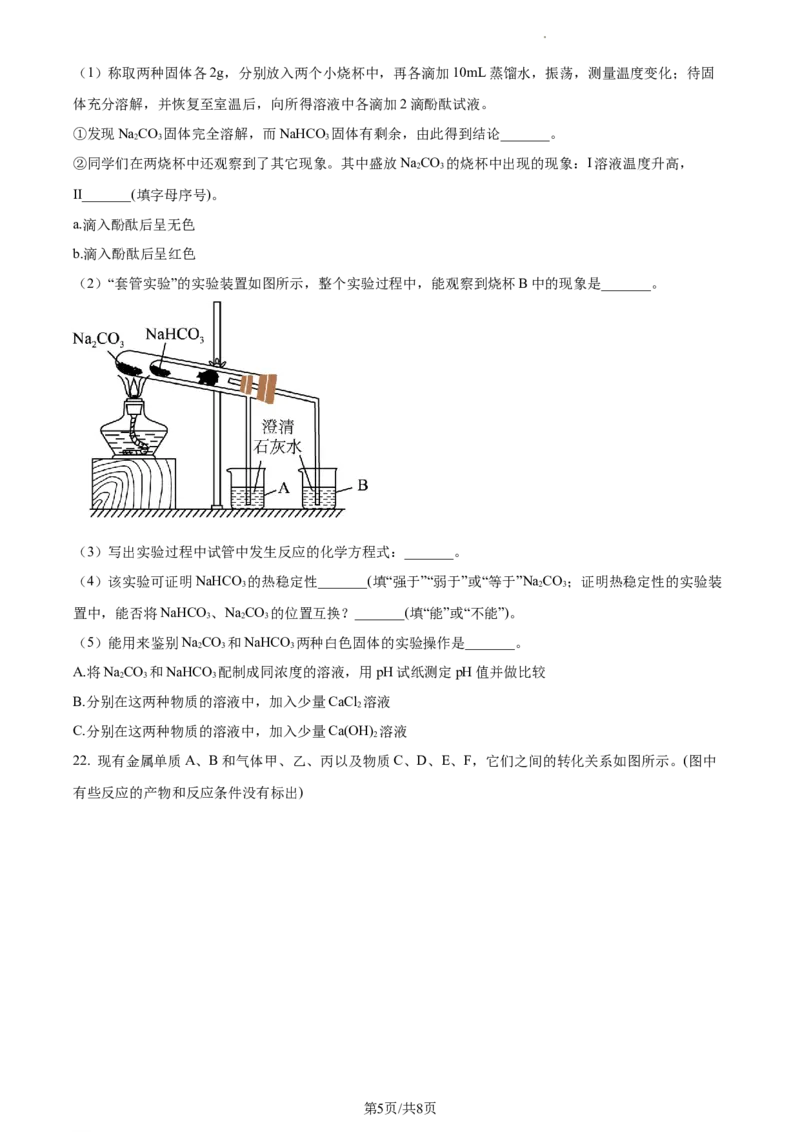
(2)“套管实验”的实验装置如图所示,整个实验过程中,能观察到烧杯B中的现象是_______。
(3)写出实验过程中试管中发生反应的化学方程式:_______。
(4)该实验可证明NaHCO 的热稳定性_______(填“强于”“弱于”或“等于”NaCO;证明热稳定性的实验装
3 2 3
置中,能否将NaHCO 、NaCO 的位置互换?_______(填“能”或“不能”)。
3 2 3
(5)能用来鉴别NaCO 和NaHCO 两种白色固体的实验操作是_______。
2 3 3
A.将NaCO 和NaHCO 配制成同浓度的溶液,用pH试纸测定pH值并做比较
2 3 3
B.分别在这两种物质的溶液中,加入少量CaCl 溶液
2
C.分别在这两种物质的溶液中,加入少量Ca(OH) 溶液
2
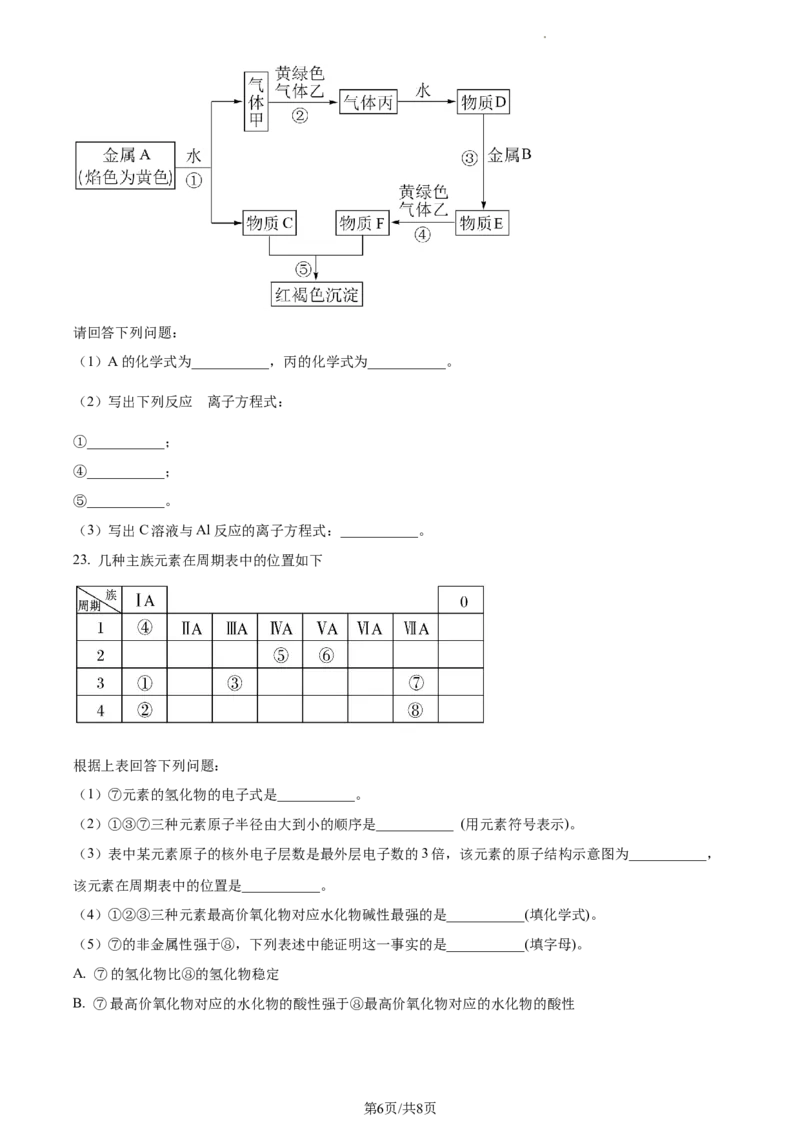
22. 现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间的转化关系如图所示。(图中
有些反应的产物和反应条件没有标出)
第5页/共8页
学科网(北京)股份有限公司请回答下列问题:
(1)A的化学式为___________,丙的化学式为___________。
的
(2)写出下列反应 离子方程式:
①___________;
④___________;
⑤___________。
(3)写出C溶液与Al反应的离子方程式:___________。
23. 几种主族元素在周期表中的位置如下
根据上表回答下列问题:
(1)⑦元素的氢化物的电子式是___________。
(2)①③⑦三种元素原子半径由大到小的顺序是___________ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为___________,
该元素在周期表中的位置是___________。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是___________(填化学式)。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是___________(填字母)。
A. ⑦的氢化物比⑧的氢化物稳定
B. ⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
第6页/共8页
学科网(北京)股份有限公司C. ⑦的单质能将⑧从其钠盐溶液中置换出来
D. ⑦的氢化物酸性比⑧的氢化物酸性弱
(6)①和④形成的化合物是___________(填“离子”或“共价”)化合物。
24. 2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有
着广泛的用途。
(1)①写出实验室中制取氯气的离子方程式___________;
②已知KMnO 与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:
4
2KMnO +16HCl(浓)=2KCl+2MnCl +5Cl↑+8H O
4 2 2 2
15.8 g KMnO 能和 _____mol HCl发生上述反应、产生的Cl 在标准状况下的体积为___________L;
4 2
③实验室还可以利用如下反应制取氯气:KClO+6HCl(浓)=KCl+3Cl ↑+3H O。若制取标准状况下6.72 L氯
3 2 2
气,反应过程中转移电子的物质的量为___________mol;
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病
毒中发挥了重要作用 ,浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用化学方程
式表示为:___________;
第7页/共8页
学科网(北京)股份有限公司第8页/共8页
学科网(北京)股份有限公司