文档内容
江苏省扬州中学2022-2023学年度高三双周练六
高三化学(选修)
试卷满分:100分。考试时间:75分钟 2023.3
第I卷(选择题; 共39分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Fe 56 Cu
64
一、单选题
1. 党的二十大报告指出“推动绿色发展,促进人与自然和谐共生”。下列做法不合理的是(
)
A. 研制可降解塑料,控制白色污染产生 B. 研发新能源汽车,降低汽油柴油消耗
C. 开发利用天然纤维,停止使用合成 D. 研究开发生物农药,减少作物农药残留
2.光气( )是一种重要的有机合成中间体,有剧毒,光气与氨气反应的化学方程式
为: .下列有关说法不正确的是( )
A. 中含有离子键和共价键 B. 原子的原子结构示意图:
C. 的球棍模型: D. 的电子式为:
3. N、O, Na、 Cl是周期表中的短周期主族元素。下列有关说法不正确的是( )
7 8 11 17
A. 离子半径:r(Na+)<r(O2-)<r(Cl-)
B. 第一电离能:I(Na)<I(N)<I(O)
1 1 1
C. 氢化物对应的稳定性:NH <HO
3 2
D. 最高价氧化物的水化物的酸性:HNO<HClO
3 4
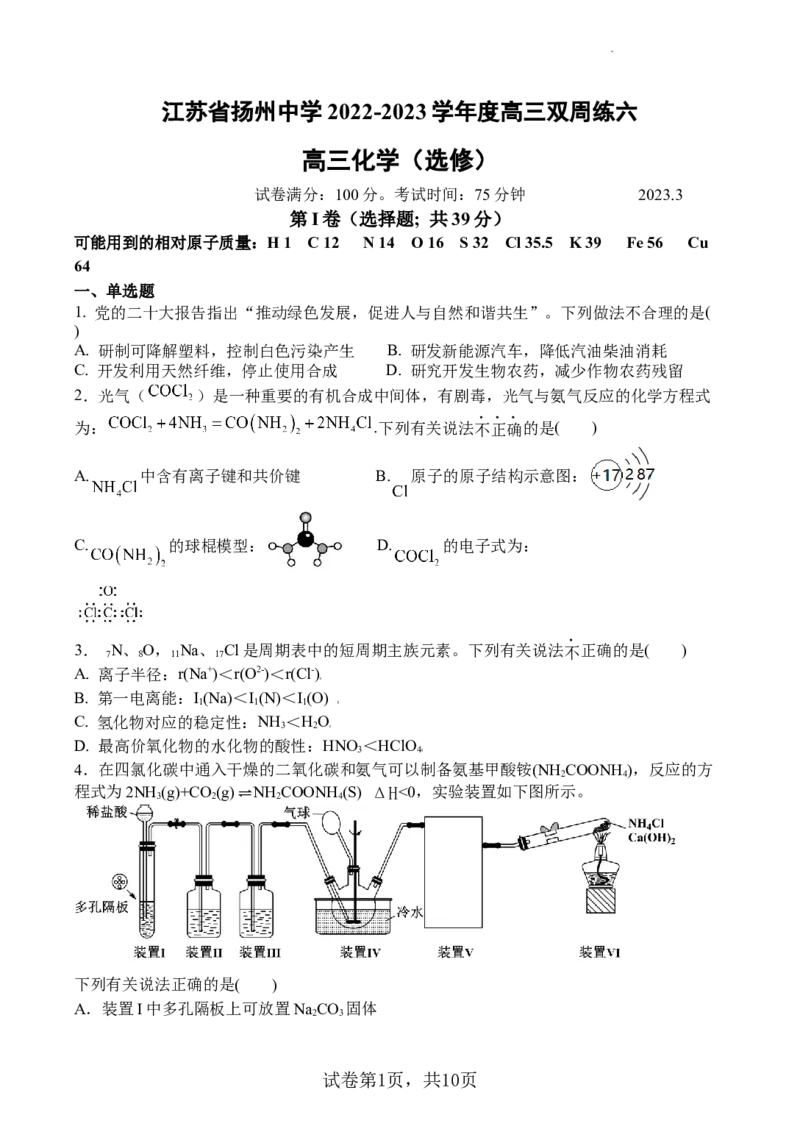
4.在四氯化碳中通入干燥的二氧化碳和氨气可以制备氨基甲酸铵(NH COONH),反应的方
2 4
程式为2NH
3
(g)+CO
2
(g)⇌NH
2
COONH
4
(S) ΔH<0,实验装置如下图所示。
下列有关说法正确的是( )
A.装置I中多孔隔板上可放置NaCO 固体
2 3
试卷第1页,共10页
学科网(北京)股份有限公司B.装置Ⅱ的作用是除去HCl,装置中可使用饱和NaCO 溶液
2 3
C.装置Ⅳ采用冷水浴可以减少气体的挥发,提高反应的平衡转化率
D.装置V的作用是干燥NH ,装置中可使用浓硫酸
3
阅读下列材料,完成5-7题:周期表中IIIA族元素及其化合物应用广泛。硼熔点很高,其硬
度仅次于金刚石,单质硼可以溶于热的浓硝酸生成硼酸(H BO),硼酸是有重要用途的一元弱
3 3
酸,能溶于水,可用作防腐剂;硼烷(B H,常温下为气态)是一种潜在的高能燃料,在O 中
2 6 2
完全燃烧生成B O 固体和液态水,燃烧热为2165kJ•mol-1;氨硼烷(H NBH )是最具潜力的储
2 3 3 3
氢材料之一,与硼烷的相对分子质量相近,但沸点却比硼烷高得多;BF 是石油化工的重要
3
催化剂;Al O 熔点很高,是两性氧化物,可溶于强酸、强碱;砷化镓(GaAs)是一种新型化合
2 3
物半导体材料。
5. 下列说法正确的是( )
A. H NBH 分子间存在氢键
3 3
B. BF 是由极性键构成的极性分子
3
C. 镓原子( Ga)基态原子核外电子排布式为4s24p1
31
D. IIIA族元素单质的晶体类型相同
6. 下列化学反应表示错误的是( )
A. 硼与热的浓硝酸反应:B+3HNO (浓) HBO+3NO↑
3 3 3 2
B. 硼酸与NaOH溶液反应:H++OH-=H O
2
C. Al O 和NaOH溶液反应:Al O+2OH-=2AlO +H O
2 3 2 3 2
D. 硼烷的燃烧热:B H(g)+3O(g)=B O(s)+3HO(l) ΔH=-2165kJ•mol-1
2 6 2 2 3 2
7. 下列物质性质与用途具有对应关系的是( )
A. 硼酸呈弱酸性,可用作防腐剂
B. BF 呈气态,可用作催化剂
3
C. Al O 熔点很高,可用作耐火材料
2 3
D. 砷化镓难溶于水,可用作半导体材料
8. 含硫矿物是多种化工生产的原料,主要有硫磺、黄铁矿(FeS)、辉铜矿(Cu S)、明矾
2 2
、绿矾(FeSO ·7H O)、胆矾(CuSO ·5H O)、重晶石(BaSO)等。硫磺、黄
4 2 4 2 4
铁矿可作为工业制硫酸的原料,辉铜矿煅烧时可发生反应: 。
直接排放会造成环境污染,可将其转化,或用石灰乳、HS等物质进行回收再利用。下列硫
2
酸盐性质与用途具有对应关系的是( )
A. 能水解形成胶体,可用作净水剂
B.FeSO 具有还原性,可作治疗贫血药剂
4
试卷第2页,共10页C.CuSO 水溶液呈酸性,可用作杀菌剂
4
D.BaSO 难溶于水,可用于制取BaS
4
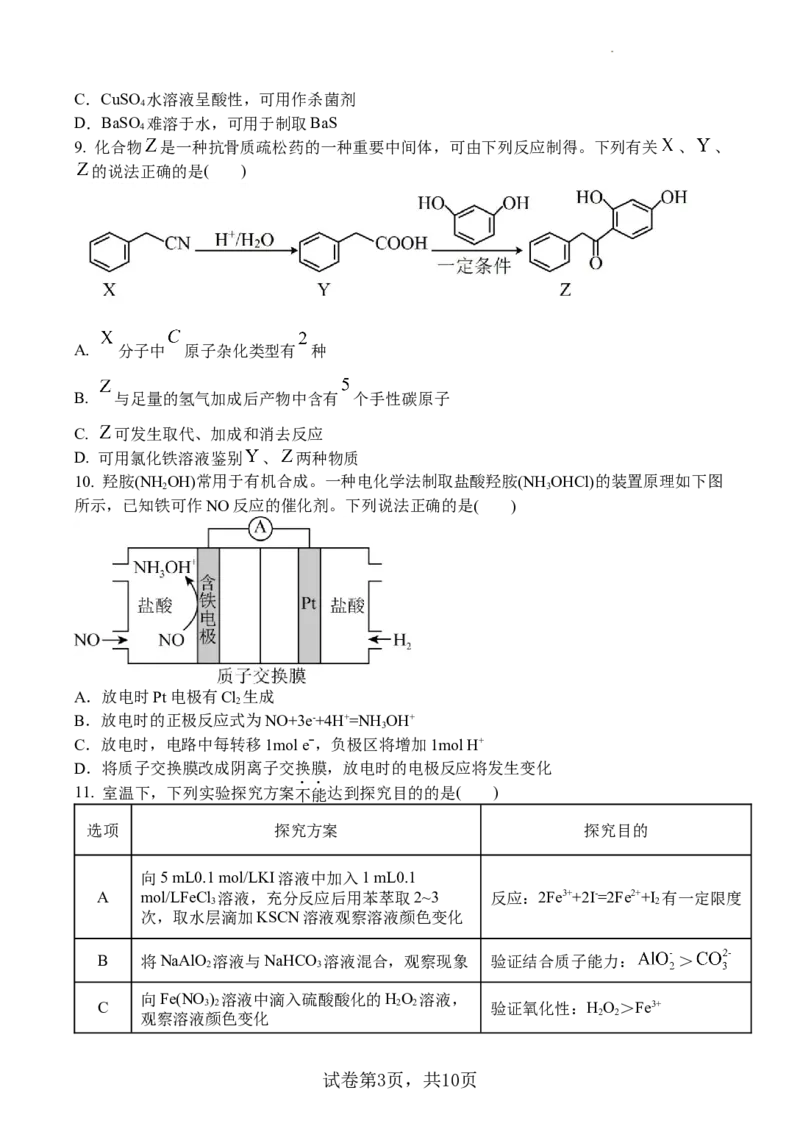
9. 化合物 是一种抗骨质疏松药的一种重要中间体,可由下列反应制得。下列有关 、 、
的说法正确的是( )
A. 分子中 原子杂化类型有 种
B. 与足量的氢气加成后产物中含有 个手性碳原子
C. 可发生取代、加成和消去反应
D. 可用氯化铁溶液鉴别 、 两种物质
10. 羟胺(NH OH)常用于有机合成。一种电化学法制取盐酸羟胺(NH OHCl)的装置原理如下图
2 3
所示,已知铁可作NO反应的催化剂。下列说法正确的是( )
A.放电时Pt电极有Cl 生成
2
B.放电时的正极反应式为NO+3e-+4H+=NHOH+
3
C.放电时,电路中每转移1mol eˉ,负极区将增加1mol H+
D.将质子交换膜改成阴离子交换膜,放电时的电极反应将发生变化
11. 室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
向5 mL0.1 mol/LKI溶液中加入1 mL0.1
A mol/LFeCl 溶液,充分反应后用苯萃取2~3 反应:2Fe3++2I-=2Fe2++I 有一定限度
3 2
次,取水层滴加KSCN溶液观察溶液颜色变化
B 将NaAlO 溶液与NaHCO 溶液混合,观察现象 验证结合质子能力: >
2 3
向Fe(NO ) 溶液中滴入硫酸酸化的HO 溶液,
C 3 2 2 2 验证氧化性:HO>Fe3+
观察溶液颜色变化 2 2
试卷第3页,共10页
学科网(北京)股份有限公司用pH计测量等温等浓度的CHCOONa和
D 3 K (CHCOO-)>K (HCOO-)
HCOONa溶液的pH,前者大于后者 h 3 h
12. 侯氏制碱法原理为:向饱和氨的食盐水中通CO 发生反应
2
NaCl+NH +CO +H O=NaHCO ↓+NHCl。已知:通入CO 过程中,始终存在:c( ) < c(
3 2 2 3 4 2
);K (H CO)=4.4×10-7, K (H CO)=4.4×10-11, K(NH ·H O)=1.8×10-5。下列说法不
1 2 3 2 2 3 3 2
正确的是( )
A. 饱和氨的食盐水中:c( ) + c(H+) = c(OH-)
B. 开始通入CO 时,主要反应的离子方程式为:CO+ 2NH ·HO= +2 +H O
2 2 3 2 2
C. 析出晶体后的溶液中:c( ) + c(NH ·H O) > c( ) + c( ) + c(H CO)
3 2 2 3
D. 过滤所得的滤液中:c( ) > c(H CO)> c( )
2 3
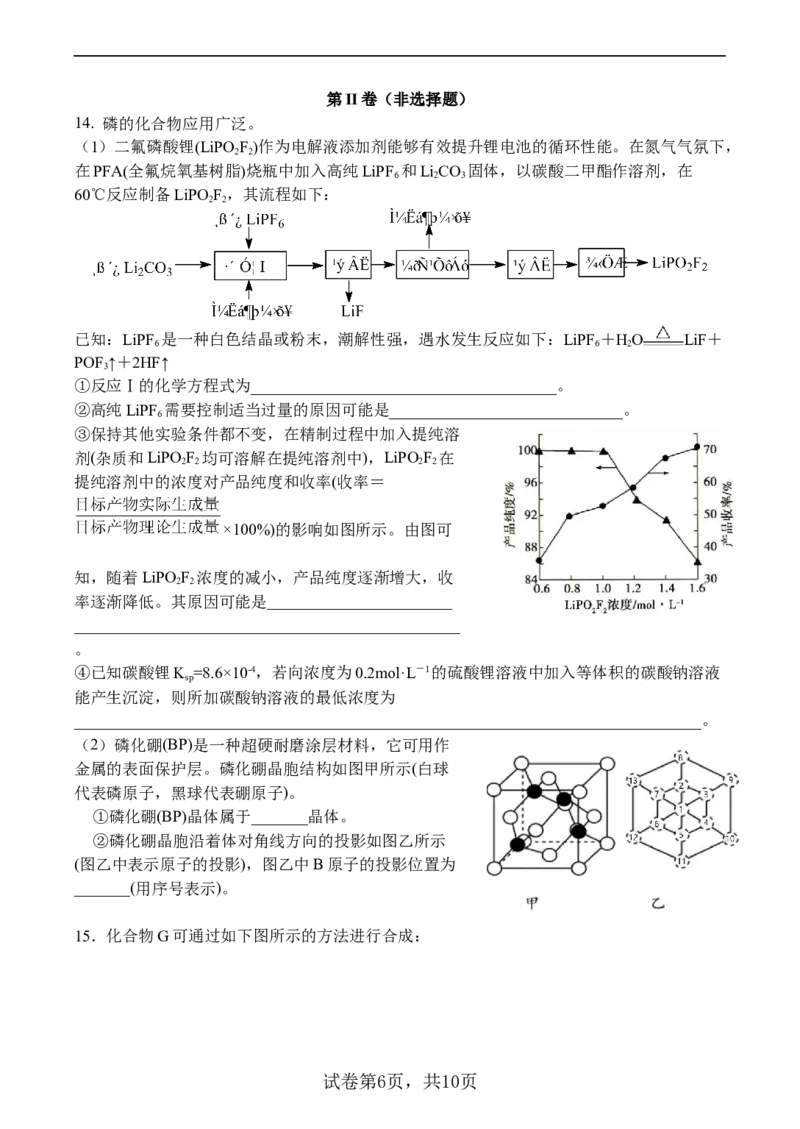
13. 合成气是一种重要的化工原料气,主要组分为CO和H。用甲烷、二氧化碳自热重整可
2
制备合成气,反应原理如下:
反应I:CH(g)+2O(g) CO(g)+2HO(g) △H=-820.6kJ·mol-1
4 2 2 2 1
反应II:CH(g)+CO (g) 2CO(g)+2H(g) △H =+247.1kJ·mol-1
4 2 2 2
⇌
反应III:CH(g)+HO(g) CO(g)+3H(g) △H =+205.9kJ·mol-1
4 2 2 3
⇌
反应IV:CO(g)+H(g) CO(g)+HO(g) △H
2 2 2 4
⇌
不同温度下,向体积为VL的含少量O 的恒压容器按照n(CO):n(CH)=1投料,实验测得不
2 2 4
⇌
同压强下平衡时 随温度的变化关系如图所示。下列说法正确的是( )
A. △H =-41.2kJ·mol-1
4
B. 某温度下,反应II的平衡常数随压强增大而减小
C. 由图可知,p>p>p
1 2 3
试卷第4页,共10页D. 压强为p 时,T>T 后,升高温度对反应IV的促进作用更大
2 m
试卷第5页,共10页
学科网(北京)股份有限公司第II卷(非选择题)
14. 磷的化合物应用广泛。
(1)二氟磷酸锂(LiPO F)作为电解液添加剂能够有效提升锂电池的循环性能。在氮气气氛下,
2 2
在PFA(全氟烷氧基树脂)烧瓶中加入高纯LiPF 和LiCO 固体,以碳酸二甲酯作溶剂,在
6 2 3
60℃反应制备LiPO F,其流程如下:
2 2
已知:LiPF 是一种白色结晶或粉末,潮解性强,遇水发生反应如下:LiPF +HO LiF+
6 6 2
POF ↑+2HF↑
3
①反应Ⅰ的化学方程式为______________________________________。
②高纯LiPF 需要控制适当过量的原因可能是_____________________________。
6
③保持其他实验条件都不变,在精制过程中加入提纯溶
剂(杂质和LiPO F 均可溶解在提纯溶剂中),LiPO F 在
2 2 2 2
提纯溶剂中的浓度对产品纯度和收率(收率=
×100%)的影响如图所示。由图可
知,随着LiPO F 浓度的减小,产品纯度逐渐增大,收
2 2
率逐渐降低。其原因可能是_______________________
________________________________________________
。
④已知碳酸锂K =8.6×10-4,若向浓度为0.2mol·L-1的硫酸锂溶液中加入等体积的碳酸钠溶液
sp
能产生沉淀,则所加碳酸钠溶液的最低浓度为
______________________________________________________________________________。
(2)磷化硼(BP)是一种超硬耐磨涂层材料,它可用作
金属的表面保护层。磷化硼晶胞结构如图甲所示(白球
代表磷原子,黑球代表硼原子)。
①磷化硼(BP)晶体属于_______晶体。
②磷化硼晶胞沿着体对角线方向的投影如图乙所示
(图乙中表示原子的投影),图乙中B原子的投影位置为
_______(用序号表示)。
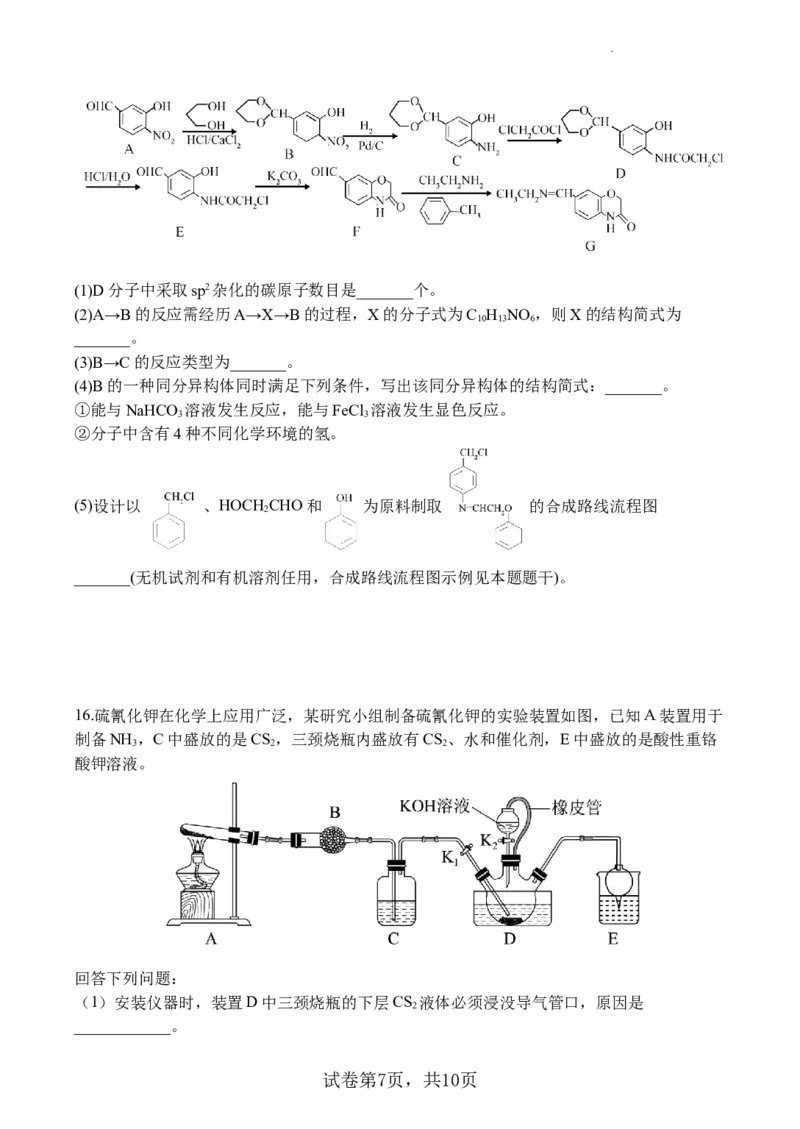
15.化合物G可通过如下图所示的方法进行合成:
试卷第6页,共10页(1)D分子中采取sp2杂化的碳原子数目是_______个。
(2)A→B的反应需经历A→X→B的过程,X的分子式为C H NO ,则X的结构简式为
10 13 6
_______。
(3)B→C的反应类型为_______。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______。
①能与NaHCO 溶液发生反应,能与FeCl 溶液发生显色反应。
3 3
②分子中含有4种不同化学环境的氢。
(5)设计以 、HOCH CHO和 为原料制取 的合成路线流程图
2
_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
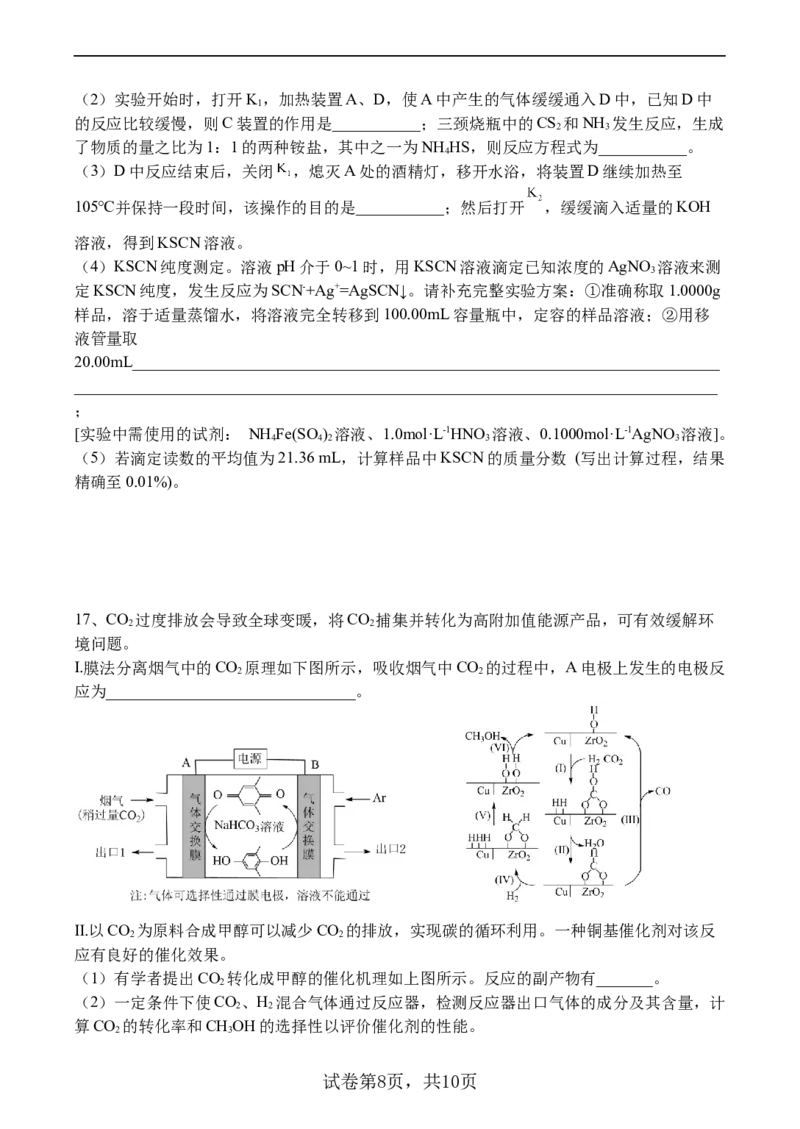
16.硫氰化钾在化学上应用广泛,某研究小组制备硫氰化钾的实验装置如图,已知A装置用于
制备NH ,C中盛放的是CS,三颈烧瓶内盛放有CS、水和催化剂,E中盛放的是酸性重铬
3 2 2
酸钾溶液。
回答下列问题:
(1)安装仪器时,装置D中三颈烧瓶的下层CS 液体必须浸没导气管口,原因是
2
____________。
试卷第7页,共10页
学科网(北京)股份有限公司(2)实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,已知D中
1
的反应比较缓慢,则C装置的作用是___________;三颈烧瓶中的CS 和NH 发生反应,生成
2 3
了物质的量之比为1:1的两种铵盐,其中之一为NH HS,则反应方程式为___________。
4
(3)D中反应结束后,关闭 ,熄灭A处的酒精灯,移开水浴,将装置D继续加热至
105℃并保持一段时间,该操作的目的是___________;然后打开 ,缓缓滴入适量的KOH
溶液,得到KSCN溶液。
(4)KSCN纯度测定。溶液pH介于0~1时,用KSCN溶液滴定已知浓度的AgNO 溶液来测
3
定KSCN纯度,发生反应为SCN-+Ag+=AgSCN↓。请补充完整实验方案:①准确称取1.0000g
样品,溶于适量蒸馏水,将溶液完全转移到100.00mL容量瓶中,定容的样品溶液;②用移
液管量取
20.00mL_________________________________________________________________________
________________________________________________________________________________
;
[实验中需使用的试剂: NH Fe(SO ) 溶液、1.0mol·L-1HNO 溶液、0.1000mol·L-1AgNO 溶液]。
4 4 2 3 3
(5)若滴定读数的平均值为21.36 mL,计算样品中KSCN的质量分数 (写出计算过程,结果
精确至0.01%)。
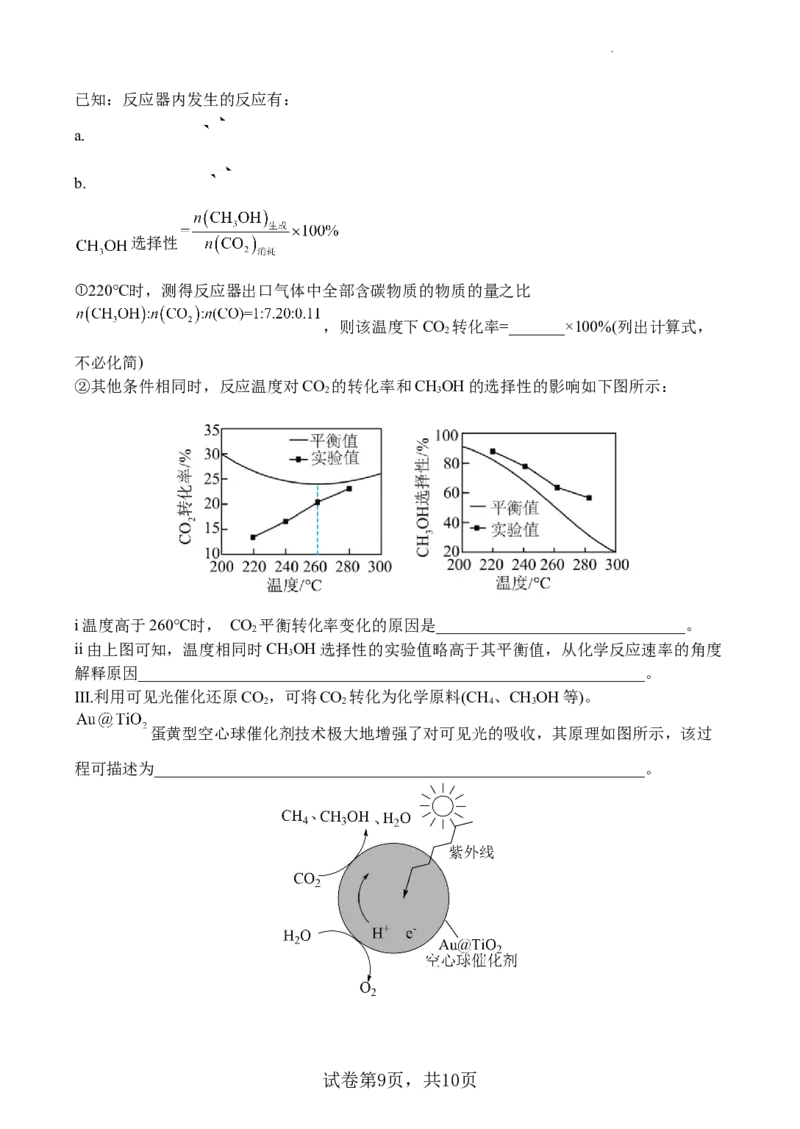
17、CO 过度排放会导致全球变暖,将CO 捕集并转化为高附加值能源产品,可有效缓解环
2 2
境问题。
Ⅰ.膜法分离烟气中的CO 原理如下图所示,吸收烟气中CO 的过程中,A电极上发生的电极反
2 2
应为_______________________________。
Ⅱ.以CO 为原料合成甲醇可以减少CO 的排放,实现碳的循环利用。一种铜基催化剂对该反
2 2
应有良好的催化效果。
(1)有学者提出CO 转化成甲醇的催化机理如上图所示。反应的副产物有_______。
2
(2)一定条件下使CO、H 混合气体通过反应器,检测反应器出口气体的成分及其含量,计
2 2
算CO 的转化率和CHOH的选择性以评价催化剂的性能。
2 3
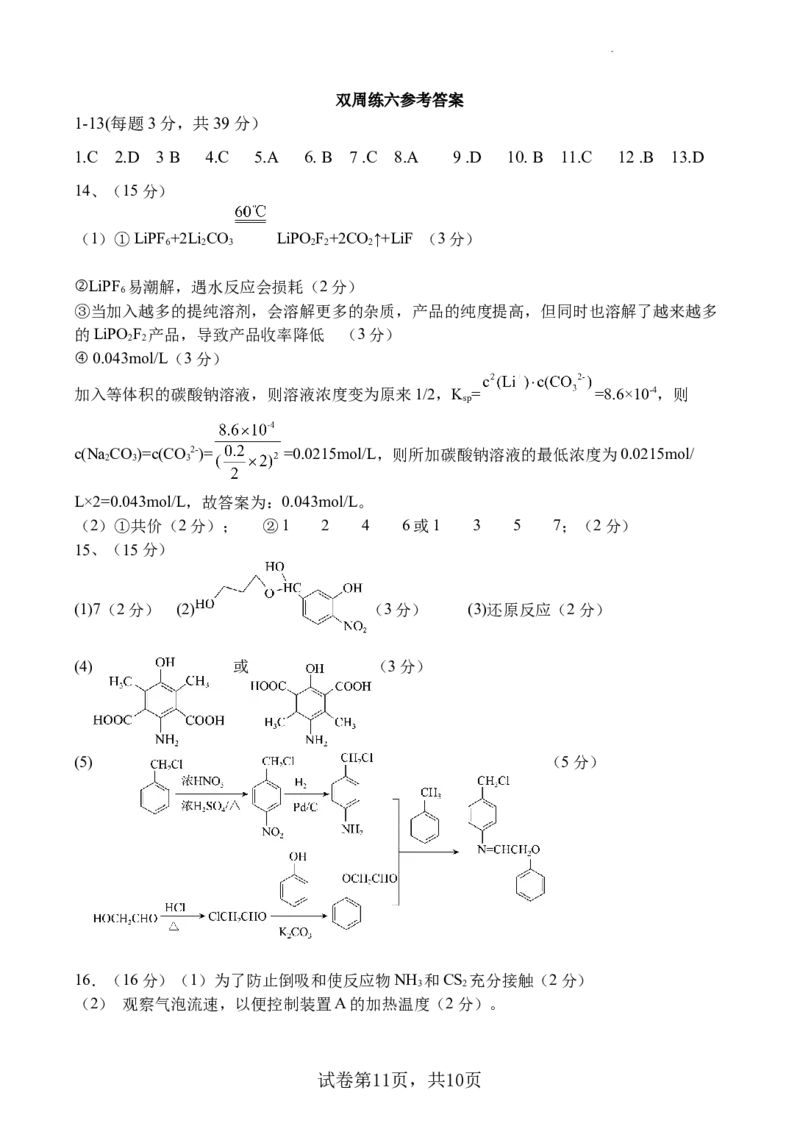
试卷第8页,共10页已知:反应器内发生的反应有:
a.
b.
选择性
①220℃时,测得反应器出口气体中全部含碳物质的物质的量之比
,则该温度下CO 转化率=_______×100%(列出计算式,
2
不必化简)
②其他条件相同时,反应温度对CO 的转化率和CHOH的选择性的影响如下图所示:
2 3
i温度高于260℃时, CO 平衡转化率变化的原因是_______________________________。
2
ii由上图可知,温度相同时CHOH选择性的实验值略高于其平衡值,从化学反应速率的角度
3
解释原因_______________________________________________________________。
Ⅲ.利用可见光催化还原CO,可将CO 转化为化学原料(CH、CHOH等)。
2 2 4 3
蛋黄型空心球催化剂技术极大地增强了对可见光的吸收,其原理如图所示,该过
程可描述为_____________________________________________________________。
试卷第9页,共10页
学科网(北京)股份有限公司试卷第10页,共10页双周练六参考答案
1-13(每题3分,共39分)
1.C 2.D 3 B 4.C 5.A 6. B 7 .C 8.A 9 .D 10. B 11.C 12 .B 13.D
14、(15分)
(1)①LiPF +2Li CO LiPO F+2CO ↑+LiF (3分)
6 2 3 2 2 2
②LiPF 易潮解,遇水反应会损耗(2分)
6
③当加入越多的提纯溶剂,会溶解更多的杂质,产品的纯度提高,但同时也溶解了越来越多
的LiPO F 产品,导致产品收率降低 (3分)
2 2
④ 0.043mol/L(3分)
加入等体积的碳酸钠溶液,则溶液浓度变为原来1/2,K = =8.6×10-4,则
sp
c(Na CO)=c(CO 2-)= =0.0215mol/L,则所加碳酸钠溶液的最低浓度为0.0215mol/
2 3 3
L×2=0.043mol/L,故答案为:0.043mol/L。
(2)①共价(2分); ②1 2 4 6或1 3 5 7;(2分)
15、(15分)
(1)7(2分) (2) (3分) (3)还原反应(2分)
(4) 或 (3分)
(5) (5分)
16.(16分)(1)为了防止倒吸和使反应物NH 和CS 充分接触(2分)
3 2
(2) 观察气泡流速,以便控制装置A的加热温度(2分)。
试卷第11页,共10页
学科网(北京)股份有限公司(2分)
(3)除去杂质NH HS(2分)
4
(4)用移液管量取20.00mL0.1000mol·L-1AgNO 溶液(1’),加入1.0mol·L-1HNO 溶液为调
3 3
节pH为0~1(1’),加入几滴NH Fe(SO ) 溶液(1’),使用KSCN溶液滴定硝酸银溶液至
4 4 2
最后一滴溶液A加入后溶液显红色,且半分钟内不褪色(1’),重复滴定2~3次(1’)(共
5分)
(5)90.82%(3分)
17.I、 +2H O+2e-= +2OH- (3分)
2
II、 (1) CO、HO (2分) ① (3分)
2
②温度升高,反应a逆向移动,反应b正向移动;温度高于260℃时,反应b正向移动的程度
大于反应a逆向移动的程度 (2分)
在该条件下反应a和反应b的速率之比大于相同条件下平衡时甲醇和CO的物质的量之比(2
分)
(3)蛋黄型空心球催化剂吸收紫外线的能量,使HO失去电子生成O 和H+,CO 得到电子和
2 2 2
H+生成CH、CHOH、HO(3分)
4 3 2
试卷第12页,共10页试卷第13页,共10页
学科网(北京)股份有限公司