文档内容
科目:化 学
(试题卷)
注意事项:
1.答题前,考生务必将自己的姓名、准考证号写在答
题卡和本试题卷的封面上,并认真核对答题卡条形码上的
姓名、准考证号和科目。
2.选择题和非选择题均须在答题卡上作答,在本试题
卷和草稿纸上作答无效。考生在答题卡上按答题卡中注意
事项的要求答题。
3.本试卷共 6 页。如缺页,考生须及时报告监考老师,
否则后果自负。
4.考试结束,将本试题卷和答题卡一并交回。
姓 名
准考证号
祝 你 考 试 顺 利 !
化学试卷 第0页 共6页
{#{QQABBQaQggigAIIAARhCEQGQCEIQkBAACAoGRFAIIAAACRFABAA=}#}2024 年常德市高三年级模拟考试
化 学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Mg 24 Fe 56
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只
有一项是符合题目要求。
1.2023年上海科技节以“悦享科技,智创未来”为主题,展示了近年来我国的科技成果。
下列说法错误的是
A.冬奥火炬“飞扬”使用的碳纤维复合材料具有强度高、耐高温的特点
B.“萌新”机器人的有机高分子材料面罩为纯净物
C.“雪龙号”极地破冰船船身由合金钢材料构成,其抗撞击能力强
D.直径为300 mm以上的大硅片首次应用于集成电路,其属于新型无机非金属材料
2.下列说法错误的是
A.汽车尾气中含有氮氧化物是因为燃料的不完全燃烧
B.核苷酸水解得到磷酸和核苷,核苷继续水解得到戊糖和碱基
C.Na O、MgO、Al O 、SiO 均属于介于离子晶体与共价晶体之间的过渡晶体
2 2 3 2
D.细胞和细胞器的双分子膜属于一种可以自组装的超分子
3.BrF 是应用最广的卤素间化合物,是一种很好的溶剂,其熔点、沸点分别为8.8℃、
3
127℃。常温下,它能与水发生反应:3BrF +5H O=HBrO +Br +9HF+O ↑。设阿伏加德
3 2 3 2 2
罗常数值为N 。下列说法正确的是
A
A.标准状况下,22.4 L的BrF 中含σ键数为3N
3 A
B.当反应中转移电子数为4N 时,可产生1 mol O
A 2
C.将反应生成的1molBr 溶于水,所得溶液中含溴的微粒总数小于2N
2 A
D.若有5mol水参与反应,则有2molBrF 被氧化
3
4.下列化学反应表示错误的是
A.Al O 与NaOH溶液反应:Al O +2NaOH+3H O=2Na[Al(OH) ]
2 3 2 3 2 4
B.碱性锌锰电池的正极反应:2MnO +2e-+2H O=2MnO(OH)+2OH-
2 2
C.向蓝色CuCl 溶液中加入浓NaCl溶液,发生反应:
2
[Cu(H O) ]2++4Cl- [CuCl ]2-+4H O
2 4 4 2
O O
D.苯甲酰胺在盐酸中水解: C +H O C +NH
2 3
NH OH
2
5.下列实验操作能达到实验目的的是
选项 实验操作 实验目的
分别称取 2gNaClO 与 NaHCO 于盛有 10mL 水的两 比较 NaClO 与 NaHCO 的
A 3 3
支试管中,充分溶解,用 pH 计测定两溶液的pH。 水解程度
向两支均盛有2 mL 5%的H O 溶液的试管中,分别加
2 2 探究不同催化剂对反应速
B 入 1mL0.1mol⋅L-1的 Fe (SO ) 溶液和 1mL0.1mol⋅L-1
2 4 3 率的影响
的CuSO 溶液。
4
向两支均盛有5mL1mol⋅L-1的Na SO 溶液的试管中,
C 2 3 探究浓度对反应速率的影响
分别滴加2mL5%和2mL15%的H O 溶液。
2 2
向2 mL 10%的NaOH溶液中加入5滴5%的CuSO 配制用于检验醛基的
D 4
溶液。 Cu(OH) 悬浊液
2
化学试卷 第1页 共6页
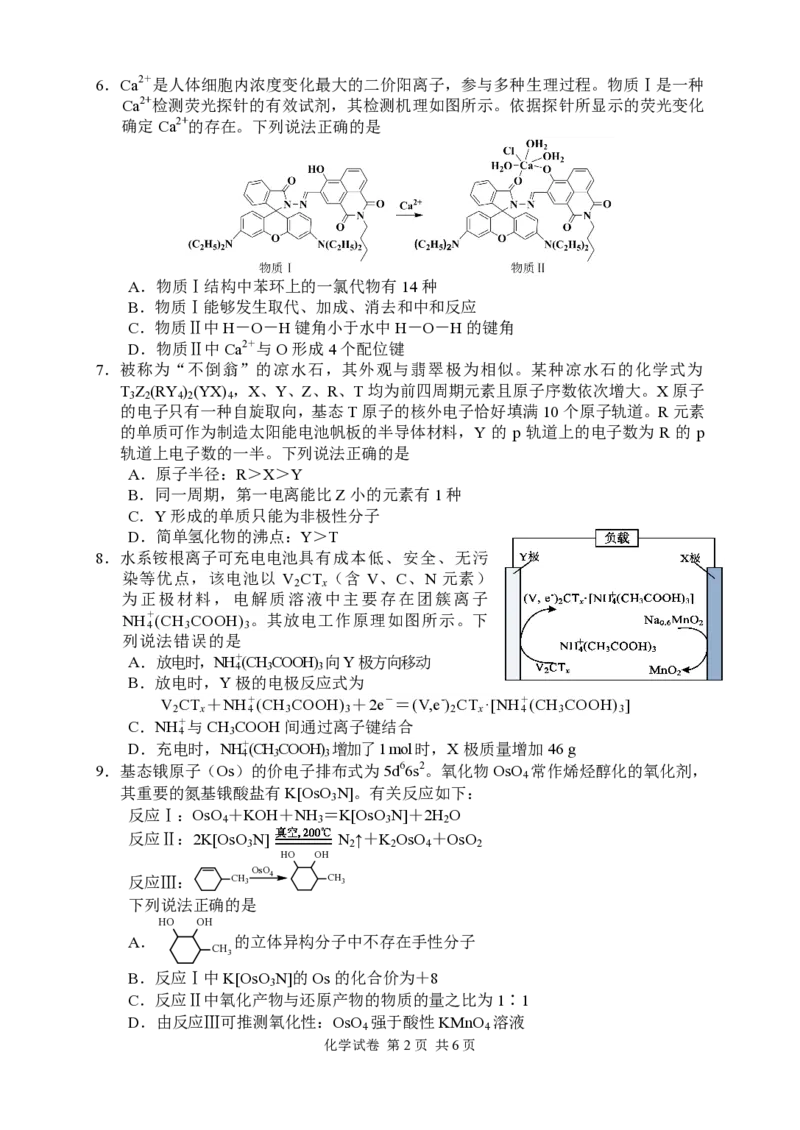
{#{QQABBQaQggigAIIAARhCEQGQCEIQkBAACAoGRFAIIAAACRFABAA=}#}6.Ca2+是人体细胞内浓度变化最大的二价阳离子,参与多种生理过程。物质Ⅰ是一种
Ca2+检测荧光探针的有效试剂,其检测机理如图所示。依据探针所显示的荧光变化
确定Ca2+的存在。下列说法正确的是
A.物质Ⅰ结构中苯环上的一氯代物有14种
B.物质Ⅰ能够发生取代、加成、消去和中和反应
C.物质Ⅱ中H-O-H键角小于水中H-O-H的键角
D.物质Ⅱ中Ca2+与O形成4个配位键
7.被称为“不倒翁”的凉水石,其外观与翡翠极为相似。某种凉水石的化学式为
T Z (RY ) (YX) ,X、Y、Z、R、T均为前四周期元素且原子序数依次增大。X原子
3 2 4 2 4
的电子只有一种自旋取向,基态T原子的核外电子恰好填满10个原子轨道。R元素
的单质可作为制造太阳能电池帆板的半导体材料,Y 的 p 轨道上的电子数为 R 的 p
轨道上电子数的一半。下列说法正确的是
A.原子半径:R>X>Y
B.同一周期,第一电离能比Z小的元素有1种
C.Y形成的单质只能为非极性分子
D.简单氢化物的沸点:Y>T
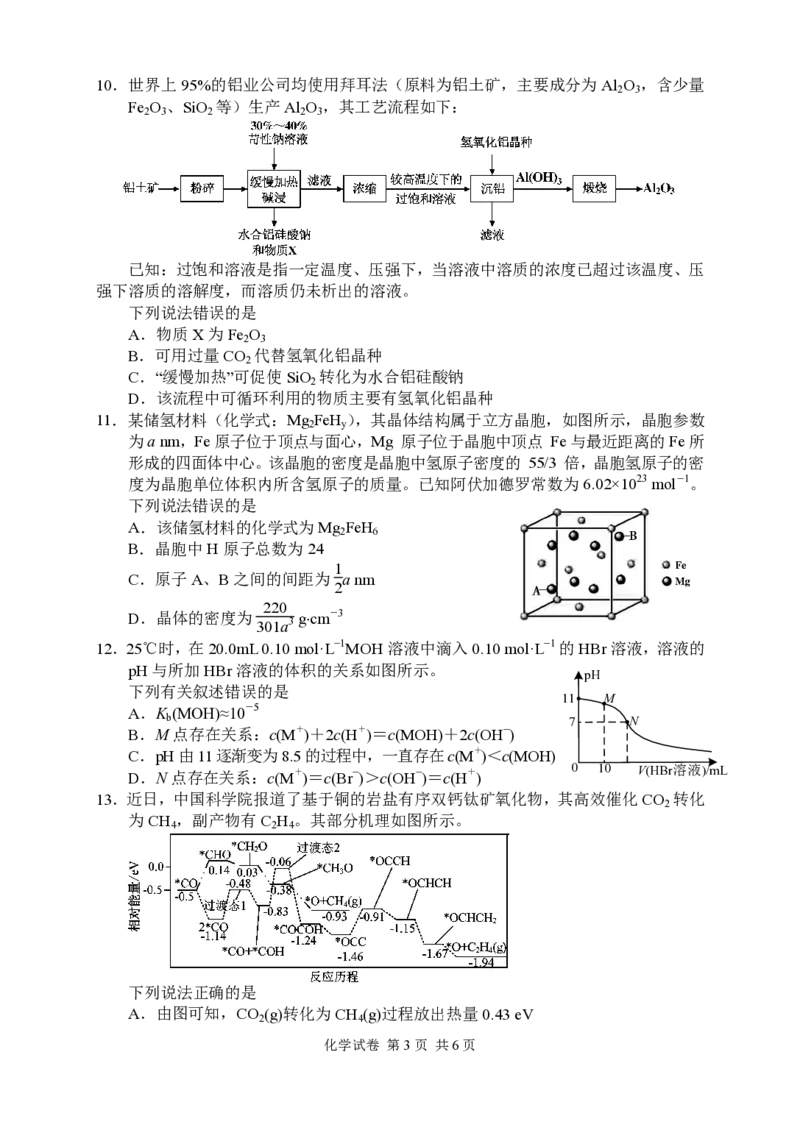
8.水系铵根离子可充电电池具有成本低、安全、无污
染等优点,该电池以 V CT (含 V、C、N 元素)
2 x
为正极材料,电解质溶液中主要存在团簇离子
NH+(CH COOH) 。其放电工作原理如图所示。下
4 3 3
列说法错误的是
A.放电时,NH+(CHCOOH) 向Y极方向移动
4 3 3
B.放电时,Y极的电极反应式为
V CT +NH+(CH COOH) +2e-=(V,e-) CT ·[NH+(CH COOH) ]
2 x 4 3 3 2 x 4 3 3
C.NH+与CH COOH间通过离子键结合
4 3
D.充电时,NH+(CHCOOH) 增加了1 mol时,X极质量增加46 g
4 3 3
9.基态锇原子(Os)的价电子排布式为5d66s2。氧化物OsO 常作烯烃醇化的氧化剂,
4
其重要的氮基锇酸盐有K[OsO N]。有关反应如下:
3
反应Ⅰ:OsO +KOH+NH =K[OsO N]+2H O
4 3 3 2
反应Ⅱ:2K[OsO
3
N] N
2
↑+K
2
OsO
4
+OsO
2
HO OH
反应Ⅲ: CH3
OsO4
CH3
下列说法正确的是
HO OH
A. 的立体异构分子中不存在手性分子
CH
3
B.反应Ⅰ中K[OsO N]的Os的化合价为+8
3
C.反应Ⅱ中氧化产物与还原产物的物质的量之比为1∶1
D.由反应Ⅲ可推测氧化性:OsO 强于酸性KMnO 溶液
4 4
化学试卷 第2页 共6页
{#{QQABBQaQggigAIIAARhCEQGQCEIQkBAACAoGRFAIIAAACRFABAA=}#}10.世界上 95%的铝业公司均使用拜耳法(原料为铝土矿,主要成分为Al O ,含少量
2 3
Fe O 、SiO 等)生产Al O ,其工艺流程如下:
2 3 2 2 3
已知:过饱和溶液是指一定温度、压强下,当溶液中溶质的浓度已超过该温度、压
强下溶质的溶解度,而溶质仍未析出的溶液。
下列说法错误的是
A.物质X为Fe O
2 3
B.可用过量CO 代替氢氧化铝晶种
2
C.“缓慢加热”可促使SiO 转化为水合铝硅酸钠
2
D.该流程中可循环利用的物质主要有氢氧化铝晶种
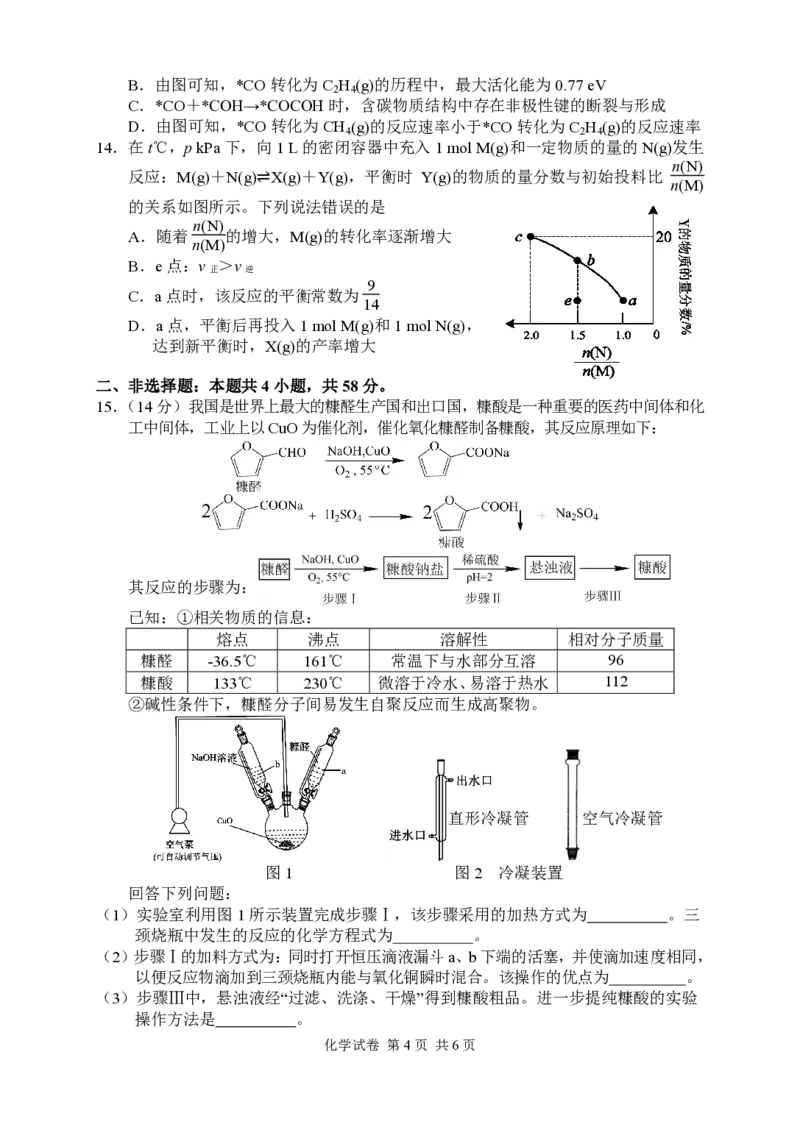
11.某储氢材料(化学式:Mg FeH ),其晶体结构属于立方晶胞,如图所示,晶胞参数
2 y
为a nm,Fe原子位于顶点与面心,Mg 原子位于晶胞中顶点 Fe与最近距离的Fe所
形成的四面体中心。该晶胞的密度是晶胞中氢原子密度的 55/3 倍,晶胞氢原子的密
度为晶胞单位体积内所含氢原子的质量。已知阿伏加德罗常数为6.02×1023 mol-1。
下列说法错误的是
A.该储氢材料的化学式为Mg FeH
2 6
B.晶胞中H原子总数为24
1
C.原子A、B之间的间距为 a nm
2
220
D.晶体的密度为
301a3
g⋅cm-3
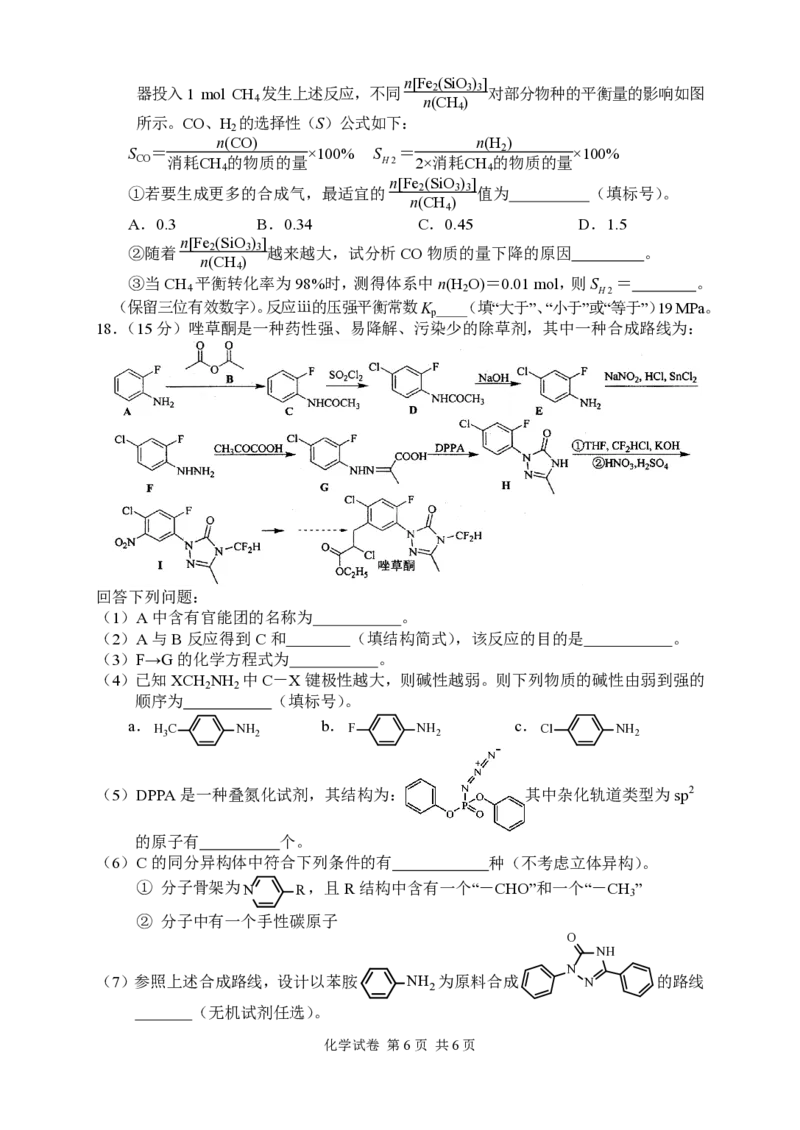
12.25℃时,在20.0mL 0.10 mol·L−1MOH溶液中滴入0.10 mol·L−1的HBr溶液,溶液的
pH与所加HBr溶液的体积的关系如图所示。
pH
下列有关叙述错误的是
11 M
A.K (MOH)≈10-5
b 7 N
B.M点存在关系:c(M+)+2c(H+)=c(MOH)+2c(OH−)
C.pH由11逐渐变为8.5的过程中,一直存在c(M+)<c(MOH)
D.N点存在关系:c(M+)=c(Br−)>c(OH−)=c(H+) 0 10 V(HBr溶液)/mL
13.近日,中国科学院报道了基于铜的岩盐有序双钙钛矿氧化物,其高效催化CO 转化
2
为CH ,副产物有C H 。其部分机理如图所示。
4 2 4
下列说法正确的是
A.由图可知,CO (g)转化为CH (g)过程放出热量0.43 eV
2 4
化学试卷 第3页 共6页
{#{QQABBQaQggigAIIAARhCEQGQCEIQkBAACAoGRFAIIAAACRFABAA=}#}B.由图可知,*CO转化为C H (g)的历程中,最大活化能为0.77 eV
2 4
C.*CO+*COH→*COCOH时,含碳物质结构中存在非极性键的断裂与形成
D.由图可知,*CO转化为CH (g)的反应速率小于*CO转化为C H (g)的反应速率
4 2 4
14.在t℃,p kPa下,向1 L的密闭容器中充入1 mol M(g)和一定物质的量的N(g)发生
n(N)
反应:M(g)+N(g) X(g)+Y(g),平衡时 Y(g)的物质的量分数与初始投料比
n(M)
的关系如图所示。下列说法错误的是
n(N)
A.随着 的增大,M(g)的转化率逐渐增大
n(M)
B.e点:v >v
正 逆
9
C.a点时,该反应的平衡常数为
14
D.a点,平衡后再投入1 mol M(g)和1 mol N(g),
达到新平衡时,X(g)的产率增大
二、非选择题:本题共4小题,共58分。
15.(14分)我国是世界上最大的糠醛生产国和出口国,糠酸是一种重要的医药中间体和化
工中间体,工业上以CuO为催化剂,催化氧化糠醛制备糠酸,其反应原理如下:
其反应的步骤为:
已知:①相关物质的信息:
熔点 沸点 溶解性 相对分子质量
糠醛 -36.5℃ 161℃ 常温下与水部分互溶 96
糠酸 133℃ 230℃ 微溶于冷水、易溶于热水 112
②碱性条件下,糠醛分子间易发生自聚反应而生成高聚物。
直形冷凝管 空气冷凝管
图1 图2 冷凝装置
回答下列问题:
(1)实验室利用图1所示装置完成步骤Ⅰ,该步骤采用的加热方式为 。三
颈烧瓶中发生的反应的化学方程式为 。
(2)步骤Ⅰ的加料方式为:同时打开恒压滴液漏斗a、b下端的活塞,并使滴加速度相同,
以便反应物滴加到三颈烧瓶内能与氧化铜瞬时混合。该操作的优点为 。
(3)步骤Ⅲ中,悬浊液经“过滤、洗涤、干燥”得到糠酸粗品。进一步提纯糠酸的实验
操作方法是 。
化学试卷 第4页 共6页
{#{QQABBQaQggigAIIAARhCEQGQCEIQkBAACAoGRFAIIAAACRFABAA=}#}2.0
1.0 CO
H2O C CO2
0 0.3 0.6 0.9 1.2 1.5
化学试卷 第5页 共6页
lom/n
(4)糠酸纯度的测定:取1.120 g提纯后的糠酸样品,配成100 mL溶液,准确量取25.00
mL于锥形瓶中,加入几滴酚酞溶液,用0.0900 mol⋅L-1KOH标准溶液滴定,平行
滴定三次,平均消耗KOH标准溶液24.80 mL。
① 量取糠酸溶液的仪器是 (填仪器名称)。
② 糠酸的纯度为 。
(5)为了提高糠酸的纯度,需提纯糠醛。实验室常用蒸馏方法得到较纯糠醛。因蒸气温
度高于140℃,实验时选用图2中空气冷凝管而不是直形冷凝管的原因是 。
16.(15分)以高铅硫化锌原矿[主要含有ZnS,含有少量PbS、ZnCO 、SiO 、FeS、In O (氧
3 2 2 3
化铟)等]为原料制备单质Zn的工艺流程如下:
稀硫酸 Zn ZnO、空气
pH=1
高铅硫化 滤液 调pH=3.5~4.5
沸腾焙烧 酸浸 除铟 电解 Zn
锌原矿 除铁
烟气 滤渣Ⅰ 滤渣Ⅱ FeOOH
已知:①K (PbS)=8.0×10-28,K (PbSO )=1.5×10-8,K (H S)=1.1×10-7,
sp sp 4 a1 2
K (H S)=1.3×10-13。
a2 2
②电解液浓度过大会导致溶液粘度变大,离子迁移速率低,电解效率低。
回答下列问题:
(1)“沸腾焙烧”的目的是 ;其中杂质FeS充分焙烧产生大量废气,其主要成
分的空间结构为 。
(2)“滤渣Ⅰ”的主要成分为 和PbSO 。若撤去“焙烧”,直接“酸浸”,调节溶
4
液中c(H+)=4.0mol⋅L-1,若要将PbS中的Pb2+沉淀完全,试计算溶液中c(H S)的
2
范围 (保留小数点后两位)。[已知H S饱和溶液中,c(H S)=0.1 mol⋅L-1]。
2 2
(3)“除铁”时Fe2+转化为FeOOH的离子方程式为 。
(4)“电解”硫酸锌溶液制备Zn的化学方程式为 ,工业所需电解液浓度为40~60
g⋅L-1的理由是 ,可用 光谱证明阴极析出的固体为Zn。
17.(14分)含铁物质在工业生产中具有重要的应用。以Fe (SiO ) 作为载氧体实现甲
2 3 3
烷部分氧化,发生的主要反应有:
ⅰ.CH(g)+3Fe(SiO)(s)CO(g)+2H(g)+2FeO(s)+9SiO(s) ∆H=+220.8 kJ⋅mol-1
4 2 33 2 3 4 2
ⅱ.CH(g)+4Fe(SiO)(s)CO(g)+2HO(g)+8FeO(s)+12SiO(s) ∆H=+316.8 kJ⋅mol-1
4 2 33 2 2 2
ⅲ.CH (g)C(s)+2H (g) ∆H=+913.0 kJ⋅mol-1
4 2
回答下列问题:
(1)反应ⅰ可在 (“高温”或“低温”)条件下自发进行。反应ⅱ的正反应活化
能 (“>”或“<”)逆反应活化能。
(2)在刚性容器、绝热体系下,仅发生反应ⅰ,则下列说法能够表明该反应已经达到
化学平衡的是 。
A.相同时间内,气态反应物8 mol σ键断裂的同 H2
时气态产物有3 mol σ键断裂
B.容器中气体的密度不再变化
C.固体中所含氧元素的质量分数不再变化
D.平衡常数不再变化
0
(3)载氧体 Fe (SiO ) 为 CH 转化为氧化物提供氧原
2 3 3 4
子,Fe 2 (SiO 3 ) 3 与CH 4 物质的量之比{
n[F
n
e
( 2 C
(S
H
iO
) 3
)
3
]
}
n[F
n
e2
(
(
C
S
H
iO
4)
3)3]
4
是影响CH 转化为合成气(CO、H )的重要因素。在900℃、0.1 MPa下,向密闭容
4 2
{#{QQABBQaQggigAIIAARhCEQGQCEIQkBAACAoGRFAIIAAACRFABAA=}#}n[Fe (SiO ) ]
器投入1 mol CH 发生上述反应,不同 2 3 3 对部分物种的平衡量的影响如图
4 n(CH )
4
所示。CO、H 的选择性(S)公式如下:
2
n(CO) n(H )
S = ×100% S = 2 ×100%
CO 消耗CH 的物质的量 H2 2×消耗CH 的物质的量
4 4
n[Fe (SiO ) ]
①若要生成更多的合成气,最适宜的 2 3 3 值为 (填标号)。
n(CH )
4
A.0.3 B.0.34 C.0.45 D.1.5
n[Fe (SiO ) ]
②随着 2 3 3 越来越大,试分析CO物质的量下降的原因 。
n(CH )
4
③当CH 平衡转化率为98%时,测得体系中n(H O)=0.01 mol,则S = 。
4 2 H2
(保留三位有效数字)。反应ⅲ的压强平衡常数K (填“大于”、“小于”或“等于”)19 MPa。
p
18.(15分)唑草酮是一种药性强、易降解、污染少的除草剂,其中一种合成路线为:
回答下列问题:
(1)A中含有官能团的名称为 。
(2)A与B反应得到C和 (填结构简式),该反应的目的是 。
(3)F→G的化学方程式为 。
(4)已知XCH NH 中C-X键极性越大,则碱性越弱。则下列物质的碱性由弱到强的
2 2
顺序为 (填标号)。
a.
H C NH
b.
F NH
c.
Cl NH
3 2 2 2
(5)DPPA是一种叠氮化试剂,其结构为: 其中杂化轨道类型为sp2
的原子有 个。
(6)C的同分异构体中符合下列条件的有 种(不考虑立体异构)。
① 分子骨架为 N R ,且R结构中含有一个“-CHO”和一个“-CH 3 ”
② 分子中有一个手性碳原子
O
NH
N
(7)参照上述合成路线,设计以苯胺 NH 为原料合成 N 的路线
2
(无机试剂任选)。
化学试卷 第6页 共6页
{#{QQABBQaQggigAIIAARhCEQGQCEIQkBAACAoGRFAIIAAACRFABAA=}#}