文档内容
2024 年邵阳市高三第二次联考试题卷
化学
本试卷共8页,18个小题。满分100分。考试用时75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、班级、考号填写在答题卡上。将条形码横贴在答题卡上
“条形码粘贴区”。
2.作答选择题时,选出每小题答案后,用2B铅笔在答题卡上对应题目选项的答案信息点涂黑
如需改动,用橡皮擦干净后,再选涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应
位置上;如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。不按以
上要求作答无效。
4.保持答题卡的整洁。考试结束后,只交答题卡,试题卷自行保存。
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 S-32 Fe-56 Ni-59 Ga-70
Ba-137
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.化学与科技、生产、生活密切相关,下列说法正确的是( )
A.聚氯乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
B.福尔马林溶液和含氯消毒液杀灭流行性病毒的原理相同
C.“嫦娥五号”配置的砷化镓太阳能电池将热能直接转化为电能
D.重油在高温、高压和催化剂作用下通过水解反应转化为小分子烃
2.下列化学用语或图示表达正确的是( )
A.石英的分子式为
B. 的电子式为
C. 的价层电子对互斥模型为
D.基态 的价层电子轨道表示式为
3.对于下列过程,描述其反应的相应离子方程式正确的是( )
A.侯氏制碱法中 晶体的制备:B.向次氯酸钙溶液中通入少量二氧化硫:
C. 溶液与过量 溶液反应:
D.将铜丝插入稀硝酸溶液中:
4.物质的性质决定用途,下列两者对应关系错误的是( )
A. 溶液呈酸性,可用于腐蚀电路板上的
B. 能够杀死将酒变成醋的酵母菌,可用作葡萄酒的抗氧化剂
C.碳纳米管具有独特的结构和大的比表面积,可用作新型储氢材料
D.等离子体中含有带电粒子且能自由移动,可应用于化学合成和材料表面改性
5.设 为阿伏加德罗常数的值,下列说法正确的是( )
A. 分子中含极性键数目一定是
B. 的 溶液中 的数目为
C.标准状况下, 一氯甲烷中含有的分子数为
D. 过氧化钡 固体中阴、阳离子总数为
6.尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病。其转化过程如图所示,下列说法正确的是(
)
A.尿黑酸和对羟基苯丙酮酸均不能形成分子内氢键
B.酪氨酸和对羟基苯丙酮酸所含的含氧官能团相同
C.尿、黑酸能与 反应制备特种、墨水D. 对羟基苯丙酮酸分别可以和 和 完全反应
7. 常用于抗酸、治疗慢性胃炎。它所含的五种元素均为短周期元素,基态 原子的价层电
子排布式为 和 位于同主族, 的最高价氧化物对应的水化物和其最简单氢化物能反应生成离
子化合物, 的周期序数和主族序数相等。下列叙述错误的是( )
A.沸点:
B.第一电离能:
C.Z元素的最高价氧化物为两性氧化物
D.W元素最高价氧化物的水化物的浓溶液在常温下可以使铁钝化
8.下列实验操作、现象和结论均正确的是( )
选 实验操作 现象 结论
项
A 取少量Fe与水蒸气高温反应后的固体产物于试管中,加 第一份溶液变血红 固体产物中铁元素有
足量的稀硫酸溶解,分成两份:第一份滴加1~2滴KSCN 色,第二份溶液紫 +2、+3两种价态
红色褪去
溶液,第二份滴加1~2滴 溶液
B 向某钾盐中滴加浓盐酸 产生的气体可以使
该钾盐一定为
品红溶液褪色
或 或二者的混
合物
C 产生沉淀
向蛋白质溶液中加入饱和 溶液 使蛋白质变
性
D 在小烧杯中加入约5g动物脂肪、6mL95%的乙醇,再加 沉淀溶解溶液呈绛 油脂已发生水解
入6mL40%的氢氧化钠溶液,微热一段时间后取少量溶 蓝色
液,加入新制氢氧化铜
A.A B.B C.C D.D
9.利用废铝箔(主要成分为 ,含少量 等)制明矾 的一种工艺流程如图:
下列说法错误的是( )
A.该工艺步骤①与步骤②顺序互换会更节约生产成本
B.②中发生的反应有:
C.③中稀 酸化的目的是将 转化成D.由④可知,室温下明矾的溶解度小于 和 的溶解度
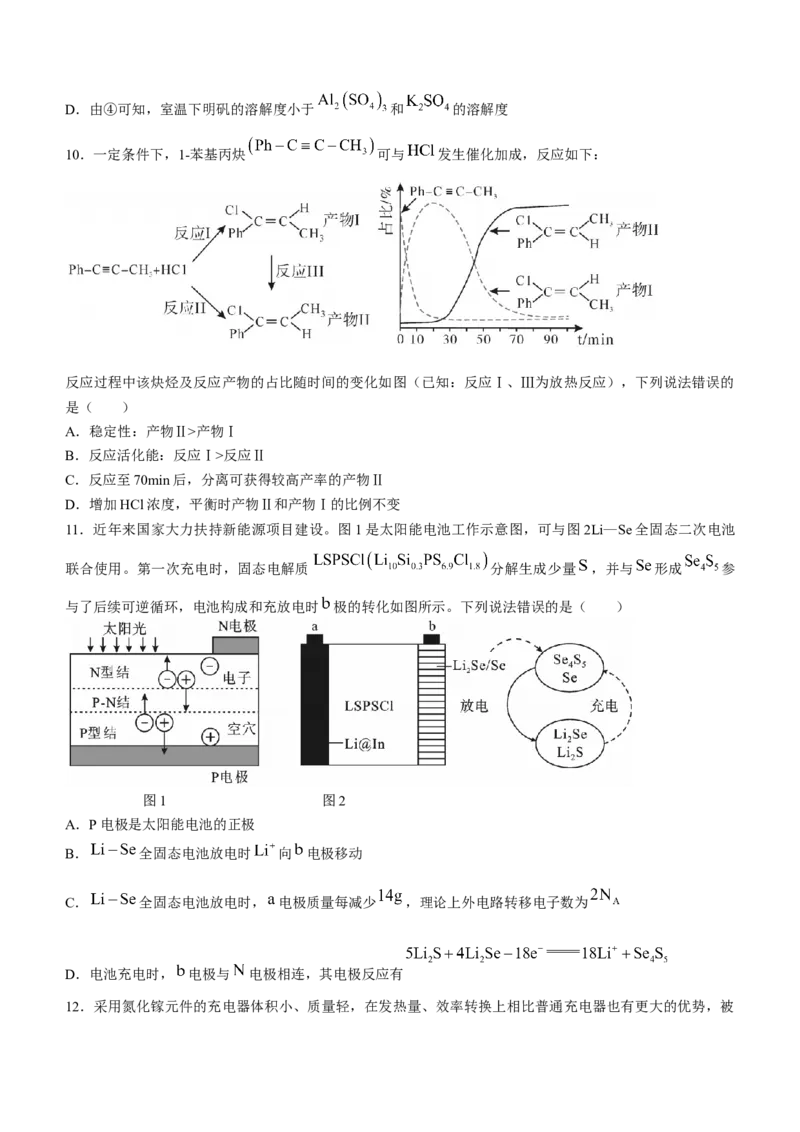
10.一定条件下,1-苯基丙炔 可与 发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法错误的
是( )
A.稳定性:产物Ⅱ>产物Ⅰ
B.反应活化能:反应Ⅰ>反应Ⅱ
C.反应至70min后,分离可获得较高产率的产物Ⅱ
D.增加HCl浓度,平衡时产物Ⅱ和产物Ⅰ的比例不变
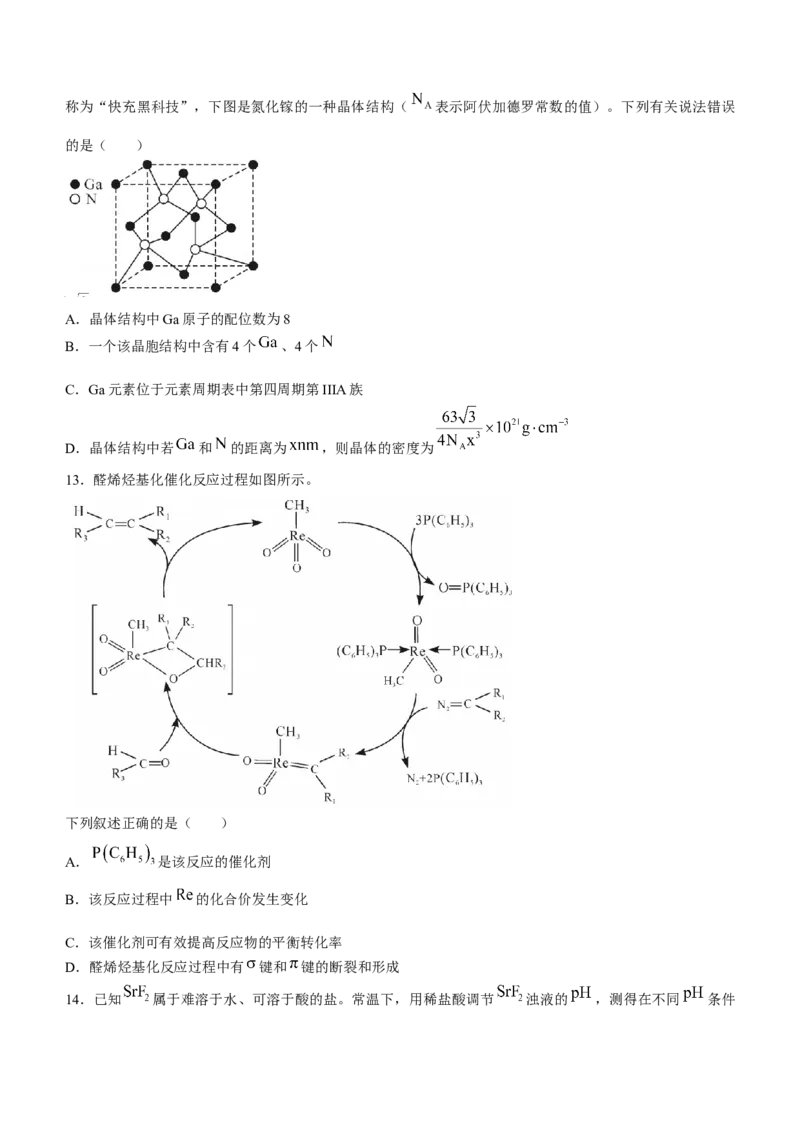
11.近年来国家大力扶持新能源项目建设。图1是太阳能电池工作示意图,可与图2Li—Se全固态二次电池
联合使用。第一次充电时,固态电解质 分解生成少量 ,并与 形成 参
与了后续可逆循环,电池构成和充放电时 极的转化如图所示。下列说法错误的是( )
图1 图2
A.P电极是太阳能电池的正极
B. 全固态电池放电时 向 电极移动
C. 全固态电池放电时, 电极质量每减少 ,理论上外电路转移电子数为
D.电池充电时, 电极与 电极相连,其电极反应有
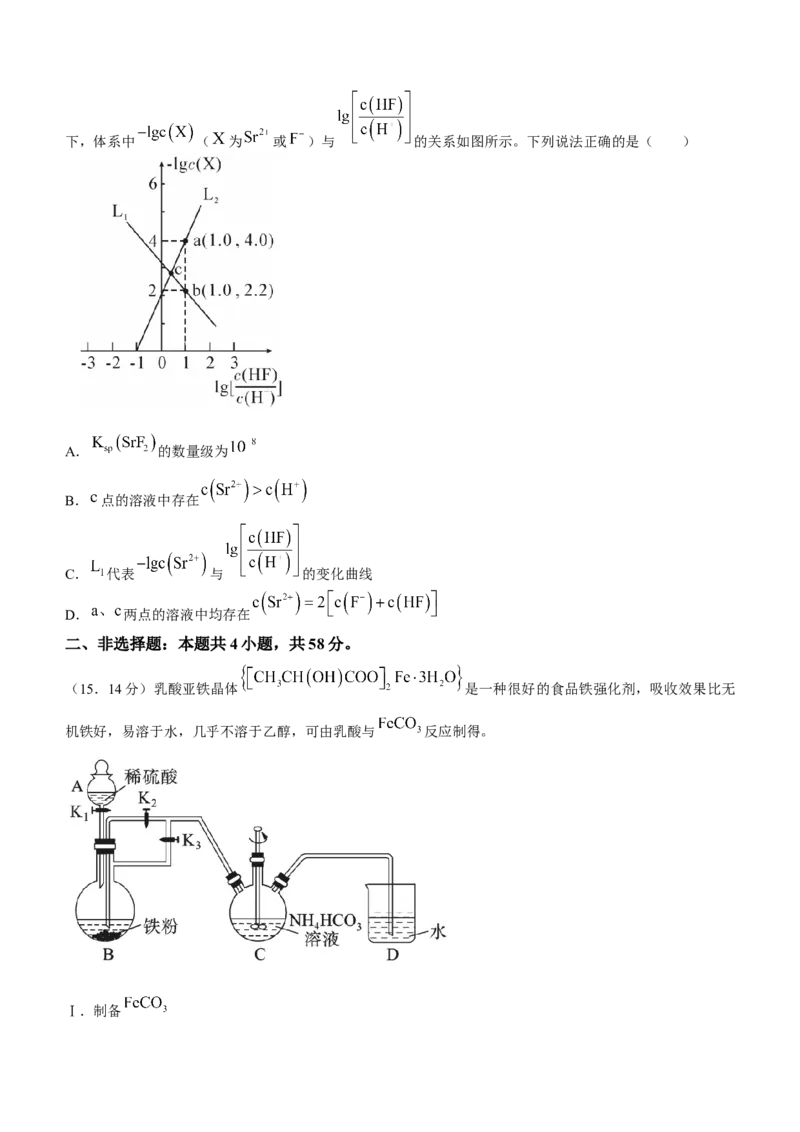
12.采用氮化镓元件的充电器体积小、质量轻,在发热量、效率转换上相比普通充电器也有更大的优势,被称为“快充黑科技”,下图是氮化镓的一种晶体结构( 表示阿伏加德罗常数的值)。下列有关说法错误
的是( )
A.晶体结构中Ga原子的配位数为8
B.一个该晶胞结构中含有4个 、4个
C.Ga元素位于元素周期表中第四周期第IIIA族
D.晶体结构中若 和 的距离为 ,则晶体的密度为
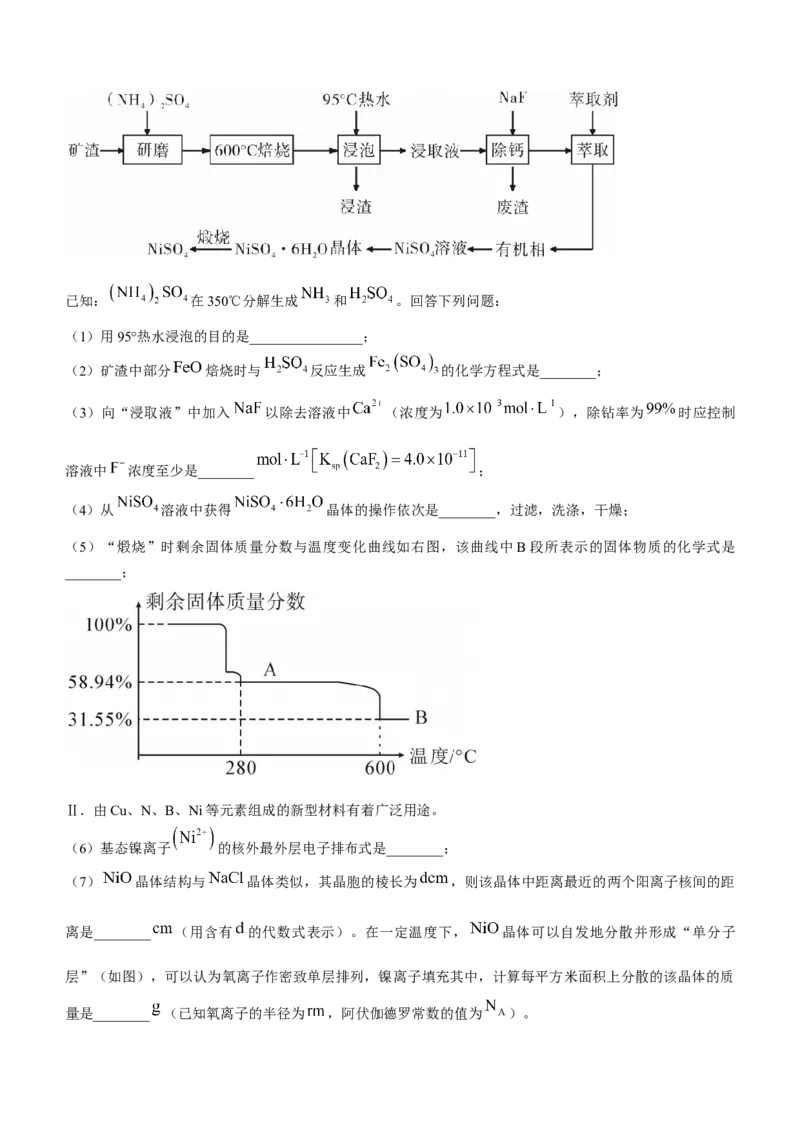
13.醛烯烃基化催化反应过程如图所示。
下列叙述正确的是( )
A. 是该反应的催化剂
B.该反应过程中 的化合价发生变化
C.该催化剂可有效提高反应物的平衡转化率
D.醛烯烃基化反应过程中有 键和 键的断裂和形成
14.已知 属于难溶于水、可溶于酸的盐。常温下,用稀盐酸调节 浊液的 ,测得在不同 条件下,体系中 ( 为 或 )与 的关系如图所示。下列说法正确的是( )
A. 的数量级为
B. 点的溶液中存在
C. 代表 与 的变化曲线
D. 两点的溶液中均存在
二、非选择题:本题共4小题,共58分。
(15.14分)乳酸亚铁晶体 是一种很好的食品铁强化剂,吸收效果比无
机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与 反应制得。
Ⅰ.制备实验步骤如下:
①检查气密性,按图示添加药品;
②在装置B中制取硫酸亚铁,并将整个装置内的空气排净;
③将装置B中溶液导入装置C中产生 沉淀;
④将装置C中混合物分离提纯,获得纯净的碳酸亚铁产品。
(1)装置 中装有 溶液的仪器名称是________________;
(2)步骤②中检验整个装置内的空气是否排净的方法是________________;
(3)装置 中生成 的离子方程式是________________;
(4)步骤③将装置B中溶液导入装置C中应先关闭开关________再打开开关________(选填“ ”或“
”);
Ⅱ.制备乳酸亚铁晶体
将制得的 加入乳酸溶液中,再加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
经系列操作后得到产品。
(5)铁氰化钾 是配合物,其配位数为________,常用于 的检验,其原理是
________________(用离子方程式表示);
Ⅲ.探究乳酸亚铁晶体中铁元素含量
称取 样品,灼烧至完全灰化,加足量盐酸溶解,加入过量KI溶液充分反应,然后加入 滴淀粉溶液,
用 硫代硫酸钠标准溶液滴定,滴定终点时,测得消耗标准溶液 。(已知:
)
(6)判断滴定终点的方法是________________;
(7)样品中铁元素的质量分数是________(用含有相关字母的代数式表示)。
16.(15分)铁、镍及其化合物在工业上有广泛的应用。
Ⅰ.从某矿渣[成分为 (铁酸镍)、 等]中回收 的工艺流程如下:已知: 在350℃分解生成 和 。回答下列问题:
(1)用95°热水浸泡的目的是________________;
(2)矿渣中部分 焙烧时与 反应生成 的化学方程式是________;
(3)向“浸取液”中加入 以除去溶液中 (浓度为 ),除钻率为 时应控制
溶液中 浓度至少是________ ;
(4)从 溶液中获得 晶体的操作依次是________,过滤,洗涤,干燥;
(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是
________;
Ⅱ.由Cu、N、B、Ni等元素组成的新型材料有着广泛用途。
(6)基态镍离子 的核外最外层电子排布式是________;
(7) 晶体结构与 晶体类似,其晶胞的棱长为 ,则该晶体中距离最近的两个阳离子核间的距
离是________ (用含有 的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子
层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质
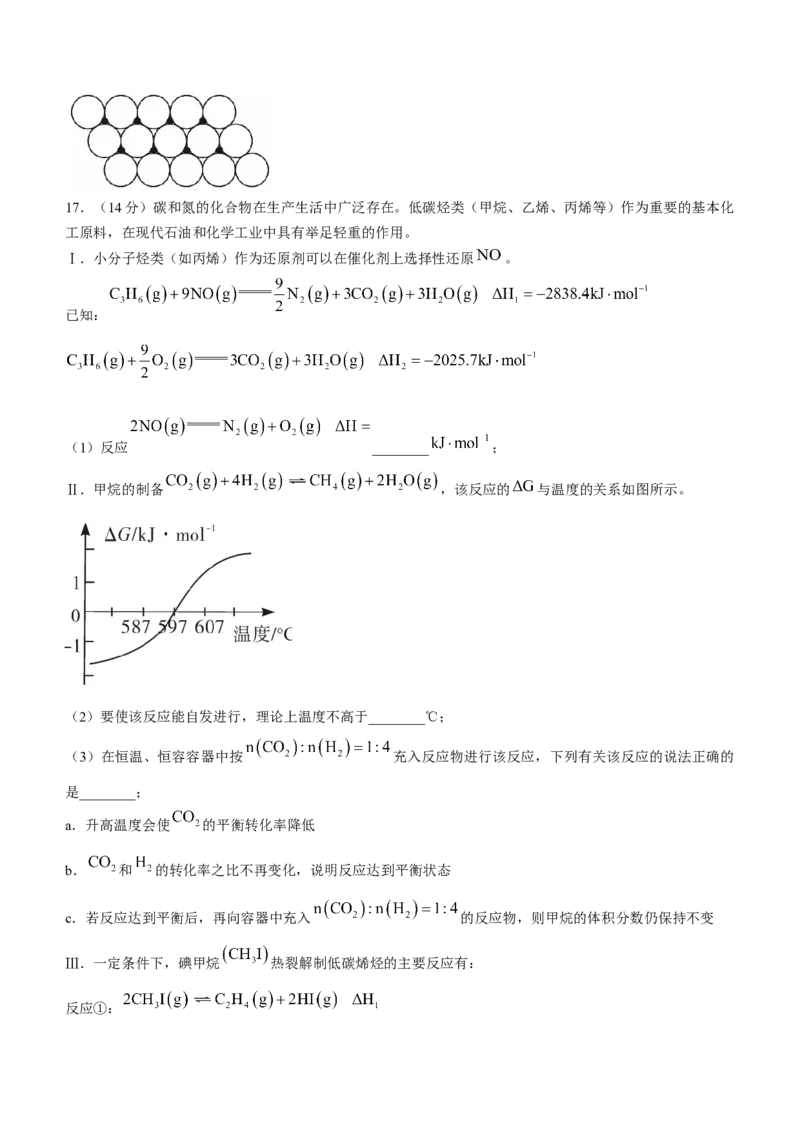
量是________ (已知氧离子的半径为 ,阿伏伽德罗常数的值为 )。17.(14分)碳和氮的化合物在生产生活中广泛存在。低碳烃类(甲烷、乙烯、丙烯等)作为重要的基本化
工原料,在现代石油和化学工业中具有举足轻重的作用。
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原 。
已知:
(1)反应 ________ ;
Ⅱ.甲烷的制备 ,该反应的 与温度的关系如图所示。
(2)要使该反应能自发进行,理论上温度不高于________℃;
(3)在恒温、恒容容器中按 充入反应物进行该反应,下列有关该反应的说法正确的
是________;
a.升高温度会使 的平衡转化率降低
b. 和 的转化率之比不再变化,说明反应达到平衡状态
c.若反应达到平衡后,再向容器中充入 的反应物,则甲烷的体积分数仍保持不变
Ⅲ.一定条件下,碘甲烷 热裂解制低碳烯烃的主要反应有:
反应①:反应②:
反应①和②在不同温度下的分压平衡常数 如下表,回答下列问题:
反应① 2.80
反应②
(4)根据表中数据推出反应①的活化能 (正)________(填“ ”或“ ”) (逆);
(5)反应②的正、逆反应速率表达式有: , ( 、 为反应速
率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系
的经验公式: [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速
率常数越________(填“大”或“小”)。当该反应达到平衡后,升高温度, 的值________(填“增
大”“减小”或“不变”);
Ⅳ.微生物燃料电池的一种重要应用是废水处理中实现碳氮联合转化为 和 ,如图所示,其中1,2为
厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。
(6)正极的电极反应式是________;
(7)协同转化总反应中当有标准状况下 生成时转移电子的个数是________。
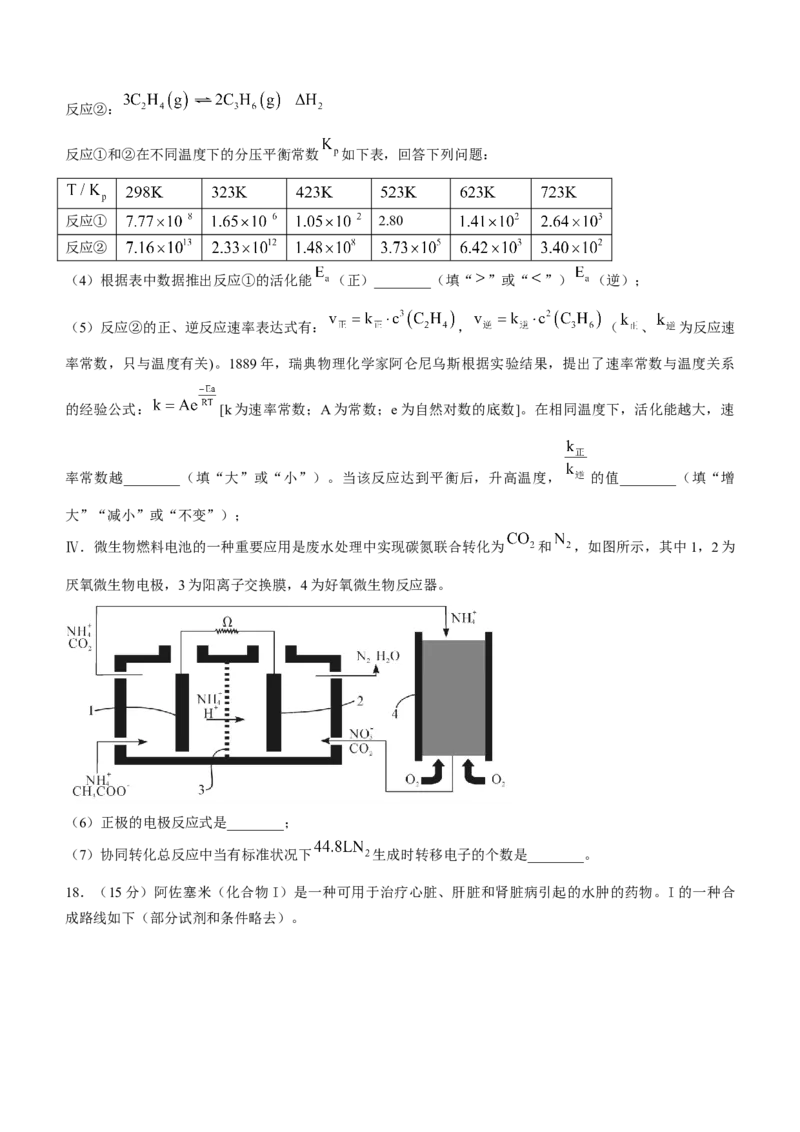
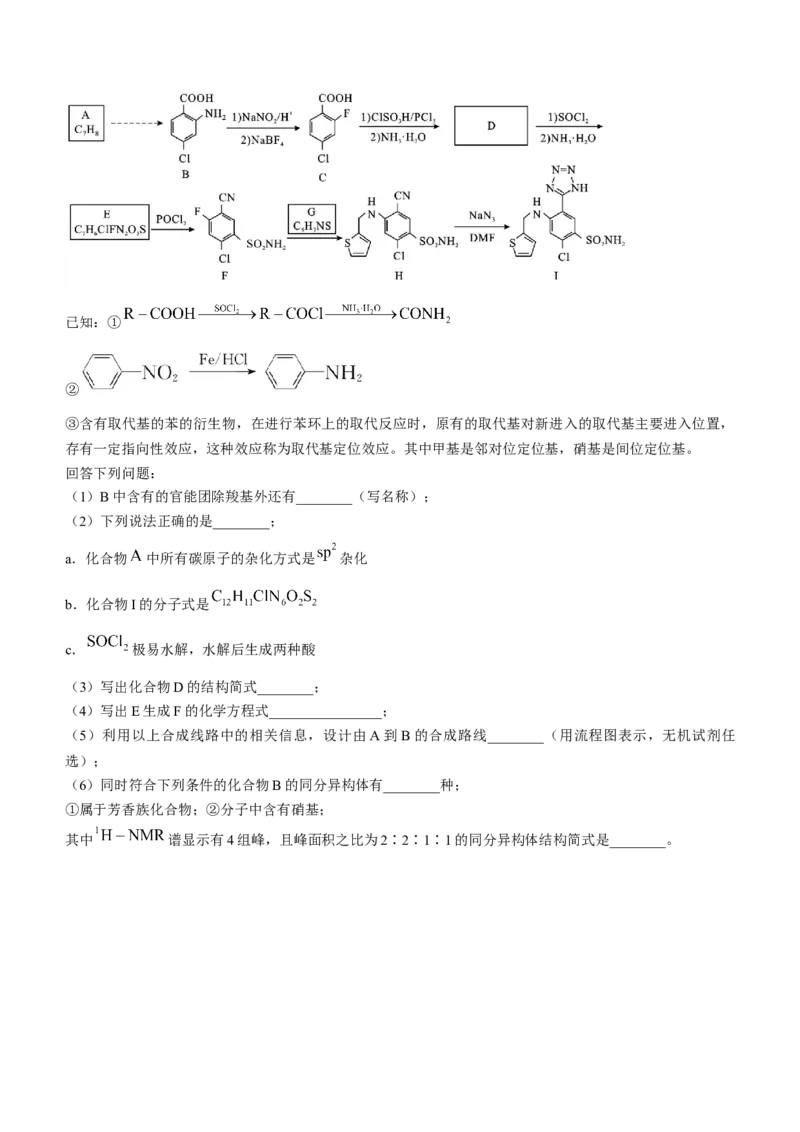
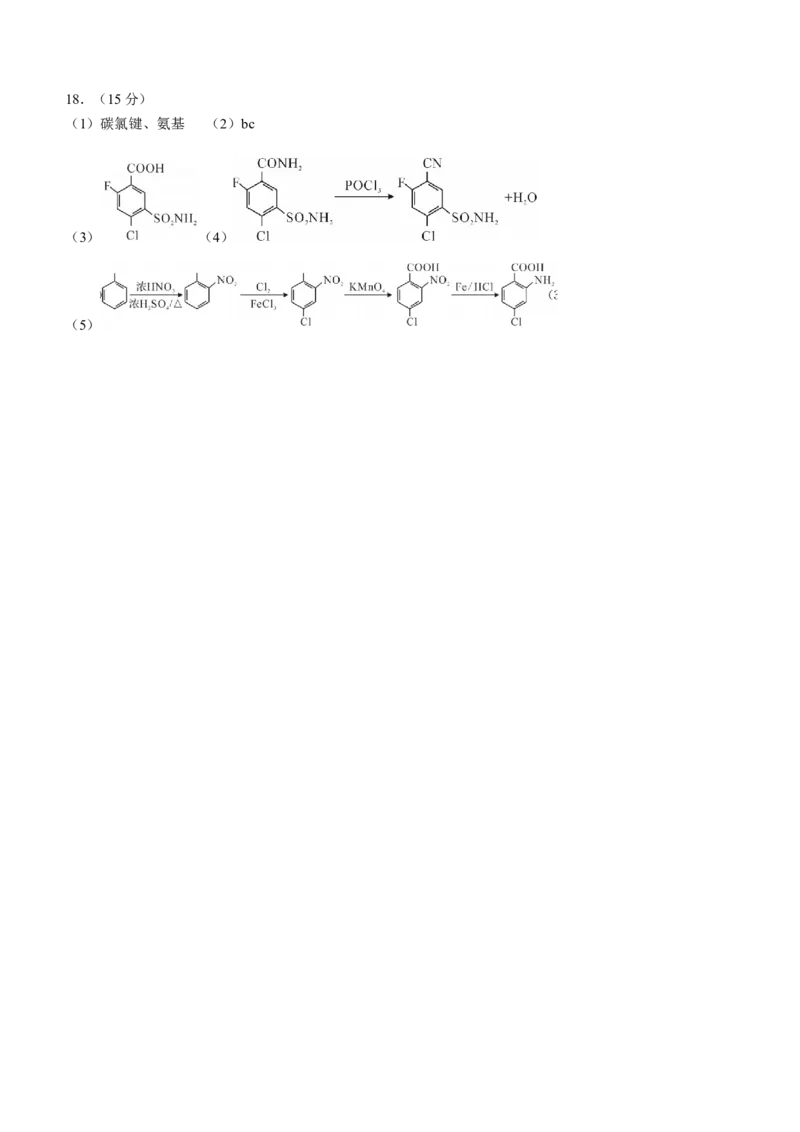
18.(15分)阿佐塞米(化合物I)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。I的一种合
成路线如下(部分试剂和条件略去)。已知:①
②
③含有取代基的苯的衍生物,在进行苯环上的取代反应时,原有的取代基对新进入的取代基主要进入位置,
存有一定指向性效应,这种效应称为取代基定位效应。其中甲基是邻对位定位基,硝基是间位定位基。
回答下列问题:
(1)B中含有的官能团除羧基外还有________(写名称);
(2)下列说法正确的是________;
a.化合物 中所有碳原子的杂化方式是 杂化
b.化合物I的分子式是
c. 极易水解,水解后生成两种酸
(3)写出化合物D的结构简式________;
(4)写出E生成F的化学方程式________________;
(5)利用以上合成线路中的相关信息,设计由A到B的合成路线________(用流程图表示,无机试剂任
选);
(6)同时符合下列条件的化合物B的同分异构体有________种;
①属于芳香族化合物;②分子中含有硝基;
其中 谱显示有4组峰,且峰面积之比为2∶2∶1∶1的同分异构体结构简式是________。2024 年邵阳市高三第二次联考试题参考答案与评分标准
化学
一、选择题:本题共14小题,每小题3分,共42分。
题号 1 2 3 4 5 6 7
答案 A C B A C C A
题号 8 9 10 11 12 13 14
答案 D C B D A D B
二、非选择题:本题共4小题,共58分。除特殊标记外,其余每空2分。
15.(14分)
(1)三颈烧瓶或三口烧瓶 (2)在装置 处用排水法收集一小试管的 验纯
(3)
(4) (5)6
(6)当滴入最后半滴硫代硫酸钠标准溶液时,溶液由蓝色变无色,且30秒不变色
(7)
16.(15分)
(1)促进 水解,使 转化成沉淀除去
(2)
(3) (4)加热浓缩溶液至有晶膜出现(蒸发浓缩),冷却结晶
(5) (6)
(7)
17.(14分)
(1) (2)597 (3)a (4)> (5)小 减小
(6) (7)18.(15分)
(1)碳氯键、氨基 (2)bc
(3) (4)
(5)