文档内容
2023年11月稽阳联谊学校高三联考化学参考答案及评分标准
一、选择题(本大题共16小题,每小题3分,共48分,每小题列出的四个备选项中只有
一个是符合题目要求的,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8
答案 A B C A D A B D
题号 9 10 11 12 13 14 15 16
答案 C D B C A C C D
非选择题部分
二、非选择题(本大题共5小题,共52分)
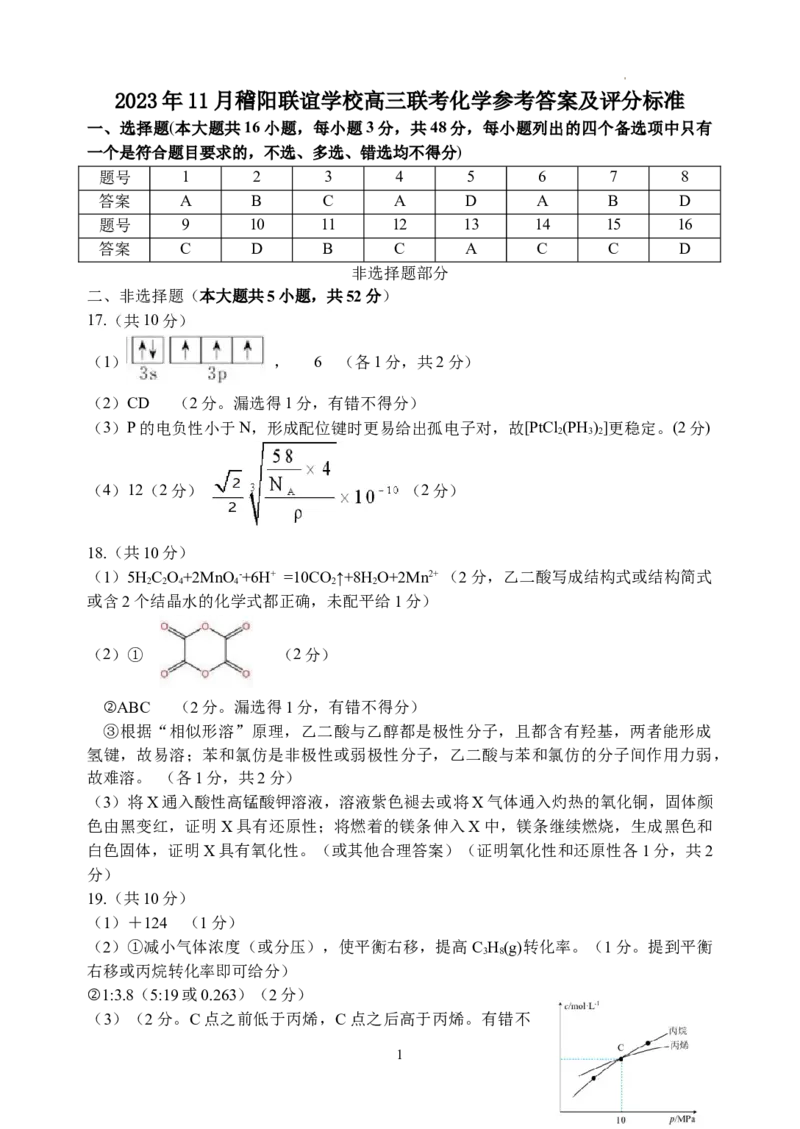
17.(共10分)
(1) , 6 (各1分,共2分)
(2)CD (2分。漏选得1分,有错不得分)
(3)P的电负性小于N,形成配位键时更易给出孤电子对,故[PtCl (PH )]更稳定。(2分)
2 3 2
(4)12(2分) (2分)
18.(共10分)
(1)5HC O+2MnO-+6H+ =10CO ↑+8H O+2Mn2+ (2分,乙二酸写成结构式或结构简式
2 2 4 4 2 2
或含2个结晶水的化学式都正确,未配平给1分)
(2)① (2分)
②ABC (2分。漏选得1分,有错不得分)
③根据“相似形溶”原理,乙二酸与乙醇都是极性分子,且都含有羟基,两者能形成
氢键,故易溶;苯和氯仿是非极性或弱极性分子,乙二酸与苯和氯仿的分子间作用力弱,
故难溶。 (各1分,共2分)
(3)将X通入酸性高锰酸钾溶液,溶液紫色褪去或将X气体通入灼热的氧化铜,固体颜
色由黑变红,证明X具有还原性;将燃着的镁条伸入X中,镁条继续燃烧,生成黑色和
白色固体,证明X具有氧化性。(或其他合理答案)(证明氧化性和还原性各1分,共2
分)
19.(共10分)
(1)+124 (1分)
(2)①减小气体浓度(或分压),使平衡右移,提高C H(g)转化率。(1分。提到平衡
3 8
右移或丙烷转化率即可给分)
②1:3.8(5:19或0.263)(2分)
(3)(2分。C点之前低于丙烯,C点之后高于丙烯。有错不
1
学科网(北京)股份有限公司得分)
(4)①A (1分)
②反应温度较低、节约能源;氧气消耗氢气,有利于平衡正向移动;利用氢气和氧气
反应放热,维持热量平衡;产品容易分离、副产物少。(写出1点即可,1分)
(5)BD (2分。对1个给1分,有错不得分)
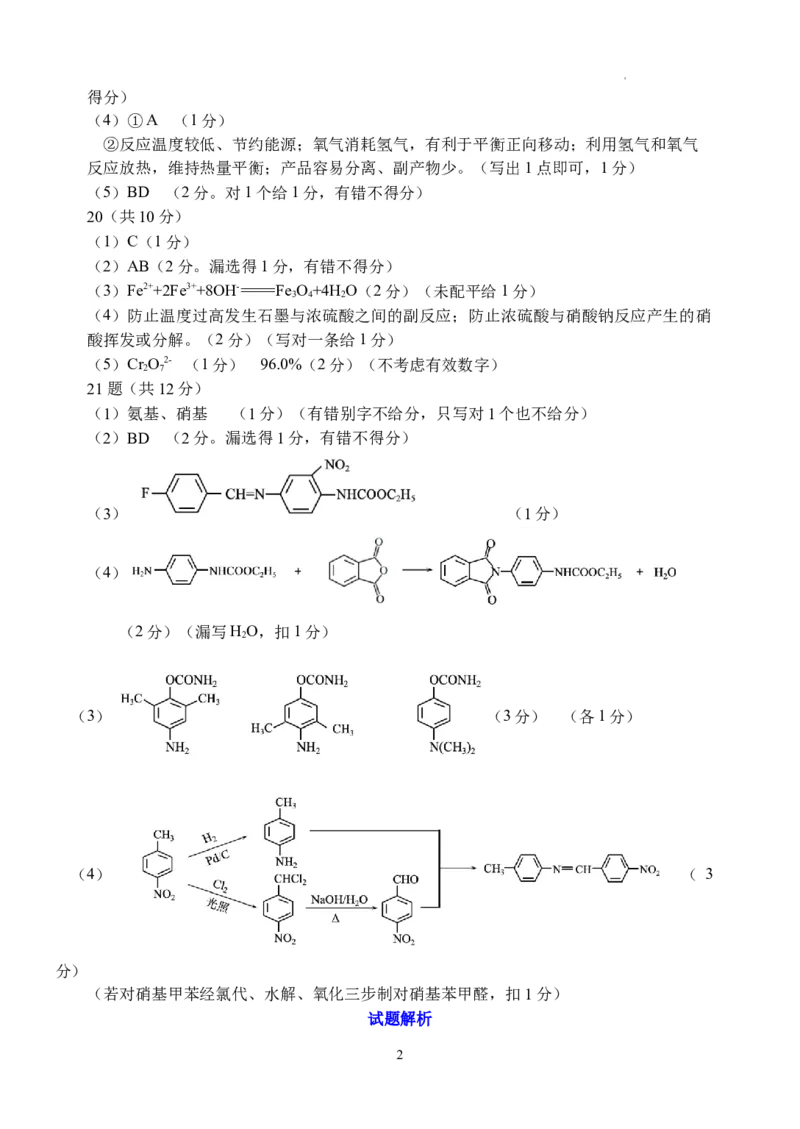
20(共10分)
(1)C(1分)
(2)AB(2分。漏选得1分,有错不得分)
(3)Fe2++2Fe3++8OH-=Fe O+4H O(2分)(未配平给1分)
3 4 2
(4)防止温度过高发生石墨与浓硫酸之间的副反应;防止浓硫酸与硝酸钠反应产生的硝
酸挥发或分解。(2分)(写对一条给1分)
(5)Cr O2- (1分) 96.0%(2分)(不考虑有效数字)
2 7
21题(共12分)
(1)氨基、硝基 (1分)(有错别字不给分,只写对1个也不给分)
(2)BD (2分。漏选得1分,有错不得分)
(3) (1分)
(4)
(2分)(漏写HO,扣1分)
2
(3) (3分) (各1分)
(4) ( 3
分)
(若对硝基甲苯经氯代、水解、氧化三步制对硝基苯甲醛,扣1分)
试题解析
2
学科网(北京)股份有限公司1.碳纳米材料主要成分为碳的单质
2.O 分子结构为V形分子;邻羟基苯甲醛分子内氢键是羟基上的氢原子与羰基上的氧原
3
子间形成的;聚丙烯结构简式为:
3.硫酸钡用饱和碳酸钠溶液处理,可转为碳酸钡,碳酸钡难溶于水,可溶于酸
4.维生素C具有还原性,因此可用于食品中的抗氧化剂
5.A:瓷坩埚中含有二氧化硅,高热条件下易与NaOH反应导致坩埚破裂;B:反应过程
中,有溴单质挥发出来,也能与硝酸银溶液产生沉淀;C:生成的乙炔中含有硫化氢等杂
质,也能使高锰酸钾溶液褪色,应先通过硫酸铜溶液,再用酸性高锰酸钾溶液检验;D:
打开止水夹,用热毛巾或浸过冰水的毛巾捂住圆底烧瓶,使NaOH溶液与氯气接触后,
即可看到喷泉现象
6.分析转化关系图,可知:过程I反应的离子方程式为:NO -+2H++e-=NO+HO;过程II
2 2
发生反应的离子方程式为:NO+NH ++2H++3e- = HO+NH ;过程 III:NH= N +4H+
4 2 2 4 2 4 2
+4e-;过程I-III的总反应为:NO -+NH+=N +2H O;
2 4 2 2
A:根据总反应式,整个过程,转化1mol NO - 向大气释放1mol N;B:过程I、II反应均消
2 2
耗氢离子,使水体酸性减弱;C:NH 能结合水电离出的氢离子而使溶液显碱性;D:过
2 4
程II中铵根离子中氮元素化合价升高,发生氧化反应。
7.A: HONH 分子中氧原子上有两个孤电子对,氮原子上有一个孤电子对,所以 33g
2
HONH 中,各原子最外层孤电子对总数为3N ;B: Na O 由钠离子和过氧根离子构成,所
2 A 2 2
以7.8g Na O 固体中含有离子总数为0.3N ,正确;C:氯气与水反应是可逆反应,N(Cl-)
2 2 A
+N(HClO)+N(ClO-)<0.2N ;D:随反应进行,浓硝酸变稀硝酸,还原产物变为NO,相同物
A
质的量的铜生成气体分子数减少,所以6.4g Cu与一定体积浓硝酸恰好完全反应,则生成
气体分子数小于0.2N
A
8.A:如ClCH NH 与CHNHCl互为同分异构体,CHNO 与CHONO互为同分异构,
2 2 3 3 2 3
CHFClBr存在对映异构体,等;B:苯酚和苯甲酸常下均为固体,不能通过蒸馏的方法进
行分离;C:乙烯在较高压力与较高温度和引发剂作用下,通加聚反应可得到低密度聚乙
烯
9.A:碘离子还原性比亚铁离子强,向FeI 溶液中滴加少量稀硝酸,首先被氧化的是碘
2
离子;B:AgCl不溶于水,对应的离子方程式应为AgCl+ 2NH ·H O = [Ag(NH )]+ +Cl -
3 2 3 2
+2HO C:Ba(OH) 少量时,氢氧根只与铁离子反应,氢氧化钡对应的离子全部参加反应,
2 2
所以对应离子方程式为3Ba2++6OH-+2Fe3++3SO2-=3BaSO ↓+2Fe(OH) ↓D:硫氢化钠溶液少
4 4 3
量,铜离子足量,不可能生成硫化氢气体,所以对应离子方程式为: Cu2+ + HS- = CuS↓+
H+
10.A: 可推测a为丁烯二酸酸酐,四个碳原子均为sp2杂化,所以a分子所有原子在同一
个平面上; B:酸酐能和NaOH溶液反应,N中含有羧基和酯基,它们均能与NaOH溶液
发生反应;C: 反应1为加聚反应生成聚合物,反应2酯酐与醇的取代反应。D: 试剂b的
结构简式为:
11.A、B、C、D、E五种元素位于元素周期表前四周期,原子序数依次增大,除 E外均
3
学科网(北京)股份有限公司为非金属元素。主族元素原子半径最小的元素为氢,所以 A为H; B的电子排布式为
1s22s22p3,为N;C与B位于同一周期,C基态原子有2个未成对电子,则C为O;D的
单质是重要的半导体材料,为Si;基态E+有电子填充的轨道无成单电子,则E+价层电子排
布为3d10,E为Cu。A:O >N>H>Si,正确;B:D与A形成化合物为SiH ,为分子晶体;
4
C:A与B可形成NH,A与C可形成HO,它们均为含有非极性键的极性分子;D:由
2 4 2 2
A、B、C、E四种元素可组成盐[Cu(NH )](NO ) ,加入无水乙醇降低了其在水中的溶解
3 4 3 2
度,能析出蓝色沉淀
12.A:根据图示放电时,步聚1中,铜离子和S均得到电子,生成硫化亚铜,正极反应
式为 ;B:“单独构建该步电池时效率较低”,可推测Cu S对步骤
2
2的正极反应起催化作用,提高了电池工作效率;C:则消耗6.5g锌时,转移2mol电子,
得到的精铜质量等于6.4g;D:根据信息,步骤2工作过程中,电池工作环境氧气浓度越
大,x值也越大,极板质量增加也越多
13.A:生成P 的活化能低,反应速率快,但P 能量低,更稳定,所以反应过程中,产
1 2
物P 的浓度先增大,因P2不断生成,使平衡向生成P 方向移动,P 浓度减小;B:过渡
1 2 1
态能量越高,反应的活化能越高,但反应的∆H与活化能高低无直接关系; C:P 1⇌ P 2
为放热过程,升高温度,有利于平衡向逆方向移动,达到平衡时,生成的产物中P 的百
2
分含量减小;D:反应过程中,υ(HNO) >υ(Z)= υ(P ) + υ(P )
1 2
14.A:步骤①会产生二氧化硫有毒气体,可用石灰乳吸收;B:硫酸浓度增大,反应速率
加快,能加快浸出速率,适当加热也能加快浸出速率;C:若先NaSO 溶液,则会使铜离
2 3
子直接与亚硫酸根结合生成亚硫酸铜等沉淀,不利于生成CuCl;D:无水乙醇可洗去水,
加快干燥速度
15.A:实验①反应后的得到等物质的量浓度的NaCO、NaHCO 、NaCl溶液,根据碳酸
2 3 3
的电离常数可知,溶液中碳酸根的水解平衡进行的程度最大,所以溶液中粒子浓度关系
为:c(Na+) >c(HCO -)>c(Cl-)>c(CO 2-)>c(OH-)>c(H+);B:实验②反应得到碳酸钙饱和溶液,
3 3
由于碳酸根离子能发生水解反应,所以c(Ca2+) > 5×10-4mol/L > c(CO 2-);C:③根据有关
3
常数,可知总反应Ca2++2HCO- = CaCO↓+ H CO↑的反应平衡常数K=5.3×104,由于碳酸
3 3 2 3
分解平衡常数未知,所以选项中平衡常数不能求得;D: ②中,Q [CaCO]≈10-2 > 2.5×10-
sp 3
9;Q [Ca(OH) ]=10-1×10-4.7=10-5.7=10-0.3×10-6< 5.5×10-6,所以只生成CaCO ;
sp 2 3
Q [MgCO]≈10-2 > 1×10-5;Q [Mg(OH) ]=10-1×10-4.7=10-5.7>1.8×10-11,能同时生成MgCO
sp 3 sp 2 3
和,Mg(OH) 沉淀可能为碱式盐;
2
16.A:硫酸没有挥发性,不会看到白烟现象; B: 硫酸铜氨溶液中滴加少量硫酸出现蓝色
沉淀,是因为硫酸破坏了铜氨离子的结构,释放出的氨与铜离子反应生成了氢氧化铜沉
淀;C:检验亚铁离子应该用K[Fe(CN) ]溶液;
3 6
17:本题以“磷单质及其化合物”为载体,考查《物质结构与性质》的主干知识和核心
素养。
(1)知道核外电子排布的构造原理和排布规则(泡利原理、洪特规则、能量最低原理),
熟悉1-36号元素基态原子的核外电子排布,正确书写和区别电子排布式和轨道表示式;
能分析判断价层电子和电子的能量。需注意区别原子中所有电子的排布和价层电子的排
布,核外运动能量不同的电子与核外运动状态不同的电子。P为15号元素,最外层电子
4
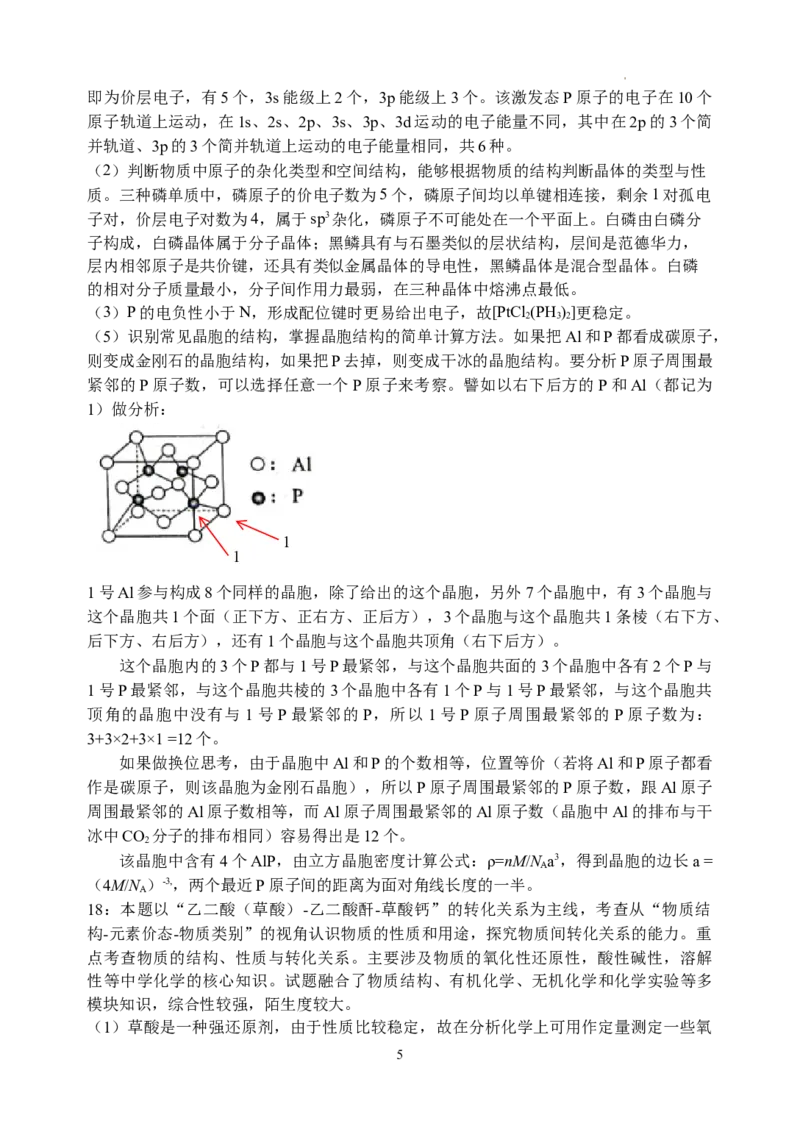
学科网(北京)股份有限公司即为价层电子,有5个,3s能级上2个,3p能级上3个。该激发态P原子的电子在10个
原子轨道上运动,在1s、2s、2p、3s、3p、3d运动的电子能量不同,其中在2p的3个简
并轨道、3p的3个简并轨道上运动的电子能量相同,共6种。
(2)判断物质中原子的杂化类型和空间结构,能够根据物质的结构判断晶体的类型与性
质。三种磷单质中,磷原子的价电子数为5个,磷原子间均以单键相连接,剩余1对孤电
子对,价层电子对数为4,属于sp3杂化,磷原子不可能处在一个平面上。白磷由白磷分
子构成,白磷晶体属于分子晶体;黑鳞具有与石墨类似的层状结构,层间是范德华力,
层内相邻原子是共价键,还具有类似金属晶体的导电性,黑鳞晶体是混合型晶体。白磷
的相对分子质量最小,分子间作用力最弱,在三种晶体中熔沸点最低。
(3)P的电负性小于N,形成配位键时更易给出电子,故[PtCl (PH )]更稳定。
2 3 2
(5)识别常见晶胞的结构,掌握晶胞结构的简单计算方法。如果把Al和P都看成碳原子,
则变成金刚石的晶胞结构,如果把P去掉,则变成干冰的晶胞结构。要分析P原子周围最
紧邻的P原子数,可以选择任意一个P原子来考察。譬如以右下后方的P和Al(都记为
1)做分析:
1
1
1号Al参与构成8个同样的晶胞,除了给出的这个晶胞,另外7个晶胞中,有3个晶胞与
这个晶胞共1个面(正下方、正右方、正后方),3个晶胞与这个晶胞共1条棱(右下方、
后下方、右后方),还有1个晶胞与这个晶胞共顶角(右下后方)。
这个晶胞内的3个P都与1号P最紧邻,与这个晶胞共面的3个晶胞中各有2个P与
1号P最紧邻,与这个晶胞共棱的3个晶胞中各有1个P与1号P最紧邻,与这个晶胞共
顶角的晶胞中没有与 1号P最紧邻的P,所以1号P原子周围最紧邻的 P原子数为:
3+3×2+3×1 =12个。
如果做换位思考,由于晶胞中Al和P的个数相等,位置等价(若将Al和P原子都看
作是碳原子,则该晶胞为金刚石晶胞),所以P原子周围最紧邻的P原子数,跟Al原子
周围最紧邻的Al原子数相等,而Al原子周围最紧邻的Al原子数(晶胞中Al的排布与干
冰中CO 分子的排布相同)容易得出是12个。
2
该晶胞中含有4个AlP,由立方晶胞密度计算公式:ρ=nM/N a3,得到晶胞的边长a =
A
(4M/N )-3,,两个最近P原子间的距离为面对角线长度的一半。
A
18:本题以“乙二酸(草酸)-乙二酸酐-草酸钙”的转化关系为主线,考查从“物质结
构-元素价态-物质类别”的视角认识物质的性质和用途,探究物质间转化关系的能力。重
点考查物质的结构、性质与转化关系。主要涉及物质的氧化性还原性,酸性碱性,溶解
性等中学化学的核心知识。试题融合了物质结构、有机化学、无机化学和化学实验等多
模块知识,综合性较强,陌生度较大。
(1)草酸是一种强还原剂,由于性质比较稳定,故在分析化学上可用作定量测定一些氧
5
学科网(北京)股份有限公司化性物质含量或浓度的试剂。该反应是氧化还原型离子反应,可考查离子方程式的书写
和氧化还原反应的配平能力。草酸是二元弱酸,碳元素为+3价,氧化生成二氧化碳。高
锰酸钾被草酸还原生成 Mn2+,若写成其他形式如 MnO 则不给分。(草酸写成
2
HC O·2H O也正确)
2 2 4 2
(2)①由题给信息可知,乙二酸加热脱水生成酸酐,该酸酐具有六元环状结构,应是 2
分子乙二酸发生脱水而成。
②根据题意,C O 与石灰水反应:C O+2Ca(OH) = 2CaC O↓+2H O,所以X是酸性氧化
4 6 4 6 2 2 4 2
物,A选项正确;由于乙二酸与氯化钙溶液反应:HC O+ CaCl ↓=CaC O+2HCl,可知草
2 2 4 2 2 4
酸钙不溶于稀盐酸,B选项正确;羧基是吸电子基,使另一个羧基的酸性增强(羟基极性
增强,羟基氢容易电离出来);甲基是推电子基,使羧基的酸性减弱;所以乙二酸的酸
性强于乙酸。C选项正确。乙二酸跟2分子乙醇反应生成乙二酸二乙酯,乙二酸跟乙二醇
反应生成乙二酸乙二酯。D选项不正确。
③根据“相似形溶”原理,乙二酸与乙醇都是极性分子,且都含有羟基,两者能形成氢
键,故易溶;苯和氯仿是非极性或弱极性分子,乙二酸与苯和氯仿的分子间作用力弱,
故难溶。
(3)类比于CO还原性的检验:将X气体通入灼热的氧化铜,固体颜色由黑变红,证明
X具有还原性;类比于CO 氧化性的检验:将点燃的镁条伸入X中,镁条继续燃烧,生
2
成黑色和白色固体,证明X具有氧化性。
19:本题以工业生产和科学研究中的“丙烷制备丙烯”的3个不断改进优化的反应原理为
线索,考查化学反应原理的主干知识和关键能力。
(1)由盖斯定律,可得ΔH = ΔH-ΔH/2 = +124kJ/mol。
1 2 3
(2)①在总压恒定的条件下,充入惰性气体,等同于扩体减压,气体浓度(或分压)减
小,使平衡向着气体分子数增大的方向移动(右移),提高了C H(g)的转化率 。
3 8
②根据图1,C H 的物质的量分数为0.4时,其平衡转化率为50%。假设混合气体为1
3 8
mol,则起始时C H 为0.4 mol,Ar为0.6 mol,。运用三段式法计算:
3 8
C H(g) H(g)+C H(g)
3 8 2 3 6
开始量/mol 0.4 0 0
变化量/mol 0.2 0.2 0.2
平衡量/mol 0.2 0.2 0.2
由于总压恒定为100 kPa,平衡时C H 为0.2 mol,C H 为0.2 mol,H 为0.2 mol,Ar为
3 8 3 6 2
0.2mol 50
0.6 mol,则C H(g)、C H(g)、H(g)的分压均为100 kPa× = kPa,故T 时反应
3 8 3 6 2 1.2mol 3 1
50 50
kPa× kPa
3 3 50
Ⅰ的平衡常数K = = kPa≈16.7 kPa。
p 50 3
kPa
3
要将C H 的平衡转化率提高到60%,假设起始时C H 为1mol,Ar为xmol,。运用三
3 8 3 8
段式法计算:
C H(g) H(g)+C H(g)
3 8 2 3 6
6
学科网(北京)股份有限公司开始量/mol 1 0 0
变化量/mol 0.6 0.6 0.6
平衡量/mol 0.4 0.6 0.6
由于总压恒定为100 kPa,平衡时C H 为0.4 mol,C H 为0.6 mol,H 为0.6 mol,Ar为x
3 8 3 6 2
mol , 则 C H(g) 分 压 为 100kPa×0.4/(1.6+x) , C H(g) 、 H(g) 的 分 压 均 为 100
3 8 3 6 2
kPa×0.6/(1.6+x) ,根据温度不变平衡常数相等:
x=3.8 (说明:本题用浓度平衡常数Kc同样可求得结果。)
(3)增大压强缩小体积,平衡时两种物质的浓度都随平衡总压(体积缩小)的增大而增
大。增大压强时,由于平衡向着气体分子数减少的逆反应方向移动,所以在两者浓度相
等之后,两者浓度增加的程度不同,丙烷的浓度增大得更多,故丙烷的浓度大于丙烯的
浓度。据此理可作图。
(4)反应Ⅱ的ΔH<0,ΔS>0,所以该反应在任何温度下都能自发进行。选项A正确。
2
升高温度,反应Ⅱ的平衡逆向移动,平衡常数减小。选项B不正确。
通入的氧气过多,将发生丙烷的深度氧化,可能生成CO或CO,使丙烯的产率降低
2
或得不到丙烯。选项C不正确。
将水液化分离出来,可提高C H 的转化率,但不能加快反应速率。选项D不正确。
3 8
与直接脱氢反应相比,氧化脱氢制备丙烯的优点是反应Ⅱ的温度较低(任何温度下
都自发)、反应Ⅰ必须在高温下才能自发,低温反应可以节约能源;产品主要是水和丙
烯,容易分离、副产物少。
(5)CO 催化氧化C H 脱氢制丙烯,在较高温度下,丙烯的产率远高于乙烯和CO,是
2 3 8
催化剂X选择性地提高产生丙烯反应速率的结果。选项A正确。
表格中的数据不一定是平衡状态的数据,不能得出该平衡体系,温度对平衡移动的
影响规律,选项B不正确。
催化剂能够改变反应速率,不同的催化剂对一定时间里没有达到平衡的转化率影响
不同,但不能改变平衡转化率和平衡常数。选项C正确。
催化剂的活性与温度有关,温度过低或过高都可能是催化剂失活。从表格中的数据
分析,温度升高,丙烯的选择性降低,但是丙烷的转化率在增大,丙烯的产率在增加。
选项D错误。
20. (1)实验室的研磨仪器为研钵
(2)A. Fe O 具有磁性,用磁力搅拌会加重团聚现象;B. Cl-干扰酸性KMnO 检验Fe2+;
3 4 4
C. 氧化石墨烯结构中有羧基、羟基和环氧基可知,NaNO 和KMnO 的作用是氧化单层石
3 4
墨烯;D. 将石墨研成细粉,可增大石墨粒子表面积,提高后续反应程度。
(3)Fe2++2Fe3++8OH-=Fe O+4H O
3 4 2
(4)防止温度过高发生石墨与浓硫酸之间的副反应;防止浓硫酸与硝酸钠反应产生的硝
酸挥发或分解。
(3)Cr
2
O
7
2- + H
2
O⇌2CrO
4
2- + 2H+,题中为酸性条件,存在形式为Cr
2
O
7
2- ;
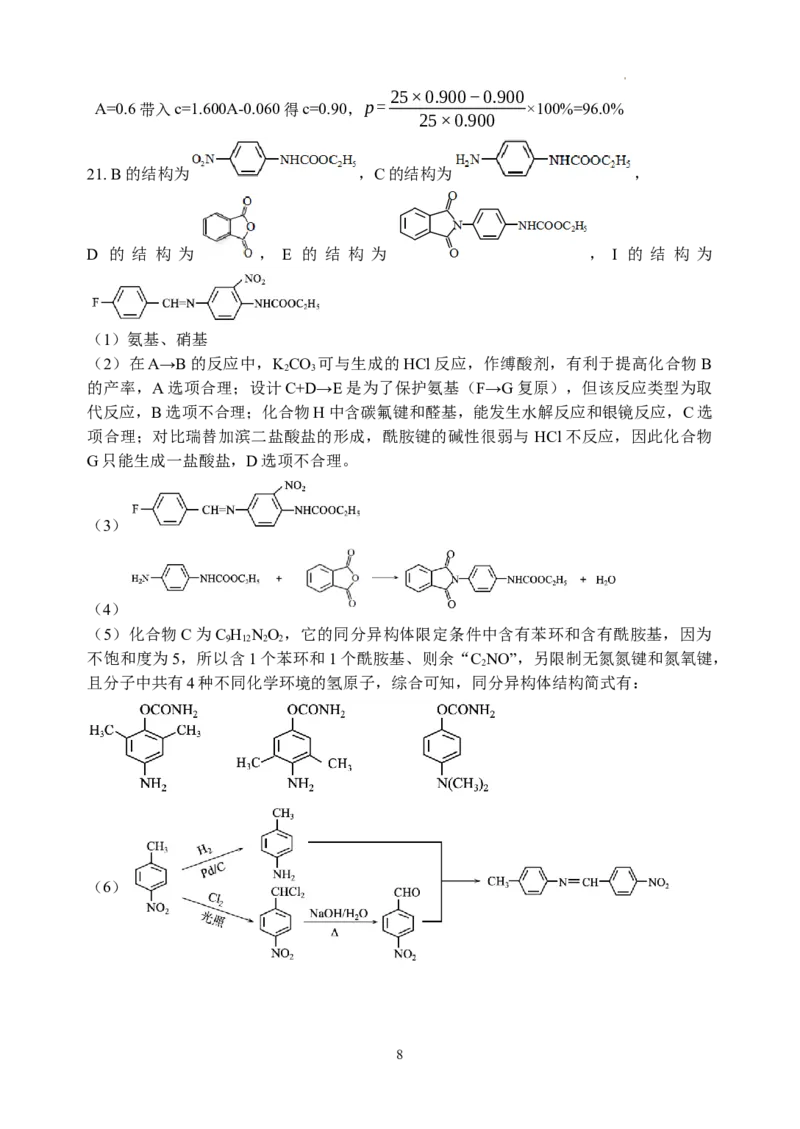
7
学科网(北京)股份有限公司25×0.900−0.900
A=0.6带入c=1.600A-0.060得c=0.90,p= ×100%=96.0%
25×0.900
21. B的结构为 ,C的结构为 ,
D 的 结 构 为 , E 的 结 构 为 , I 的 结 构 为
(1)氨基、硝基
(2)在A→B的反应中,KCO 可与生成的HCl反应,作缚酸剂,有利于提高化合物 B
2 3
的产率,A选项合理;设计C+D→E是为了保护氨基(F→G复原),但该反应类型为取
代反应,B选项不合理;化合物H中含碳氟键和醛基,能发生水解反应和银镜反应,C选
项合理;对比瑞替加滨二盐酸盐的形成,酰胺键的碱性很弱与 HCl不反应,因此化合物
G只能生成一盐酸盐,D选项不合理。
(3)
(4)
(5)化合物C为C H NO ,它的同分异构体限定条件中含有苯环和含有酰胺基,因为
9 12 2 2
不饱和度为5,所以含1个苯环和1个酰胺基、则余“C NO”,另限制无氮氮键和氮氧键,
2
且分子中共有4种不同化学环境的氢原子,综合可知,同分异构体结构简式有:
(6)
8
学科网(北京)股份有限公司