文档内容
★ 保密·启用前
★
吉林地区普通高中2023-2024学年度高三年级第一次模拟考试
化 学 试 题
说明:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。答非选择题时,将答案写
在答题卡上。写在试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 O 16 Na 23 S 32 Fe 56 Ni 59
一、选择题(每小题只有一个正确答案,每题3分,共45分)
1.化学与日常生活息息相关。下列说法错误的是
A. 使用含磷洗涤剂会造成水体污染
B. 小苏打的主要成分是Na CO
2 3
C. 干冰可用在舞台上制造“云雾”
D. 使用食品添加剂不应降低食品本身营养价值
2.碳是构成地球生命的重要元素。下列说法正确的是
A.自然界中不存在游离态的碳
B.碳的化合物数量众多分布极广
C.向空气中排放二氧化碳会形成酸雨
D.碳酸盐的沉积会增加自然界中CO 含量
2
3.自然界中硅元素主要以硅酸盐和二氧化硅的形式存在于地壳中。下列有关硅元素的说
法正确的是
A.水泥、水晶、玛瑙都属于硅酸盐工业产品
B.制造太阳能电池板的主要材料是二氧化硅
C.华为“麒麟”芯片的主要材料是单晶硅
D. 陶瓷和玻璃都使用共同的原料石灰石
4.下列颜色变化与氧化还原反应无关的是
A.将乙醇滴入酸性KCrO 溶液中,溶液由橙色变为绿色
2 2 7
B.将SO 通入滴有酚酞的NaOH溶液中,溶液红色褪去
2
C.将SO 通入氯水中,溶液浅黄绿色褪去
2
D.将新制氯水滴入紫色石蕊溶液中,溶液先变红后褪色
5. 下列有关离子检验涉及的反应表达错误的是
高三化学试题 第1页 (共8页)A. Fe2+:K+ + Fe2+ + [Fe(CN) ]3- = KFe[Fe(CN) ]↓
6 6
B. Fe3+:Fe3+ + 3SCN- Fe(SCN)
3
C. NH + :NH + + OH- = NH ·HO
4 4 3 2
D. SO:Ba2++SO = BaSO ↓
4
6.设N 为阿伏加德罗常数的值,下列有关说法正确的是
A
A.56g铁粉与1molCl 充分反应,转移的电子数为3N
2 A
B.1mol·L−1的Na SO 溶液中含有的Na+ 数目为2N
2 4 A
C.1mol Na O 与足量CO 反应时,转移电子数为2N
2 2 2 A
D.标准状况下,22.4L由CH 和CH 组成的混合气体中含有H原子的数目为4N
4 2 4 A
7.实验室中下列有关试剂的保存方法错误的是
A.浓硝酸应密封保存在铁制容器中
B.少量的钠保存在煤油中
C.NaOH溶液保存在具有橡胶塞的玻璃试剂瓶中
D.液溴存放在棕色试剂瓶中并加水封
8.已知断裂下列化学键需要吸收的能量:H−H为436 kJ·mol−1,F−F为153 kJ·mol−1,H−F
为565 kJ·mol−1。下列说法中正确的是
A.H 与F 反应的热化学方程式为H(g) + F (g) = 2HF(g) ΔH=-541kJ
2 2 2 2
B.44.8 L HF(g)分解成22.4 L H (g)和22.4 L F (g)吸收541 kJ的热量
2 2
C.1 mol H (g)与1 mol F (g)反应生成2 molHF(l)放出的热量小于541 kJ
2 2
D.在相同条件下,2 mol HF(g)的能量小于1 mol H (g)与1 mol F (g)的能量总和
2 2
9.类推的思维方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经
过实验的验证。以下类推的结论中正确的是
A.Na SO 能使酸性KMnO 溶液褪色,故Na CO 也能使酸性KMnO 溶液褪色
2 3 4 2 3 4
B.稀盐酸与镁反应生成H,故稀硝酸与镁反应也生成H
2 2
C.氯单质与水反应生成次氯酸,故溴单质与水反应生成次溴酸
D.SO 是酸性氧化物,故NO 也是酸性氧化物
2 2
10.下列反应的离子方程式正确的是
A.碘化亚铁溶液与等物质的量的氯气:2Fe2+ + 2I-+ 2Cl = 2Fe3+ + I + 4Cl-
2 2
B.用稀硝酸除去试管内壁银镜:3Ag + 4H+ + NO - = 3Ag+ + NO↑ + 2H O
3 2
高三化学试题 第2页 (共8页)C.用醋酸和淀粉-KI溶液检验加碘盐中的IO -:IO - + 5I- + 6H+ = 3I + 3H O
3 3 2 2
D.向硫化钠溶液通入足量二氧化硫:S2- + 2SO + 2H O = H S + 2HSO -
2 2 2 3
11.下列有关说法错误的是
A.Na与HO的反应是熵增的放热反应,该反应能自发进行
2
B.某吸热反应能自发进行,因此该反应是熵增反应
C.2NO(g) + 2CO(g) = N (g) + 2CO (g)在常温下能自发进行,则该反应ΔH>0
2 2
D.反应NH (g) + HCl(g) = NH Cl(s)在室温下可自发进行,则该反应ΔH<0
3 4
12.根据下列实验操作和现象,得出的结论合理且正确的是
选项 实验操作 现象 结论
A 用洁净铂丝蘸取溶液进行焰色试验 火焰呈黄色 原溶液中有Na+,无K+
将碳酸钠与盐酸反应产生的气体通
B 烧杯中液体变浑浊 非金属性:Cl>C>Si
入盛有硅酸钠溶液的烧杯中
先生成白色沉淀,
某溶液中加入Ba(NO ) 溶液,再加
C 3 2 加盐酸后白色沉淀 原溶液中有SO
足量盐酸
不消失
D 将Fe(NO 3 ) 2 样品溶于稀硫酸后滴加 溶液变红 不能确定 Fe(NO 3 ) 2 原样
KSCN溶液 品是否变质
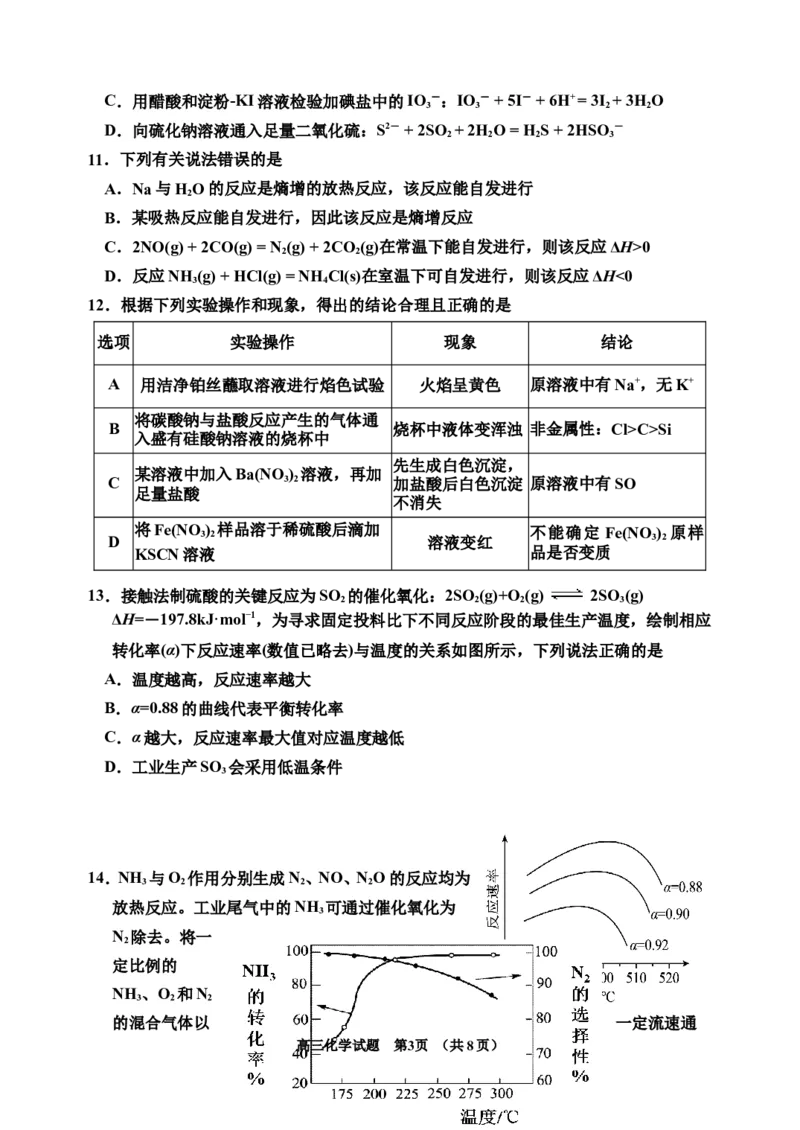
13.接触法制硫酸的关键反应为SO 的催化氧化:2SO (g)+O (g) 2SO(g)
2 2 2 3
ΔH=-197.8kJ·mol−1,为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应
转化率(α)下反应速率(数值已略去)与温度的关系如图所示,下列说法正确的是
A.温度越高,反应速率越大
B.α=0.88的曲线代表平衡转化率
C.α越大,反应速率最大值对应温度越低
D.工业生产SO 会采用低温条件
3
14.NH 与O 作用分别生成N、NO、NO的反应均为
3 2 2 2
放热反应。工业尾气中的NH 可通过催化氧化为
3
N 除去。将一
2
定比例的
NH 、O 和N
3 2 2
的混合气体以 一定流速通
高三化学试题 第3页 (共8页)过装有催化剂的反应管,NH 的转化率、生成N 的选择性[ 100%]与温度
3 2
的关系如图所示。下列说法错误的是
A.其他条件不变,升高温度,NH 的平衡转化率降低
3
B.其他条件不变,在175~300 ℃范围,随温度的升高,出口处N 和氮氧化物的量
2
均不断增大
C.催化氧化除去尾气中的NH 选择反应温度应略小于225℃
3
D.高效除去尾气中的NH ,需研发低温下NH 转化率高和N 选择性高的催化剂
3 3 2
15.Ce(CO) 可用于催化剂载体及功能材料的制备。天然独居石中铈(Ce)主要以CePO
2 3 3 4
形式存在,还含有SiO 、Al O、FeO、CaF 等物质。以独居石为原料制备
2 2 3 2 3 2
Ce(CO)· 8HO的工艺流程如图所示:
2 3 3 2
下列说法正确的是
A.“焙烧”时,酸性废气含HF,SO
2
B.“水浸”后,滤渣Ⅰ的成分是SiO
2
C.“除磷”时,离子反应为Fe3+ + H PO = FePO ↓+ 3H+
3 4 4
D.“沉铈”后,滤液中大量存在的阴离子只有Cl-
二、非选择题(本大题共4个小题,共55分)
16.(13分)氮、磷元素的单质和它们的化合物用途广泛,与生产、生活有密切关系。
请回答下列问题。
高三化学试题 第4页 (共8页)(1)下列属于氮的固定的是 。
a. 工业上N 和H 合成NH b. NH 催化氧化生成NO
2 2 3 3
c. N 和O 放电条件下生成NO d. NH 与灼热的氧化铜反应生成N
2 2 3 2
(2)NH(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,
2 4
其化学反应方程式为 。
(3)实验室中向浓氨水中加CaO固体可以快速制备氨气,请解释其反应原理
。
(4)Si N 是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性
3 4
质稳定,但生产成本较高。根据以上描述推测Si N 可能有哪些用途 。
3 4
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 HPO 溶液,则NaHPO
3 2 2 2
是 (填“正盐”或“酸式盐”)。
②已知常温下酸性:HPO > CH COOH > H PO-,则HPO 与足量CH COONa
3 3 3 2 3 3 3 3
溶液混合的离子反应方程式为 。
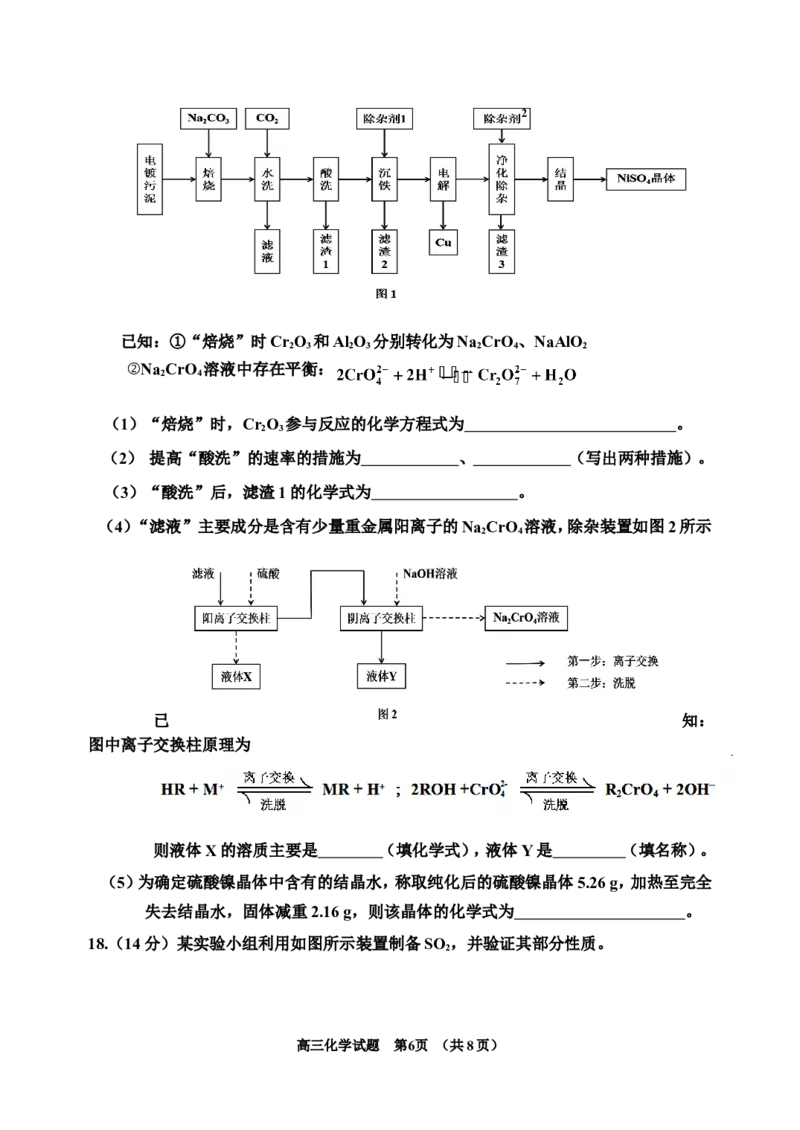
17.(14分)硫酸镍一般用于电镀、催化剂制备和医药制造等领域。电镀污泥中主要含有
CrO、CuO、NiO、Al O、FeO 和SiO 等物质。一种从电镀污泥制备回收金属铜和制
2 3 2 3 2 3 2
备硫酸镍晶体的工艺流程如图1,回答下列问题:
高三化学试题 第5页 (共8页)2
已知:①“焙烧”时CrO 和Al O 分别转化为Na CrO 、NaAlO
2 3 2 3 2 4 2
②Na CrO 溶液中存在平衡:
2 4
(1)“焙烧”时,CrO 参与反应的化学方程式为 。
2 3
(2) 提高“酸洗”的速率的措施为 、 (写出两种措施)。
(3)“酸洗”后,滤渣1的化学式为 。
(4)“滤液”主要成分是含有少量重金属阳离子的Na CrO 溶液,除杂装置如图2所示
2 4
已 知:
图中离子交换柱原理为
则液体X的溶质主要是 (填化学式),液体Y是 (填名称)。
(5)为确定硫酸镍晶体中含有的结晶水,称取纯化后的硫酸镍晶体5.26 g,加热至完全
失去结晶水,固体减重2.16 g,则该晶体的化学式为 。
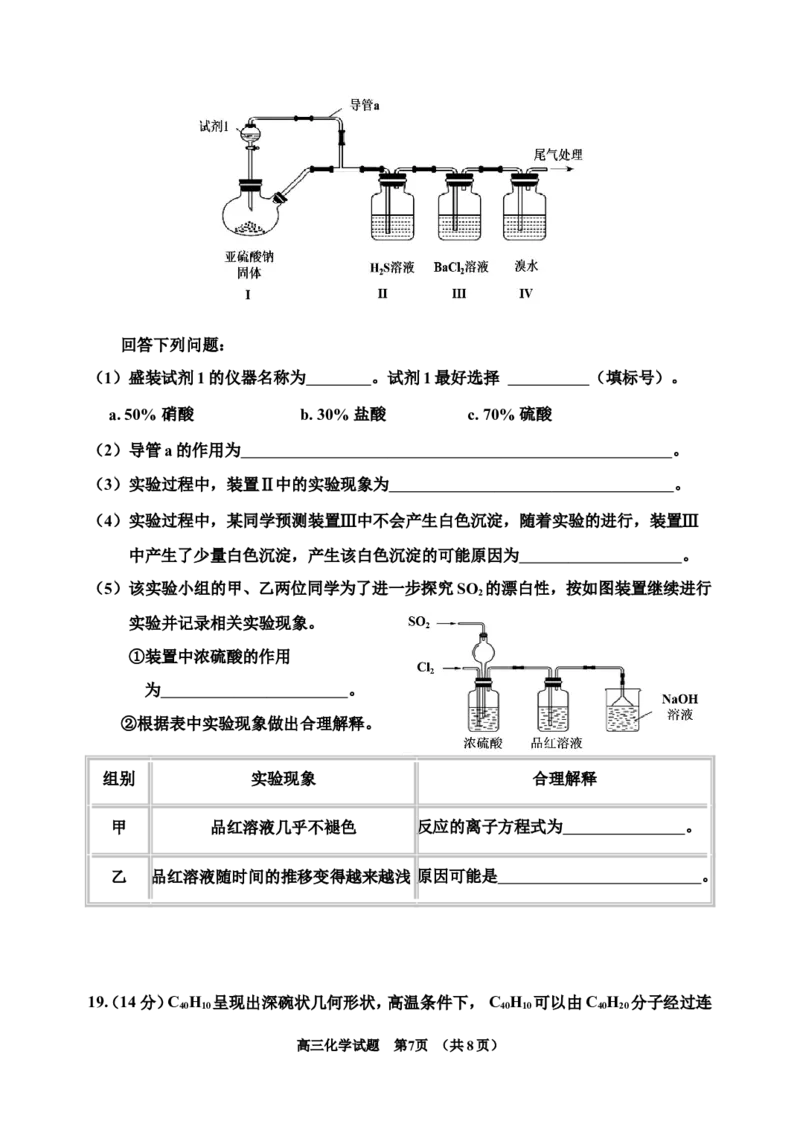
18.(14分)某实验小组利用如图所示装置制备SO ,并验证其部分性质。
2
高三化学试题 第6页 (共8页)回答下列问题:
(1)盛装试剂1的仪器名称为 。试剂1最好选择 (填标号) 。
a. 50% 硝酸 b. 30% 盐酸 c. 70% 硫酸
(2)导管a的作用为 。
(3)实验过程中,装置Ⅱ中的实验现象为 。
(4)实验过程中,某同学预测装置Ⅲ中不会产生白色沉淀,随着实验的进行,装置Ⅲ
中产生了少量白色沉淀,产生该白色沉淀的可能原因为 。
(5)该实验小组的甲、乙两位同学为了进一步探究SO 的漂白性,按如图装置继续进行
2
实验并记录相关实验现象。
①装置中浓硫酸的作用
为 。
②根据表中实验现象做出合理解释。
组别 实验现象 合理解释
甲 品红溶液几乎不褪色 反应的离子方程式为 。
乙 品红溶液随时间的推移变得越来越浅 原因可能是 。
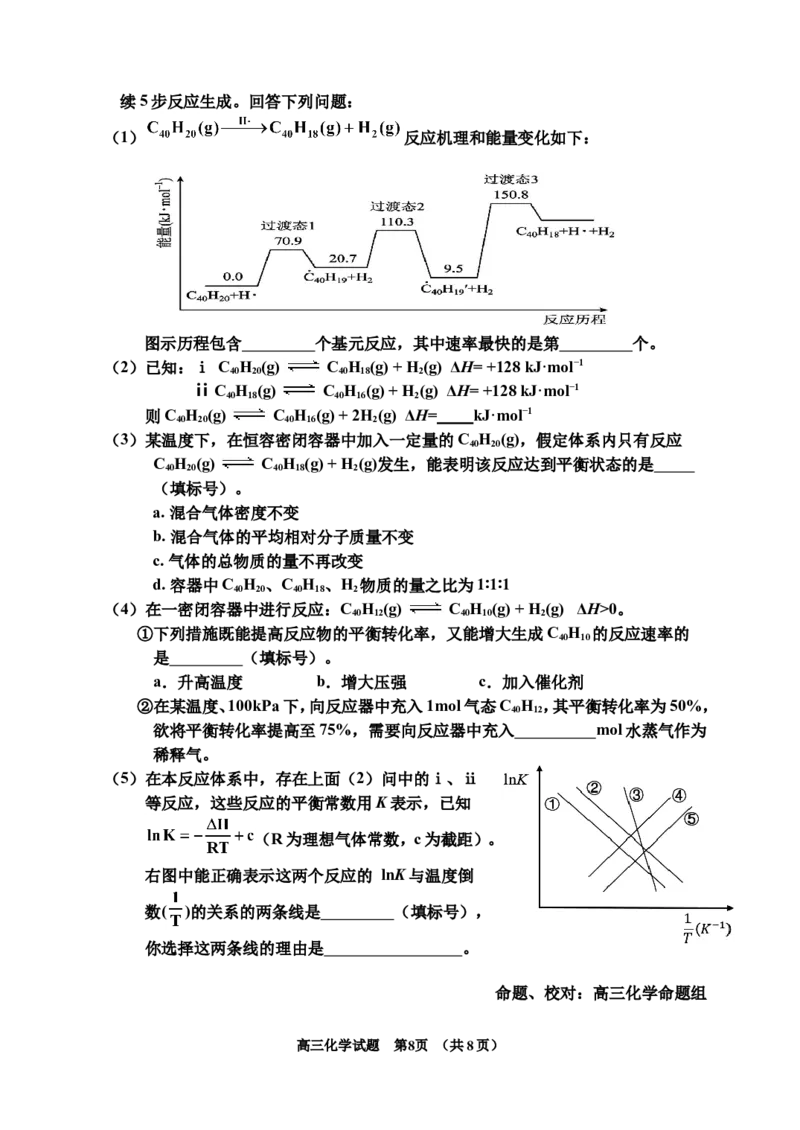
19(. 14分)C H 呈现出深碗状几何形状,高温条件下, C H 可以由C H 分子经过连
40 10 40 10 40 20
高三化学试题 第7页 (共8页)续5步反应生成。回答下列问题:
(1) 反应机理和能量变化如下:
图示历程包含 个基元反应,其中速率最快的是第 个。
(2)已知:ⅰ C H (g) C H (g) + H (g) ΔH= +128 kJ·mol−1
40 20 40 18 2
ⅱ C H (g) C H (g) + H (g) ΔH= +128 kJ·mol−1
40 18 40 16 2
则C H (g) C H (g) + 2H (g) ΔH= kJ·mol−1
40 20 40 16 2
(3)某温度下,在恒容密闭容器中加入一定量的C H (g),假定体系内只有反应
40 20
C H (g) C H (g) + H (g)发生,能表明该反应达到平衡状态的是
40 20 40 18 2
(填标号)。
a. 混合气体密度不变
b. 混合气体的平均相对分子质量不变
c. 气体的总物质的量不再改变
d. 容器中C H 、C H 、H 物质的量之比为1∶1∶1
40 20 40 18 2
(4)在一密闭容器中进行反应:C H (g) C H (g) + H (g) ΔH>0。
40 12 40 10 2
①下列措施既能提高反应物的平衡转化率,又能增大生成C H 的反应速率的
40 10
是 (填标号)。
a.升高温度 b.增大压强 c.加入催化剂
②在某温度、100kPa下,向反应器中充入1mol气态C H ,其平衡转化率为50%,
40 12
欲将平衡转化率提高至75%,需要向反应器中充入 mol水蒸气作为
稀释气。
(5)在本反应体系中,存在上面(2)问中的ⅰ、ⅱ
等反应,这些反应的平衡常数用K表示,已知
(R为理想气体常数,c为截距)。
右图中能正确表示这两个反应的 lnK与温度倒
数( )的关系的两条线是 (填标号),
你选择这两条线的理由是 。
命题、校对:高三化学命题组
高三化学试题 第8页 (共8页)