文档内容
江苏省如皋中学2024—2025学年度高三年级测试
化 学 试 题
命题人: 审核人:
试卷总分100分,考试时间75分钟
本卷可能用到的相对原子质量:H1 C12 N14 O16
单项选择题:本题包括8小题,每小题2分,共计16分。每小题只有一个选项符合题意。
1.实现物质转化是化学反应的应用之一。下列有关物质的转化说法正确的是
A.工业上用CO还原MgO的方法制取金属镁
B.用氨气制取铵态化肥属于氮的固定中的一种
C.工业上用焦炭和二氧化硅反应可以制取高纯度的单质硅
D.石油的裂化或裂解可以制取小分子的烷烃和烯烃
Δ
2.反应NH Cl+NaNO = = = =NaCl+N ↑+2H O可用于实验室制取N₂。下列说法正确的是
4 2 2 2
A.NO -的N原子的轨道杂化方式为sp2 B.NH Cl是共价化合物
2 4
C.H O的VSEPR模型为V形 D.N 是电解质
2 2
3.下列物质结构与性质或物质性质与用途具有对应关系的是
A.Cl 易溶于水,可用于消毒杀菌
2
B.Na SiO 溶液呈碱性,可用作木材防火剂
2 3
C.CO具有还原性,可用于脱除汽车尾气中的NO
D.氨基(-NH ) 中氮原子含有孤电子对,可与羧基反应生成酰胺基
2
4.M、R、T、X、Y为短周期主族元素,且原子序数依次增大。M的基态原子所含3个能级
中电子数均相等;T的基态原子2p能级上的未成对电子数与M原子的相同;X与T位于同一
周期;Y和T位于同一主族。下列说法正确的是
A.原子半径:r(Y)>r(X)>r(T) B.第一电离能:I (R)>I (T)>I (M)
1 1 1
C.电负性:χ(R)>χ(T)>χ(M) D.Y的氧化物对应水化物一定为强酸
5.下列选项中所示的物质间转化均能在指定条件下实现的是
H2O 氨水 C O2 浓硫 酸
A.Al O ――→Al(OH) ―――→NH AlO B.Mg――→C ――→ SO C.S
2 3 3 4 2 点 燃 △ 2
足量 O2 H2O 稀硝酸 H2O
――→SO ――→H SO D.Cu―――→NO――→HNO
点 燃 3 2 4 3
6.下实验室制取NH 并探究其还原性,下列实验装置能达到实验目的的是
3
NaOH溶液
CuO
NH NH NH
3 3 3
NH Cl溶液
4 浓硫酸
水
A.制取NH B.干燥NH C.验证氨气的还原性 D.吸收尾气
3 37.下列有关物质结构的说法正确的是
A.氯化亚砜(SOCl )属于非极性分子 B.S 的结构为 ,是共价晶体
2 8
C.CH 的熔沸点高于SiH D.1mol尿素[CO(NH ) ]中含有7 molσ键
4 4 2 2
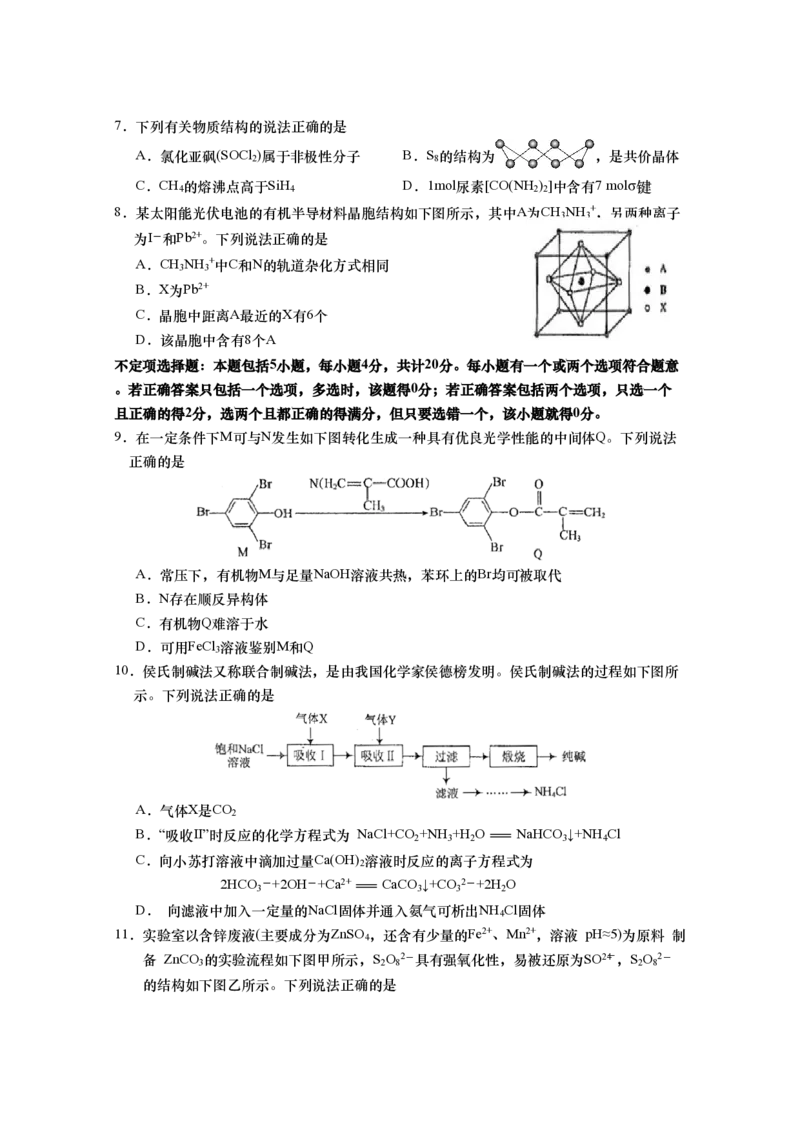
8.某太阳能光伏电池的有机半导材料晶胞结构如下图所示,其中A为CH NH +,另两种离子
3 3
为I-和Pb2+。下列说法正确的是
A.CH NH +中C和N的轨道杂化方式相同
3 3
B.X为Pb2+
C.晶胞中距离A最近的X有6个
D.该晶胞中含有8个A
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意
。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个
且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
9.在一定条件下M可与N发生如下图转化生成一种具有优良光学性能的中间体Q。下列说法
正确的是
A.常压下,有机物M与足量NaOH溶液共热,苯环上的Br均可被取代
B.N存在顺反异构体
C.有机物Q难溶于水
D.可用FeCl 溶液鉴别M和Q
3
10.侯氏制碱法又称联合制碱法,是由我国化学家侯德榜发明。侯氏制碱法的过程如下图所
示。下列说法正确的是
A.气体X是CO
2
B.“吸收Ⅱ”时反应的化学方程式为 NaCl+CO +NH +H O=NaHCO ↓+NH Cl
2 3 2 3 4
C.向小苏打溶液中滴加过量Ca(OH) 溶液时反应的离子方程式为
2
2HCO -+2OH-+Ca2+=CaCO ↓+CO 2-+2H O
3 3 3 2
D. 向滤液中加入一定量的NaCl固体并通入氨气可析出NH Cl固体
4
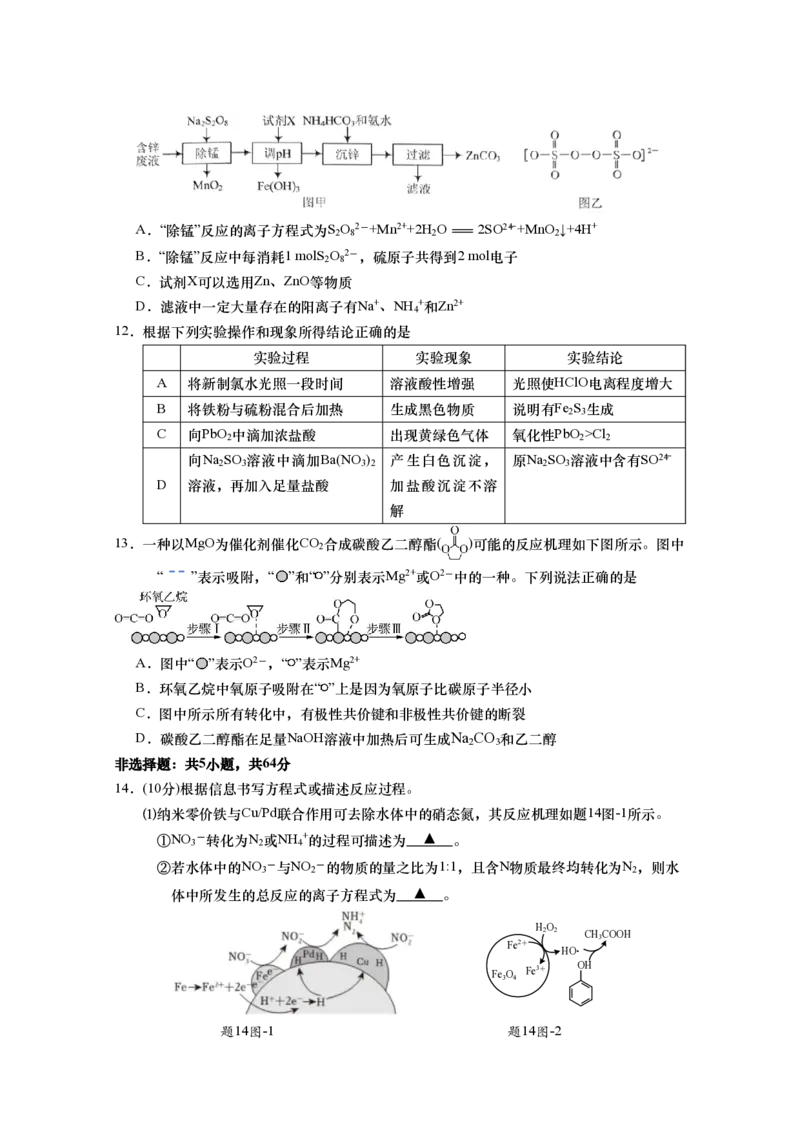
11.实验室以含锌废液(主要成分为ZnSO ,还含有少量的Fe2+、Mn2+,溶液 pH≈5)为原料 制
4
备 ZnCO 的实验流程如下图甲所示,S O 2-具有强氧化性,易被还原为SO2-4 ,S O 2-
3 2 8 2 8
的结构如下图乙所示。下列说法正确的是A.“除锰”反应的离子方程式为S O 2-+Mn2++2H O=2SO2-4 +MnO ↓+4H+
2 8 2 2
B.“除锰”反应中每消耗1 molS O 2-,硫原子共得到2 mol电子
2 8
C.试剂X可以选用Zn、ZnO等物质
D.滤液中一定大量存在的阳离子有Na+、NH +和Zn2+
4
12.根据下列实验操作和现象所得结论正确的是
实验过程 实验现象 实验结论
A 将新制氯水光照一段时间 溶液酸性增强 光照使HClO电离程度增大
B 将铁粉与硫粉混合后加热 生成黑色物质 说明有Fe S 生成
2 3
C 向PbO 中滴加浓盐酸 出现黄绿色气体 氧化性PbO >Cl
2 2 2
向Na SO 溶液中滴加Ba(NO ) 产生白色沉淀, 原Na SO 溶液中含有SO2-4
2 3 3 2 2 3
D 溶液,再加入足量盐酸 加盐酸沉淀不溶
解
13.一种以MgO为催化剂催化CO 合成碳酸乙二醇酯( )可能的反应机理如下图所示。图中
2
“ ”表示吸附,“ ”和“ ”分别表示Mg2+或O2-中的一种。下列说法正确的是
A.图中“ ”表示O2-,“ ”表示Mg2+
B.环氧乙烷中氧原子吸附在“ ”上是因为氧原子比碳原子半径小
C.图中所示所有转化中,有极性共价键和非极性共价键的断裂
D.碳酸乙二醇酯在足量NaOH溶液中加热后可生成Na CO 和乙二醇
2 3
非选择题:共5小题,共64分
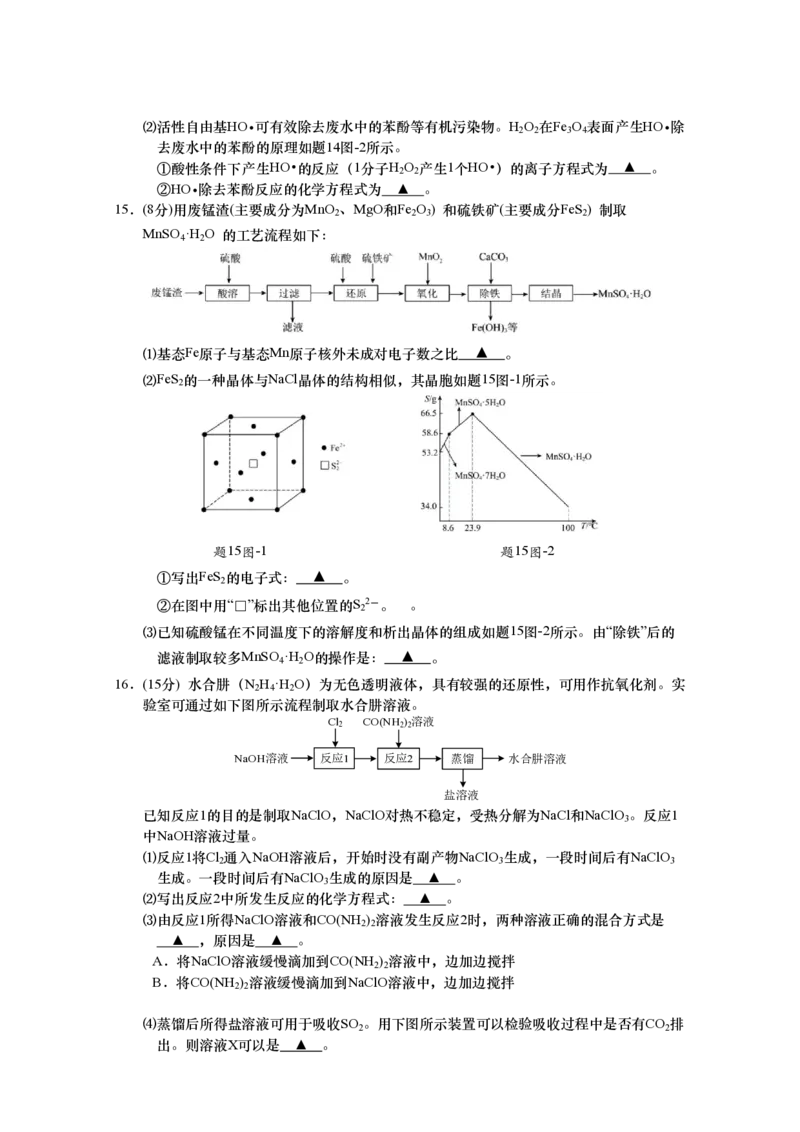
14.(10分)根据信息书写方程式或描述反应过程。
⑴纳米零价铁与Cu/Pd联合作用可去除水体中的硝态氮,其反应机理如题14图-1所示。
①NO -转化为N 或NH +的过程可描述为 ▲ 。
3 2 4
②若水体中的NO -与NO -的物质的量之比为1:1,且含N物质最终均转化为N ,则水
3 2 2
体中所发生的总反应的离子方程式为 ▲ 。
HO
2 2 CHCOOH
3
Fe2+
HO
FeO
Fe3+ OH
3 4
题14图-1 题14图-2⑵活性自由基HO 可有效除去废水中的苯酚等有机污染物。H O 在Fe O 表面产生HO 除
2 2 3 4
去废水中的苯酚的原理如题14图-2所示。
①酸性条件下产生HO 的反应(1分子H O 产生1个HO )的离子方程式为 ▲ 。
2 2
②HO 除去苯酚反应的化学方程式为 ▲ 。
15.(8分)用废锰渣(主要成分为MnO 、MgO和Fe O ) 和硫铁矿(主要成分FeS ) 制取
2 2 3 2
MnSO ·H O 的工艺流程如下:
4 2
⑴基态Fe原子与基态Mn原子核外未成对电子数之比 ▲ 。
⑵FeS 的一种晶体与NaCl晶体的结构相似,其晶胞如题15图-1所示。
2
题15图-1 题15图-2
①写出FeS 的电子式: ▲ 。
2
②在图中用“□”标出其他位置的S 2-。 。
2
⑶已知硫酸锰在不同温度下的溶解度和析出晶体的组成如题15图-2所示。由“除铁”后的
滤液制取较多MnSO ·H O的操作是: ▲ 。
4 2
16.(15分) 水合肼(N H ·H O)为无色透明液体,具有较强的还原性,可用作抗氧化剂。实
2 4 2
验室可通过如下图所示流程制取水合肼溶液。
Cl CO(NH)溶液
2 22
NaOH溶液 反应1 反应2 蒸馏 水合肼溶液
盐溶液
已知反应1的目的是制取NaClO,NaClO对热不稳定,受热分解为NaCl和NaClO 。反应1
3
中NaOH溶液过量。
⑴反应1将Cl 通入NaOH溶液后,开始时没有副产物NaClO 生成,一段时间后有NaClO
2 3 3
生成。一段时间后有NaClO 生成的原因是 ▲ 。
3
⑵写出反应2中所发生反应的化学方程式: ▲ 。
⑶由反应1所得NaClO溶液和CO(NH ) 溶液发生反应2时,两种溶液正确的混合方式是
2 2
▲ ,原因是 ▲ 。
A.将NaClO溶液缓慢滴加到CO(NH ) 溶液中,边加边搅拌
2 2
B.将CO(NH ) 溶液缓慢滴加到NaClO溶液中,边加边搅拌
2 2
⑷蒸馏后所得盐溶液可用于吸收SO 。用下图所示装置可以检验吸收过程中是否有CO 排
2 2
出。则溶液X可以是 ▲ 。SO
2
溶液X 溶液Y
盐溶液
⑸为测定所得水合肼溶液(溶质为N H ·H O)的质量分数,现进行如下实验:取1.000 g
2 4 2
溶液于250 mL容量瓶中,加水定容至250 mL,准确量取25.00 mL其中溶液于锥形瓶中
,加入硫酸酸化后,加入约1 g NaHCO ,用0.1000 mol·L-1 碘(I )标准溶液滴定至
3 2
终点。滴定终点时消耗碘标准溶液的体积为24 mL。计算水合肼溶液的质量分数,并
写出计算过程。滴定过程中的反应如下:
N H ·H O+H SO +NaHCO +I -N +CO ↑+Na SO +NaI+H O(未配平)
2 4 2 2 4 3 2 2 2 2 4 2
17.(15分)有机化合物F是一种药物中间体,可通过如下图所示的转化合成得到:
NO NH
2 2
①Ag(NH 3 ) 2 OH,△ B CH 3 I C Fe
②H+ KCO NHCl
2 3 4
CHO O O
A D
H
N
N
O O
NaBH
O 4 O
H+
O O O O
E F
⑴化合物E中,含氧官能团的名称为 ▲ 。
⑵有机物C的分子式为C H NO ,其结构简式为 ▲ 。
9 9 4
⑶D→E的反应分为两步,第一步会生成一个分子式为C H NO 的中间产物。则该中间
14 19 4
产物的结构简式为 ▲ 。
⑷D的一种同分异构体符合下列条件,写出该同分异构体的结构简式: ▲ 。
Ⅰ.是一种α-氨基酸
Ⅱ.含有苯环,分子中有7种化学环境不同的氢
CH 酸性KMnO4溶液 COOH 浓H NO3
⑸已知:① 3 - - - - - - - - - - - - - - -→ - - - - - - - - - - - -→
浓H2S O4,△
COOH
NO
2
H
② N R(R表示H或烃基)易被酸性KMnO
4
氧化
COOH
O H
N
写出以甲苯、 为原料制备 的合成路线流程图
CHCCH
3 3
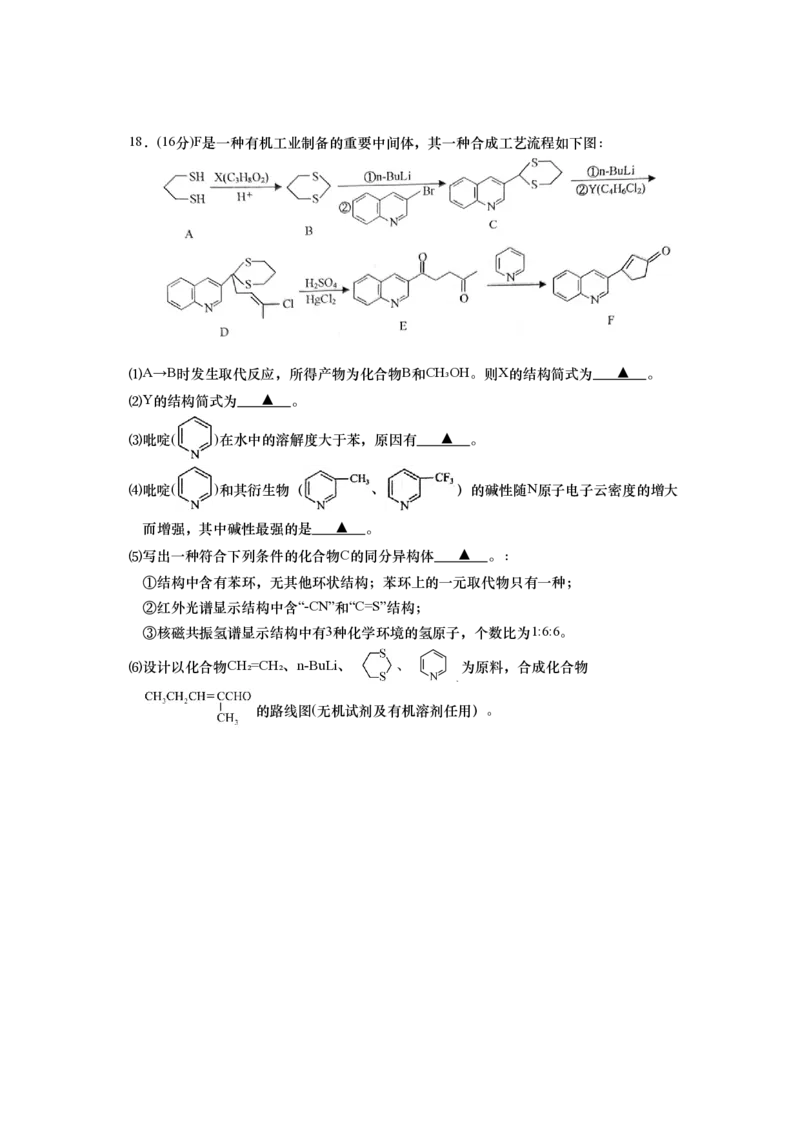
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)18.(16分)F是一种有机工业制备的重要中间体,其一种合成工艺流程如下图:
⑴A→B时发生取代反应,所得产物为化合物B和CH₃OH。则X的结构简式为 ▲ 。
⑵Y的结构简式为 ▲ 。
⑶吡啶( )在水中的溶解度大于苯,原因有 ▲ 。
⑷吡啶( )和其衍生物( 、 )的碱性随N原子电子云密度的增大
而增强,其中碱性最强的是 ▲ 。
⑸写出一种符合下列条件的化合物C的同分异构体 ▲ 。:
①结构中含有苯环,无其他环状结构;苯环上的一元取代物只有一种;
②红外光谱显示结构中含“-CN”和“C=S”结构;
③核磁共振氢谱显示结构中有3种化学环境的氢原子,个数比为1:6:6。
⑹设计以化合物CH₂=CH₂、n-BuLi、 、 为原料,合成化合物
HgCl 2 CHCHCHO N
HSO 3 2
2 4
的路线图(无机试剂及有机溶剂任用)。江苏省如皋中学2024—2025学年度高三年级测试
化学试题参考答案与评分标准
选择题(共36分)
单项选择题:本题包括8小题,每小题2分,共计16分。每小题只有一个选项符合题意。
1.D 2.A 3.C 4.B 5.B 6.C 7.D 8.A
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意
。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个
且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
9.CD 10.BD 11.A 12.C 13.AD
非选择题(共64分)
14.(1)①NO -在铁表面得到电子被还原为NO -,NO -被吸附在Cu和Pd表面的活性H继续还原
3 2 2
为N 或NH + (3分)
2 4
②4Fe+NO -+NO -+10H+=4Fe2++N ↑+5 H O (3分)(气体和沉淀符号暂不扣分,条
3 2 2 2
件1分,物质全对配平错误只得1分)
(2)①H+ +H O +Fe2+ = H O+Fe3+ + HO• (2分)
2 2 2
②4HO•+C H OH+H O→3CH COOH (2分)
6 5 2 3
(共10分)
15.(1)4:5 (2分)
· ·· ·
(2) ①Fe2+[:S:S:]2-(2分)
· ·· ·
② (2分)
(3)在100℃左右蒸发溶液至有大量固体析出,控制温度不低于90℃下趁热过滤(2分)
(共8分)
16.⑴Cl 与NaOH溶液的反应为放热反应,反应一段时间溶液温度升高,NaClO分解产生
2
NaClO (2分)
3
⑵CO(NH ) +NaClO+2NaOH=N H ·H O+NaCl+Na CO (3分)
2 2 2 4 2 2 3
⑶A (2分) N H ·H O有强还原性,NaClO过量时N H ·H O会被氧化 (2分)
2 4 2 2 4 2
⑷KMnO 溶液 (2分)
4
⑸n(I )=0.10 mol·L-1×0.024 L=2.4×10-3 mol
2
由电子得失守恒n(I ) ×2=n(N H ·H O) ×4可得
2 2 4 2
锥形瓶中n(N H ·H O)=1.2×10-3 mol
2 4 2
原1.000 g溶液中含N H ·H O的物质的量n(N H ·H O)=1.2×10-2 mol
2 4 2 2 4 2
m(N H ·H O)=1.2×10-2 mol×50 g·mol-1=0.6 g
2 4 2
0.6 g
水合肼溶液的质量分数w(N H ·H O)= ×100%=60% (4分)
2 4 2
1.000 g
(共15分)
17.⑴ 酯基、醚键(2分)NO
2
⑵ (2分)
O O
H
N
⑶ HO O (3分)
O O
CHCHCOOH
⑷ 2 (3分)
NH
2
⑸
CH CH COOH COOH
3 3
浓HNO 3 NO 2 酸性KMnO 4 NO 2 Fe NH 2
浓H 2 SO 4 ,△ NH 4 Cl
O COOH COOH
H
CHCCH N NaBH N
3 3 4
H+
(5分)
(共15分)
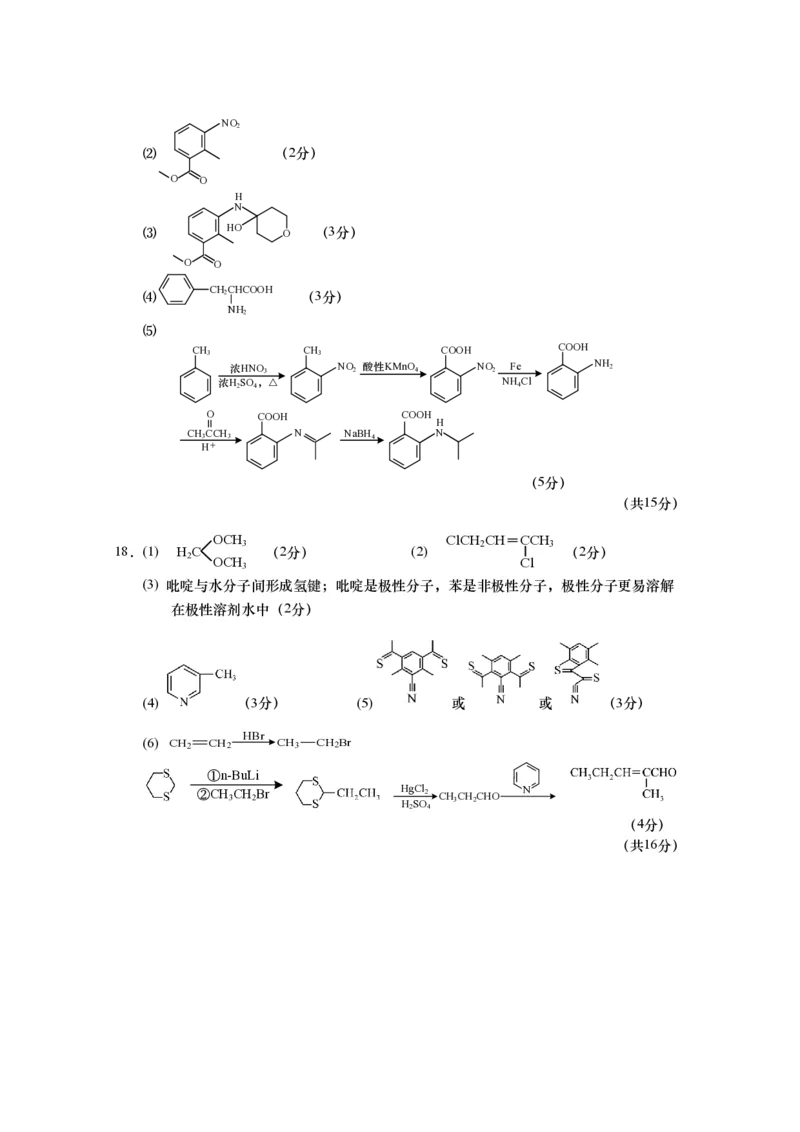
OCH ClCH CH=CCH
3 2 3
18.(1) H C (2分) (2) (2分)
2 OCH Cl
3
(3) 吡啶与水分子间形成氢键;吡啶是极性分子,苯是非极性分子,极性分子更易溶解
在极性溶剂水中(2分)
(4) (3分) (5) 或 或 (3分)
HBr
(6) CH 2 CH 2 CH 3 CH 2 Br
①n-BuLi
②CH 3 CH 2 Br H H g S C O l 2 CH 3 CH 2 CHO N
2 4
(4分)
(共16分)