文档内容
楚雄州春季学期高二年级第一次月考卷
化学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题
区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:人教版选择性必修2第一章~第二章。
5.可能用到的相对原子质量:H-1 C-12 O-16
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的)
1. 下列说法正确的是
A. 各电子层含有的原子轨道数为2n2(n为电子层序数)
B. 电子的“自旋”类似于地球的“自转”
C. 电子仅在激发态跃迁到基态时才会产生原子光谱
D. 霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关
【答案】D
【解析】
【详解】A.各电子层含有的原子轨道数为 (n为电子层序数),A项错误;
B.电子在原子核外高速、无规则运动,电子的“自旋”并不意味着电子像地球那样绕轴“自转”,B项
错误;
C.电子在能量较高的激发态跃迁到较低激发态或基态时,会产生发射光谱,电子由能量较低的基态跃迁
到激发态时,会产生吸收光谱,吸收光谱与发射光谱总称原子光谱,C项错误;
D.霓虹灯光、节日焰火等是原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处
于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,
即与电子跃迁释放能量有关,D项正确;
故答案为:D。
2. 《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。下列说法正确的是
A. 第一电离能:
B. 基态原子未成对电子数:
C. 键角:
D. 基态Zn原子核外电子的空间运动状态有30种
【答案】C
【解析】
【详解】A.第一电离能: ,A项错误;
B.基态Zn原子未成对电子数为0,基态C原子未成对电子数为2,B项错误;
C. 分子中C原子为sp杂化, 为直线形结构,键角为180°, 中心原子的价层电子对个数
,其空间结构为平面三角形,键角为120°,C项正确;
D.空间运动状态=已占原子轨道数,基态Zn原子占有的轨道数 ,其核外电子
的空间运动状态有15种,D项错误;
综上,答案是C。
3. 下列分子的空间结构为正四面体形的是
A. B. C. D.
【答案】B
【解析】
【详解】A. 中S原子的价层电子对数为3,孤电子对数为1,该分子的空间结构为V形,A项错误;
B. 中C原子的价层电子对数为4,孤电子对数为0,该分子的空间结构为正四面体形,B项正确;
的
C. 中O原子 价层电子对数为4,孤电子对数为2,该分子的空间结构为V形,C项错误;
D. 中C原子的价层电子对数为2,孤电子对数为0,该分子的空间结构为直线形,D项错误;
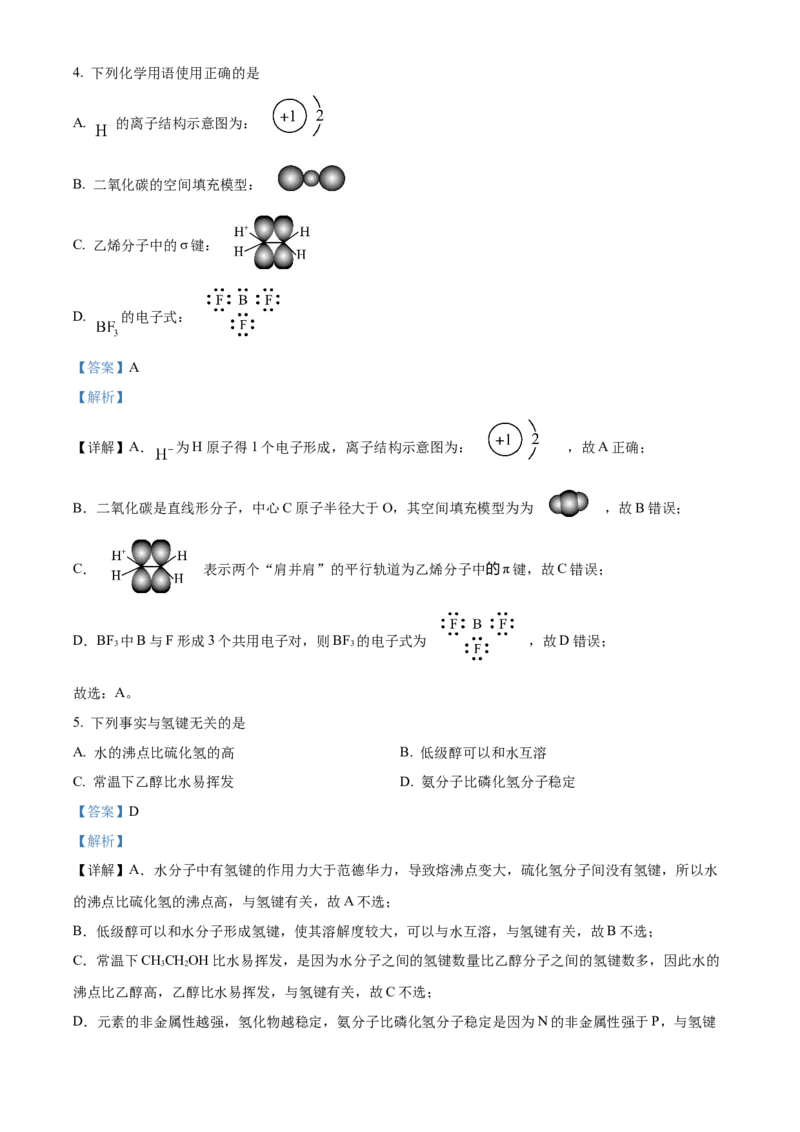
故选B。4. 下列化学用语使用正确的是
A. 的离子结构示意图为:
B. 二氧化碳的空间填充模型:
C. 乙烯分子中的σ键:
D. 的电子式:
【答案】A
【解析】
【详解】A. 为H原子得1个电子形成,离子结构示意图为: ,故A正确;
B.二氧化碳是直线形分子,中心C原子半径大于O,其空间填充模型为为 ,故B错误;
C. 表示两个“肩并肩”的平行轨道为乙烯分子中的π键,故C错误;
D.BF 中B与F形成3个共用电子对,则BF 的电子式为 ,故D错误;
3 3
故选:A。
5. 下列事实与氢键无关的是
A. 水的沸点比硫化氢的高 B. 低级醇可以和水互溶
C. 常温下乙醇比水易挥发 D. 氨分子比磷化氢分子稳定
【答案】D
【解析】
【详解】A.水分子中有氢键的作用力大于范德华力,导致熔沸点变大,硫化氢分子间没有氢键,所以水
的沸点比硫化氢的沸点高,与氢键有关,故A不选;
B.低级醇可以和水分子形成氢键,使其溶解度较大,可以与水互溶,与氢键有关,故B不选;
C.常温下CHCHOH比水易挥发,是因为水分子之间的氢键数量比乙醇分子之间的氢键数多,因此水的
3 2
沸点比乙醇高,乙醇比水易挥发,与氢键有关,故C不选;
D.元素的非金属性越强,氢化物越稳定,氨分子比磷化氢分子稳定是因为N的非金属性强于P,与氢键无关,故D选;
故选D。
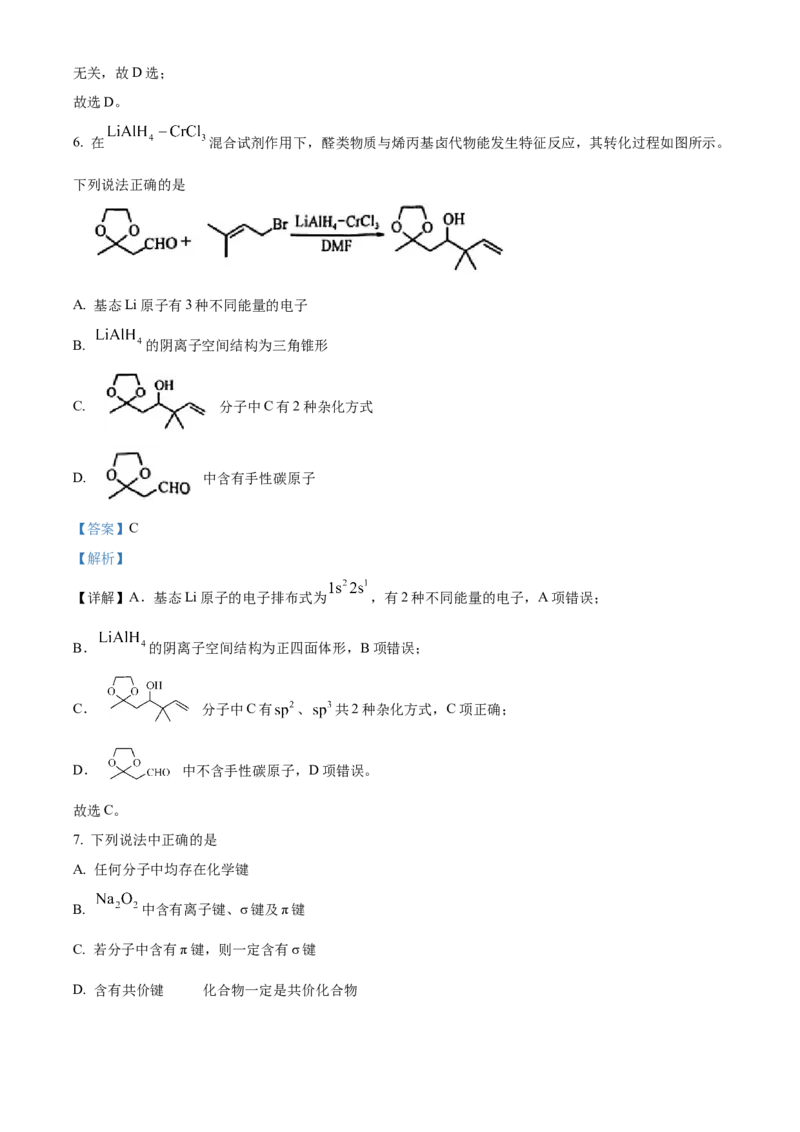
6. 在 混合试剂作用下,醛类物质与烯丙基卤代物能发生特征反应,其转化过程如图所示。
下列说法正确的是
A. 基态Li原子有3种不同能量的电子
B. 的阴离子空间结构为三角锥形
C. 分子中C有2种杂化方式
D. 中含有手性碳原子
【答案】C
【解析】
【详解】A.基态Li原子的电子排布式为 ,有2种不同能量的电子,A项错误;
B. 的阴离子空间结构为正四面体形,B项错误;
C. 分子中C有 、 共2种杂化方式,C项正确;
D. 中不含手性碳原子,D项错误。
故选C。
7. 下列说法中正确的是
A. 任何分子中均存在化学键
B. 中含有离子键、σ键及π键
C. 若分子中含有π键,则一定含有σ键
的
D. 含有共价键 化合物一定是共价化合物【答案】C
【解析】
【详解】A.稀有气体为单原子分子,分子中不存在化学键,A项错误;
B. 中含有离子键、σ键,不含有π键,B项错误;
C.若分子中含有π键,则一定含有σ键,C项正确;
D.离子化合物也可能含有共价键,如NaOH、 等,只含有共价键的化合物才是共价化合物,D项
错误。
故选C。
8. 三氯化硼的熔点为 ,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙
述错误的是
A. 三氯化硼分子间不含氢键 B. 三氯化硼中心原子采用 杂化
C. 三氯化硼分子呈正三角形,属非极性分子 D. 其分子空间结构类似三氯化氮
【答案】D
【解析】
【详解】A.B的非金属性较弱,氯化硼分子间不含有氢键,A正确;
B.BCl 中B不存在孤对电子,成键数为3,则B为sp2杂化,B正确;
3
C.分子中键与键之间的夹角为120°,可知氯化硼分子呈正三角形,结构对称,正负电荷的中心重合,属
非极性分子,C正确;
D.三氯化氮为三角锥,氯化硼分子呈正三角形,空间结构不类似,D错误;
故选D。
9. 下列说法正确的是
A. 1s、2s、3s的电子云轮廓图均为球形且大小相同
B. 价层电子排布为 的元素位于第五周期第 A族
C. 最外层电子数相同的原子不一定位于同一主族,也可能在同一周期
D. 基态氧原子电子排布图表示为 ,违背了泡利原理
【答案】C
【解析】
【详解】A.s能级电子云轮廓图均为球形,但能量不同,轮廓大小不同,A项错误;B.价层电子排布为5s25p1的元素最外层电子数为3,电子层数是5,最后一个电子排在p轨道,所以该元
素位于第五周期第ⅢA族,B项错误;
C.最外层电子数相同的元素不一定处于同一主族,如Mg和He,Ca和Fe的最外层电子数均为两个,Ca
位于第ⅡA族,Fe位于第Ⅷ族,且均位于第四周期,C项正确;
D.处于基态的氧原子电子排布图表示成 违背了洪特规则,2p轨道上单电
子的自旋状态应相同,D项错误;
故选C。
10. 下列说法正确的是
A. 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
B. σ键是电子云“肩并肩”重叠形成的而π键则是“头碰头”重叠形成的
C. 、 、 中 ( 、Cl、Br)键长、键角均相等
D. 中σ键和π键的数目之比为4∶1
【答案】A
【解析】
【详解】A.共价键的键能越大,共价键越牢固,越不容易断裂,由该键形成的分子越稳定,A项正确;
的
B.σ键是电子云“头碰头”重叠形成 而π键则是“肩并肩”重叠形成的,B项错误;
C.由于F、Cl、Br的原子半径不同,故 ( 、Cl、Br)键长不相等,C项错误;
D.单键都为σ键,双键含有一个σ键和一个π键,故 中σ键和π键的数目之
比为9∶1,D项错误;
答案选A。
11. 下列说法错误的是
A. 中心原子的杂化类型为
B. 是含有极性键的非极性分子
C. 在进行化学反应时,分子中的σ键比π键活泼D. 中孤电子对与成键电子对之间的排斥作用比成键电子对之间的排斥作用强
【答案】C
【解析】
【详解】A. 中心原子的价层电子对数为3,孤电子对数为0,C原子的杂化类型为 ,A项正确;
B. 中化学键是不同元素形成的,属于极性键,其是直线形分子,正电荷中心和负电荷中心相重合,
属于非极性分子,B项正确;
C.乙烯分子中的π键不如σ键牢固,反应时比较容易断裂,C项错误;
D.分子中中心原子的孤电子对与成键电子对之间的排斥作用比成键电子对之间的排斥作用强,D项正确;
故选C。
12. 下列对分子结构及其性质的解释中,错误的是
A. 在 中的溶解度很大,因其是非极性分子
B. 沸点: < ,因为前者形成了分子间氢键
C. 羟基乙酸 不具有手性,因其分子中不存在手性碳原子
D. 酸性: ,因为F的电负性大,使 中 极性增强
【答案】B
【解析】
【详解】A. 在 中的溶解度很大,因其是非极性分子,A项正确;
B. 的沸点低于 是因为后者易形成分子间氢键,前者易形成分子
内氢键,B项错误;
C.羟基乙酸 分子中没有手性碳原子,所以不属于手性分子,C项正确;
D. 的酸性强于 是因为F的电负性大,使 中 极性增强,更易
电离出氢离子,D项正确。故选B。
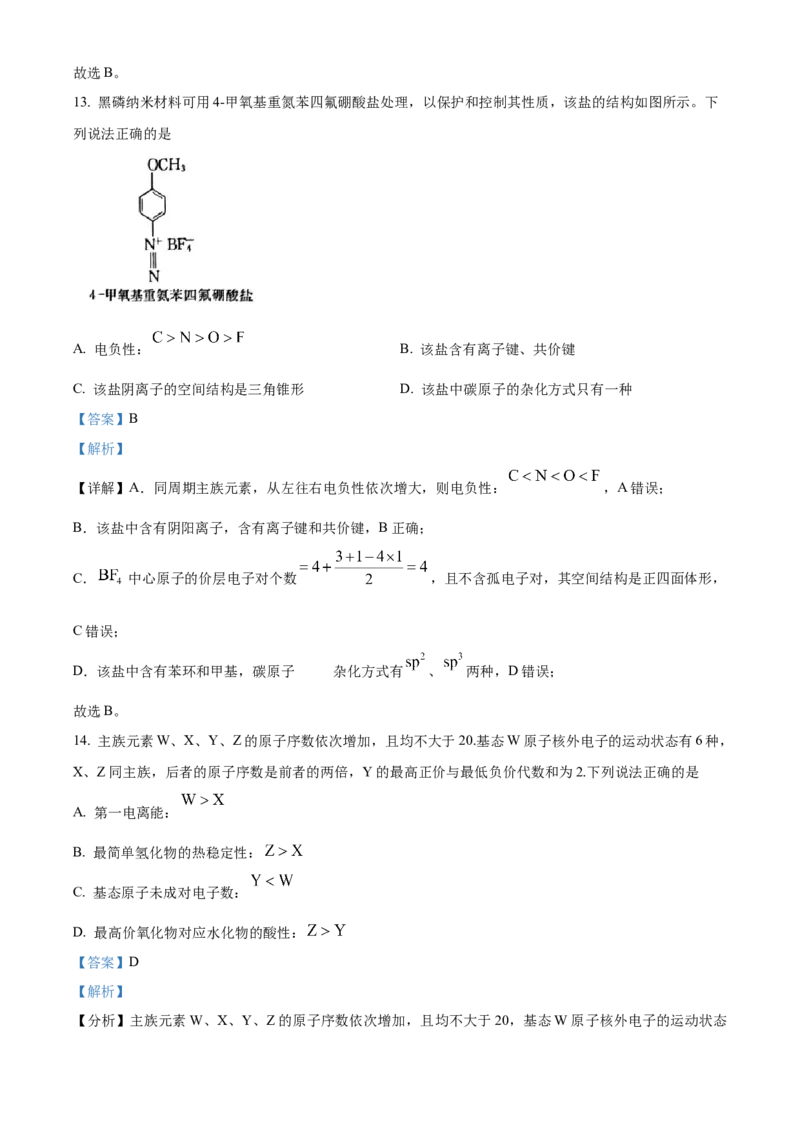
13. 黑磷纳米材料可用4-甲氧基重氮苯四氟硼酸盐处理,以保护和控制其性质,该盐的结构如图所示。下
列说法正确的是
A. 电负性: B. 该盐含有离子键、共价键
C. 该盐阴离子的空间结构是三角锥形 D. 该盐中碳原子的杂化方式只有一种
【答案】B
【解析】
【详解】A.同周期主族元素,从左往右电负性依次增大,则电负性: ,A错误;
B.该盐中含有阴阳离子,含有离子键和共价键,B正确;
C. 中心原子的价层电子对个数 ,且不含孤电子对,其空间结构是正四面体形,
C错误;
的
D.该盐中含有苯环和甲基,碳原子 杂化方式有 、 两种,D错误;
故选B。
14. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20.基态W原子核外电子的运动状态有6种,
X、Z同主族,后者的原子序数是前者的两倍,Y的最高正价与最低负价代数和为2.下列说法正确的是
A. 第一电离能:
B. 最简单氢化物的热稳定性:
C. 基态原子未成对电子数:
D. 最高价氧化物对应水化物的酸性:
【答案】D
【解析】
【分析】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,基态W原子核外电子的运动状态有6种,W含有6个电子,W为C元素,X、Z同主族,后者的原子序数是前者的两倍,X为O元素,Z
为S元素,Y的最高正价与最低负价代数和为2,则最高正价为+5价,最低负价位-3价,Y为P元素,以
此解答。
【详解】A.同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一
电离能大于其相邻元素,据此判断第一电离能大小顺序为:O>C,A错误;
B.同主族元素,从上往下元素非金属性依次减小,则非金属性:O>S,元素非金属性越强,最简单氢化
物越稳定,则最简单氢化物的热稳定性:HO>HS,B错误;
2 2
C.P基态原子电子排布式为1s22s22p63s23p3,有3个未成对电子,C基态原子电子排布式为1s22s22p2,有2
个未成对电子,则基态原子未成对电子数: ,C错误;
D.同周期主族元素,从左往右,非金属性依次增大,则非金属性:S>P,元素非金属性越强,最高价氧化
物对应水化物的酸性越强,则酸性: ,D正确;
故选D。
二、非选择题(本题共4小题,共58分)
15. 北京工商大学课题组最近合成CuO/ZnO纳米材料能提高有机硅单体合成反应(Rochow-MüllerProcess)的
选择性和产率。化学反应如下:
回答下列问题:
(1)甲中氯、氢、碳的电负性由大到小的顺序为___________。
(2)基态Zn原子的电子排布式为___________。
(3)若基态C原子的电子排布式写为 ,则违背了___________原理。
(4)Zn元素位于元素周期表中第___________周期第___________族。
(5)Cu原子的第二电离能比Zn原子的第二电离能明显增大的原因是___________。
(6)Si原子中,能量最高的电子的电子云在空间有___________个伸展方向;原子核外的电子有两种相反
的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数,则基态Si原子的核外电子自旋磁量子数的代数和为___________。
【答案】(1)
(2) 或
(3)泡利 (4) ①. 四 ②. B
(5)Cu原子失去1个电子后, 的原子轨道为全充满结构,比较稳定
(6) ①. 3 ②. 或
【解析】
【小问1详解】
结合HCl中H为+1价,Cl为-1价,CCl 中C为+4价,Cl为-1价,CH 中C为-4价,H为+1价,可以推知
4 4
甲中Cl、H、C的电负性由大到小的顺序为 。
【小问2详解】
Zn 原子序数为30,基态电子排布式为 或 。
【小问3详解】
若将基态C原子电子排布式写成 ,则在2s轨道中排了3个电子,违背了泡利不相容原理,即任
一轨道最多容纳 2 个自旋相反的电子。
【小问4详解】
Zn原子序数为30,元素周期表中,Zn位于第四周期第 B族。
【
小问5详解】
Cu原子的第二电离能比Zn原子的第二电离能明显增大的原因是:Cu原子失去1个电子后, 的原子轨
道为全充满结构,比较稳定。
【小问6详解】
基态Si的最高能级电子为3p电子,p轨道在空间有3个相互垂直的伸展方向;基态Si原子共有 14 个电
子,其中除最外层 3p2有两个未成对且自旋相同的电子外,其余均成对自旋相互抵消,故全部电子自旋磁
量子数的代数和为 + + = +1或- - = -1。16. 短周期主族元素X、Y、Z、W、M、N的原子序数依次增大,X核外电子只有1种运动状态,Y、W
的2p轨道均含有2个未成对电子,M、N均是与X不同主族的金属元素。回答下列问题:
(1)基态M原子有___________种不同空间运动状态的电子,价层电子排布式为___________。
(2)基态N原子中,核外电子占据的最高能层的符号是___________,该金属单质与NaOH溶液反应的离
子方程式为___________。
(3)Y的氢化物沸点___________(填“一定”或“不一定”)低于W的氢化物的沸点。
(4)由X、Y、Z、W共同组成的一种无机含氧酸盐的化学式为___________,其阳离子中心原子的价层电
子对数为___________。
【答案】(1) ①. 6 ②.
(2) ①. M ②.
(3)不一定 (4) ①. 、 等 ②. 4
【解析】
【分析】X只有1种运动状态,则X是H元素;Y、W的2p轨道均含有2个未成对电子,且短周期主族元
素X、Y、Z、W、M、N的原子序数依次增大,则Y的2p轨道只有2个电子,Y是C元素,W的2p轨道
有四个电子,W是O元素;Z位于Y、W之间,则Z是N元素;M、N均是与X不同主族的金属元素,则
M、N分别是Mg元素,Al元素。
【小问1详解】
根据以上分析可知M原子是镁原子,其电子排布式为1s22s22p63s2,故有6种不同空间运动状态的电子,价
层电子排布式为:3s2;
【小问2详解】
基态原子是Al原子,其电子排布式为1s22s22p63s23p1,故核外电子占据的最高能层的符号是M,Al与
NaOH溶液反应的离子方程式为 ;
【小问3详解】
Y是C元素,W是O元素,O的氢化物是HO或HO,碳的氢化物非常多,其沸点随碳原子数目增加而
2 2 2
升高,则Y的氢化物沸点不一定低于W的氢化物的沸点;
【小问4详解】
由H、C、N、O共同组成的一种无机含氧酸盐的化学式为 、 等;其阳离子中心原子的价层电子对数为4+ =4。
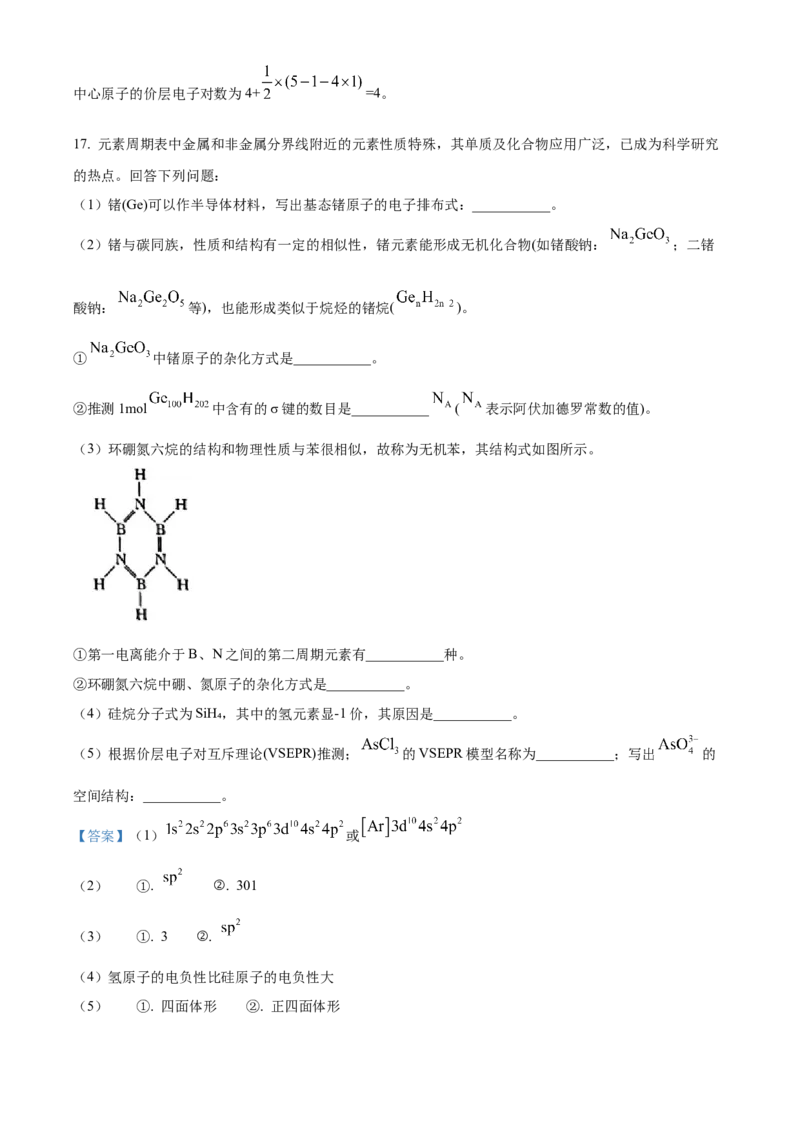
17. 元素周期表中金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,已成为科学研究
的热点。回答下列问题:
(1)锗(Ge)可以作半导体材料,写出基态锗原子的电子排布式:___________。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠: ;二锗
酸钠: 等),也能形成类似于烷烃的锗烷( )。
① 中锗原子的杂化方式是___________。
②推测1mol 中含有的σ键的数目是___________ ( 表示阿伏加德罗常数的值)。
(3)环硼氮六烷的结构和物理性质与苯很相似,故称为无机苯,其结构式如图所示。
①第一电离能介于B、N之间的第二周期元素有___________种。
②环硼氮六烷中硼、氮原子的杂化方式是___________。
(4)硅烷分子式为SiH₄,其中的氢元素显-1价,其原因是___________。
(5)根据价层电子对互斥理论(VSEPR)推测; 的VSEPR模型名称为___________;写出 的
空间结构:___________。
【答案】(1) 或
(2) ①. ②. 301
(3) ①. 3 ②.
(4)氢原子的电负性比硅原子的电负性大
(5) ①. 四面体形 ②. 正四面体形【解析】
【小问1详解】
Ge为32号元素,电子排布式为 或 。
【小问2详解】
①Na GeO 中锗原子的价层电子对数为:3+ =3,VSEPR模型为平面三角形,则杂化方式为
2 3
sp2,故答案为:sp2;
②GeH 与烷烃结构类似,分子中的共价键均为σ键,n个Ge原子之间形成(n-1)个σ键,Ge与2n+2
n 2n+2
个H原子形成(2n+2)个σ键,所以1个分子中σ键的个数为(2n+2)+(n-1)=3n+1,1mol 中
含有的σ键的数目为301N ,故答案为:301;
A
【小问3详解】
①Be的2p轨道全空,其第一电离能高于B,N的2p轨道半充满,其第一电离能高于O,则第一电离能介
于B、N之间的第二周期元素有Be、C、O共3种,故答案为:3。
②B、N原子都是3个σ,无孤对电子,故为sp2杂化。
【小问4详解】
SiH 分子中氢和硅以共价键相连,H原子吸电子能力比Si原子强,即氢原子的电负性比硅原子的电负性大,
4
则共用电子对偏向H原子,因此H显负价;
【小问5详解】
的价层电子对数为3+ =4,故VSEPR模型名称为四面体形; 的价层电子对数为4+
=4,故空间结构为正四面体。
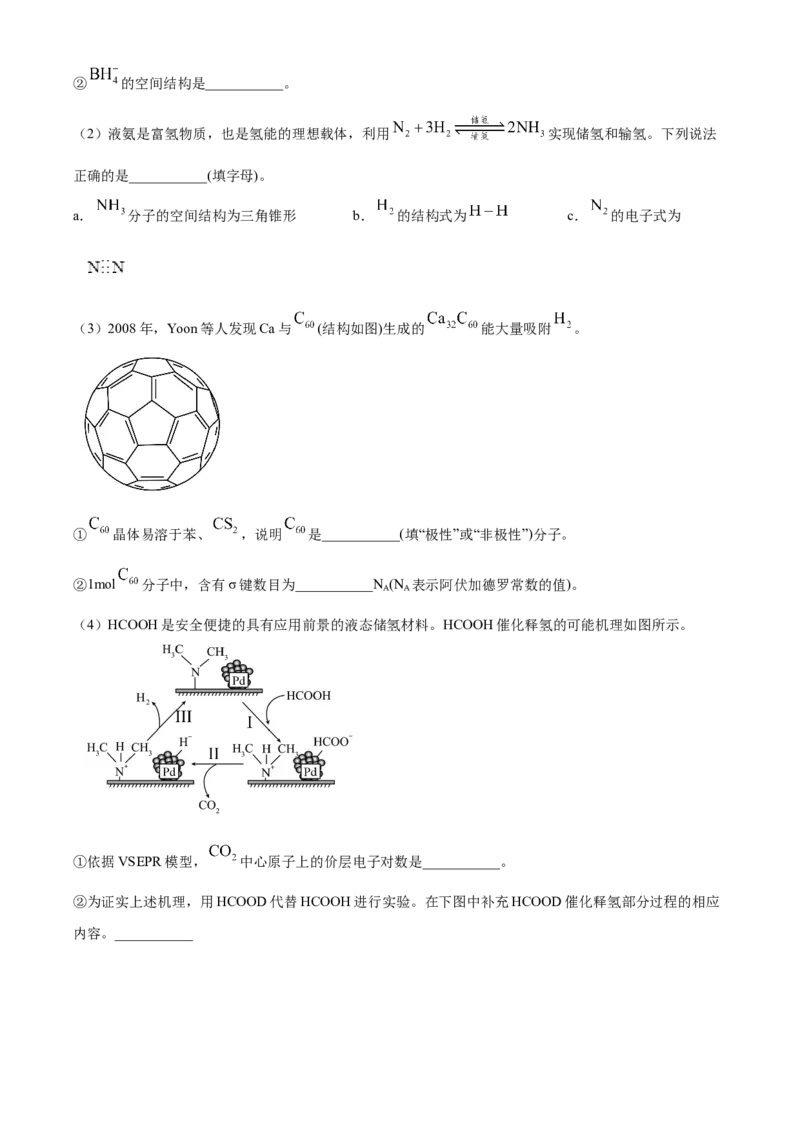
18. 氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载
体化合物、碳质材料、金属氢化物等。回答下列问题:
(1) 是一种过渡元素硼氢化物储氢材料。
①基态 的电子排布式可表示为___________。② 的空间结构是___________。
(2)液氨是富氢物质,也是氢能的理想载体,利用 实现储氢和输氢。下列说法
正确的是___________(填字母)。
a. 分子的空间结构为三角锥形 b. 的结构式为 c. 的电子式为
(3)2008年,Yoon等人发现Ca与 (结构如图)生成的 能大量吸附 。
① 晶体易溶于苯、 ,说明 是___________(填“极性”或“非极性”)分子。
②1mol 分子中,含有σ键数目为___________N (N 表示阿伏加德罗常数的值)。
A A
(4)HCOOH是安全便捷的具有应用前景的液态储氢材料。HCOOH催化释氢的可能机理如图所示。
①依据VSEPR模型, 中心原子上的价层电子对数是___________。
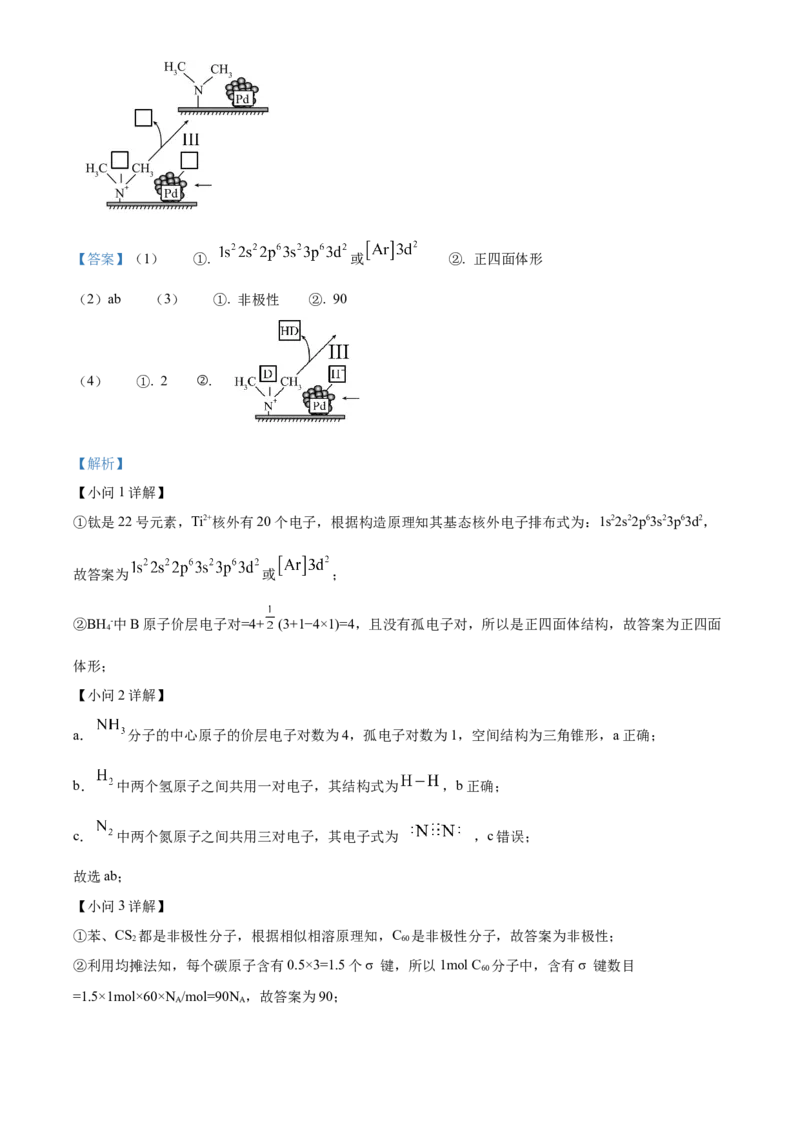
②为证实上述机理,用HCOOD代替HCOOH进行实验。在下图中补充HCOOD催化释氢部分过程的相应
内容。___________【答案】(1) ①. 或 ②. 正四面体形
(2)ab (3) ①. 非极性 ②. 90
(4) ①. 2 ②.
【解析】
【小问1详解】
①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为:1s22s22p63s23p63d2,
故答案为 或 ;
②BH-中B原子价层电子对=4+ (3+1−4×1)=4,且没有孤电子对,所以是正四面体结构,故答案为正四面
4
体形;
【小问2详解】
a. 分子的中心原子的价层电子对数为4,孤电子对数为1,空间结构为三角锥形,a正确;
b. 中两个氢原子之间共用一对电子,其结构式为 ,b正确;
c. 中两个氮原子之间共用三对电子,其电子式为 ,c错误;
故选ab;
【小问3详解】
①苯、CS 都是非极性分子,根据相似相溶原理知,C 是非极性分子,故答案为非极性;
2 60
②利用均摊法知,每个碳原子含有0.5×3=1.5个σ 键,所以1mol C 分子中,含有σ 键数目
60
=1.5×1mol×60×N /mol=90N ,故答案为90;
A A【小问4详解】
① 分子中C原子的价层电子对数为 ;