文档内容
2024.10 高二第一学期十月阶段练习-化学
原子量:H 1 C 12 O 16 Na 23 P 31 S 32 Cl 35.5 Ba 137
一、选择题(每题只有一个选项符合题意,1-20题每题 3分,21-25题每题 2分,共 70
分)
1. 关于中国传统文化中的“文房四宝”,下列叙述中不正确的是( )
A. 可用灼烧法鉴别毛笔笔头是否含蛋白质
B. 用墨写字利用了常温下碳的稳定性
C. 纸的主要成分纤维素属于合成高分子化合物
D. 用工具打磨石材制砚台的过程是物理变化
【答案】C
【解析】
【详解】A项、毛笔笔头主要成分是蛋白质,灼烧会产生特殊的气味,假的毛笔笔头是化学纤维,所以用
灼烧法可鉴别毛笔笔头的真伪,故A正确;
B项、碳的化学性质稳定,在空气中不易反应,所以用墨写字画画可长久不褪色,故B正确;
C项、纸的原料是木材,主要成分是纤维素,纤维素属于天然高分子化合物,故C错误;
D项、用工具打磨石材制砚台的过程中没有新物质生成,是物理变化,故D正确。
故选C。
【点睛】本题考查物质的性质及用途,注意分析物质的性质,把握常见物质的性质和鉴别方法为解答的关
键。
2. 用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低
的是( )
A. AgNO CuCl Cu(NO ) B. KCl Na SO CuSO
3 2 3 2 2 4 4
C. CaCl KOH NaNO D. HCl HNO K SO
2 3 3 2 4【答案】B
【解析】
【详解】由电解规律可得:
类型 化学物质 pH变化
放O 生酸型 CuSO 、AgNO、Cu(NO ) 降低
2 4 3 3 2
放O 生酸型 KCl、CaCl 升高
2 2
CuCl 升高
2
电解电解质型
HCl 升高
NaNO 、NaSO 、KSO 不变
3 2 4 2 4
电解HO型 KaOH 升高
2
HNO 降低
3
故选B。
3. 下列热化学方程式正确的是
选
已知条件 热化学方程式
项
A 的燃烧热为
、 完全反应,放出
B
热量
C
D 白磷( )比 红磷能量多
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.燃烧热是指1mol可燃物完全燃烧生成稳定氧化物所释放的热量,应是1mol气态H 和气态O
2 2反应生成1mol液态水放出的热量,故A错误;
B.根据1molSO 、0.5molO 完全反应后,放出热量98.3kJ可知,则2molSO 、1molO 完全反应后,放出
2 2 2 2
热量196.6kJ,因此2SO (g)+O(g) 2SO (g) ΔH=−196.6 kJ∙mol−1,故B错误;
2 2 3
C.根据 ΔH=−57.3 kJ∙mol−1,生成BaSO 沉淀,放出的热量大于114.6 kJ
4
,故HSO (aq)+Ba(OH)(aq)=BaSO(s)+2HO(l) ΔH<−114.6 kJ∙mol−1,故C错误;
2 4 2 4 2
D.根据31g即0.25mol白磷比31g即1mol红磷能量多bkJ,白磷转化为红磷会释放能量,1mol白磷固体
变为4mol红磷固体释放4bkJ的热量,因此 ,故D正确。
综上所述,答案为D。
4. 下列有关反应的离子方程式不正确的是
A. 氧化铁与稀盐酸混合:
B. 溶解Cu:
C. 碳酸氢钠溶液与稀 反应:
D. 氯气与碘化钾溶液:
【答案】C
【解析】
【详解】A.氧化铁与盐酸发生复分解反应生成氯化铁和水,A正确;
B.氯化铁与铜反应生成氯化亚铁和氯化铜,B正确;
C.碳酸氢钠与稀硫酸反应生成硫酸钠、水和二氧化碳,离子方程式为: ,C
错误;
D.氯气与碘化钾溶液反应生成氯化钾和碘单质,D正确;
答案选C。
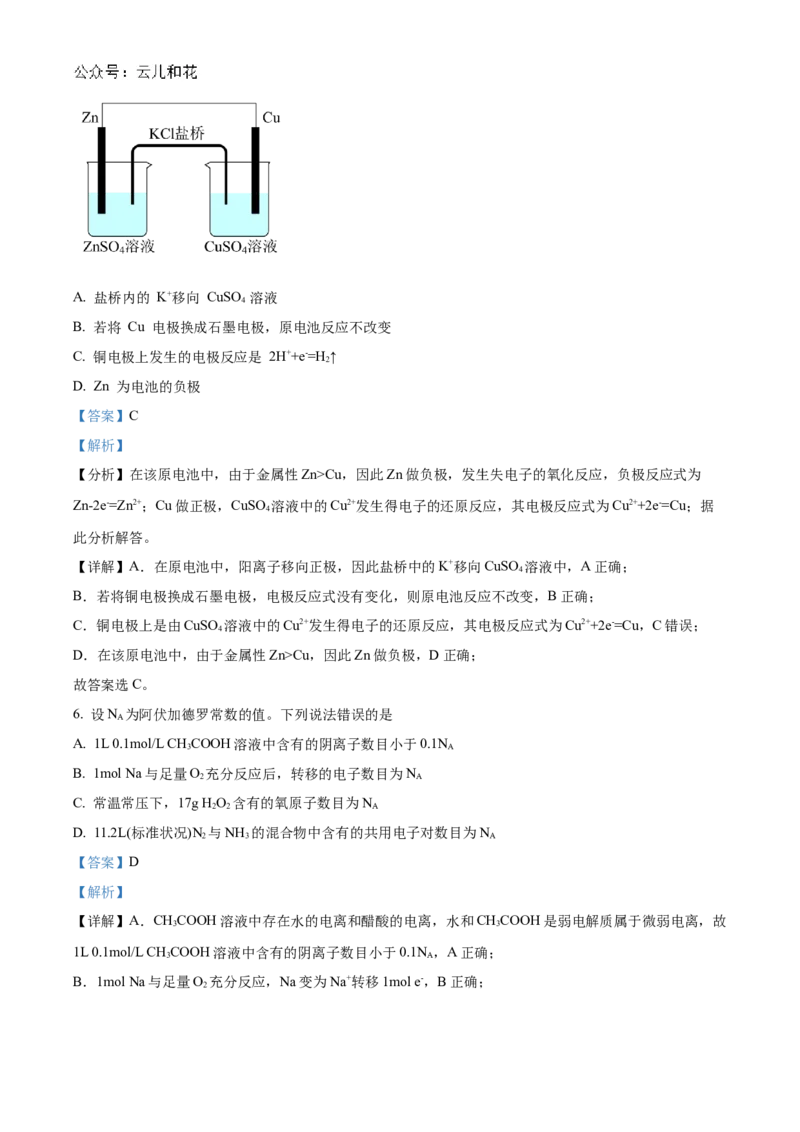
5. 关于下图装置的说法,错误的是A. 盐桥内的 K+移向 CuSO 溶液
4
B. 若将 Cu 电极换成石墨电极,原电池反应不改变
C. 铜电极上发生的电极反应是 2H++e-=H ↑
2
D. Zn 为电池的负极
【答案】C
【解析】
【分析】在该原电池中,由于金属性Zn>Cu,因此Zn做负极,发生失电子的氧化反应,负极反应式为
Zn-2e-=Zn2+;Cu做正极,CuSO 溶液中的Cu2+发生得电子的还原反应,其电极反应式为Cu2++2e-=Cu;据
4
此分析解答。
【详解】A.在原电池中,阳离子移向正极,因此盐桥中的K+移向CuSO 溶液中,A正确;
4
B.若将铜电极换成石墨电极,电极反应式没有变化,则原电池反应不改变,B正确;
C.铜电极上是由CuSO 溶液中的Cu2+发生得电子的还原反应,其电极反应式为Cu2++2e-=Cu,C错误;
4
D.在该原电池中,由于金属性Zn>Cu,因此Zn做负极,D正确;
故答案选C。
6. 设N 为阿伏加德罗常数的值。下列说法错误的是
A
A. 1L 0.1mol/L CH COOH溶液中含有的阴离子数目小于0.1N
3 A
B. 1mol Na与足量O 充分反应后,转移的电子数目为N
2 A
C. 常温常压下,17g H O 含有的氧原子数目为N
2 2 A
D. 11.2L(标准状况)N 与NH 的混合物中含有的共用电子对数目为N
2 3 A
【答案】D
【解析】
【详解】A.CHCOOH溶液中存在水的电离和醋酸的电离,水和CHCOOH是弱电解质属于微弱电离,故
3 3
1L 0.1mol/L CH COOH溶液中含有的阴离子数目小于0.1N ,A正确;
3 A
B.1mol Na与足量O 充分反应,Na变为Na+转移1mol e-,B正确;
2C.17g H O 的物质的量为= = = 0.5mol,含有的氧原子数目为2×0.5mol×N =N ,C正确;
2 2 A A
D.N 与NH 分子中均含有3对共用电子对,故11.2L(标准状况) N 与NH 的混合物中含有的共用电子对数
2 3 2 3
目为 ×3×N =1.5N ,D错误;
A A
故选D。
7. 下列在指定溶液中的各组离子,一定能够大量共存的是
A. 无色溶液中: 、 、 、
B. 的溶液中: 、 、 、
C. 的溶液中: 、 、 、
D. 电解 溶液后的溶液中: 、 、 、
【答案】A
【解析】
【详解】A.该组离子之间不反应,离子可大量共存,且离子均为无色,故A正确;
B.pH=11的溶液显碱性,OH-与 反应生成碳酸根离子和水,不能大量存在,故B错误;
C.pH=1的溶液显酸性,H+、 发生反应生成二氧化硫和水,不能大量共存,故C错误;
D.电解 溶液生成铜、硫酸和氧气,反应后的溶液是硫酸,H+与 反应生成硅酸,不能共存,
故D错误;
故选:A。
8. 利用右图所示装置可以将温室气体CO 转化为燃料气体CO。下列说法中,正确的是
2A. 该过程是将太阳能转化为化学能的过程
B. 电极a表面发生还原反应
C. 该装置工作时,H+从b极区向a极区移动
D. 该装置中每生成1 mol CO,同时生成1 mol O
2
【答案】A
【解析】
【详解】A.根据图示,该过程是将太阳能转化为化学能的过程,故A正确;
B.根据图示,电极a表面发生水转化为氧气的过程,反应中O元素的化合价升高,被氧化,发生氧化反
应,故B错误;
C.根据图示,a为负极,b为正极,H+从a极区向b极区移动,故C错误;
D.根据得失电子守恒,该装置中每生成1 mol CO,同时生成 mol O,故D错误;
2
故选A。
9. 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 反应 在点燃条件下才能剧烈反应,所以不能设计成原电池
B. 碱性氢氧燃料电池的负极反应为
C. 常温常压下,氢氧燃料电池放电过程中消耗 ,转移电子的数目为
D. 同温同压下, ,在燃料电池和点燃条件下的 相同
【答案】D
【解析】
【详解】A.反应 是自发的氧化还原反应,能设计成原电池,A错误;
B.碱性氢氧燃料电池的负极是氢气失去电子和氢氧根离子反应生成水,负极反应式为H+2e-+2OH-
2
=2H O,B错误;
2C.常温常压下气体摩尔体积大于22.4/mol,氢氧燃料电池放电过程中消耗氢气11.2L,则氢气的物质的量
小于0.5mol,反应转移电子小于0.5mol×2=1mol,故数目小于6.02×1023,C错误;
D.反应的焓变与反应途径无关,在燃料电池和点燃条件下的 相同,D正确;
故选D。
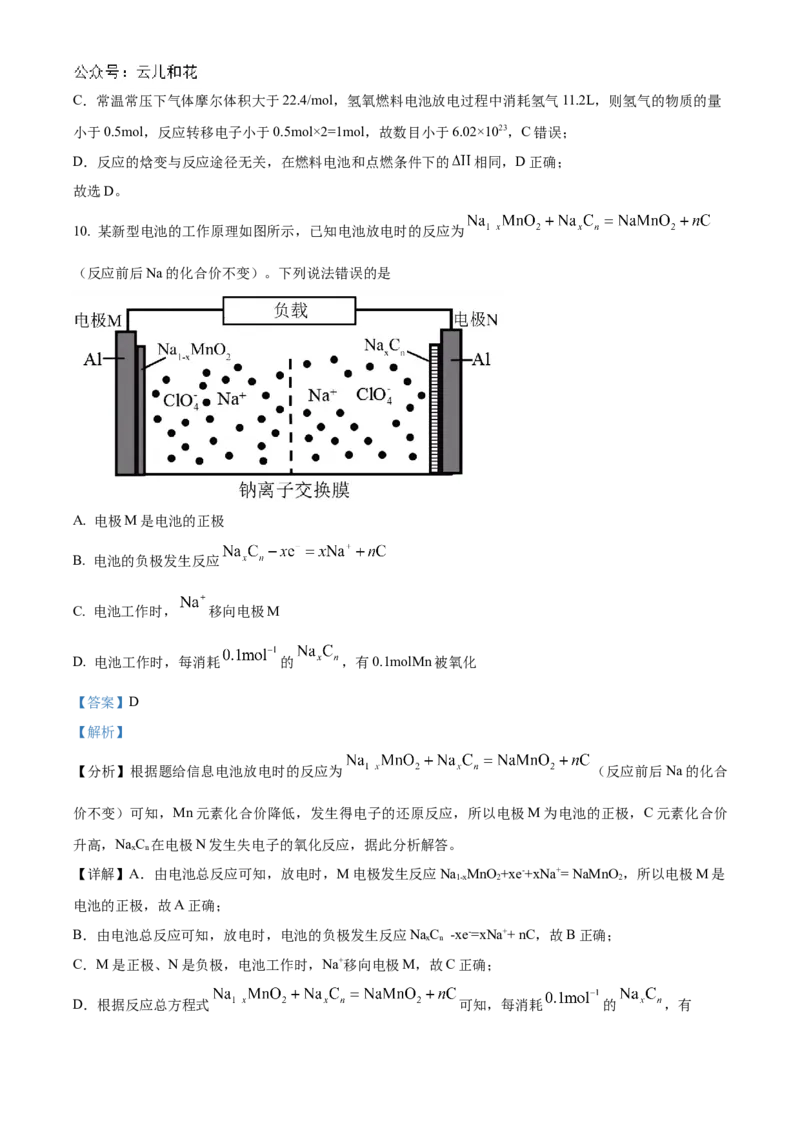
10. 某新型电池的工作原理如图所示,已知电池放电时的反应为
(反应前后Na的化合价不变)。下列说法错误的是
A. 电极M是电池的正极
B. 电池的负极发生反应
C. 电池工作时, 移向电极M
D. 电池工作时,每消耗 的 ,有0.1molMn被氧化
【答案】D
【解析】
【分析】根据题给信息电池放电时的反应为 (反应前后Na的化合
价不变)可知,Mn元素化合价降低,发生得电子的还原反应,所以电极M为电池的正极,C元素化合价
升高,NaC 在电极N发生失电子的氧化反应,据此分析解答。
x n
【详解】A.由电池总反应可知,放电时,M电极发生反应Na MnO +xe-+xNa+= NaMnO ,所以电极M是
1-x 2 2
电池的正极,故A正确;
B.由电池总反应可知,放电时,电池的负极发生反应NaC -xe-=xNa++ nC,故B正确;
x n
C.M是正极、N是负极,电池工作时,Na+移向电极M,故C正确;
D.根据反应总方程式 可知,每消耗 的 ,有0.1molMn被还原,故D错误;
答案选D。
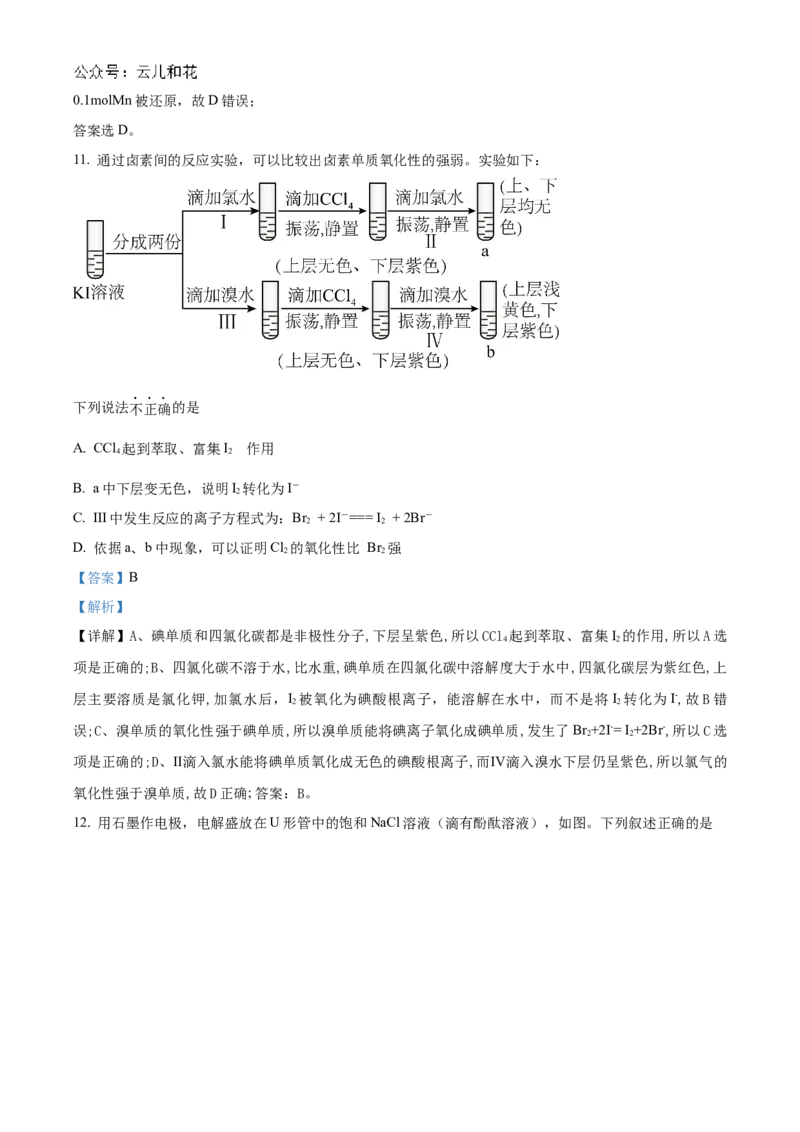
11. 通过卤素间的反应实验,可以比较出卤素单质氧化性的强弱。实验如下:
下列说法不正确的是
的
A. CCl 起到萃取、富集I 作用
4 2
B. a中下层变无色,说明I 转化为I-
2
C. Ⅲ中发生反应的离子方程式为:Br + 2I-=== I + 2Br-
2 2
D. 依据a、b中现象,可以证明Cl 的氧化性比 Br 强
2 2
【答案】B
【解析】
【详解】A、碘单质和四氯化碳都是非极性分子,下层呈紫色,所以CCl 起到萃取、富集I 的作用,所以A选
4 2
项是正确的;B、四氯化碳不溶于水,比水重,碘单质在四氯化碳中溶解度大于水中,四氯化碳层为紫红色,上
层主要溶质是氯化钾,加氯水后,I 被氧化为碘酸根离子,能溶解在水中,而不是将I 转化为I-,故B错
2 2
误;C、溴单质的氧化性强于碘单质,所以溴单质能将碘离子氧化成碘单质,发生了Br +2I-= I +2Br-,所以C选
2 2
项是正确的;D、Ⅱ滴入氯水能将碘单质氧化成无色的碘酸根离子,而Ⅳ滴入溴水下层仍呈紫色,所以氯气的
氧化性强于溴单质,故D正确; 答案:B。
12. 用石墨作电极,电解盛放在U形管中的饱和NaCl溶液(滴有酚酞溶液),如图。下列叙述正确的是A. 通电后,NaCl发生电离
B. 通电一段时间后,阳极附近溶液先变红
C. 当阳极生成0.1 mol气体时,整个电路中转移了0.1 mol e-
D. 电解饱和食盐水的总反应式为:2NaCl+2H O 2NaOH+H ↑+Cl↑
2 2 2
【答案】D
【解析】
【分析】用石墨作电极电解饱和氯化钠溶液,阴极发生还原反应,电极反应式为:2HO+2e-=H↑+2OH-,
2 2
生成NaOH,该极呈碱性;阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl↑,总反应为:2NaCl+2H O
2 2
2NaOH+H ↑+Cl↑,以此解答该题。
2 2
【详解】A.NaCl为强电解质,无论是否通电,在溶液中都发生电离,A错误;
B.阳极生成氯气,阴极生成NaOH,则阴极附近溶液先变红,B错误;
C.阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl↑,生成0.1mol氯气时,转移电子为0.2mol,C错误;
2
D.电解饱和食盐水,阳极生成氯气,阴极生成氢气和氢氧化钠,总方程式为2NaCl+2H O
2
2NaOH+H ↑+Cl↑,D正确;
2 2
故选;D。
【点睛】本题考查电解原理,为高频考点,侧重于学生的分析、计算能力的考查,难度一般,掌握离子放
电顺序是解题的关键,注意基础知识的积累掌握。易错点是氢氧根离子在阴极产生的判断。
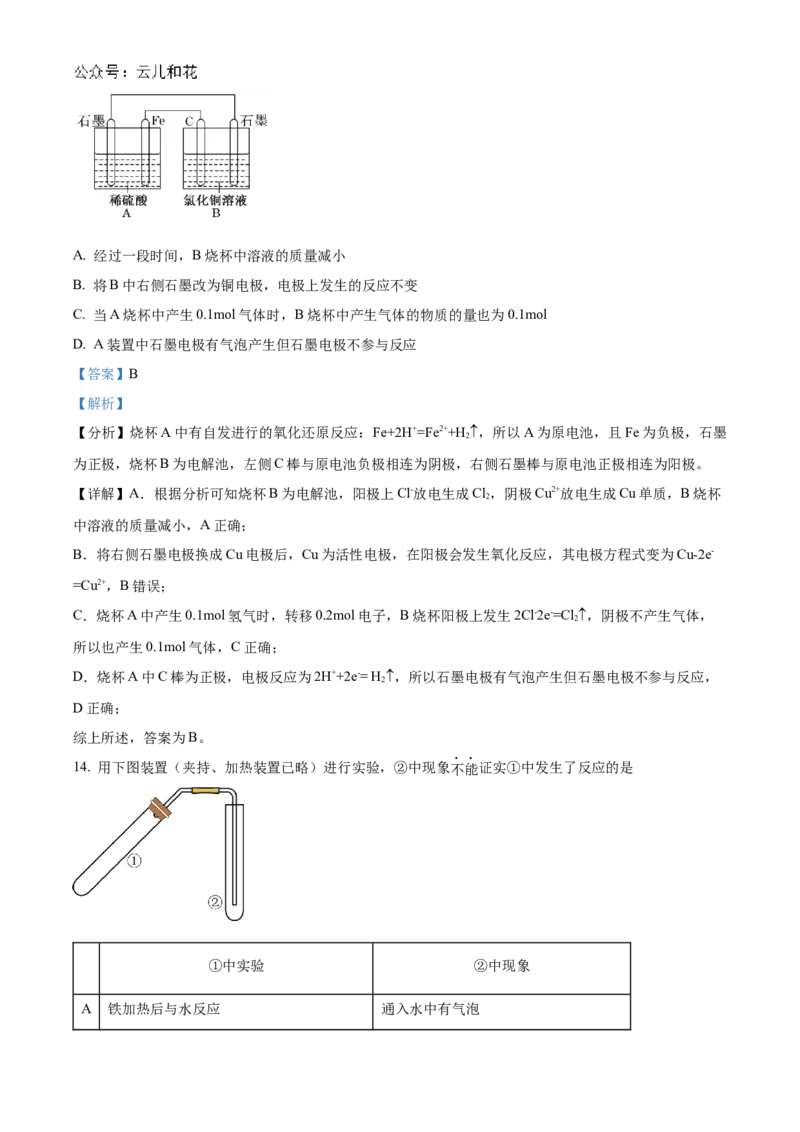
13. 烧杯A中盛放 的 溶液,烧杯B中盛放 的 溶液(两种溶液均足量),
组成的装置如图所示。下列说法不正确的是A. 经过一段时间,B烧杯中溶液的质量减小
B. 将B中右侧石墨改为铜电极,电极上发生的反应不变
C. 当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D. A装置中石墨电极有气泡产生但石墨电极不参与反应
【答案】B
【解析】
【分析】烧杯A中有自发进行的氧化还原反应:Fe+2H+=Fe2++H ,所以A为原电池,且Fe为负极,石墨
2
为正极,烧杯B为电解池,左侧C棒与原电池负极相连为阴极,右侧石墨棒与原电池正极相连为阳极。
【详解】A.根据分析可知烧杯B为电解池,阳极上Cl-放电生成Cl,阴极Cu2+放电生成Cu单质,B烧杯
2
中溶液的质量减小,A正确;
B.将右侧石墨电极换成Cu电极后,Cu为活性电极,在阳极会发生氧化反应,其电极方程式变为Cu-2e-
=Cu2+,B错误;
C.烧杯A中产生0.1mol氢气时,转移0.2mol电子,B烧杯阳极上发生2Cl-2e-=Cl,阴极不产生气体,
2
所以也产生0.1mol气体,C正确;
D.烧杯A中C棒为正极,电极反应为2H++2e-= H ,所以石墨电极有气泡产生但石墨电极不参与反应,
2
D正确;
综上所述,答案为B。
14. 用下图装置(夹持、加热装置已略)进行实验,②中现象不能证实①中发生了反应的是
①中实验 ②中现象
A 铁加热后与水反应 通入水中有气泡加热 溶液和浓NaOH溶液的混合
B 湿润的红色石蕊试纸变蓝
物
饱和 溶液的上层有无色油状液
C 加热乙酸、乙醇和浓硫酸的混合物
体产生
将铁粉、碳粉和NaCl溶液的混合物放置
D 导管中倒吸形成一段水柱
一段时间
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.铁加热后不能与水发生反应,铁只能与水蒸气在高温条件下发生反应,②中有气泡是①中空
气受热膨胀造成的,所以不能证实①中发生了反应,A符合题意;
B.加热时氯化铵与浓NaOH溶液反应生成氨气,氨气为碱性气体,遇到湿润的红色石蕊试纸会变蓝,B
不符合题意;
C.加热乙酸、乙醇和浓硫酸的混合物,生成乙酸乙酯,饱和碳酸钠溶液可吸收乙醇、除去乙酸、降低酯
的溶解度,则充分振荡后,饱和NaCO 溶液的上层有无色油状液体乙酸乙酯析出,C不符合题意;
2 3
D.铁粉、碳粉和NaCl溶液的混合物,构成原电池,Fe发生吸氧腐蚀,则导管中倒吸形成一段水柱,D不
符合题意;
故选A 。
15. 下列“实验结论”与“实验操作及现象”不相符的一项是
选
实验操作及现象 实验结论
项
A 向某溶液中加入 溶液,生成白色沉淀 该溶液中一定含有
B 将银白色的金属钠放置在空气中,钠表面很快变暗 金属钠具有还原性
C 向某溶液中加入 溶液,生成白色沉淀 该溶液中可能含有
用玻璃棒蘸取氯水滴到蓝色石蕊试纸上,试纸先变红,随后褪 氯水中含有酸性物质、漂白性物
D
色 质
A. A B. B C. C D. D
【答案】A
【解析】【详解】A.白色沉淀可能为氢氧化铝或氢氧化镁等,由操作和现象可知,该溶液中不一定含有Mg2+,故
A错误;
B.将银白色的金属钠放置在空气中,钠表面很快变暗,说明Na与氧气发生氧化反应生成了氧化钠,钠表
现出还原性,故B正确;
C.向某溶液中加入AgNO 溶液,生成的白色沉淀可能为Ag CO,不一定为AgCl,则原溶液中可能含有
3 2 3
Cl-,故C正确;
D.氯水含盐酸、次氯酸,次氯酸具有漂白性,则蓝色石蕊试纸先变红,随后褪色,故D正确;
故选:A。
的
16. 取 和 混合溶液,加入过量 溶液后得到29.02g白色沉淀,用过量稀硝
酸处理产生气体2.24L(标准状况)。下列说法不正确的是
A. 混合溶液中 的物质的量浓度0.1mol/L
B. 混合溶液中 的物质的量浓度0.4mol/L
C. 29.02g白色沉淀用过量稀硝酸处理,沉淀质量减少19.7g
D. 处理沉淀消耗的硝酸的溶质的物质的量0.2mol
【答案】A
【解析】
【分析】用过量稀硝酸处理产生气体2.24L,该气体应为二氧化碳,其物质的量为: ;
则碳酸钠的物质的量以及生成碳酸钡的物质的量均为 0.1mol,生成碳酸钡的质量为 0.1mol×197g/
mol=19.7g;则硫酸钡的质量为29.02-19.7=9.32g,其物质的量为 ,可知 的
物质的量为0.04mol,据此分析解答;
【详解】A.由以上分析可知 的物质的量为0.1mol,则其浓度为: ,故A错
误;
B.由以上分析可知 的物质的量为0.04mol,混合溶液中 的物质的量浓度=0.4mol/L,故B正确;
C.29.02g白色沉淀用过量稀硝酸处理,其中碳酸钡溶于硝酸,其质量为19.7g,故C正确;
D.1mol碳酸钡消耗2mol硝酸,则0.1mol碳酸钡溶解消耗0.2mol硝酸,故D正确;
故选:A。
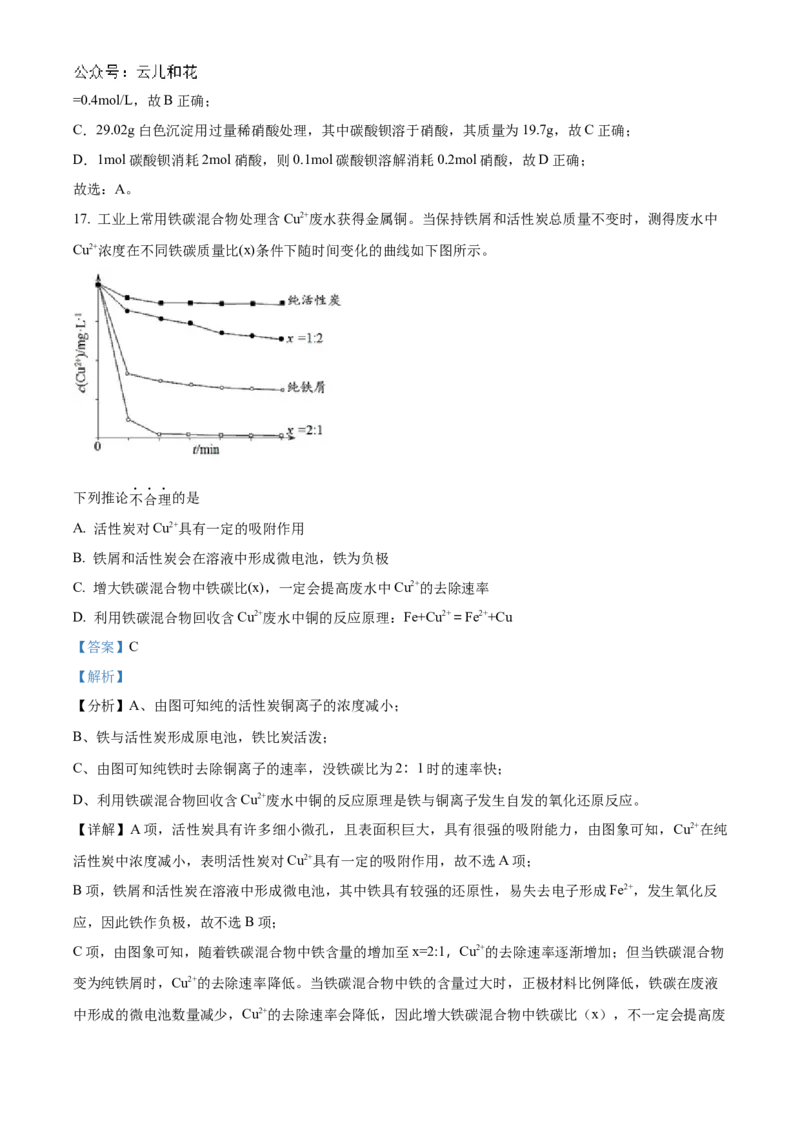
17. 工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中
Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
【答案】C
【解析】
【分析】A、由图可知纯的活性炭铜离子的浓度减小;
B、铁与活性炭形成原电池,铁比炭活泼;
C、由图可知纯铁时去除铜离子的速率,没铁碳比为2:1时的速率快;
D、利用铁碳混合物回收含Cu2+废水中铜的反应原理是铁与铜离子发生自发的氧化还原反应。
【详解】A项,活性炭具有许多细小微孔,且表面积巨大,具有很强的吸附能力,由图象可知,Cu2+在纯
活性炭中浓度减小,表明活性炭对Cu2+具有一定的吸附作用,故不选A项;
B项,铁屑和活性炭在溶液中形成微电池,其中铁具有较强的还原性,易失去电子形成Fe2+,发生氧化反
应,因此铁作负极,故不选B项;
C项,由图象可知,随着铁碳混合物中铁含量的增加至x=2:1,Cu2+的去除速率逐渐增加;但当铁碳混合物
变为纯铁屑时,Cu2+的去除速率降低。当铁碳混合物中铁的含量过大时,正极材料比例降低,铁碳在废液
中形成的微电池数量减少,Cu2+的去除速率会降低,因此增大铁碳混合物中铁碳比(x),不一定会提高废水中Cu2+的去除速率,故选C项;
D项,在铁碳微电池中,碳所在电极发生还原反应,Cu2+得到电子生成铜单质;因此该微电池的总反应方
程式为Fe+Cu2+=Fe2++Cu,故不选D项。
为
综上所述,本题正确答案 C。
【点睛】本题对电化学的原理和学生看图识的能力的考查,题目有利于培养学生的良好的科学素养,侧重
于考查学生的分析、实验能力的考查,注意把握提给信息以及物质的性质,为解答该题的关键。
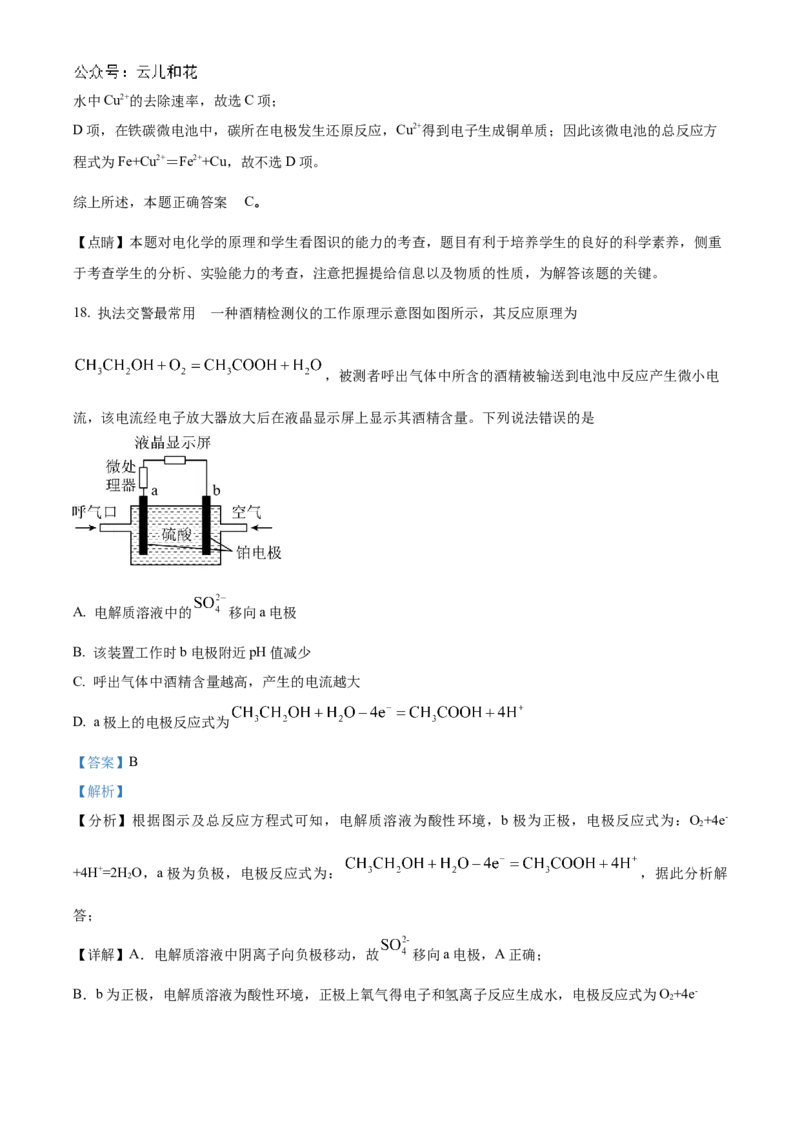
的
18. 执法交警最常用 一种酒精检测仪的工作原理示意图如图所示,其反应原理为
,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电
流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法错误的是
A. 电解质溶液中的 移向a电极
B. 该装置工作时b电极附近pH值减少
C. 呼出气体中酒精含量越高,产生的电流越大
D. a极上的电极反应式为
【答案】B
【解析】
【分析】根据图示及总反应方程式可知,电解质溶液为酸性环境,b极为正极,电极反应式为:O+4e-
2
+4H+=2H O,a极为负极,电极反应式为: ,据此分析解
2
答;
【详解】A.电解质溶液中阴离子向负极移动,故 移向a电极,A正确;
B.b为正极,电解质溶液为酸性环境,正极上氧气得电子和氢离子反应生成水,电极反应式为O+4e-
2+4H+=2H O,b电极附近氢离子浓度减小,pH增大,B错误;
2
C.单位时间内,人呼出的气体中酒精含量越高,酒精失电子数越多,所以微处理器中通过的电流越大,C
正确;
D.a极是负极,CHCHOH失电子发生氧化反应生成CHCOOH,a极的电极反应式为:
3 2 3
,D正确;
答案选B。
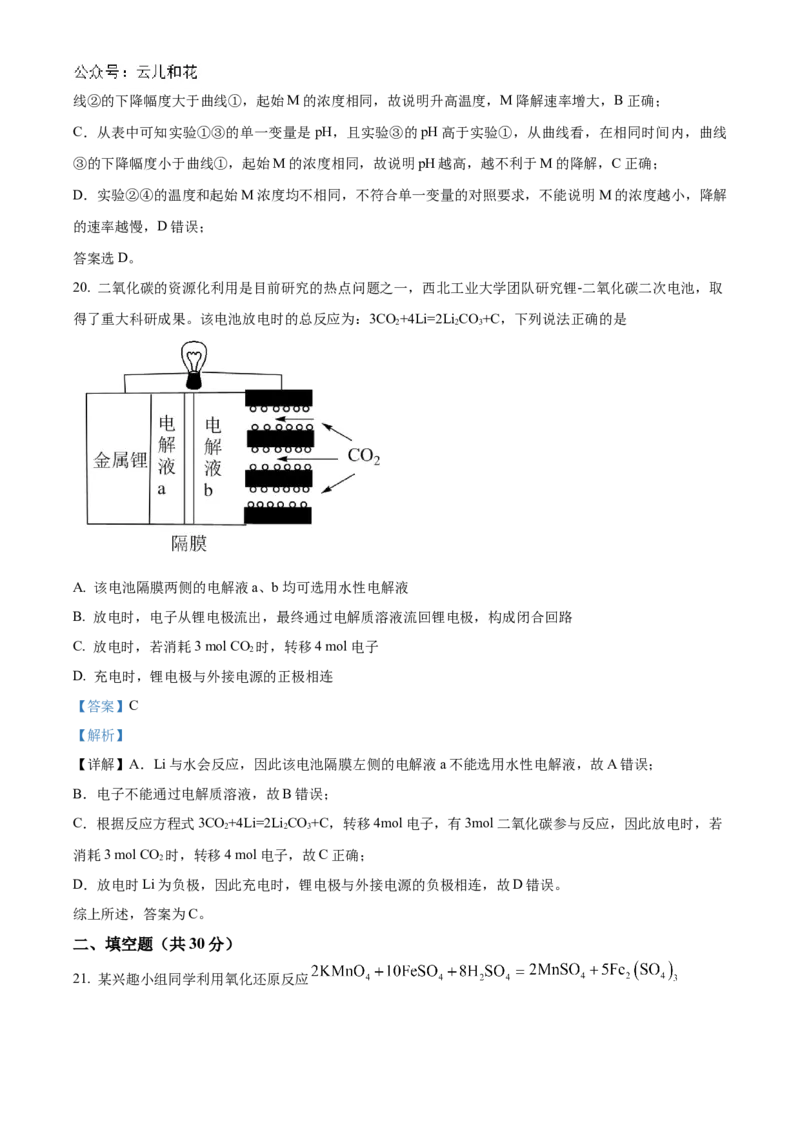
19. 用NaFeO 溶液氧化废水中的还原性污染物 M,为研究降解效果。设计如下对比实验探究温度、浓度、
2 4
pH 对降解速率和效果的影响,实验测得 M 的浓度与时间关系如图所示,下列说法错误的是
实验编号 温度℃ pH
① 25 1
② 45 1
③ 25 7
④ 25 1
A. 实验①在 15min 内 M 的降解速率为 1.33×10-5mol/(L·min)
B. 实验①②说明升高温度,M 降解速率增大
C. 实验①③证明 pH 越高,越不利于 M 的降解
D. 实验②④说明 M 的浓度越小,降解的速率越慢
【答案】D
【解析】
【详解】A.实验①在15min内M的降解速率为 =1.33×10-5mol/(L·min),A正确;
B.从表中可知实验①②的单一变量是温度,且实验②的温度高于实验①,从曲线看,在相同时间内,曲线②的下降幅度大于曲线①,起始M的浓度相同,故说明升高温度,M降解速率增大,B正确;
C.从表中可知实验①③的单一变量是pH,且实验③的pH高于实验①,从曲线看,在相同时间内,曲线
③的下降幅度小于曲线①,起始M的浓度相同,故说明pH越高,越不利于M的降解,C正确;
D.实验②④的温度和起始M浓度均不相同,不符合单一变量的对照要求,不能说明M的浓度越小,降解
的速率越慢,D错误;
答案选D。
20. 二氧化碳的资源化利用是目前研究的热点问题之一,西北工业大学团队研究锂-二氧化碳二次电池,取
得了重大科研成果。该电池放电时的总反应为:3CO+4Li=2Li CO+C,下列说法正确的是
2 2 3
A. 该电池隔膜两侧的电解液a、b均可选用水性电解液
B. 放电时,电子从锂电极流出,最终通过电解质溶液流回锂电极,构成闭合回路
C. 放电时,若消耗3 mol CO 时,转移4 mol电子
2
D. 充电时,锂电极与外接电源的正极相连
【答案】C
【解析】
【详解】A.Li与水会反应,因此该电池隔膜左侧的电解液a不能选用水性电解液,故A错误;
B.电子不能通过电解质溶液,故B错误;
C.根据反应方程式3CO+4Li=2Li CO+C,转移4mol电子,有3mol二氧化碳参与反应,因此放电时,若
2 2 3
消耗3 mol CO 时,转移4 mol电子,故C正确;
2
D.放电时Li为负极,因此充电时,锂电极与外接电源的负极相连,故D错误。
综上所述,答案为C。
二、填空题(共30分)
21. 某兴趣小组同学利用氧化还原反应设计了如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 ,盐桥中
装有饱和 溶液。回答下列问题:
(1)发生氧化反应的烧杯是______(填“甲”或“乙”)。
(2)工作时,盐桥中的 移向______(“甲”或“乙”)烧杯。
(3)甲烧杯中发生的电极反应为______。
【答案】(1)乙 (2)乙
(3) +8H++5e-=Mn2++4H O
2
【解析】
【分析】由 可知,在反应中
Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极;
【小问1详解】
b为负极,亚铁离子失电子生成铁离子,则乙烧杯中发生氧化反应;
【小问2详解】
阴离子向负极移动,则盐桥中的 移向乙烧杯中;
【小问3详解】
甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为 +8H++5e-=Mn2++4H O。
2
22. 二甲醚 被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①②
③
(1)则反应 ______ 。
(2)以下说法能说明反应 达到平衡状态的有______。
A. 和 的浓度之比为3:1
B.单位时间内断裂3个 同时断裂1个
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(3)如图所示装置,装置A是二甲醚燃料电池,已知该装置工作时电子从b极流出,a极流入。
①A池中a电极为电池的______极(填“正或负”),电极反应式为______。
②当装置A中消耗0.25mol二甲醚时,此时转移的电子的物质的量为______;装置A中溶液的pH会
______(填写“增大”“减小”或“不变”)。
【答案】(1)−246.1
(2)BDE (3) ①. 正 ②. O+4e-+2H O=4OH- ③. 3mol ④. 减小
2 2
【解析】
【小问1详解】
根据盖斯定律,①×2+②+③得3H(g)+3CO(g) CHOCH (g)+CO (g),∆H=(-90.7kJmol−1)×2-23.5kJmol−1-
2 3 3 2
41.2kJmol−1=−246.1kJmol−1; ⇌ ⋅ ⋅
【小问⋅2详解】 ⋅
A.H 和CO 的浓度之比为3:1,无法判断二者浓度是否继续变化,则无法判断平衡状态,故A错误;
2 2B.二氧化碳分子中含有2个碳氧双键,单位时间内断裂3个H−H同时生成1个C=O,表示的是正反应速
率,断裂1个 表示逆反应速率,则正逆反应速率相等,能说明达到平衡状态,故B正确;
C.恒温恒容条件下,混合气体的密度为定值,不能根据密度判断平衡状态,故C错误;
D.混合气体的质量不变,混合气体的物质的量为变量,则气体的平均摩尔质量为变量,当气体的平均摩
尔质量保持不变时,表明该反应达到平衡状态,故D正确;
E.该反应为放热反应,绝热体系中,体系的温度为变量,当体系的温度保持不变时,表面正逆反应速率
相等,该反应达到平衡状态,故E正确;
故选BDE;
【小问3详解】
①a为正极,b极是负极,正极上氧气得电子生成氢氧根离子,a电极反应式为:O+4e-+2H O=4OH-;
2 2
②装置A中负极电极反应式为:CHOCH +16OH--12e-=2 +11H O,消耗0.25molCHOCH 时,则转移
3 3 2 3 3
电子为0.25mol×12=3mol,OH-被消耗,所以装置A中溶液的pH会减小。
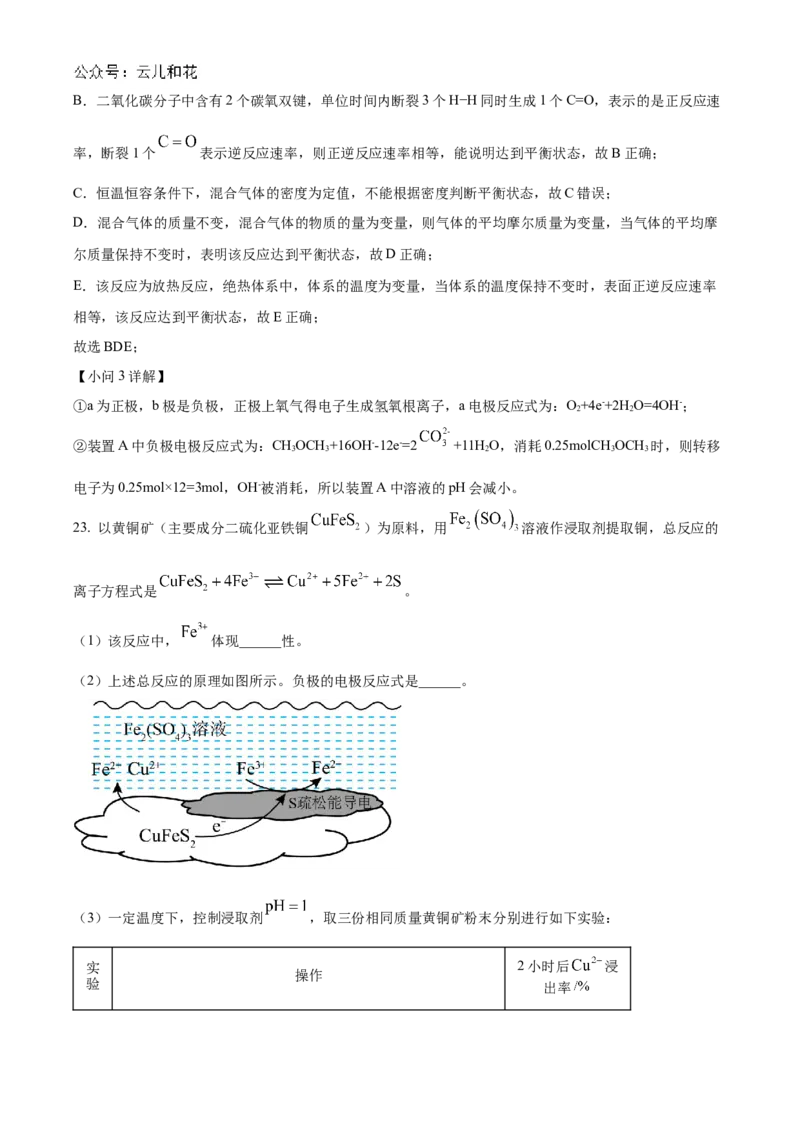
23. 以黄铜矿(主要成分二硫化亚铁铜 )为原料,用 溶液作浸取剂提取铜,总反应的
离子方程式是 。
(1)该反应中, 体现______性。
(2)上述总反应的原理如图所示。负极的电极反应式是______。
(3)一定温度下,控制浸取剂 ,取三份相同质量黄铜矿粉末分别进行如下实验:
实 2小时后 浸
操作
验
出率Ⅰ 加入足量 溶液 78.2
Ⅱ 加入足量 溶液,通入空气 90.8
加入足量 溶液,再加入少量
Ⅲ 98.0
溶液
由实验Ⅲ推测,在浸取 过程中 作催化剂,催化原理是:ⅰ.
,ⅱ. 。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量 溶液,充分混合后静置。取上层清液,加入稀盐
酸,观察到溶液中______,证明发生反应ⅰ。
b.取少量 粉末,加入______溶液,充分混合后静置。取上层清液,加入稀盐酸,有白色沉淀,证明
发生反应ⅱ。
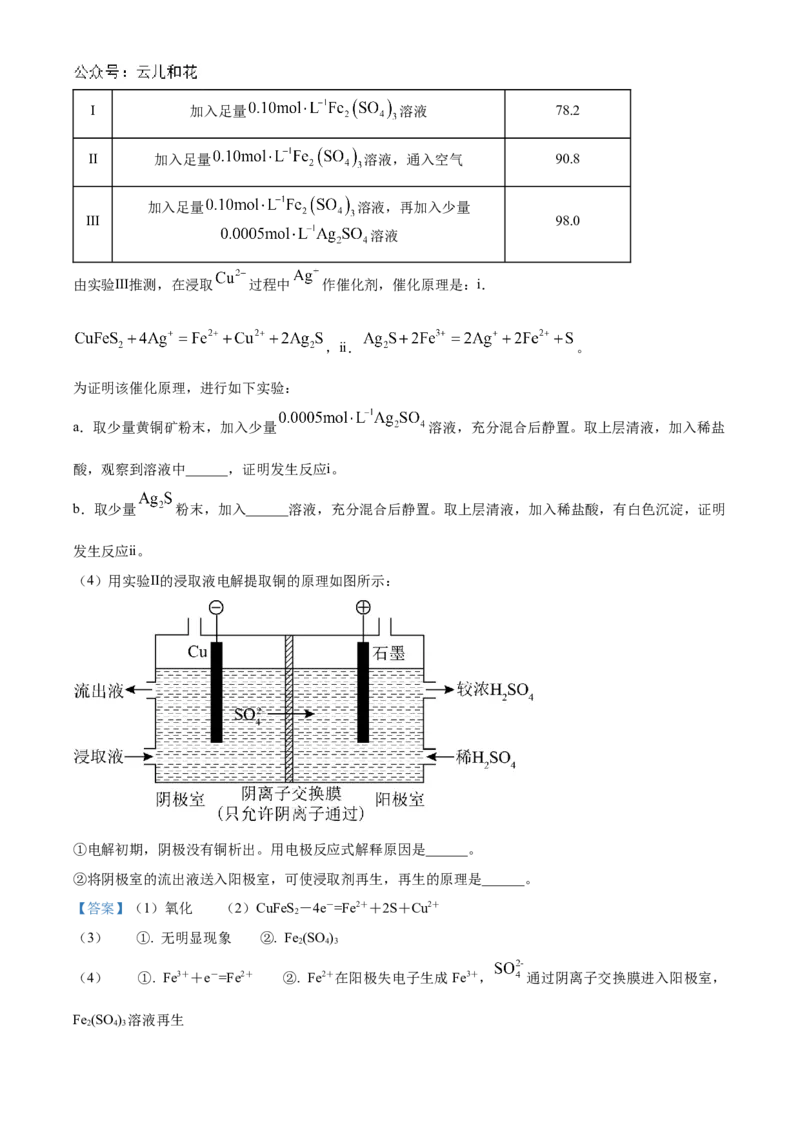
(4)用实验Ⅱ的浸取液电解提取铜的原理如图所示:
①电解初期,阴极没有铜析出。用电极反应式解释原因是______。
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是______。
【答案】(1)氧化 (2)CuFeS-4e-=Fe2++2S+Cu2+
2
(3) ①. 无明显现象 ②. Fe (SO )
2 4 3
(4) ①. Fe3++e-=Fe2+ ②. Fe2+在阳极失电子生成Fe3+, 通过阴离子交换膜进入阳极室,
Fe (SO ) 溶液再生
2 4 3【解析】
【分析】总反应的离子方程式是 ,负极是CuFeS 失电子发生氧化
2
反应,正极是铁离子得电子生成亚铁离子,电极反应式为Fe3++e-=Fe2+;
【小问1详解】
根据离子反应方程式,Fe3+→Fe2+,化合价降低,因此Fe3+表现氧化性;
【小问2详解】
根据原电池的工作原理,失电子的一极为负极,因此CuFeS 作负极,其电极反应式为CuFeS-4e-=Fe2+
2 2
+2S+Cu2+;
【小问3详解】
a.根据反应方程式,Ag+完全反应转化为沉淀,溶液中没有Ag+,因此可通过检验Ag+,判断是否发生了
i;取上层清液,加入稀盐酸,没有沉淀产生,说明溶液中不含Ag+,即说明i发生;
b.根据ii反应,需要加入Fe (SO ) 溶液;
2 4 3
【小问4详解】
①实验Ⅱ中,加入过量Fe (SO ) 溶液,Fe3+过量,因为Fe3+的氧化性强于Cu2+,因此Fe3+先放电,即Fe3+
2 4 3
+e-=Fe2+;
②阳极上发生Fe2+-e-=Fe3+,Fe2+在阳极失电子生成Fe3+, 通过阴离子交换膜进入阳极室,Fe (SO )
2 4 3
溶液再生。