文档内容
四川省 2024—2025 学年上学期期中调研测试
高二化学试卷
试卷共8页,18小题,满分100分。考试用时75分钟。
注意事项:
1.考查范围:选择性必修1第一章至第三章第一节。
2.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡指定位置上。
3.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦千净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
4.考生必须保持答题卡的整洁。考试结束后,请将答题卡交回。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是最符合题目要求的。
1.能源的转化为人类生产生活提供了动力。下列物件在工作过程中主要发生化学能与热能的转化的是(
)
A B C D
硅太阳能电池板 自热火锅发热包 风力发电机 新能源汽车电池
2.勒夏特列原理广泛存在于生产、生活中。下列操作或现象与平衡移动原理无关的是( )
A.夏天,打开冰镇啤酒瓶盖产生大量泡沫
B.在制备乙酸乙酯过程中,加入过量的乙醇
C.实验室可用排饱和食盐水的方法收集 气体
D.月饼中添加由铁粉、氯化钠和活性炭等组成的脱氧剂
3.1868年狄肯和洪特发明了用氯化铜作催化剂,在加热条件下用空气中的氧气和氯化氢反应制氯气的方法,
其原理可表示为 。在不同条件下的化学反应速率如下,其中表
示的反应速率最快的是( )
A. B.
C. D.4.太空“冰雪”实验是将过饱和醋酸钠液体迅速结晶,形成热的“冰球”。下列有关说法正确的是
( )
A.醋酸钠在水中不能全部电离 B.析出的晶体属于共价化合物
C.醋酸钠在熔融状态下不导电 D.结晶形成冰球是一个放热过程
5.已知:共价键 、 、 键能分别为 、 、 ,则
反应 的 等于( )
A. B. C. D.
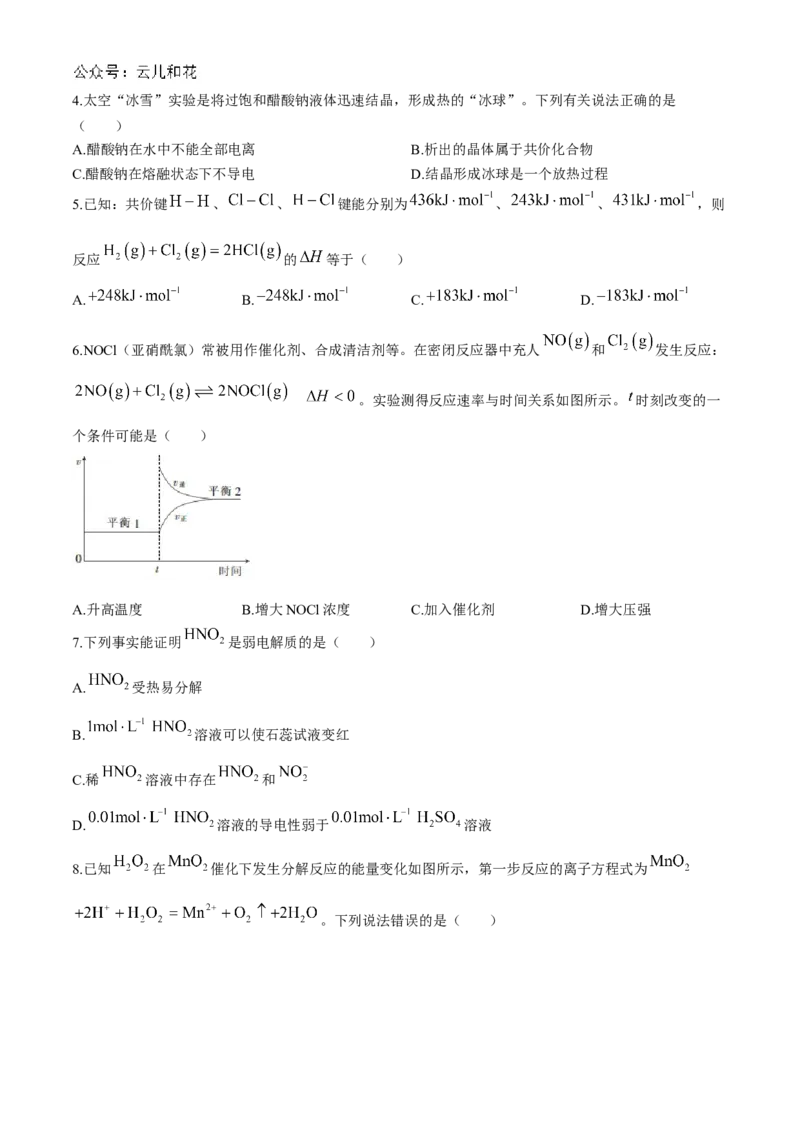
6.NOCl(亚硝酰氯)常被用作催化剂、合成清洁剂等。在密闭反应器中充人 和 发生反应:
。实验测得反应速率与时间关系如图所示。 时刻改变的一
个条件可能是( )
A.升高温度 B.增大NOCl浓度 C.加入催化剂 D.增大压强
7.下列事实能证明 是弱电解质的是( )
A. 受热易分解
B. 溶液可以使石蕊试液变红
C.稀 溶液中存在 和
D. 溶液的导电性弱于 溶液
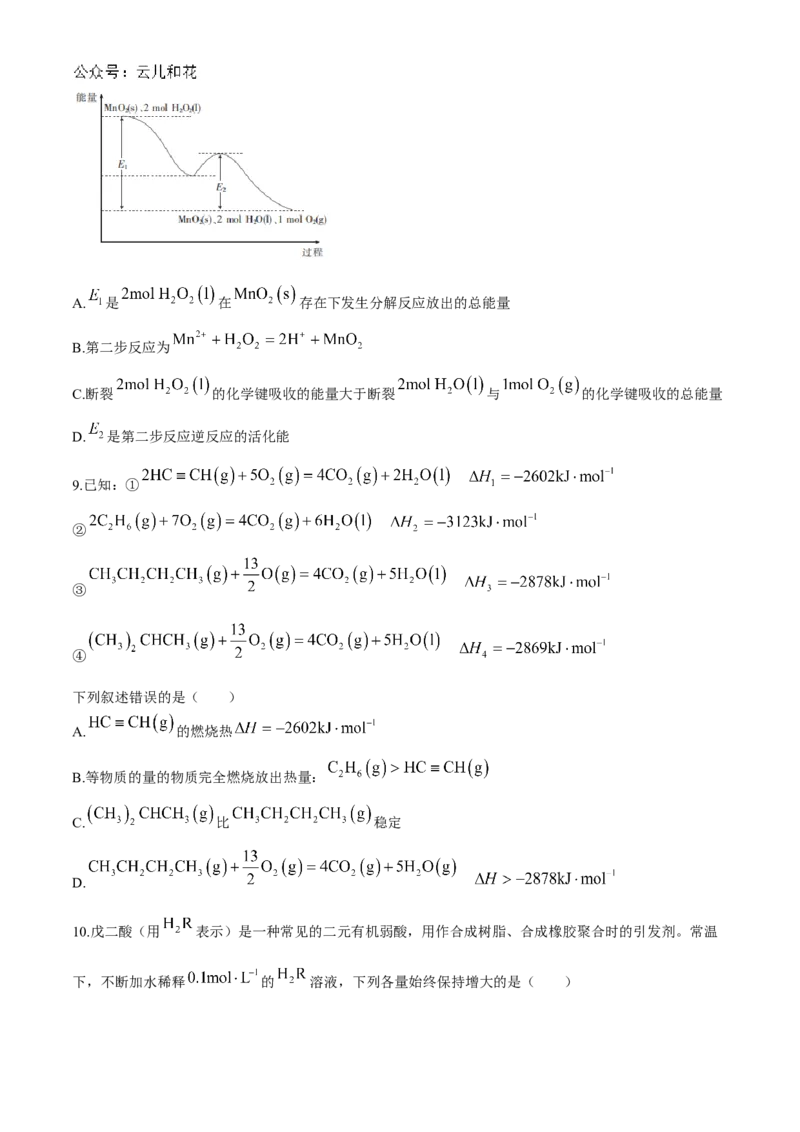
8.已知 在 催化下发生分解反应的能量变化如图所示,第一步反应的离子方程式为
。下列说法错误的是( )A. 是 在 存在下发生分解反应放出的总能量
B.第二步反应为
C.断裂 的化学键吸收的能量大于断裂 与 的化学键吸收的总能量
D. 是第二步反应逆反应的活化能
9.已知:①
②
③
④
下列叙述错误的是( )
A. 的燃烧热
B.等物质的量的物质完全燃烧放出热量:
C. 比 稳定
D.
10.戊二酸(用 表示)是一种常见的二元有机弱酸,用作合成树脂、合成橡胶聚合时的引发剂。常温
下,不断加水稀释 的 溶液,下列各量始终保持增大的是( )A. B. C. D.
11.根据下列操作及现象不能得到相应结论的是( )
选项 操作及现象 结论
(橙色)
向 溶液中滴加5滴
A
(橙色) ,
溶液,黄色加深
平衡转化率增大
向量热计的内筒中加入 硫酸,再加入
稀硫酸与 发生中和反应
B 溶液,测量反应后体系的温 生成0.01mol液态水,还生成
度,测得该反应放出的热量大于0.573kJ(实验前已分别测
沉淀,额外放出热量
量酸和碱的温度)
其他条件相同, 溶液和 溶液反应, 当其他条件不变时,增大反应物的
C
浓度,化学反应速率减小
溶液浓度越大,析出硫沉淀所需时间越短
向 双氧水中加入0.5g铁红,产生气泡速率加快
D 铁红能做双氧水分解反应的催化剂
(反应后铁红仍为0.5g)
12. 时,向刚性密闭容器加入足量铁粉和1mol的水蒸气,发生反应:
,达到平衡后,固体增重12g。下列说法错误的是( )
A.平衡后移走FeO,平衡不移动
B.700℃时,该反应平衡常数
C.平衡后再通入1mol水蒸气,再次达到平衡时水蒸气的转化率降低
D.断裂 键的同时断裂 键,此时正、逆反应速率相等
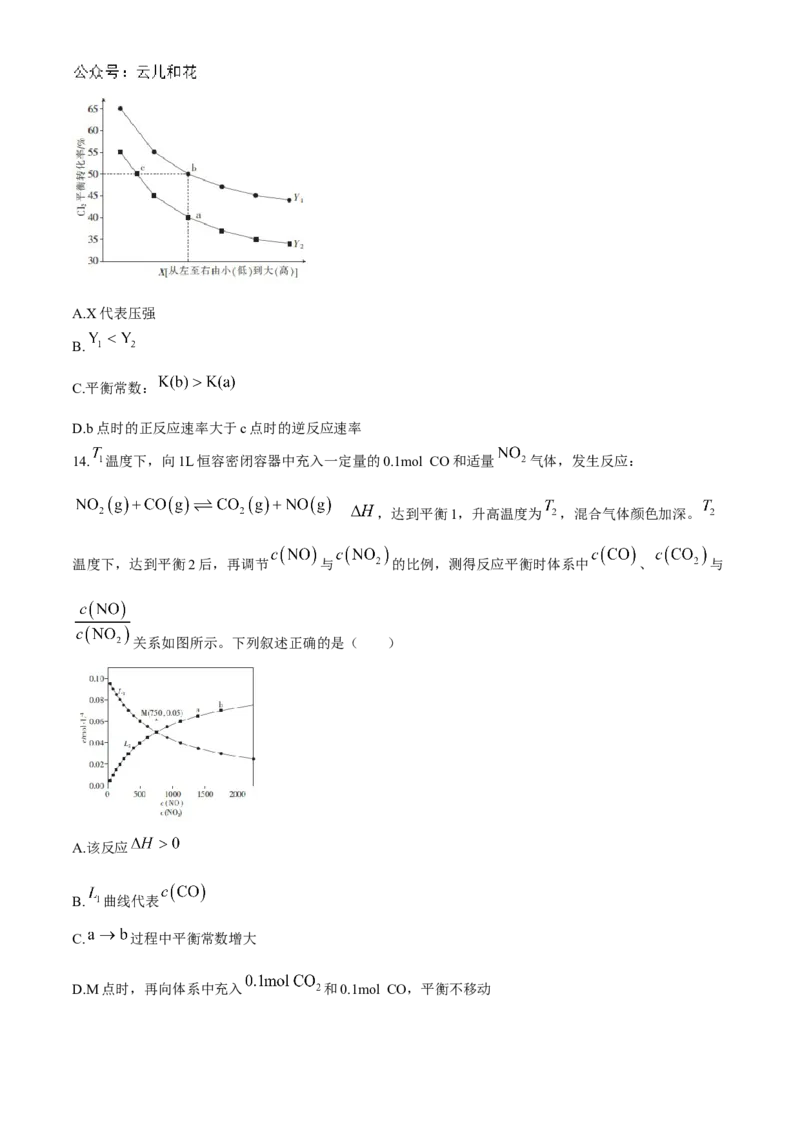
13.三氯氧钒( )主要用作溶剂、烯烃聚合的催化剂。合成原理是
(g) 。在密闭反应器中充入足量 、 和 发
生上述反应,测得 平衡转化率与温度、压强关系如图所示。下列叙述正确的是( )A.X代表压强
B.
C.平衡常数:
D.b点时的正反应速率大于c点时的逆反应速率
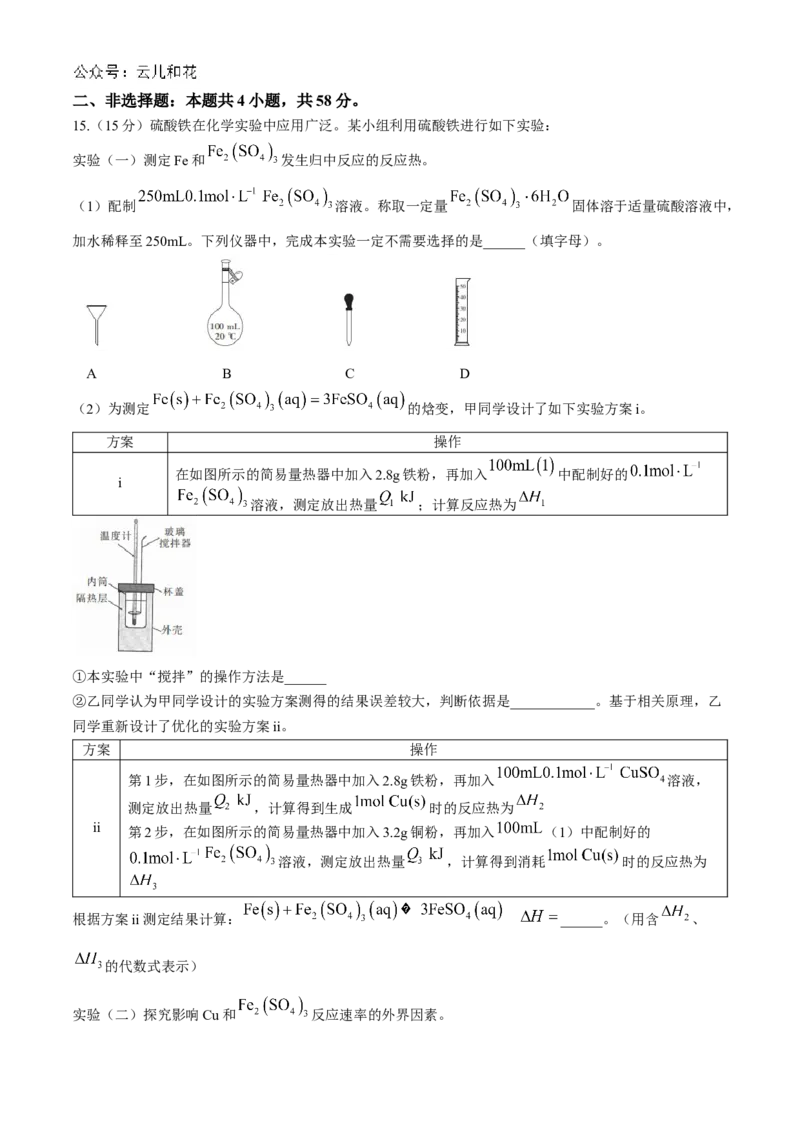
14. 温度下,向1L恒容密闭容器中充入一定量的0.1mol CO和适量 气体,发生反应:
,达到平衡1,升高温度为 ,混合气体颜色加深。
温度下,达到平衡2后,再调节 与 的比例,测得反应平衡时体系中 、 与
关系如图所示。下列叙述正确的是( )
A.该反应
B. 曲线代表
C. 过程中平衡常数增大
D.M点时,再向体系中充入 和0.1mol CO,平衡不移动二、非选择题:本题共4小题,共58分。
15.(15分)硫酸铁在化学实验中应用广泛。某小组利用硫酸铁进行如下实验:
实验(一)测定Fe和 发生归中反应的反应热。
(1)配制 溶液。称取一定量 固体溶于适量硫酸溶液中,
加水稀释至250mL。下列仪器中,完成本实验一定不需要选择的是______(填字母)。
A B C D
(2)为测定 的焓变,甲同学设计了如下实验方案i。
方案 操作
在如图所示的简易量热器中加入2.8g铁粉,再加入 中配制好的
i
溶液,测定放出热量 ;计算反应热为
①本实验中“搅拌”的操作方法是______
②乙同学认为甲同学设计的实验方案测得的结果误差较大,判断依据是____________。基于相关原理,乙
同学重新设计了优化的实验方案ii。
方案 操作
第1步,在如图所示的简易量热器中加入2.8g铁粉,再加入 溶液,
测定放出热量 ,计算得到生成 时的反应热为
ii
第2步,在如图所示的简易量热器中加入3.2g铜粉,再加入 (1)中配制好的
溶液,测定放出热量 ,计算得到消耗 时的反应热为
根据方案ii测定结果计算: ______。(用含 、
的代数式表示)
实验(二)探究影响Cu和 反应速率的外界因素。实 纯铜粉质 水 水浴 测定铜粉完全溶解所用时
验 量/g 体积/mL 体积/mL 温度/℃ 间/min
Ⅰ 0.3 60 0 35℃
Ⅱ 0.3 50 35℃
Ⅲ 0.3 60 0 45℃
(3)上述反应的离子方程式为______;实验中, ______。
(4)设计实验Ⅰ、Ⅱ的目的是______。
(5)实验结果: ,由此可推出的实验结论是______。
16.(14分) 时,几种弱酸的电离平衡常数如表所示,请回答下列问题。
弱酸 电离平衡常数(25℃)
HA
、
HC
、
(1) 时,浓度均为 的下列四种溶液中 最大的是______(填字母)。
A.HA B. C.HC D.
(2)写出 分步电离的电离方程式:______。
(3) 时,等体积、电离出的 相同的HA和HC溶液分别与形状完全相同的足量Zn粒反应生成
:
①起始时,两溶液中: ______ (填“>”“<”或“=”,下同)。
②生成 的起始速率: ______
③反应完全后,生成 的质量: ______ 。
(4)计算 时 的平衡常数 ______-
(5)向NaC溶液中加入少量 的离子方程式为______
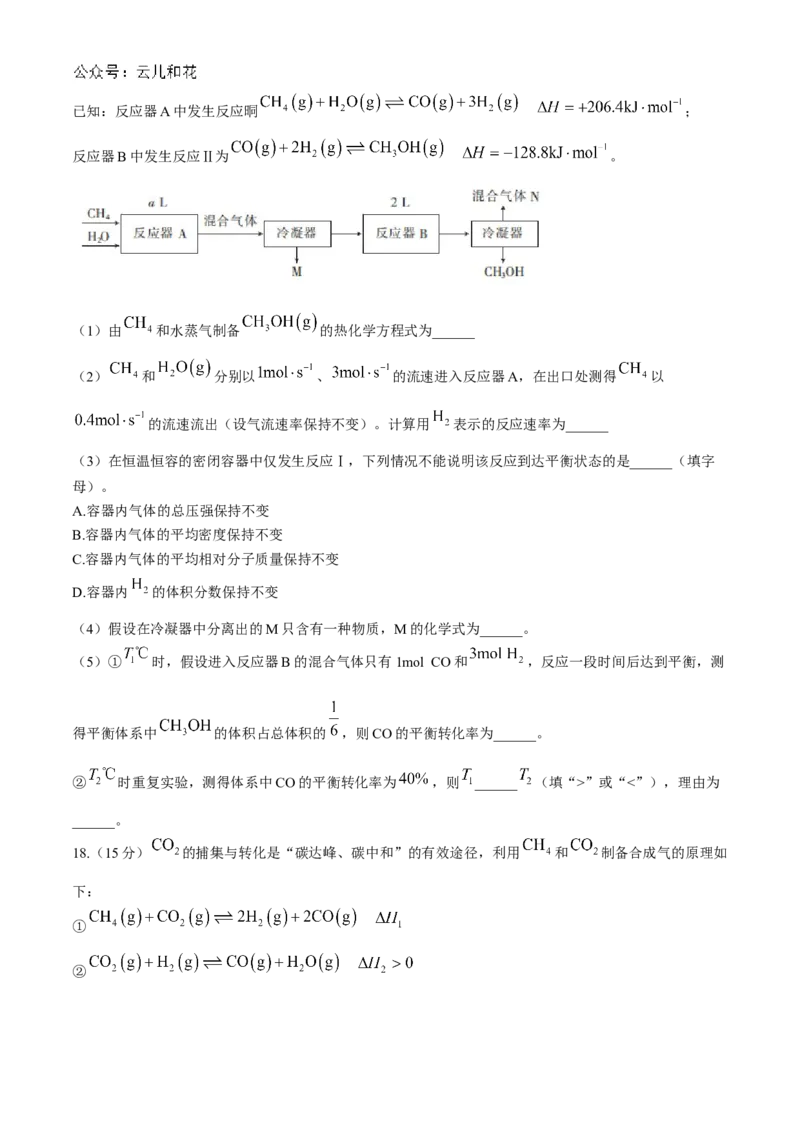
17.(14分)甲醇不但是重要的化工原料,还是优良的能源和车用燃料。某科研小组设计如下合成工艺:已知:反应器A中发生反应晍 ;
反应器B中发生反应Ⅱ为 。
(1)由 和水蒸气制备 的热化学方程式为______
(2) 和 分别以 、 的流速进入反应器A,在出口处测得 以
的流速流出(设气流速率保持不变)。计算用 表示的反应速率为______
(3)在恒温恒容的密闭容器中仅发生反应Ⅰ,下列情况不能说明该反应到达平衡状态的是______(填字
母)。
A.容器内气体的总压强保持不变
B.容器内气体的平均密度保持不变
C.容器内气体的平均相对分子质量保持不变
D.容器内 的体积分数保持不变
(4)假设在冷凝器中分离出的M只含有一种物质,M的化学式为______。
(5)① 时,假设进入反应器B的混合气体只有1mol CO和 ,反应一段时间后达到平衡,测
得平衡体系中 的体积占总体积的 ,则CO的平衡转化率为______。
② 时重复实验,测得体系中CO的平衡转化率为 ,则 ______ (填“>”或“<”),理由为
______。
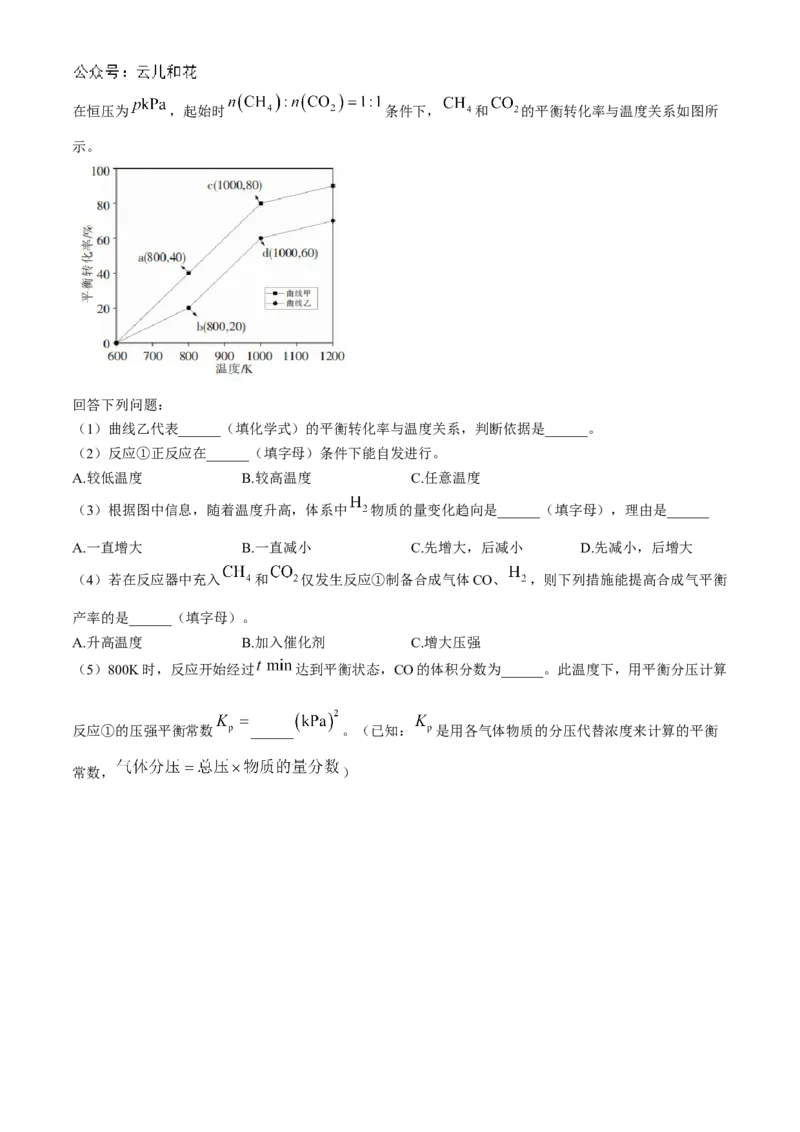
18.(15分) 的捕集与转化是“碳达峰、碳中和”的有效途径,利用 和 制备合成气的原理如
下:
①
②在恒压为 ,起始时 条件下, 和 的平衡转化率与温度关系如图所
示。
回答下列问题:
(1)曲线乙代表______(填化学式)的平衡转化率与温度关系,判断依据是______。
(2)反应①正反应在______(填字母)条件下能自发进行。
A.较低温度 B.较高温度 C.任意温度
(3)根据图中信息,随着温度升高,体系中 物质的量变化趋向是______(填字母),理由是______
A.一直增大 B.一直减小 C.先增大,后减小 D.先减小,后增大
(4)若在反应器中充入 和 仅发生反应①制备合成气体CO、 ,则下列措施能提高合成气平衡
产率的是______(填字母)。
A.升高温度 B.加入催化剂 C.增大压强
(5)800K时,反应开始经过 达到平衡状态,CO的体积分数为______。此温度下,用平衡分压计算
反应①的压强平衡常数 ______ 。(已知: 是用各气体物质的分压代替浓度来计算的平衡
常数, )四川省2024—2025学年上学期期中调研测试
高二化学参考答案
1.【答案】B
【解析】硅太阳能电池板发电过程是太阳能转化为电能,A项不符合题意;自热火锅发热包工作过程是化
学能转化为热能,B项符合题意;风力发电过程是风能转化为电能,C项不符合题意;新能源汽车电池放
电过程是化学能转化为电能,充电过程是电能转化为化学能,D项不符合题意。
2.【答案】D
【解析】减小压强,平衡向气体分子数增大的方向移动,促进碳酸分解逸出 ,A项不符合题意;加入
过量乙醇,平衡向生成乙酸乙酯的方向移动,B项不符合题意; 溶于水存在平衡:
,饱和食盐水中含有 , 浓度增大,上述平衡逆向移动,导致
的消耗量和溶解度减小,故实验室可用排饱和食盐水的方法收集 气体,能用勒夏特列原理解释,C
项不符合题意;脱氧剂是为了防止月饼被氧化,与平衡移动无关,D项符合题意。
3.【答案】A
【解析】将选项中的反应速率都换成用 表示的反应速率,并且用同一单位,在同一化学反应中,不同
物质的反应速率之比等于其化学计量系数之比,A项 ;B项
;C项 ;D项
综上所述,A项表示的反应速率最快。
4.【答案】D
【解析】醋酸钠在水中能完全电离,属于强电解质,A项错误;析出的晶体为醋酸钠,醋酸钠为离子化合
物,B项错误;醋酸钠为离子化合物,熔融状态下能导电,C项错误;由形成热的“冰球”可知,结晶是
一个放热过程,D项正确。
5.【答案】D
【解析】反应热等于断裂共价键的键能与形成共价键的键能之差,
,D项正确。
6.【答案】B
【解析】观察图像可知,改变条件,逆反应速率“突增”,正反应速率“渐增”。逆反应速率大于正反应速率,平衡向逆反应方向移动。升高温度,正、逆反应速率都“突增”,A项不符合题意;增大NOCl浓
度,逆反应速率“突增”,正反应速率在原点基础上“渐增”,平衡向逆反应方向移动,B项符合题意;
加入催化剂,正、逆反应速率同倍数增大,平衡不移动,C项不符合题意;增大压强,正、逆反应速率都
“突增”,平衡向正反应方向移动,D项不符合题意。
7.【答案】C
【解析】热稳定性与强酸弱酸无关,如HI为强酸,但是受热也易分解,A项不符合题意;
溶液能使石蕊试液变红,说明 溶液能电离出H⁺使溶液显酸性,但不能证明其是弱
电解质,B项不符合题意;稀 溶液中存在 和 ,说明 在水中部分电离,属于弱电
解质,C项符合题意; 是一元酸,硫酸是二元酸,D项不符合题意。
8.【答案】C
【解析】 是生成物与反应物的能量差,故是 分解反应放出的总能量,A项正确;结合总
反应式和题中给的第一步反应式可写出第二步反应式为 ,B项正确;由图
像可知该反应是放热反应,反应物总键能小于生成物总键能,C项错误; 是第二步反应的活化分子与生
成物的能量差,是第二步反应逆反应的活化能,D项正确。
9.【答案】A
【解析】 燃烧热指在101kPa时,1mol 完全燃烧生成 和 时
所放出的热量, ,A项错误;根据热化学方程式可知, 和
完全燃烧, 放出热量较多,B项正确;由 可知
本身所含能量高,物质本身能量越低越稳定,C项正确;液态水变为气态水时要吸
收热量,D项正确。
10.【答案】B
【解析】加水稀释过程中,溶液酸性减弱, 减小, ,
,A、C项保持减小; ,B项保持增大;,D项保持不变。
11.【答案】C
【解析】加入NaOH溶液,消耗 ,使平衡正向移动, 平衡转化率增大,A项正确;
硫酸与 溶液反应生成0.01mol液态水,还生成 沉
淀,额外放出热量,故测得放出的热量大于0.573kJ,B项正确; 是反应物,其他条件相同,
溶液浓度越大,析出硫沉淀所需时间越短,说明其他条件不变时,增大反应物浓度,化学反应速
率加快,C项错误;铁红反应前后质量不变,化学性质不变,故铁红做双氧水分解时的催化剂,D项正确。
12.【答案】C
【解析】FeO是纯固体,平衡后移走FeO,平衡不移动,A项正确;列三段式:
解得 ,即平衡时 , , ,B项
正确;该反应为反应前后气体体积不变的反应,平衡后再通入1mol水蒸气,再次达到平衡时水蒸气的转
化率不变,C项错误;断裂2mol H—O键的同时断裂1mol H—H键,此时正、逆反应速率相等,达到平
衡,D项正确。
13.【答案】D
【解析】该反应的正反应是气体分子数减小的反应,也是放热反应,若 代表压强,增大压强,平衡正向
移动, 平衡转化率增大,与图像不符,故 代表温度,升高温度,平衡逆向移动,氯气平衡转化率降
低,与图像相符,A项错误; 代表压强,增大压强, 平衡转化率增大,则 ,B项错误;a点
和b点对应温度相等,平衡常数相等,C项错误;b点相当于在c点的基础上加压升温后达到了新平衡,正、
逆反应速率均比原平衡大,D项正确。
14.【答案】D
【解析】平衡后升高温度,气体颜色加深,说明平衡逆向移动,即正反应是放热反应,A项错误;根据
,当 减小, 增大时, 增大,结合图像可知, 代表, 代表 ,B项错误;a→b过程中,温度不变,平衡常数不变,C项错误;根据M点计
算, ,则 ,故M点时再充入
和0.1mol CO,平衡不移动,D项正确。
15.【答案】(1)AB(2分,选对1个得1分,多选或错选不得分)
(2)①上下移动玻璃搅拌器(1分)
②铁粉过量,且硫酸铁溶液中含硫酸,铁粉与硫酸反应会有气体生成,对实验造成干扰(2分,答到Fe会
与稀硫酸反应即可得2分) (2分)
(3) (2分,物质错误不得分,未配平扣1分) 10(2分)
(4)探究浓度对反应速率的影响(2分,合理即可)
(5)其他条件相同(1分),升高温度,反应速率增大(1分)
【解析】(1)配制250mL溶液,不需要漏斗和100mL容量瓶,A、B项符合题意。
(2)②甲的实验方案误差较大是因为铁粉过量,(1)中配制好的硫酸铁溶液含硫酸,铁粉与硫酸反应会
有气体生成,对实验造成干扰;方案ii中,发生两个反应:
, ,根据盖斯定律,加合得到总反
应: 。
(3)根据控制变量实验要求,只改变一个变量,溶液体积必须相等,便于判断。
(4)设计实验Ⅰ、Ⅱ的目的是探究浓度对反应速率的影响。
(5)由 知,其他条件不变时,升高温度,反应速率增大。
16.【答案】(1)D(2分)
(2) 、 (2分,写对1个得1分,未写“
⇌
”不得分)
(3)①=(2分) ②=(2分) ③<(2分)
(4)600(或 ,2分)
(5) (2分,物质错误不得分,未配平扣1分)
【解析】(1)溶液中 最大,则酸性最强,其相应的电离平衡常数最大,D项符合题意。(2) 为二元弱酸,分步电离: ; 。
(3)①由HA和HC溶液电离出的 相同可知 的浓度和 的浓度相同;②两种酸溶液与Zn反应
的本质是电离出的氢离子与Zn反应,故两溶液与Zn反应的初始速率相同;③由于HA的电离平衡常数大
于HC,故两者电离出等浓度的氢离子,HA的浓度小于HC的浓度,故最终HA溶液生成 的质量小于
HC溶液生成 的质量。
(4)HA、HC的电离方程式分别为 、 ;故 ,
。
(5)由表可知,酸性: ,向NaC溶液中加入少量 的离子方程式为
。
17.【答案】(1) (2分,物质或数据错误不得分,漏写物
质状态或单位扣1分,未写“
⇌
”不扣分)
(2) (2分,漏写单位扣1分)
(3)B(2分) (4) (2分) (5)①50%(2分,写0.5也给分)
②<(2分)该反应为放热反应,升高温度,平衡逆向移动,CO的平衡转化率减小(2分,合理即可)
【解析】(1)根据盖斯定律,①+②得:
。
(2)根据反应器A中的反应方程式和进、出口 的流速可知:
。
(3)恒温恒容密闭容器中,该反应前后全部为气体,当气体平均密度不再改变时不能表明反应达到平衡
状态,B项符合题意。(4)根据图示可知,从冷凝器中分离出来的物质为 。
(5)①反应器B中发生反应Ⅱ,设 ℃下反应达到平衡时转化x mol CO,根据三段式:
起始(mol): 1 3 0
转化(mol):
平衡(mol):
根据题意: ,解得 ;则CO的转化率为 ;②该
反应为放热反应,升高温度,平衡逆向移动,CO的平衡转化率减小,故 。
18.【答案】(1) (1分)反应①中 和 的平衡转化率相等,反应②又消耗了 ,故相同
温度下, 平衡转化率大于 (2分,合理即可)
(2)B(2分) (3)A(2分)根据图中数据可知,反应①生成的 物质的量比反应②消耗的 物质
的量多(2分,合理即可)
(4)A(2分) (5)25%(2分,写(0.25或 也给分) (2分)
【解析】(1)观察反应式可知,反应①中 和 的平衡转化率相等,反应②又消耗了 ,故相
同温度下, 平衡转化率大于 ,图像中相同温度下曲线甲代表的转化率大于曲线乙,故曲线甲代
表 平衡转化率与温度关系,乙代表 平衡转化率与温度关系。
(2)随着温度升高, 平衡转化率增大,说明反应①是吸热反应,反应①正反应是气体分子数增大的
反应,即熵增反应,在较高温度下正反应能自发进行。
(3)根据图中数据可知,反应①生成的 物质的量比反应②消耗的 物质的量多,故氢气物质的量一
直增大。
(4)升温,反应①平衡正向移动;加入催化剂,反应①平衡不移动;增大压强,反应①平衡逆向移动,
故A项符合题意。(5)设初始时 ,三段式计算如下:
①
始(mol) 0 0
转(mol)
平(mol)
②
始(mol) 0
转(mol)
平(mol)
800K时, 、 平衡转化率分别为40%、20%,有 , ,解得: 。
平衡时气体物质的量:
气体 CO
物质的量
气体总物质的量为2.4a。CO的体积分数 ;
压强平衡常数: 。