文档内容
哈师大附中 2023-2024 学年度高二下学期联合期末考试
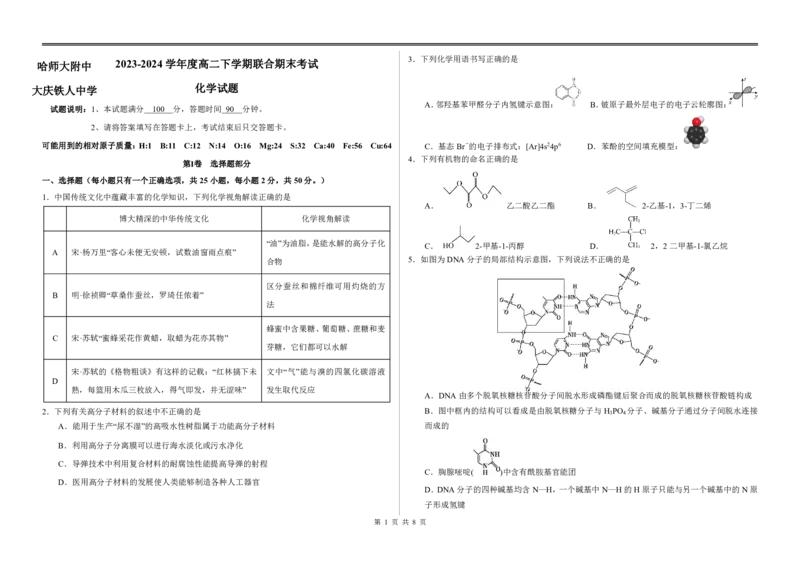
3.下列化学用语书写正确的是
化学试题
大庆铁人中学
A.邻羟基苯甲醛分子内氢键示意图: B.铍原子最外层电子的电子云轮廓图:
试题说明:1、本试题满分 100 分,答题时间 90 分钟。
2、请将答案填写在答题卡上,考试结束后只交答题卡。
可能用到的相对原子质量:H:1 B:11 C:12 N:14 O:16 Mg:24 S:32 Ca:40 Fe:56 Cu:64 C.基态Br-的电子排布式:[Ar]4s24p6 D.苯酚的空间填充模型:
4.下列有机物的命名正确的是
第Ⅰ卷 选择题部分
一、选择题(每小题只有一个正确选项,共25小题,每小题2分,共50分。)
1.中国传统文化中蕴藏丰富的化学知识,下列化学视角解读正确的是
A. 乙二酸乙二酯 B. 2-乙基-1,3-丁二烯
博大精深的中华传统文化 化学视角解读
“油”为油脂,是能水解的高分子化
C. 2-甲基-1-丙醇 D. 2,2二甲基-1-氯乙烷
A 宋·杨万里“客心未便无安顿,试数油窗雨点痕”
合物 5.如图为DNA分子的局部结构示意图,下列说法不正确的是
区分蚕丝和棉纤维可用灼烧的方
B 明·徐祯卿“草桑作蚕丝,罗琦任侬着”
法
蜂蜜中含果糖、葡萄糖、蔗糖和麦
C 宋·苏轼“蜜蜂采花作黄蜡,取蜡为花亦其物”
芽糖,它们都可以水解
宋·苏轼的《格物粗谈》有这样的记载:“红林搞下未 文中“气”能与溴的四氯化碳溶液
D
熟,每篮用木瓜三枚放入,得气即发,并无涩味” 发生取代反应
A.DNA由多个脱氧核糖核苷酸分子间脱水形成磷酯键后聚合而成的脱氧核糖核苷酸链构成
2.下列有关高分子材料的叙述中不正确的是 B.图中框内的结构可以看成是由脱氧核糖分子与H
3
PO
4
分子、碱基分子通过分子间脱水连接
A.能用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 而成的
B.利用高分子分离膜可以进行海水淡化或污水净化
C.导弹技术中利用复合材料的耐腐蚀性能提高导弹的射程
C.胸腺嘧啶( )中含有酰胺基官能团
D.医用高分子材料的发展使人类能够制造各种人工器官
D.DNA分子的四种碱基均含N—H,一个碱基中N—H的H原子只能与另一个碱基中的N原
子形成氢键
第 1 页 共 8 页
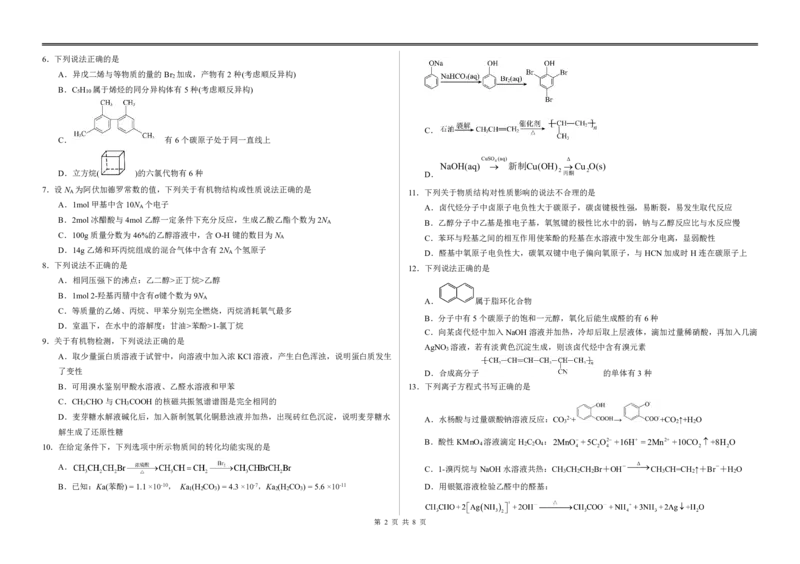
{#{QQABZYQQogAgAIIAAAgCQQ0qCgKQkACACSgOwAAMoAAAgAFABAA=}#}6.下列说法正确的是
A.异戊二烯与等物质的量的Br 加成,产物有2种(考虑顺反异构)
2
B.C H 属于烯烃的同分异构体有5种(考虑顺反异构)
5 10
C.
C. 有6个碳原子处于同一直线上
CuSO 4 (aq) Δ
NaOH(aq) 新制Cu(OH) Cu O(s)
D.立方烷( )的六氯代物有6种 D. 2丙酮 2
7.设N
A
为阿伏加德罗常数的值,下列关于有机物结构或性质说法正确的是
11.下列关于物质结构对性质影响的说法不合理的是
A.1mol甲基中含10N
A
个电子
A.卤代烃分子中卤原子电负性大于碳原子,碳卤键极性强,易断裂,易发生取代反应
B.2mol冰醋酸与4mol乙醇一定条件下充分反应,生成乙酸乙酯个数为2N
A B.乙醇分子中乙基是推电子基,氧氢键的极性比水中的弱,钠与乙醇反应比与水反应慢
C.100g质量分数为46%的乙醇溶液中,含O-H键的数目为N
A C.苯环与羟基之间的相互作用使苯酚的羟基在水溶液中发生部分电离,显弱酸性
D.14g乙烯和环丙烷组成的混合气体中含有2N
A
个氢原子
D.醛基中氧原子电负性大,碳氧双键中电子偏向氧原子,与HCN加成时H连在碳原子上
8.下列说法不正确的是
12.下列说法正确的是
A.相同压强下的沸点:乙二醇>正丁烷>乙醇
B.1mol2-羟基丙腈中含有σ键个数为9N
A A. 属于脂环化合物
C.等质量的乙烯、丙烷、甲苯分别完全燃烧,丙烷消耗氧气最多
B.分子中有5个碳原子的饱和一元醇,氧化后能生成醛的有6种
D.室温下,在水中的溶解度:甘油>苯酚>1-氯丁烷
C.向某卤代烃中加入NaOH溶液并加热,冷却后取上层液体,滴加过量稀硝酸,再加入几滴
9.关于有机物检测,下列说法正确的是
AgNO 溶液,若有淡黄色沉淀生成,则该卤代烃中含有溴元素
3
A.取少量蛋白质溶液于试管中,向溶液中加入浓KCl溶液,产生白色浑浊,说明蛋白质发生
了变性 D.合成高分子 的单体有3种
B.可用溴水鉴别甲酸水溶液、乙醛水溶液和甲苯 13.下列离子方程式书写正确的是
C.CH CHO与CH COOH的核磁共振氢谱谱图是完全相同的
3 3
D.麦芽糖水解液碱化后,加入新制氢氧化铜悬浊液并加热,出现砖红色沉淀,说明麦芽糖水
A.水杨酸与过量碳酸钠溶液反应:CO 2-+ → +CO ↑+H O
3 2 2
解生成了还原性糖
B.酸性KMnO 溶液滴定H C O :2MnO+5C O2+16H+ =2Mn2++10CO +8H O
10.在给定条件下,下列选项中所示物质间的转化均能实现的是 4 2 2 4 4 2 4 2 2
A. C.1-溴丙烷与NaOH水溶液共热:CH CH CH Br+OH- CH CH=CH ↑+Br-+H O
3 2 2 3 2 2
B.已知:Ka(苯酚)=1.1×10-10, Ka (H CO )=4.3×10-7,Ka (H CO )=5.6×10-11 D.用银氨溶液检验乙醛中的醛基:
1 2 3 2 2 3
第 2 页 共 8 页
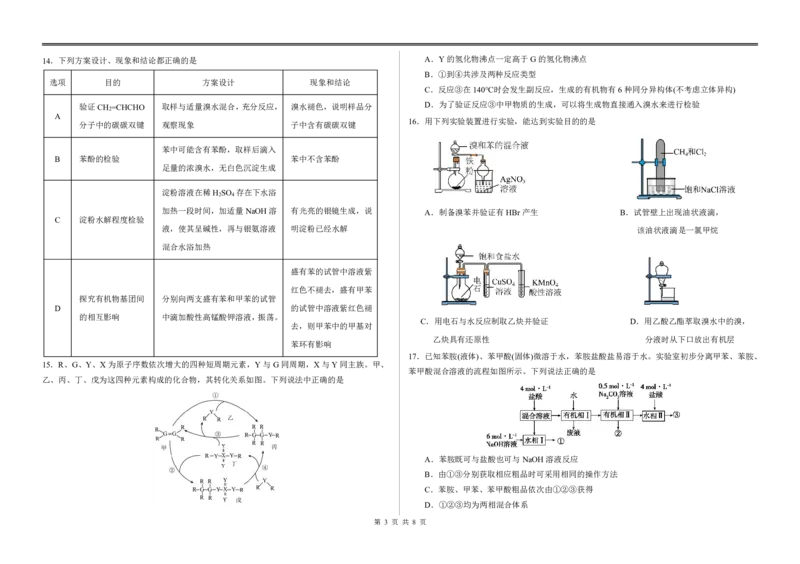
{#{QQABZYQQogAgAIIAAAgCQQ0qCgKQkACACSgOwAAMoAAAgAFABAA=}#}14.下列方案设计、现象和结论都正确的是 A.Y的氢化物沸点一定高于G的氢化物沸点
B.①到④共涉及两种反应类型
选项 目的 方案设计 现象和结论
C.反应③在140℃时会发生副反应,生成的有机物有6种同分异构体(不考虑立体异构)
验证CH =CHCHO 取样与适量溴水混合,充分反应, 溴水褪色,说明样品分 D.为了验证反应③中甲物质的生成,可以将生成物直接通入溴水来进行检验
2
A
16.用下列实验装置进行实验,能达到实验目的的是
分子中的碳碳双键 观察现象 子中含有碳碳双键
苯中可能含有苯酚,取样后滴入
B 苯酚的检验 苯中不含苯酚
足量的浓溴水,无白色沉淀生成
淀粉溶液在稀H SO 存在下水浴
2 4
加热一段时间,加适量NaOH溶 有光亮的银镜生成,说 A.制备溴苯并验证有HBr产生 B.试管壁上出现油状液滴,
C 淀粉水解程度检验
液,使其呈碱性,再与银氨溶液 明淀粉已经水解 该油状液滴是一氯甲烷
混合水浴加热
盛有苯的试管中溶液紫
红色不褪去,盛有甲苯
探究有机物基团间 分别向两支盛有苯和甲苯的试管
D 的试管中溶液紫红色褪
的相互影响 中滴加酸性高锰酸钾溶液,振荡。
C.用电石与水反应制取乙炔并验证 D.用乙酸乙酯萃取溴水中的溴,
去,则甲苯中的甲基对
乙炔具有还原性 分液时从下口放出有机层
苯环有影响
17.已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。实验室初步分离甲苯、苯胺、
15.R、G、Y、X为原子序数依次增大的四种短周期元素,Y与G同周期,X与Y同主族。甲、
苯甲酸混合溶液的流程如图所示。下列说法正确的是
乙、丙、丁、戊为这四种元素构成的化合物,其转化关系如图。下列说法中正确的是
A.苯胺既可与盐酸也可与NaOH溶液反应
B.由①③分别获取相应粗品时可采用相同的操作方法
C.苯胺、甲苯、苯甲酸粗品依次由①②③获得
D.①②③均为两相混合体系
第 3 页 共 8 页
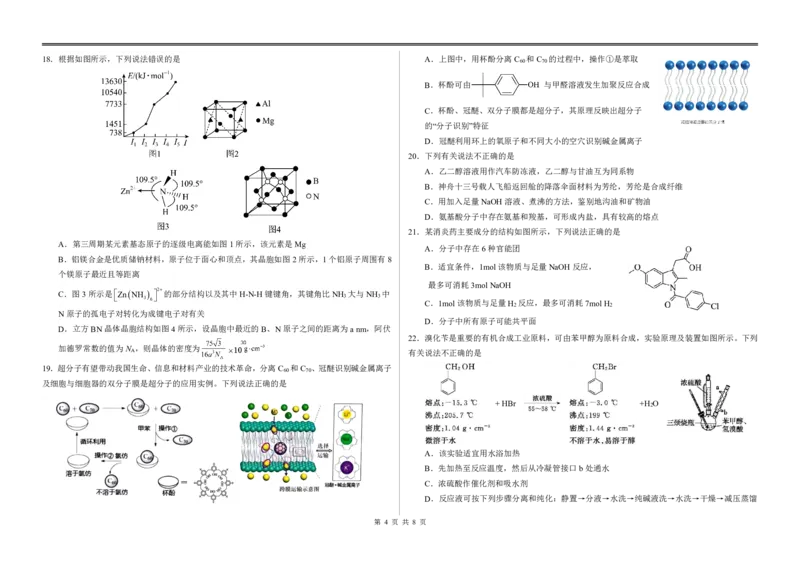
{#{QQABZYQQogAgAIIAAAgCQQ0qCgKQkACACSgOwAAMoAAAgAFABAA=}#}18.根据如图所示,下列说法错误的是 A.上图中,用杯酚分离C 和C 的过程中,操作①是萃取
60 70
B.杯酚可由 与甲醛溶液发生加聚反应合成
C.杯酚、冠醚、双分子膜都是超分子,其原理反映出超分子
的“分子识别”特征
D.冠醚利用环上的氧原子和不同大小的空穴识别碱金属离子
20.下列有关说法不正确的是
A.乙二醇溶液用作汽车防冻液,乙二醇与甘油互为同系物
B.神舟十三号载人飞船返回舱的降落伞面材料为芳纶,芳纶是合成纤维
C.用加入足量NaOH溶液、煮沸的方法,鉴别地沟油和矿物油
D.氨基酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点
21.某消炎药主要成分的结构如图所示,下列说法正确的是
A.第三周期某元素基态原子的逐级电离能如图1所示,该元素是Mg
A.分子中存在6种官能团
B.铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示,1个铝原子周围有8
B.适宜条件,1mol该物质与足量NaOH反应,
个镁原子最近且等距离
最多可消耗3molNaOH
C.图3所示是ZnNH 2 的部分结构以及其中H-N-H键键角,其键角比NH 大与NH 中
3 6 3 3 C.1mol该物质与足量H 反应,最多可消耗7molH
2 2
N原子的孤电子对转化为成键电子对有关
D.分子中所有原子可能共平面
D.立方BN晶体晶胞结构如图4所示,设晶胞中最近的B、N原子之间的距离为anm,阿伏
22.溴化苄是重要的有机合成工业原料,可由苯甲醇为原料合成,实验原理及装置如图所示。下列
加德罗常数的值为N ,则晶体的密度为
A 有关说法不正确的是
19.超分子有望带动我国生命、信息和材料产业的技术革命,分离C 和C 、冠醚识别碱金属离子
60 70
及细胞与细胞器的双分子膜是超分子的应用实例。下列说法正确的是
+HBr +H O
2
A.该实验适宜用水浴加热
B.先加热至反应温度,然后从冷凝管接口b处通水
C.浓硫酸作催化剂和吸水剂
D.反应液可按下列步骤分离和纯化:静置→分液→水洗→纯碱液洗→水洗→干燥→减压蒸馏
第 4 页 共 8 页
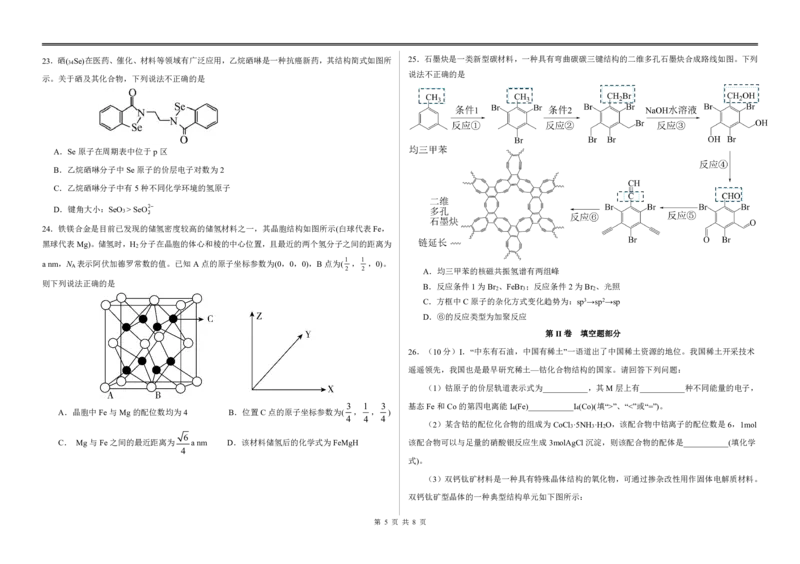
{#{QQABZYQQogAgAIIAAAgCQQ0qCgKQkACACSgOwAAMoAAAgAFABAA=}#}23.硒( Se)在医药、催化、材料等领域有广泛应用,乙烷硒啉是一种抗癌新药,其结构简式如图所 25.石墨炔是一类新型碳材料,一种具有弯曲碳碳三键结构的二维多孔石墨炔合成路线如图。下列
34
说法不正确的是
示。关于硒及其化合物,下列说法不正确的是
A.Se原子在周期表中位于p区
B.乙烷硒啉分子中Se原子的价层电子对数为2
C.乙烷硒啉分子中有5种不同化学环境的氢原子
D.键角大小:SeO >SeO
3
24.铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(白球代表Fe,
黑球代表Mg)。储氢时,H 分子在晶胞的体心和棱的中心位置,且最近的两个氢分子之间的距离为
2
1 1
anm,N 表示阿伏加德罗常数的值。已知A点的原子坐标参数为(0,0,0),B点为( , ,0)。
A
2 2 A.均三甲苯的核磁共振氢谱有两组峰
则下列说法正确的是
B.反应条件1为Br 、FeBr ;反应条件2为Br 、光照
2 3 2
C.方框中C原子的杂化方式变化趋势为:sp3→sp2→sp
D.⑥的反应类型为加聚反应
第II卷 填空题部分
26.(10分)I.“中东有石油,中国有稀土”一语道出了中国稀土资源的地位。我国稀土开采技术
遥遥领先,我国也是最早研究稀土—钴化合物结构的国家。请回答下列问题:
(1)钴原子的价层轨道表示式为___________,其M层上有___________种不同能量的电子,
3 1 3 基态Fe和Co的第四电离能I (Fe)___________I (Co)(填“>”、“<”或“=”)。
A.晶胞中Fe与Mg的配位数均为4 B.位置C点的原子坐标参数为( , , ) 4 4
4 4 4
(2)某含钴的配位化合物的组成为CoCl ·5NH ·H O,该配合物中钴离子的配位数是6,1mol
3 3 2
6
C. Mg与Fe之间的最近距离为 anm D.该材料储氢后的化学式为FeMgH 该配合物可以与足量的硝酸银反应生成3molAgCl沉淀,则该配合物的配体是___________(填化学
4
式)。
(3)双钙钛矿材料是一种具有特殊晶体结构的氧化物,可通过掺杂改性用作固体电解质材料。
双钙钛矿型晶体的一种典型结构单元如下图所示:
第 5 页 共 8 页
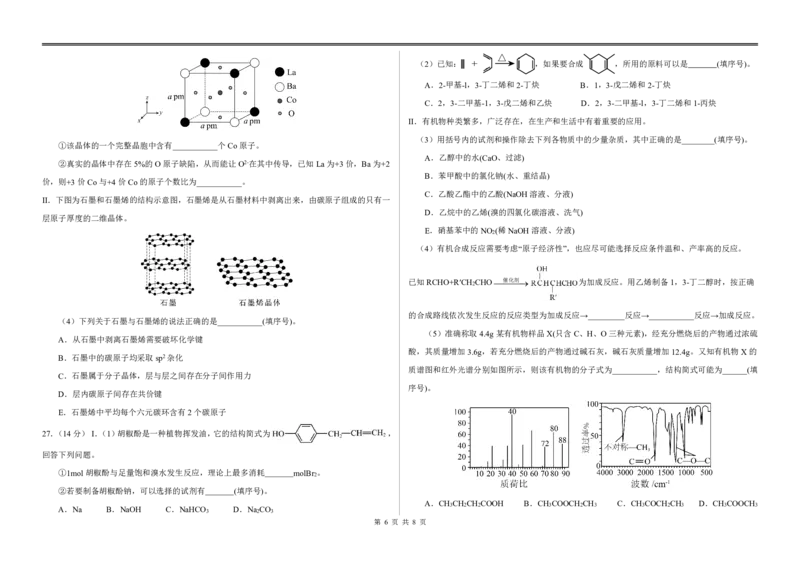
{#{QQABZYQQogAgAIIAAAgCQQ0qCgKQkACACSgOwAAMoAAAgAFABAA=}#}(2)已知: ,如果要合成 ,所用的原料可以是 (填序号)。
A.2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D.2,3-二甲基-l,3-丁二烯和1-丙炔
II.有机物种类繁多,广泛存在,在生产和生活中有着重要的应用。
(3)用括号内的试剂和操作除去下列各物质中的少量杂质,其中正确的是________(填序号)。
①该晶体的一个完整晶胞中含有___________个Co原子。
A.乙醇中的水(CaO、过滤)
②真实的晶体中存在5%的O原子缺陷,从而能让O2-在其中传导,已知La为+3价,Ba为+2
B.苯甲酸中的氯化钠(水、重结晶)
价,则+3价Co与+4价Co的原子个数比为___________。
C.乙酸乙酯中的乙酸(NaOH溶液、分液)
II.下图为石墨和石墨烯的结构示意图,石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一
D.乙烷中的乙烯(溴的四氯化碳溶液、洗气)
层原子厚度的二维晶体。
E.硝基苯中的NO (稀NaOH溶液、分液)
2
(4)有机合成反应需要考虑“原子经济性”,也应尽可能选择反应条件温和、产率高的反应。
已知RCHO+R′CH CHO催化剂 为加成反应。用乙烯制备1,3-丁二醇时,按正确
2
的合成路线依次发生反应的反应类型为加成反应→_________反应→___________反应→加成反应。
(4)下列关于石墨与石墨烯的说法正确的是___________(填序号)。
(5)准确称取4.4g某有机物样品X(只含C、H、O三种元素),经充分燃烧后的产物通过浓硫
A.从石墨中剥离石墨烯需要破坏化学键
酸,其质量增加3.6g,若充分燃烧后的产物通过碱石灰,碱石灰质量增加12.4g。又知有机物X的
B.石墨中的碳原子均采取sp2杂化
质谱图和红外光谱分别如图所示,则该有机物的分子式为___________,结构简式可能为______(填
C.石墨属于分子晶体,层与层之间存在分子间作用力
序号)。
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有2个碳原子
27.(14分)I.(1)胡椒酚是一种植物挥发油,它的结构简式为 ,
回答下列问题。
①1mol胡椒酚与足量饱和溴水发生反应,理论上最多消耗 molBr 。
2
②若要制备胡椒酚钠,可以选择的试剂有 (填序号)。
A.CH CH CH COOH B.CH COOCH CH C.CH COCH CH D.CH COOCH
A.Na B.NaOH C.NaHCO D.Na CO 3 2 2 3 2 3 3 2 3 3 3
3 2 3
第 6 页 共 8 页
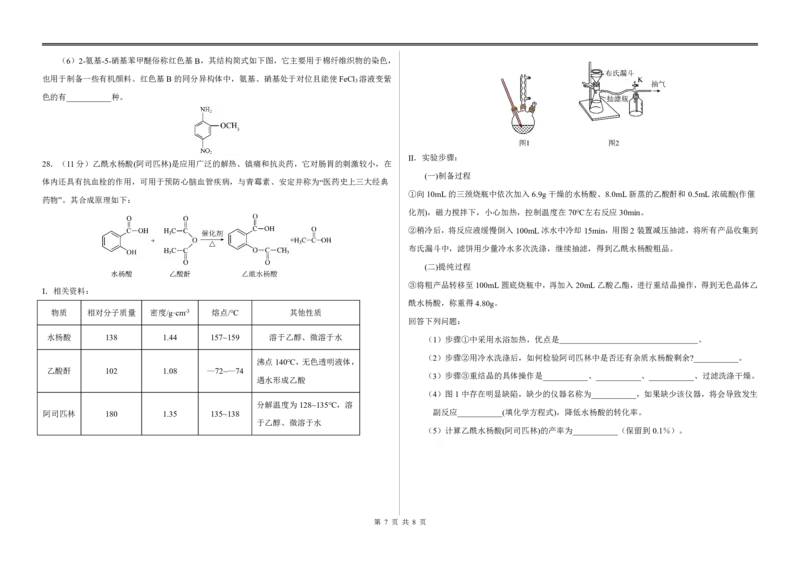
{#{QQABZYQQogAgAIIAAAgCQQ0qCgKQkACACSgOwAAMoAAAgAFABAA=}#}(6)2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如下图,它主要用于棉纤维织物的染色,
也用于制备一些有机颜料。红色基B的同分异构体中,氨基、硝基处于对位且能使FeCl 溶液变紫
3
色的有___________种。
Ⅱ.实验步骤:
28.(11分)乙酰水杨酸(阿司匹林)是应用广泛的解热、镇痛和抗炎药,它对肠胃的刺激较小,在
(一)制备过程
体内还具有抗血栓的作用,可用于预防心脑血管疾病,与青霉素、安定并称为“医药史上三大经典
①向10mL的三颈烧瓶中依次加入6.9g干燥的水杨酸、8.0mL新蒸的乙酸酐和0.5mL浓硫酸(作催
药物”。其合成原理如下:
化剂),磁力搅拌下,小心加热,控制温度在70℃左右反应30min。
②稍冷后,将反应液缓慢倒入100mL冰水中冷却15min,用图2装置减压抽滤,将所有产品收集到
布氏漏斗中,滤饼用少量冷水多次洗涤,继续抽滤,得到乙酰水杨酸粗品。
(二)提纯过程
③将粗产品转移至100mL圆底烧瓶中,再加入20mL乙酸乙酯,进行重结晶操作,得到无色晶体乙
Ⅰ.相关资料:
酰水杨酸,称重得4.80g。
物质 相对分子质量 密度/g·cm-3 熔点/℃ 其他性质
回答下列问题:
水杨酸 138 1.44 157~159 溶于乙醇、微溶于水 (1)步骤①中采用水浴加热,优点是 。
(2)步骤②用冷水洗涤后,如何检验阿司匹林中是否还有杂质水杨酸剩余?___________。
沸点140℃,无色透明液体,
乙酸酐 102 1.08 —72~—74
(3)步骤③重结晶的具体操作是___________、___________、___________、过滤洗涤干燥。
遇水形成乙酸
(4)图1中存在明显缺陷,缺少的仪器名称为___________,如果缺少该仪器,将会导致发生
分解温度为128~135℃,溶
阿司匹林 180 1.35 135~138 副反应___________(填化学方程式),降低水杨酸的转化率。
于乙醇、微溶于水
(5)计算乙酰水杨酸(阿司匹林)的产率为___________(保留到0.1%)。
第 7 页 共 8 页
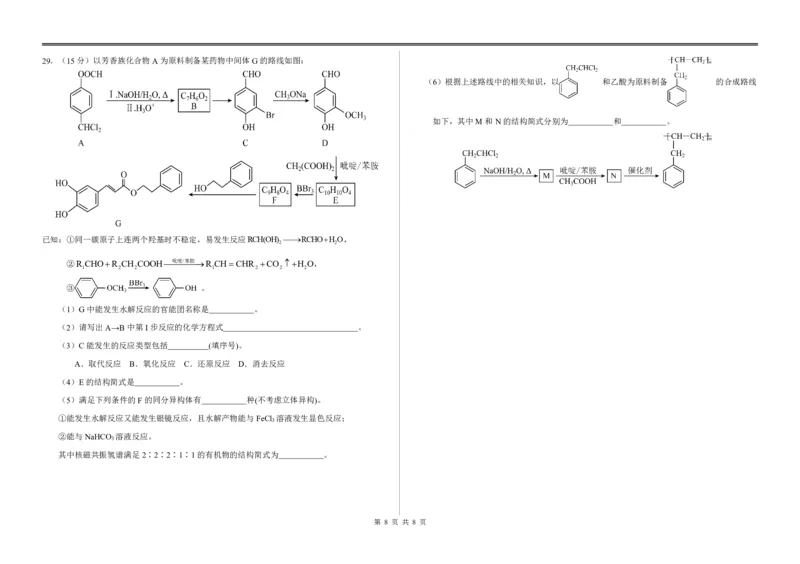
{#{QQABZYQQogAgAIIAAAgCQQ0qCgKQkACACSgOwAAMoAAAgAFABAA=}#}29.(15分)以芳香族化合物A为原料制备某药物中间体G的路线如图:
(6)根据上述路线中的相关知识,以 和乙酸为原料制备 的合成路线
如下,其中M和N的结构简式分别为 和 。
已知:①同一碳原子上连两个羟基时不稳定,易发生反应RCH(OH) RCHOHO,
2 2
②R CHOR CH COOH吡啶/苯胺R CHCHR CO H O,
1 2 2 1 2 2 2
③ 。
(1)G中能发生水解反应的官能团名称是 。
(2)请写出A→B中第I步反应的化学方程式 。
(3)C能发生的反应类型包括 (填序号)。
A.取代反应 B.氧化反应 C.还原反应 D.消去反应
(4)E的结构简式是 。
(5)满足下列条件的F的同分异构体有 种(不考虑立体异构)。
①能发生水解反应又能发生银镜反应,且水解产物能与FeCl 溶液发生显色反应;
3
②能与NaHCO 溶液反应。
3
其中核磁共振氢谱满足2∶2∶2∶1∶1的有机物的结构简式为 。
第 8 页 共 8 页
{#{QQABZYQQogAgAIIAAAgCQQ0qCgKQkACACSgOwAAMoAAAgAFABAA=}#}