文档内容
2024.10 高二第一学期十月阶段练习-化学
原子量:H 1 C 12 O 16 Na 23 P 31 S 32 Cl 35.5 Ba 137
一、选择题(每题只有一个选项符合题意,1-20题每题 3分,21-25题每题 2分,共 70
分)
1. 关于中国传统文化中的“文房四宝”,下列叙述中不正确的是( )
A. 可用灼烧法鉴别毛笔笔头是否含蛋白质
B. 用墨写字利用了常温下碳的稳定性
C. 纸的主要成分纤维素属于合成高分子化合物
D. 用工具打磨石材制砚台的过程是物理变化
2. 用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低
的是( )
A. AgNO CuCl Cu(NO ) B. KCl Na SO CuSO
3 2 3 2 2 4 4
.
C CaCl KOH NaNO D. HCl HNO K SO
2 3 3 2 4
3. 下列热化学方程式正确的是
选
已知条件 热化学方程式
项
A 的燃烧热为
、 完全反应,放出
B
热量
CD 白磷( )比 红磷能量多
A. A B. B C. C D. D
4. 下列有关反应的离子方程式不正确的是
A. 氧化铁与稀盐酸混合:
B. 溶解Cu:
C. 碳酸氢钠溶液与稀 反应:
D. 氯气与碘化钾溶液:
5. 关于下图装置的说法,错误的是
A. 盐桥内的 K+移向 CuSO 溶液
4
B. 若将 Cu 电极换成石墨电极,原电池反应不改变
C. 铜电极上发生的电极反应是 2H++e-=H ↑
2
D. Zn 为电池的负极
6. 设N 为阿伏加德罗常数的值。下列说法错误的是
A
A. 1L 0.1mol/L CH COOH溶液中含有的阴离子数目小于0.1N
3 A
B. 1mol Na与足量O 充分反应后,转移的电子数目为N
2 A
C. 常温常压下,17g H O 含有的氧原子数目为N
2 2 A
D. 11.2L(标准状况)N 与NH 的混合物中含有的共用电子对数目为N
2 3 A
7. 下列在指定溶液中的各组离子,一定能够大量共存的是
A. 无色溶液中: 、 、 、B. 的溶液中: 、 、 、
C. 的溶液中: 、 、 、
D. 电解 溶液后的溶液中: 、 、 、
8. 利用右图所示装置可以将温室气体CO 转化为燃料气体CO。下列说法中,正确的是
2
A. 该过程是将太阳能转化为化学能的过程
B. 电极a表面发生还原反应
C. 该装置工作时,H+从b极区向a极区移动
D. 该装置中每生成1 mol CO,同时生成1 mol O
2
9. 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 反应 在点燃条件下才能剧烈反应,所以不能设计成原电池
B. 碱性氢氧燃料电池的负极反应为
C. 常温常压下,氢氧燃料电池放电过程中消耗 ,转移电子的数目为
D. 同温同压下, ,在燃料电池和点燃条件下的 相同
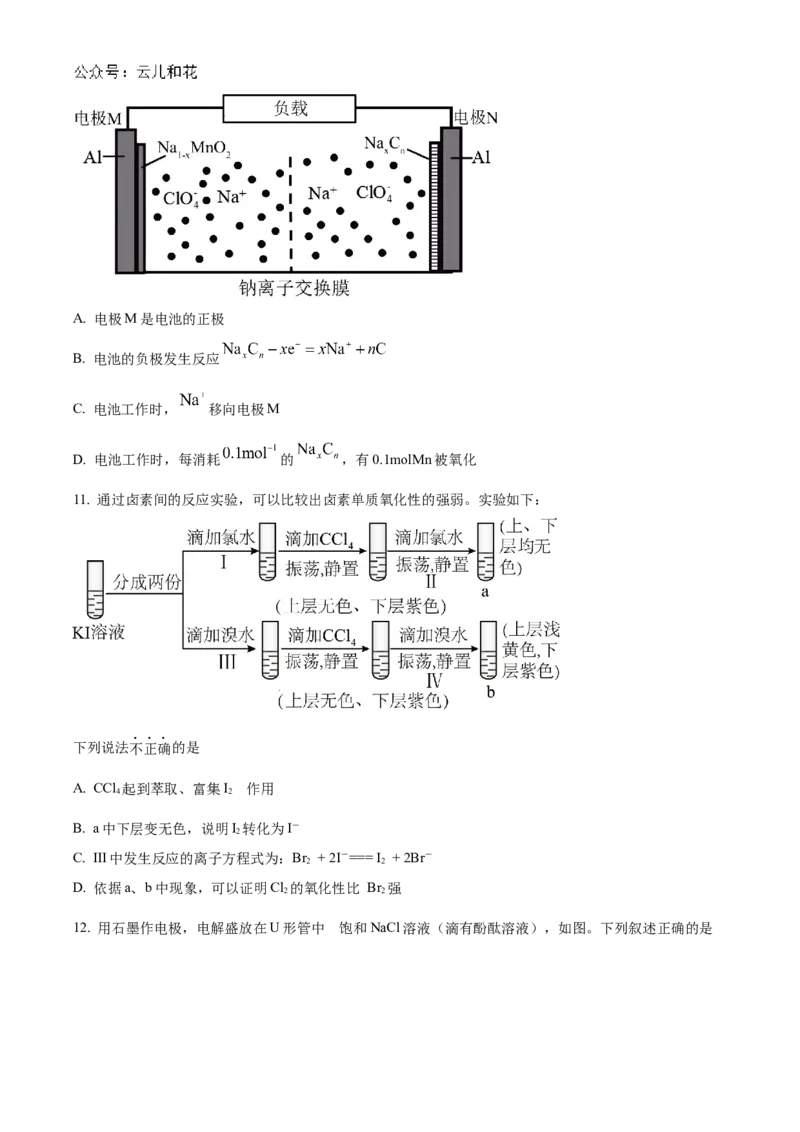
10. 某新型电池的工作原理如图所示,已知电池放电时的反应为
(反应前后Na的化合价不变)。下列说法错误的是A. 电极M是电池的正极
B. 电池的负极发生反应
C. 电池工作时, 移向电极M
D. 电池工作时,每消耗 的 ,有0.1molMn被氧化
11. 通过卤素间的反应实验,可以比较出卤素单质氧化性的强弱。实验如下:
下列说法不正确的是
的
A. CCl 起到萃取、富集I 作用
4 2
B. a中下层变无色,说明I 转化为I-
2
C. Ⅲ中发生反应的离子方程式为:Br + 2I-=== I + 2Br-
2 2
D. 依据a、b中现象,可以证明Cl 的氧化性比 Br 强
2 2
的
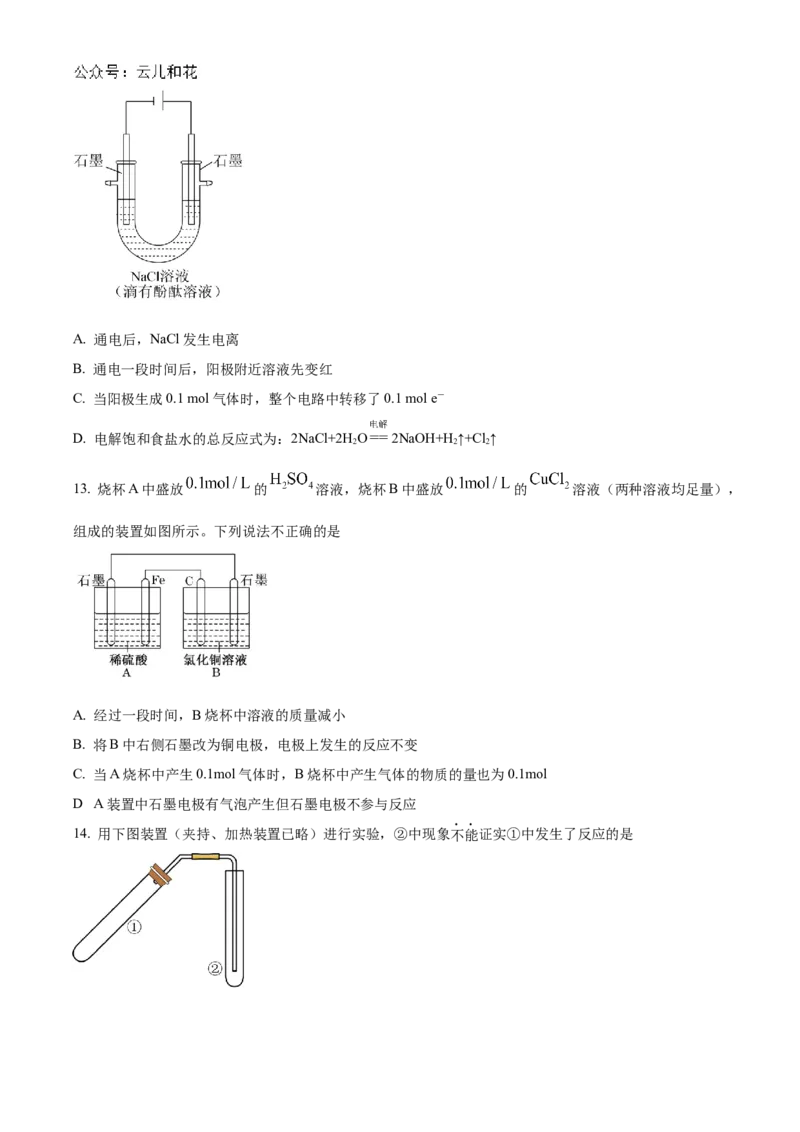
12. 用石墨作电极,电解盛放在U形管中 饱和NaCl溶液(滴有酚酞溶液),如图。下列叙述正确的是A. 通电后,NaCl发生电离
B. 通电一段时间后,阳极附近溶液先变红
C. 当阳极生成0.1 mol气体时,整个电路中转移了0.1 mol e-
D. 电解饱和食盐水的总反应式为:2NaCl+2H O 2NaOH+H ↑+Cl↑
2 2 2
13. 烧杯A中盛放 的 溶液,烧杯B中盛放 的 溶液(两种溶液均足量),
组成的装置如图所示。下列说法不正确的是
A. 经过一段时间,B烧杯中溶液的质量减小
B. 将B中右侧石墨改为铜电极,电极上发生的反应不变
C. 当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
.
D A装置中石墨电极有气泡产生但石墨电极不参与反应
14. 用下图装置(夹持、加热装置已略)进行实验,②中现象不能证实①中发生了反应的是①中实验 ②中现象
A 铁加热后与水反应 通入水中有气泡
加热 溶液和浓NaOH溶液的混合
B 湿润的红色石蕊试纸变蓝
物
饱和 溶液的上层有无色油状液
C 加热乙酸、乙醇和浓硫酸的混合物
体产生
将铁粉、碳粉和NaCl溶液的混合物放置
D 导管中倒吸形成一段水柱
一段时间
A. A B. B C. C D. D
15. 下列“实验结论”与“实验操作及现象”不相符的一项是
选
实验操作及现象 实验结论
项
A 向某溶液中加入 溶液,生成白色沉淀 该溶液中一定含有
B 将银白色的金属钠放置在空气中,钠表面很快变暗 金属钠具有还原性
C 向某溶液中加入 溶液,生成白色沉淀 该溶液中可能含有
用玻璃棒蘸取氯水滴到蓝色石蕊试纸上,试纸先变红,随后褪 氯水中含有酸性物质、漂白性物
D
色 质
A. A B. B C. C D. D
16. 取 和 的混合溶液,加入过量 溶液后得到29.02g白色沉淀,用过量稀硝
酸处理产生气体2.24L(标准状况)。下列说法不正确的是
A. 混合溶液中 的物质的量浓度0.1mol/L
B. 混合溶液中 的物质的量浓度0.4mol/L
C. 29.02g白色沉淀用过量稀硝酸处理,沉淀质量减少19.7g
D. 处理沉淀消耗的硝酸的溶质的物质的量0.2mol
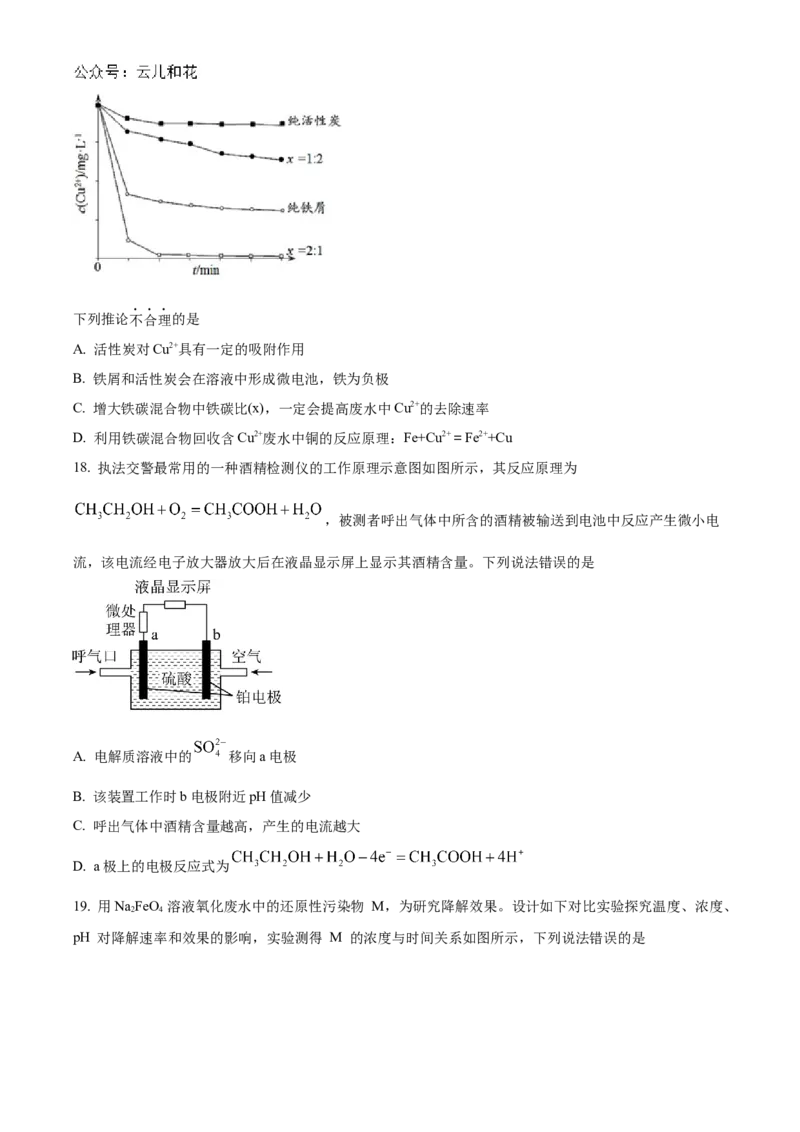
17. 工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中
Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
18. 执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为
,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电
流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法错误的是
A. 电解质溶液中的 移向a电极
B. 该装置工作时b电极附近pH值减少
C. 呼出气体中酒精含量越高,产生的电流越大
D. a极上的电极反应式为
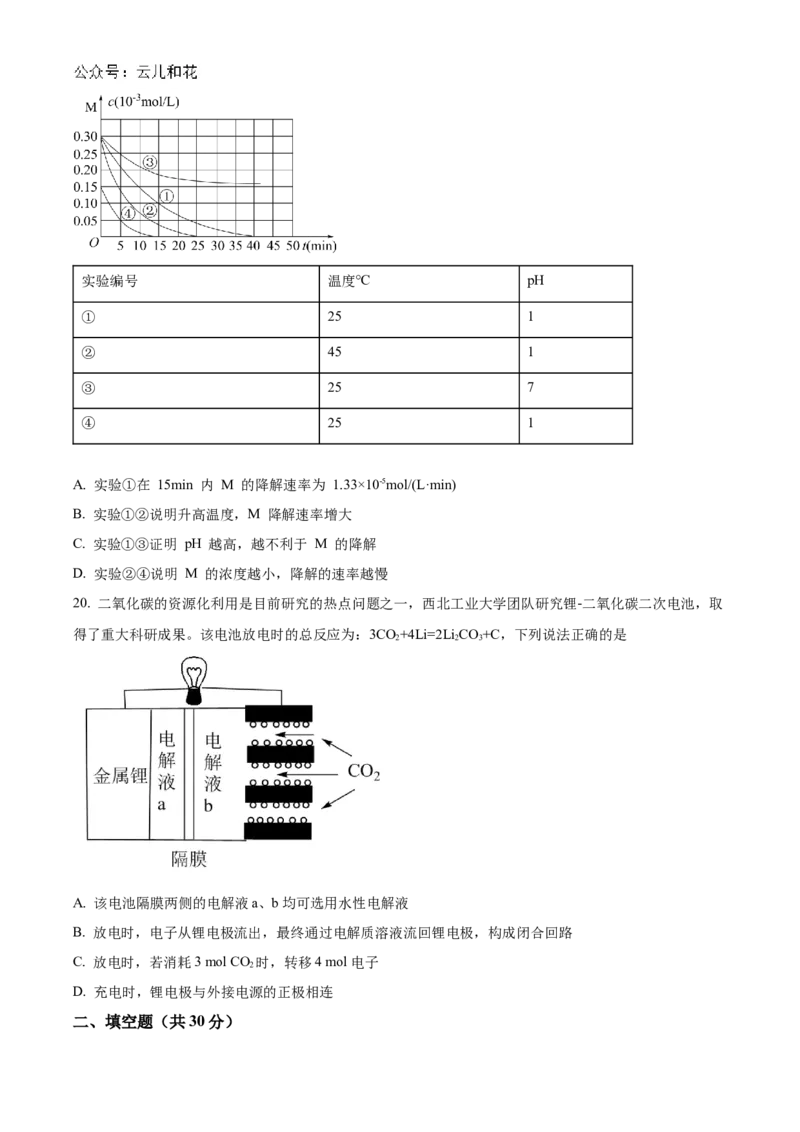
19. 用NaFeO 溶液氧化废水中的还原性污染物 M,为研究降解效果。设计如下对比实验探究温度、浓度、
2 4
pH 对降解速率和效果的影响,实验测得 M 的浓度与时间关系如图所示,下列说法错误的是实验编号 温度℃ pH
① 25 1
② 45 1
③ 25 7
④ 25 1
A. 实验①在 15min 内 M 的降解速率为 1.33×10-5mol/(L·min)
B. 实验①②说明升高温度,M 降解速率增大
C. 实验①③证明 pH 越高,越不利于 M 的降解
D. 实验②④说明 M 的浓度越小,降解的速率越慢
20. 二氧化碳的资源化利用是目前研究的热点问题之一,西北工业大学团队研究锂-二氧化碳二次电池,取
得了重大科研成果。该电池放电时的总反应为:3CO+4Li=2Li CO+C,下列说法正确的是
2 2 3
A. 该电池隔膜两侧的电解液a、b均可选用水性电解液
B. 放电时,电子从锂电极流出,最终通过电解质溶液流回锂电极,构成闭合回路
C. 放电时,若消耗3 mol CO 时,转移4 mol电子
2
D. 充电时,锂电极与外接电源的正极相连
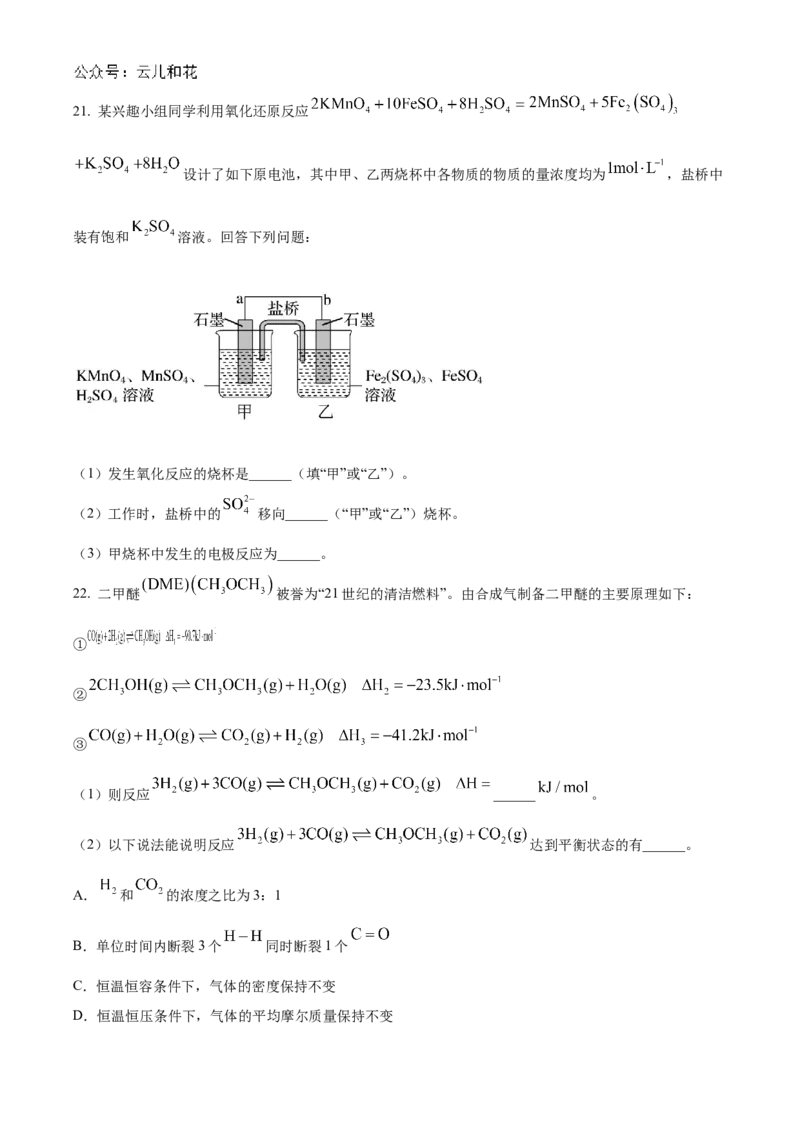
二、填空题(共30分)21. 某兴趣小组同学利用氧化还原反应
设计了如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 ,盐桥中
装有饱和 溶液。回答下列问题:
(1)发生氧化反应的烧杯是______(填“甲”或“乙”)。
(2)工作时,盐桥中的 移向______(“甲”或“乙”)烧杯。
(3)甲烧杯中发生的电极反应为______。
22. 二甲醚 被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①
②
③
(1)则反应 ______ 。
(2)以下说法能说明反应 达到平衡状态的有______。
A. 和 的浓度之比为3:1
B.单位时间内断裂3个 同时断裂1个
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变E.绝热体系中,体系的温度保持不变
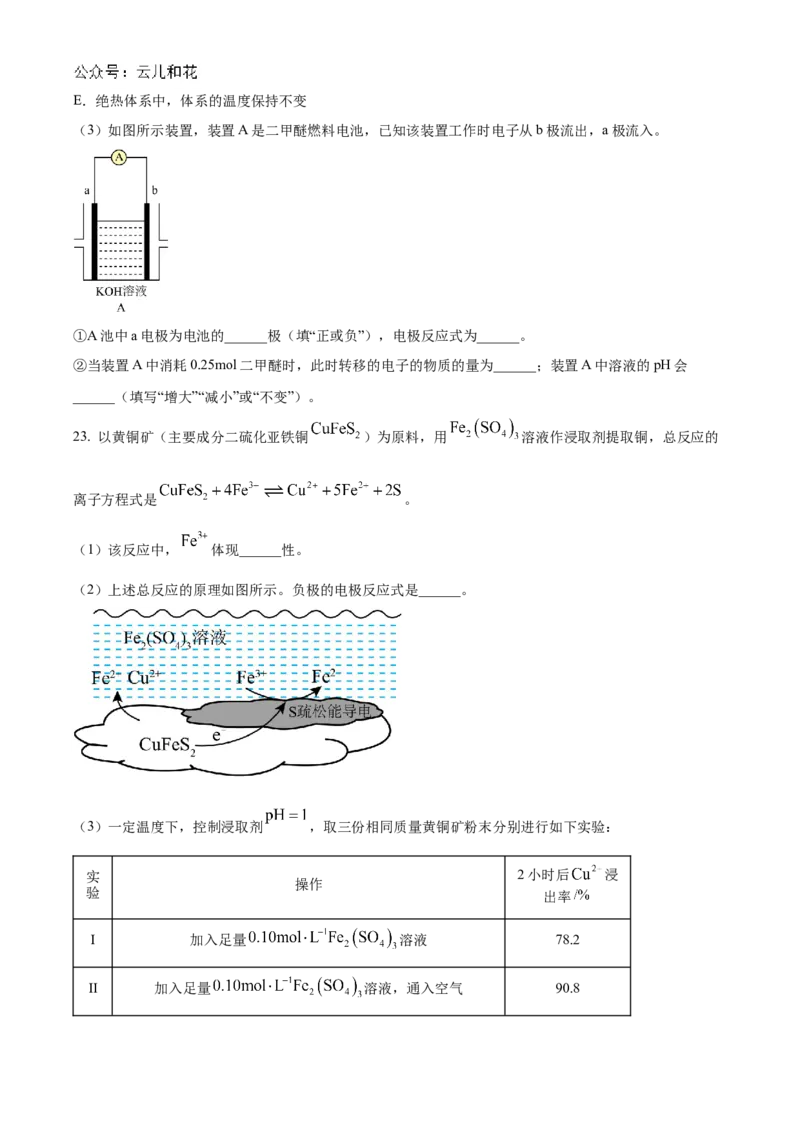
(3)如图所示装置,装置A是二甲醚燃料电池,已知该装置工作时电子从b极流出,a极流入。
①A池中a电极为电池的______极(填“正或负”),电极反应式为______。
②当装置A中消耗0.25mol二甲醚时,此时转移的电子的物质的量为______;装置A中溶液的pH会
______(填写“增大”“减小”或“不变”)。
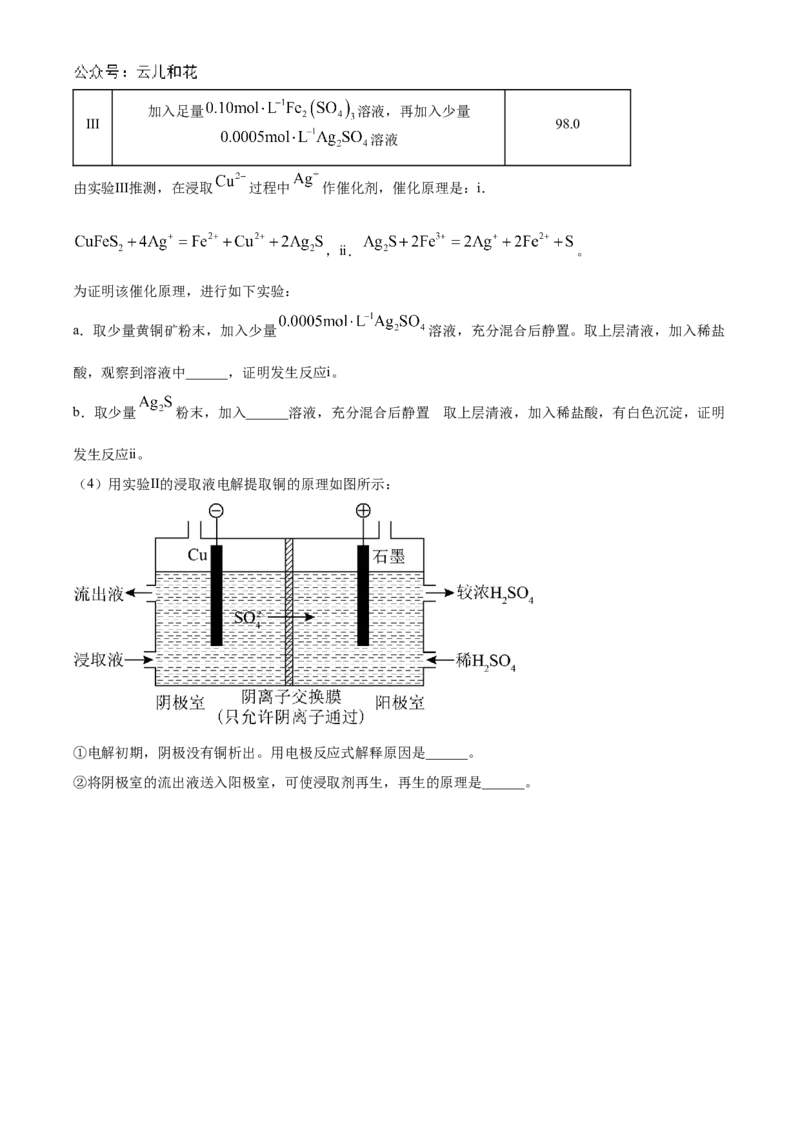
23. 以黄铜矿(主要成分二硫化亚铁铜 )为原料,用 溶液作浸取剂提取铜,总反应的
离子方程式是 。
(1)该反应中, 体现______性。
(2)上述总反应的原理如图所示。负极的电极反应式是______。
(3)一定温度下,控制浸取剂 ,取三份相同质量黄铜矿粉末分别进行如下实验:
实 2小时后 浸
操作
验
出率
Ⅰ 加入足量 溶液 78.2
Ⅱ 加入足量 溶液,通入空气 90.8加入足量 溶液,再加入少量
Ⅲ 98.0
溶液
由实验Ⅲ推测,在浸取 过程中 作催化剂,催化原理是:ⅰ.
,ⅱ. 。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量 溶液,充分混合后静置。取上层清液,加入稀盐
酸,观察到溶液中______,证明发生反应ⅰ。
。
b.取少量 粉末,加入______溶液,充分混合后静置 取上层清液,加入稀盐酸,有白色沉淀,证明
发生反应ⅱ。
(4)用实验Ⅱ的浸取液电解提取铜的原理如图所示:
①电解初期,阴极没有铜析出。用电极反应式解释原因是______。
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是______。