文档内容
楚雄州春季学期高二年级第一次月考卷
化学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题
区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:人教版选择性必修2第一章~第二章。
5.可能用到的相对原子质量:H-1 C-12 O-16
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的)
1. 下列说法正确的是
A. 各电子层含有的原子轨道数为2n2(n为电子层序数)
B. 电子的“自旋”类似于地球的“自转”
C. 电子仅在激发态跃迁到基态时才会产生原子光谱
D. 霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关
2. 《中华本草》等中医典籍中,记载了炉甘石( )入药,可用于治疗皮肤炎症或表面创伤。下列说法
正确的是
A. 第一电离能:
B. 基态原子未成对电子数:
C. 键角:
D. 基态Zn原子核外电子的空间运动状态有30种
3. 下列分子的空间结构为正四面体形的是
A. B. C. D.
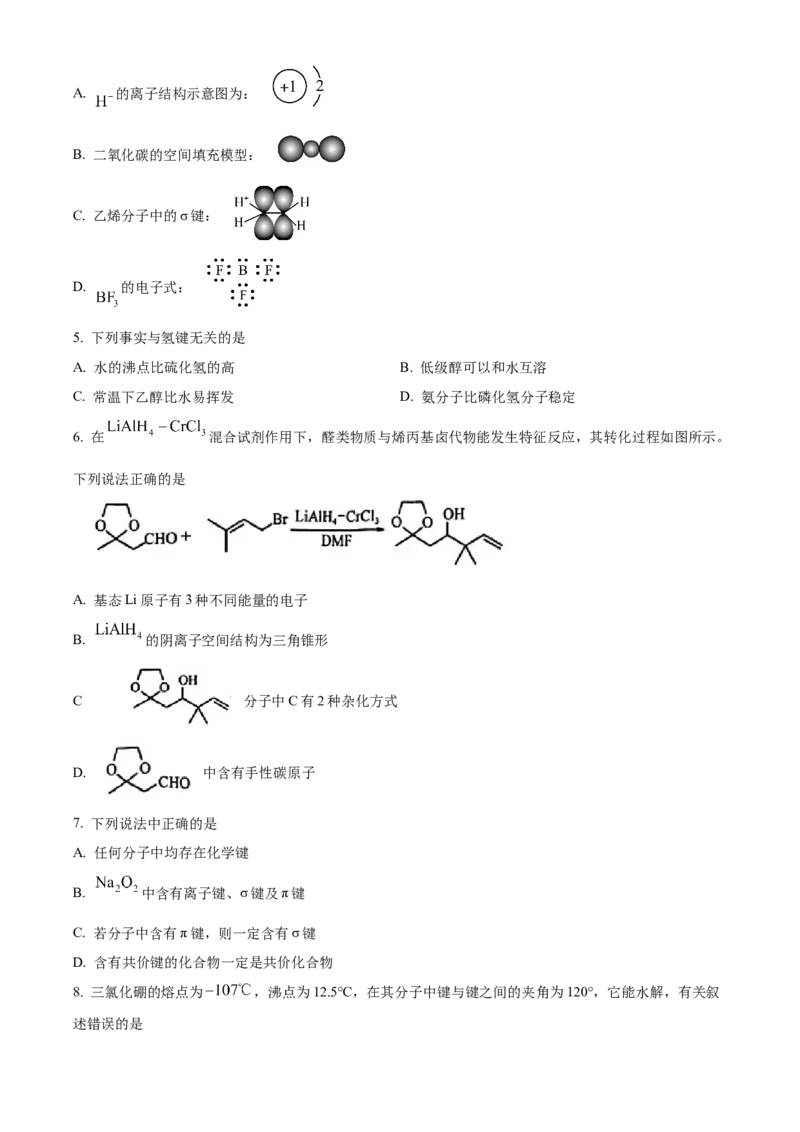
4. 下列化学用语使用正确的是A. 的离子结构示意图为:
B. 二氧化碳的空间填充模型:
C. 乙烯分子中的σ键:
D. 的电子式:
5. 下列事实与氢键无关的是
A. 水的沸点比硫化氢的高 B. 低级醇可以和水互溶
C. 常温下乙醇比水易挥发 D. 氨分子比磷化氢分子稳定
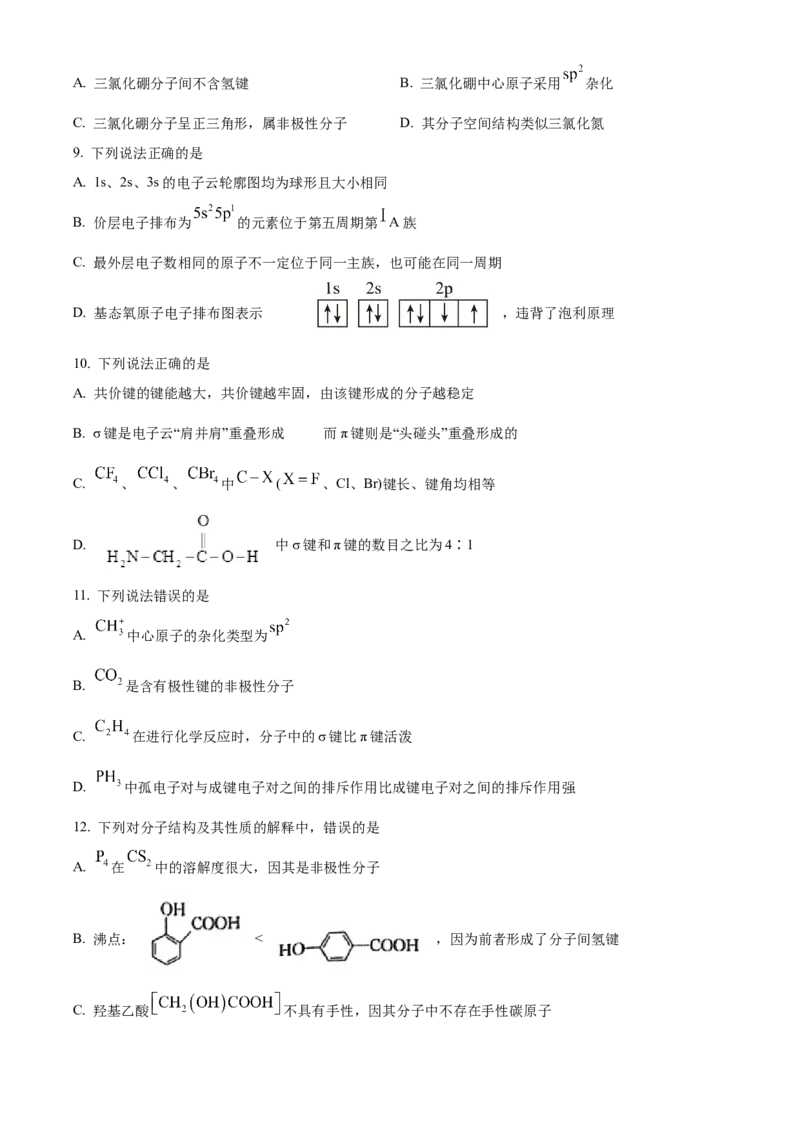
6. 在 混合试剂作用下,醛类物质与烯丙基卤代物能发生特征反应,其转化过程如图所示。
下列说法正确的是
A. 基态Li原子有3种不同能量的电子
B. 的阴离子空间结构为三角锥形
C . 分子中C有2种杂化方式
D. 中含有手性碳原子
7. 下列说法中正确的是
A. 任何分子中均存在化学键
B. 中含有离子键、σ键及π键
C. 若分子中含有π键,则一定含有σ键
D. 含有共价键的化合物一定是共价化合物
8. 三氯化硼的熔点为 ,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙
述错误的是A. 三氯化硼分子间不含氢键 B. 三氯化硼中心原子采用 杂化
C. 三氯化硼分子呈正三角形,属非极性分子 D. 其分子空间结构类似三氯化氮
9. 下列说法正确的是
A. 1s、2s、3s的电子云轮廓图均为球形且大小相同
B. 价层电子排布为 的元素位于第五周期第 A族
C. 最外层电子数相同的原子不一定位于同一主族,也可能在同一周期
D. 基态氧原子电子排布图表示 ,违背了泡利原理
为
10. 下列说法正确的是
A. 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
的
B. σ键是电子云“肩并肩”重叠形成 而π键则是“头碰头”重叠形成的
C. 、 、 中 ( 、Cl、Br)键长、键角均相等
D. 中σ键和π键的数目之比为4∶1
11. 下列说法错误的是
A. 中心原子的杂化类型为
B. 是含有极性键的非极性分子
C. 在进行化学反应时,分子中的σ键比π键活泼
D. 中孤电子对与成键电子对之间的排斥作用比成键电子对之间的排斥作用强
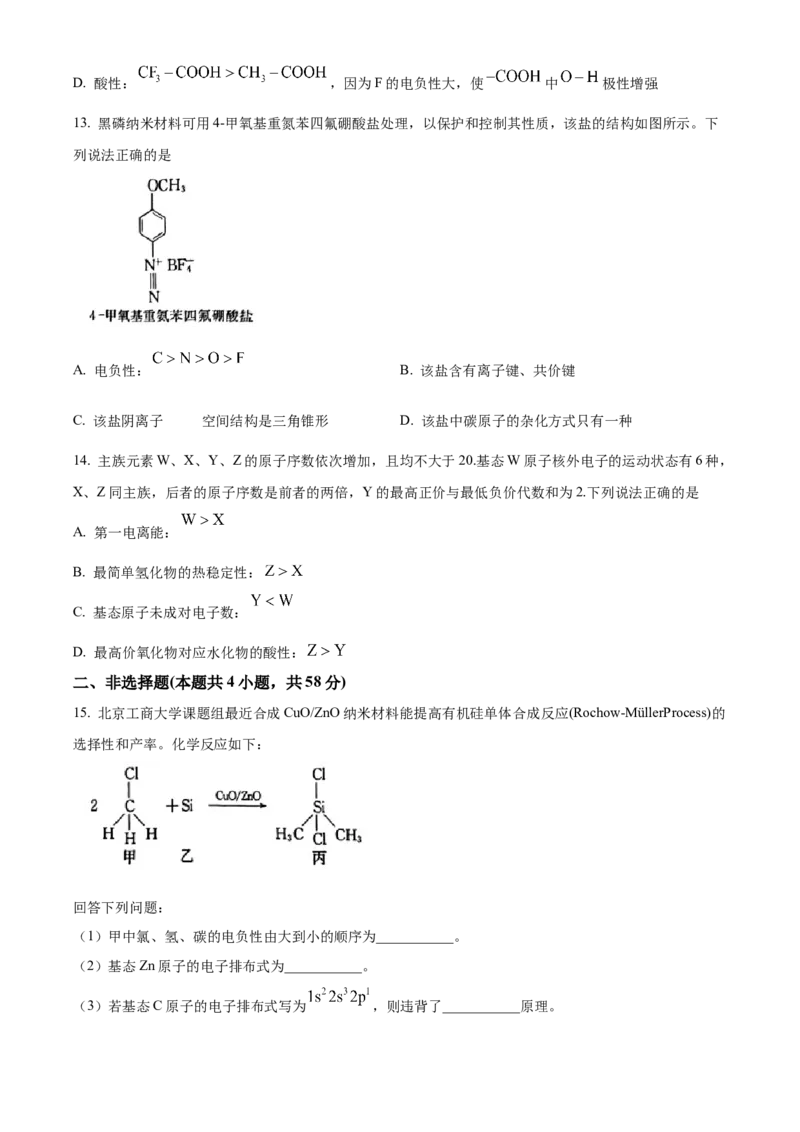
12. 下列对分子结构及其性质的解释中,错误的是
A. 在 中的溶解度很大,因其是非极性分子
B. 沸点: < ,因为前者形成了分子间氢键
C. 羟基乙酸 不具有手性,因其分子中不存在手性碳原子D. 酸性: ,因为F的电负性大,使 中 极性增强
13. 黑磷纳米材料可用4-甲氧基重氮苯四氟硼酸盐处理,以保护和控制其性质,该盐的结构如图所示。下
列说法正确的是
A. 电负性: B. 该盐含有离子键、共价键
的
C. 该盐阴离子 空间结构是三角锥形 D. 该盐中碳原子的杂化方式只有一种
14. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20.基态W原子核外电子的运动状态有6种,
X、Z同主族,后者的原子序数是前者的两倍,Y的最高正价与最低负价代数和为2.下列说法正确的是
A. 第一电离能:
B. 最简单氢化物的热稳定性:
C. 基态原子未成对电子数:
D. 最高价氧化物对应水化物的酸性:
二、非选择题(本题共4小题,共58分)
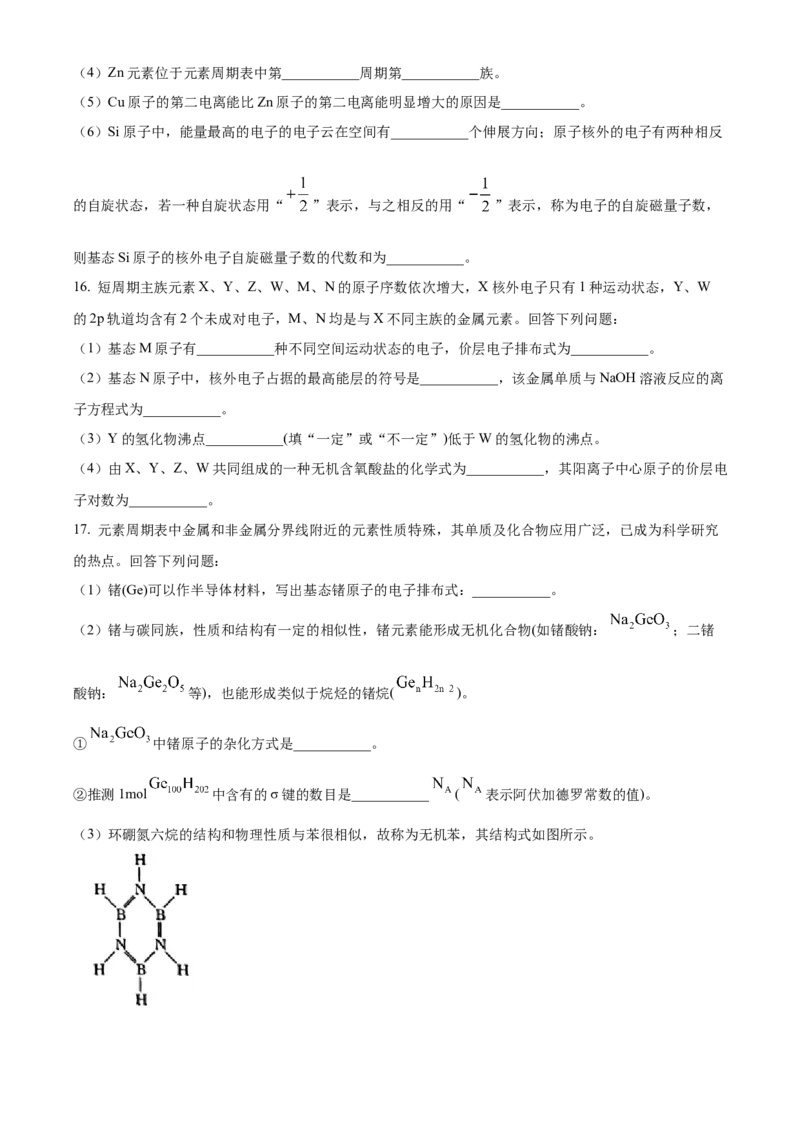
15. 北京工商大学课题组最近合成CuO/ZnO纳米材料能提高有机硅单体合成反应(Rochow-MüllerProcess)的
选择性和产率。化学反应如下:
回答下列问题:
(1)甲中氯、氢、碳的电负性由大到小的顺序为___________。
(2)基态Zn原子的电子排布式为___________。
(3)若基态C原子的电子排布式写为 ,则违背了___________原理。(4)Zn元素位于元素周期表中第___________周期第___________族。
(5)Cu原子的第二电离能比Zn原子的第二电离能明显增大的原因是___________。
(6)Si原子中,能量最高的电子的电子云在空间有___________个伸展方向;原子核外的电子有两种相反
的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数,
则基态Si原子的核外电子自旋磁量子数的代数和为___________。
16. 短周期主族元素X、Y、Z、W、M、N的原子序数依次增大,X核外电子只有1种运动状态,Y、W
的2p轨道均含有2个未成对电子,M、N均是与X不同主族的金属元素。回答下列问题:
(1)基态M原子有___________种不同空间运动状态的电子,价层电子排布式为___________。
(2)基态N原子中,核外电子占据的最高能层的符号是___________,该金属单质与NaOH溶液反应的离
子方程式为___________。
(3)Y的氢化物沸点___________(填“一定”或“不一定”)低于W的氢化物的沸点。
(4)由X、Y、Z、W共同组成的一种无机含氧酸盐的化学式为___________,其阳离子中心原子的价层电
子对数为___________。
17. 元素周期表中金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,已成为科学研究
的热点。回答下列问题:
(1)锗(Ge)可以作半导体材料,写出基态锗原子的电子排布式:___________。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠: ;二锗
酸钠: 等),也能形成类似于烷烃的锗烷( )。
① 中锗原子的杂化方式是___________。
②推测1mol 中含有的σ键的数目是___________ ( 表示阿伏加德罗常数的值)。
(3)环硼氮六烷的结构和物理性质与苯很相似,故称为无机苯,其结构式如图所示。①第一电离能介于B、N之间的第二周期元素有___________种。
②环硼氮六烷中硼、氮原子的杂化方式是___________。
(4)硅烷分子式为SiH₄,其中的氢元素显-1价,其原因是___________。
(5)根据价层电子对互斥理论(VSEPR)推测; 的VSEPR模型名称为___________;写出 的
空间结构:___________。
18. 氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载
体化合物、碳质材料、金属氢化物等。回答下列问题:
(1) 是一种过渡元素硼氢化物储氢材料。
①基态 的电子排布式可表示为___________。
② 的空间结构是___________。
(2)液氨是富氢物质,也是氢能的理想载体,利用 实现储氢和输氢。下列说法
正确的是___________(填字母)。
a. 分子的空间结构为三角锥形 b. 的结构式为 c. 的电子式为
(3)2008年,Yoon等人发现Ca与 (结构如图)生成的 能大量吸附 。
① 晶体易溶于苯、 ,说明 是___________(填“极性”或“非极性”)分子。
②1mol 分子中,含有σ键数目为___________N (N 表示阿伏加德罗常数的值)。
A A
(4)HCOOH是安全便捷的具有应用前景的液态储氢材料。HCOOH催化释氢的可能机理如图所示。①依据VSEPR模型, 中心原子上的价层电子对数是___________。
的
②为证实上述机理,用HCOOD代替HCOOH进行实验。在下图中补充HCOOD催化释氢部分过程
相应内容。___________