文档内容
秘密★启用前
2024年11月
绵阳南山中学 2024 年秋季 2023 级半期考试
化学试题
本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,
共6页;答题卡共2页。满分100分,考试时间75分钟。
注意事项:
1. 答题前,考生务必将自己的班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考
号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其
它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;
在草稿纸、试题卷上答题无效。
3.考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 N14 O 16 Na 23 S 32 Cu 64
第Ⅰ卷 选择题
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1. 化学与生产、生活密切相关,下列说法正确的是( )
A.CaCO 饱和溶液导电能力很弱,故CaCO 是弱电解质
3 3
B.氯化铵溶液显酸性可用作铁制品的除锈剂
C.由煤转化的水煤气燃烧时放出的热量比直接燃烧煤放出的热量多
D.高炉炼铁时可通过增加塔高来降低体系中CO的百分含量
2.在48mL0.1mol/LCH COOH的溶液中加入12mL0.4mol/LNaOH溶液,则混合溶液显( )
3
A.弱酸性 B.强酸性 C.中性 D.碱性
3.将下列溶液加热蒸干并灼烧,可以得到原溶质的是( )
A.氯化镁溶液 B.硫酸亚铁溶液 C.碳酸氢钠溶液 D.硫酸铝溶液
4.在100mL0.1mol/LCH COOH溶液中,欲使CHCOOH的电离程度和溶液的pH都增大,可采用的方法
3 3
是( )
A.加少量的1mol/LNaOH溶液 B.加少量1mol/L盐酸
C.加少量CHCOONa固体 D.微热
3
5.下列事实不能用勒夏特列原理解释的是( )
A.光照新制氯水时,溶液的颜色逐渐变浅
B.夏天,打开啤酒瓶时会在瓶口逸出气体
C.工业合成氨选择500 ℃高温条件
D.由NO (g)和NO(g)组成的平衡体系,加压后分子数减少
2 2 4
6.分别向1L1mol·L-1的NaOH的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸;④稀醋酸,恰好完全反应
的热效应分别为△H、△H、△H、△H,下列关系正确的是( )
1 2 3 4
A.△H >△H >△H >△H B.△H<△H=△H <△H
1 2 3 4 1 2 3 4
C.△H>△H =△H >△H D.△H>△H =△H =△H
1 2 3 4 4 1 2 3
7.某温度下,在恒容密闭容器中进行反应:X(g)+W(s) Z(g)+Y(g)。下列叙述正确的是( )
A.增加W的用量,将缩短达到平衡的时间
试卷第1页,共6页B.减小压强,平衡正向移动,速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.达到平衡后,增加X的用量,X转化率减小
8. 设N 为阿伏加德罗常数的值,下列说法正确的是( )
A
A. 16gO 与30gNO充分反应后的体系中含有的分子数为N
2 A
B. 1LpH=2的稀HSO 中含有的H+数为0.02N
2 4 A
C. 1L0.5mol/LAlCl 溶液中含有的Al3+小于0.5N
3 A
D. 3mol H 与1mol N 充分反应后,生成物的分子数为2N
2 2 A
9.下列说法正确的是( )
A.0.1mol/LNaHCO 溶液中c(H CO)+c(HCO -)=0.1mol/L
3 2 3 3
B.常温下,将1×10-6mol/L的HCl溶液稀释100倍,稀释后pH=8
C.100℃,水的pH约为6,呈酸性
D.常温下,NaCN溶液呈碱性,说明HCN是弱酸
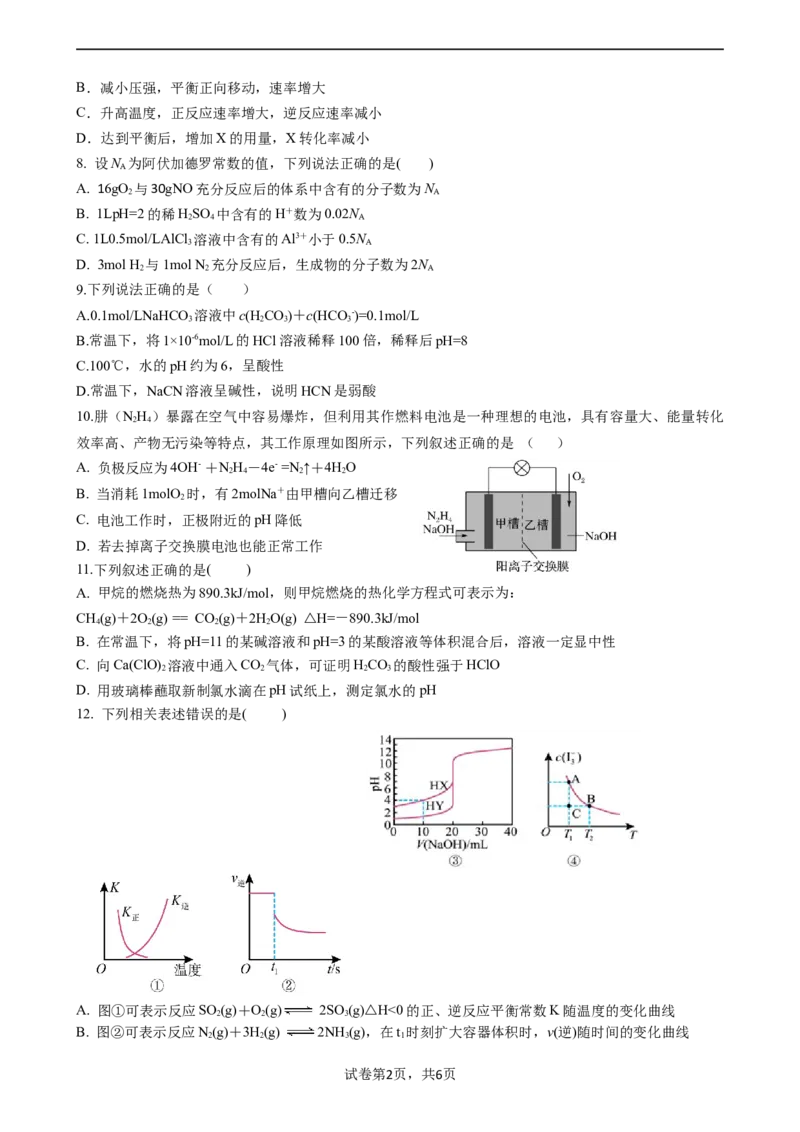
10.肼(NH )暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化
2 4
效率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是 ( )
A. 负极反应为4OH- +NH-4e- =N ↑+4HO
2 4 2 2
B. 当消耗1molO 时,有2molNa+由甲槽向乙槽迁移
2
C. 电池工作时,正极附近的pH降低
D. 若去掉离子交换膜电池也能正常工作
11.下列叙述正确的是( )
A. 甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH
4
(g)+2O
2
(g) == CO
2
(g)+2H
2
O(g) △H=-890.3kJ/mol
B. 在常温下,将pH=11的某碱溶液和pH=3的某酸溶液等体积混合后,溶液一定显中性
C. 向Ca(ClO) 溶液中通入CO 气体,可证明HCO 的酸性强于HClO
2 2 2 3
D. 用玻璃棒蘸取新制氯水滴在pH试纸上,测定氯水的pH
12. 下列相关表述错误的是( )
A. 图①可表示反应SO (g)+O(g) 2SO (g)△H<0的正、逆反应平衡常数K随温度的变化曲线
2 2 3
B. 图②可表示反应N(g)+3H(g) 2NH (g),在t 时刻扩大容器体积时,v(逆)随时间的变化曲线
2 2 3 1
试卷第2页,共6页C. 若图③表示用0.1mol/L的NaOH溶液分别滴定20mL 0.1mol/L一元酸HX、HY的滴定曲线,则HY的
酸性大于HX
D. 若图④表示反应I(aq)+I-(aq) I-(aq)平衡时c(I-)与T的关系,则C点v(正)c(Na+)>c(H+)>c(OH-)
3
B. b点c(CHCOO-)=c(Na+),V< 20mL
3 1
C. c点c(CHCOO-)大于b点
3
D. a、b、c三点中c点水的电离程度最大
第Ⅱ卷 非选择题(共58分)
15. (15分)某同学利用近期所学酸碱中和滴定原理设计实验方案,用一定浓度的盐酸测定某烧碱的纯
度,请大家试根回答下列问题:
(1)称取4.4g烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需
。
(2)进行中和滴定时,不能用所盛溶液润洗的仪器是_______。
A.酸式滴定管 B.碱式滴定管 C.锥形瓶
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为2.40ml,滴定后
液面如右图,则此时消耗标准溶液的体积为_____mL;
(4)若用0.2010mol/L标准盐酸滴定,滴定时装标准液的仪器名称为 ,选酚酞为指示剂,滴定
时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到
即可判断达到滴定终点。
(5)在滴定过程中,锥形瓶下面预先放一张白纸的作用是 。
(6)滴定过程,下列情况会使测定结果偏高的是_______(填序号)。
①记录起始体积时,仰视读数,终点时俯视
②碱式滴定管水洗后,就用来量取待测液
③滴定前,酸式滴定管有气泡,滴定后消失
④锥形瓶水洗后,又用待测液润洗
(7)根据表中数据,计算样品烧碱的质量分数为_______(结果保留四位有效数字,假设烧碱中不含有与
酸反应的杂质)
标准盐酸体积(mL)
待测液体积
滴定次数
(mL)
滴定前读数(mL) 滴定后读数(mL)
第一次 10.00 0.50 20.45
第二次 10.00 4.00 24.05
第三次 10.00 3.00 26.50
16.(14分)甲醇的用途十分广泛,主要用于有机合成、作燃料、生产农药、作良好的有机溶剂等。催化
试卷第3页,共6页CO和H 反应可以合成甲醇,反应化学方程式为
2
CO(g)+2H(g) CHOH(g)。
2 3
已知:Ⅰ CO(g)+H(g) CO(g)+HO(g) △H=+41kJ·mol-1;
2 2 2 1
Ⅱ CO(g)+3H(g) CHOH(g)+HO(g) △H=-58kJ·mol-1。
2 2 3 2 2
回答下列问题:
(1)写出催化CO和H 合成甲醇的热化学反应方程式: 。
2
(2)向2L密闭容器中加入2molCO 和6molH ,在适当的催化剂作用下,发生反应:CO(g)+3H(g)
2 2 2 2
CHOH(g)+HO(g) △H<0。
3 2
①该反应自发进行的条件是___________(填“低温”“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是___________(填字母)。
a.混合气体的平均相对分子质量保持不变 b.混合气体的密度保持不变
c.1molCO 生成的同时有3mol H-H键断裂 d.CO 和H 的转化率相等
2 2 2
③反应经过20min后达到平衡,CHOH的物质的量为1mol。平衡建立过程中,H 的平均反应速率
3 2
v(H )=___________;若该反应的起始压强为100Kpa,则该反应的平衡常数Kp= 。若20min
2
时向容器中再充入1molCO 和1mol HO,则平衡___________(填“正向”、“逆向”或“不”)移动。
2 2
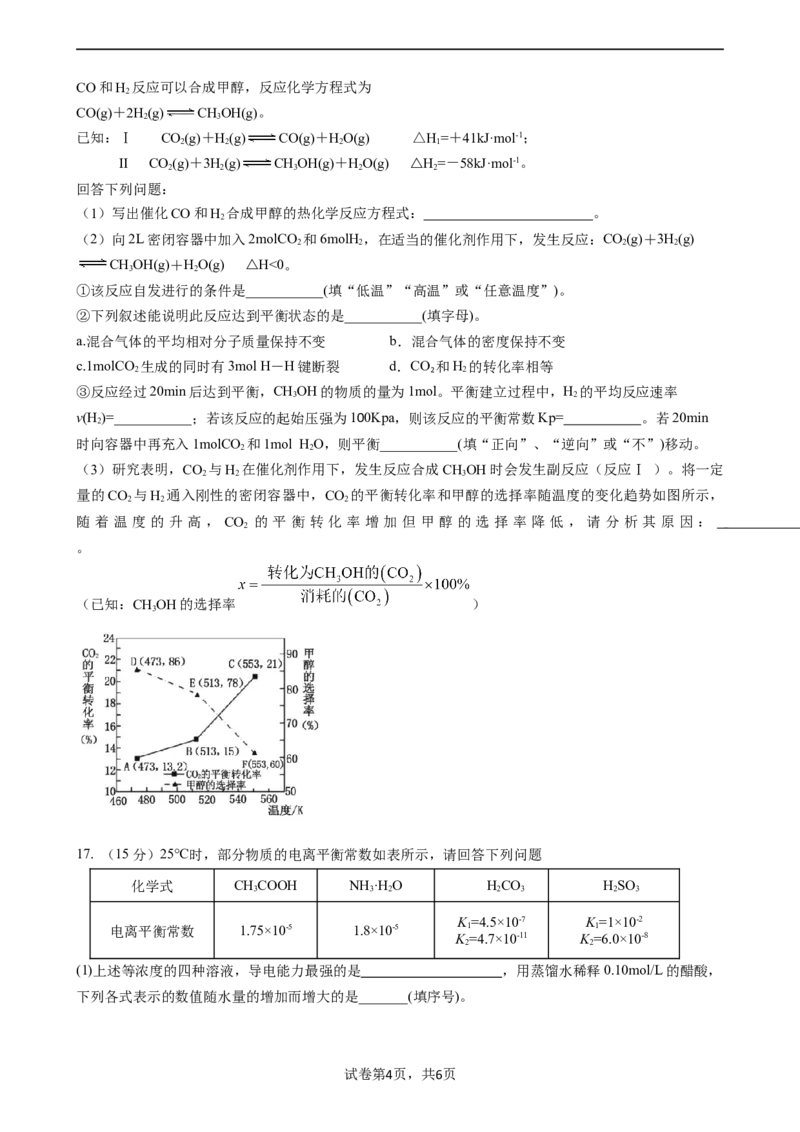
(3)研究表明,CO 与H 在催化剂作用下,发生反应合成CHOH时会发生副反应(反应Ⅰ )。将一定
2 2 3
量的CO 与H 通入刚性的密闭容器中,CO 的平衡转化率和甲醇的选择率随温度的变化趋势如图所示,
2 2 2
随 着 温 度 的 升 高 , CO 的 平 衡 转 化 率 增 加 但 甲 醇 的 选 择 率 降 低 , 请 分 析 其 原 因 :
2
。
(已知:CHOH的选择率 )
3
17. (15分)25℃时,部分物质的电离平衡常数如表所示,请回答下列问题
化学式 CHCOOH NH ·HO HCO HSO
3 3 2 2 3 2 3
K =4.5×10-7 K =1×10-2
电离平衡常数 1.75×10-5 1.8×10-5 1 1
K =4.7×10-11 K =6.0×10-8
2 2
(1)上述等浓度的四种溶液,导电能力最强的是 ,用蒸馏水稀释0.10mol/L的醋酸,
下列各式表示的数值随水量的增加而增大的是_______(填序号)。
试卷第4页,共6页a. b. c.
(2)25℃时,NaHSO 的水解平衡常数K =_______,溶液显 性。
3 h
(3)若向氨水中加入稀硫酸至恰好中和,所得溶液的pH (填“>”“=”或“<”)7,用离子方程式表
示其原因: 。
若向氨水中加入稀硫酸至溶液pH=7,此时溶液中的c(NH+)=a mol/L,则c(SO 2-)= mol/L。
4 4
(4)相同温度下,等pH的①CHCOONa溶液、②NaCO 溶液、③NaSO 溶液,三种溶液的物质的量浓度
3 2 3 2 3
由大到小排序为_______。少量SO 通入NaCO 溶液的离子方程式为 。
2 2 3
18.(14分)孔雀石的主要成分为Cu (OH)CO (含少量FeO、Fe O 、SiO )。某小组同学在实验室以孔
2 2 3 2 3 2
雀石为原料制备胆矾,并测定所得胆矾中结晶水的含量。实验步骤如下:
完成下列填空:
(1)孔雀石研磨后再加足量稀硫酸溶解,研磨孔雀石的目的是 ;孔雀石的主要成分与稀硫酸
反应的离子方程式为 ,滤液中的金属离子有 。
(2)加入“c、d”是为了除去某些杂质,则最好先加 溶液,再加 固体调节溶液pH的范
围至3.2~4.7之间。
(3)操作a依次为 、过滤、洗涤和干燥等。
(4)在利用灼烧前后质量变化测定所得胆矾(CuSO •xHO)中结晶水x值的实验过程中,若测定结果偏
4 2
大,可能的原因是 。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.加热胆矾晶体时有晶体从坩埚中溅出
(5)根据上述流程可知,孔雀石中Cu (OH)CO 的质量分数为 。(用m 和m 表达)
2 2 3 1 2
试卷第5页,共6页