文档内容
射洪中学高 2023 级高二下期半期考试
化学试题
(考试时间:75分钟 满分:100分)
注意事项:
1.答卷前,考生务必将自己的班级、姓名、考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡对应题号的位置上。写在本试卷上无效。
4.考试结束后,将答题卡交回。
可能用到的相对原子量:H-1 C-12 O-16 P-31 Ca-40 Y-89 Br-80
第 I 卷(选择题,共 45 分)
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是
符合题目要求的。
1.化学与生产、生活、社会密切相关。下列有关说法中,不正确的是
A.古代的蜡是高级脂肪酸甘油酯,属于高分子化合物
B.乙炔燃烧放出大量热,可用氧炔焰来焊接、切割金属
C.烟花的绚烂多彩与电子跃迁有关
D.乙烯被称为“石化工业之母”,可用作植物生长调节剂、塑料制造、合成纤维与橡胶生
产、农药与化学品合成等
2.锌的性质与铝相似,可发生反应Zn+2NaOH+2H O=Na Zn(OH) +H ↑。下列关于反应物和产
2 2 4 2
物的性质说法正确的是
A.五种物质中有两种离子晶体、三种分子晶体
B.钠电离最外层一个电子所需要的能量: >
C.1molNa Zn(OH) 中存在6mol配位键
2 4
D.锌的熔点高于水的熔点,是因为锌的相对原子质量大,分子间作用力大的原因
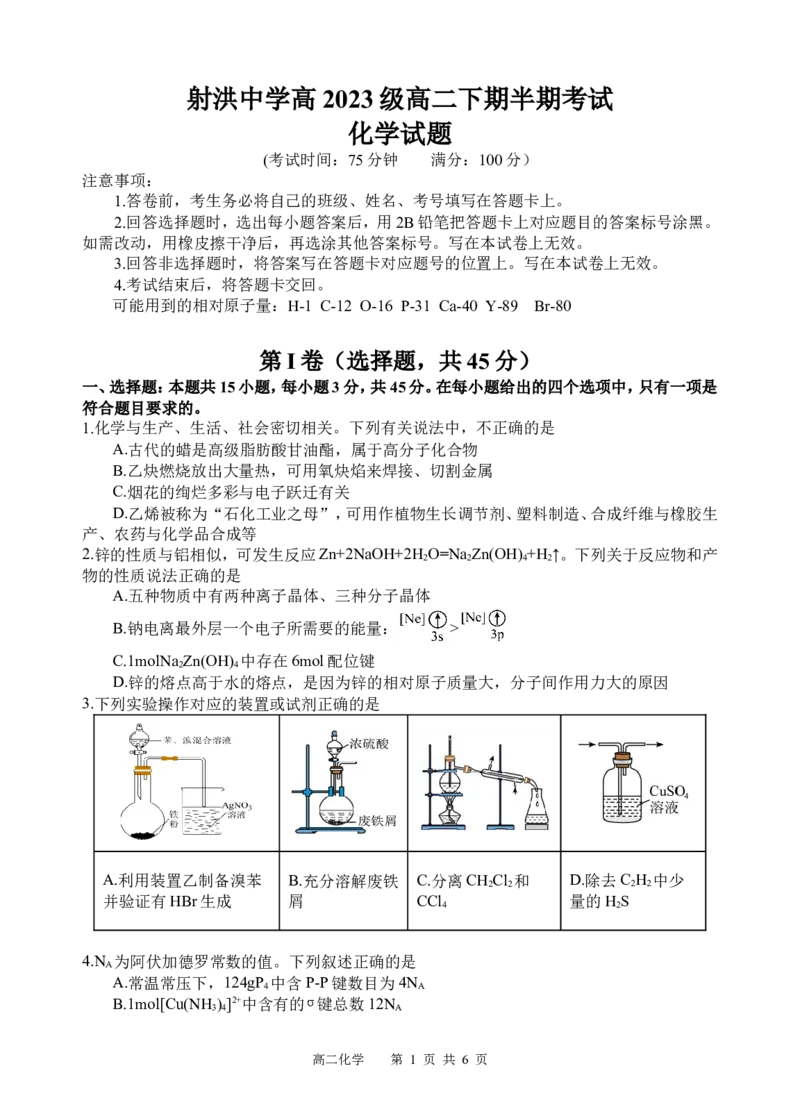
3.下列实验操作对应的装置或试剂正确的是
A.利用装置乙制备溴苯 B.充分溶解废铁 C.分离CH Cl 和 D.除去C H 中少
2 2 2 2
并验证有HBr生成 屑 CCl 量的H S
4 2
4.N 为阿伏加德罗常数的值。下列叙述正确的是
A
A.常温常压下,124gP 中含P-P键数目为4N
4 A
B.1mol[Cu(NH ) ]2+中含有的 键总数12N
3 4 A
高二化学 第 1 页 共 6 页C.46gCH CH OH中sp3杂化的原子数为2N
3 2 A
D.含4molSi-O键的SiO 晶体中硅原子数目为N
2 A
5.下列反应中前者属于取代反应,后者属于加成反应的是
A.光照甲烷与氯气的混合物;乙烯使酸性高锰酸钾溶液褪色
B.苯滴入浓硝酸和浓硫酸的混合液中水浴加热;乙烯与水蒸气在一定条件下反应生成乙醇
C.乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷
D.在苯中滴入溴水,充分振荡,溴水褪色;乙烯使溴水褪色
6.下列说法错误的是
A. 键和 键比例为
B.某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7733、10540、13630、
17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C. 与 互为等电子体, 中含有的 键数目为 , 的电子式为
D.已知反应 ,若该反应中有 键断裂,则形成的
键数目为
7.下列说法错误的是
A.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
B.可用四氯化碳萃取碘水中的碘单质
C.将相同大小的钠块分别投入乙醇和水中,乙醇比水反应更剧烈
D.三氟乙酸的酸性强于三氯乙酸的酸性
8.分子之间可通过空间结构和作用力协同产生某种选择性,从而实现分子识别。下图是一种分
子梭,在链状分子A上有两个不同的识别位点。下列说法错误的是
A.分子B含有醚键,属于冠醚,可以与分子A形成超分子
B.酸性条件下,分子B与位点2之间存在氢键N-H···O
C.分子B内部有很大的空间,能识别所有碱金属离子
D.通过加入酸或碱,实现分子梭在两个不同状态之间的切换
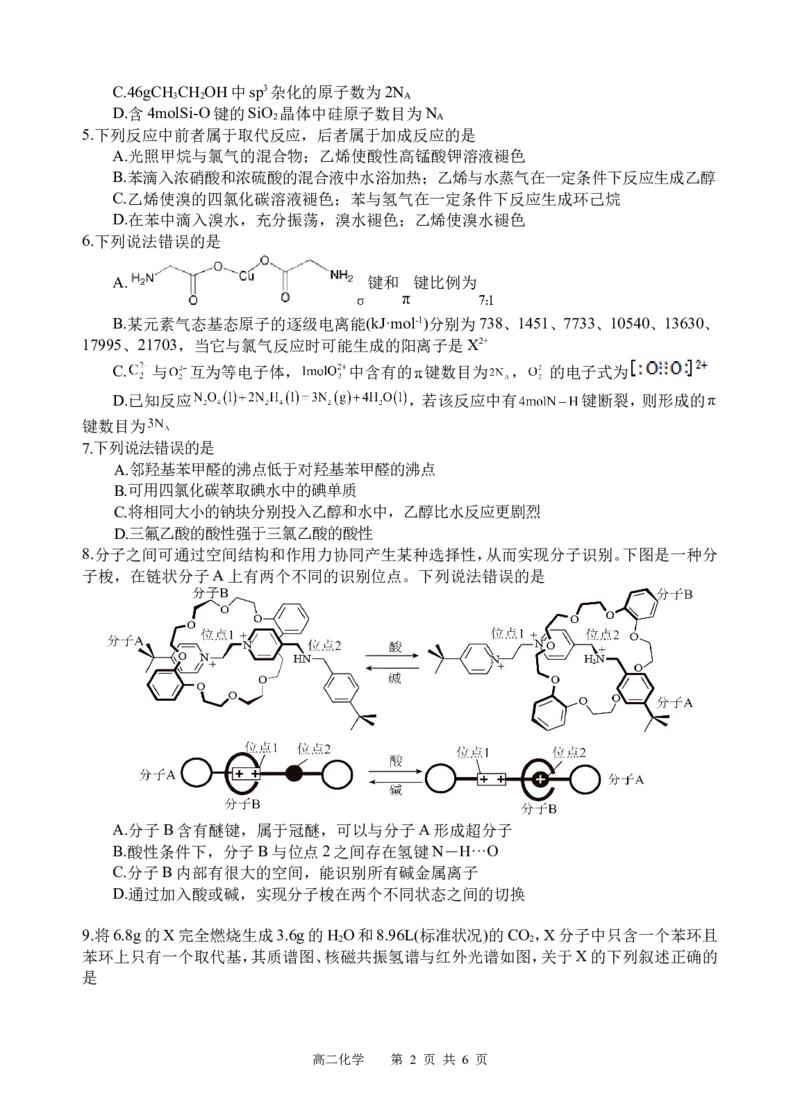
9.将6.8g的X完全燃烧生成3.6g的H O和8.96L(标准状况)的CO ,X分子中只含一个苯环且
2 2
苯环上只有一个取代基,其质谱图、核磁共振氢谱与红外光谱如图,关于X的下列叙述正确的
是
高二化学 第 2 页 共 6 页A. 化合物X的分子式为C H O
8 10 2
B. 由核磁共振氢谱可知,X分子中有3种不同化学环境的氢原子
C. 符合题中X分子核磁共振氢谱、红外光谱的有机物有1种
D.X分子中所有的原子一定在同一个平面上
10.从苯甲醛和KOH溶液反应后的混合液中分离出苯甲醇和苯甲酸的过程如下:
已知甲基叔丁基醚的密度为 ,下列说法错误的是
A. “萃取”过程的萃取剂也可以选择乙醇
B. “有机层”从分液漏斗上口倒出
C. “操作X”为蒸馏,“试剂Y”可选用盐酸
D.实验所得的苯甲酸粗产品,可以利用重结晶进一步提纯
11.下列关于晶体的说法正确的是
A.Si与C同属IVA族,因此SiO₂和CO₂两种晶体中的微粒间作用力完全相同
B金刚石与石墨两种晶体中的C 原子杂化方式相同
C.NaHSO₄固体加热熔化时破坏了该物质中的离子键和共价键
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
12.下列说法不正确 的是
A.只含有一种等效氢的C H ,可命名为2,2-二甲基丙烷
5 12
B. 的一氯代物有4种
C.2-甲基-3-己烯存在顺反异构
D.二环 丁烷( )的二溴代物有4种(不考虑立体异构)
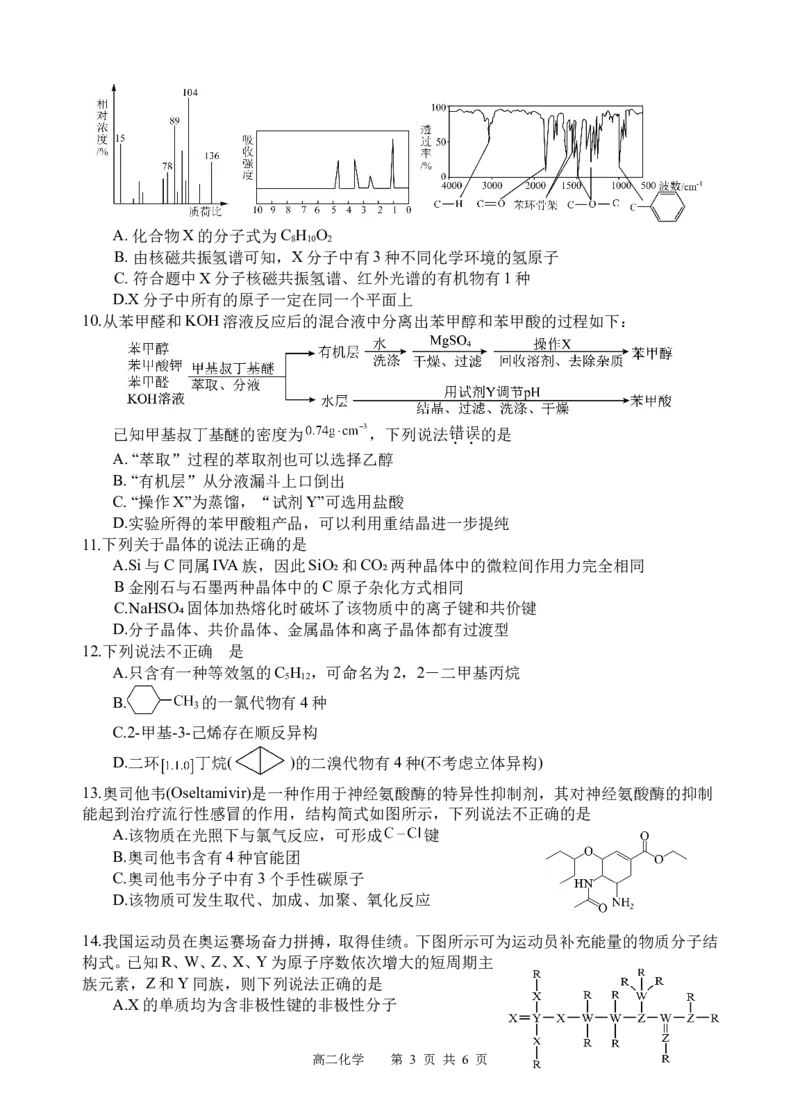
13.奥司他韦(Oseltamivir)是一种作用于神经氨酸酶的特异性抑制剂,其对神经氨酸酶的抑制
能起到治疗流行性感冒的作用,结构简式如图所示,下列说法不正确的是
A.该物质在光照下与氯气反应,可形成 键
B.奥司他韦含有4种官能团
C.奥司他韦分子中有3个手性碳原子
D.该物质可发生取代、加成、加聚、氧化反应
14.我国运动员在奥运赛场奋力拼搏,取得佳绩。下图所示可为运动员补充能量的物质分子结
构式。已知R、W、Z、X、Y为原子序数依次增大的短周期主
族元素,Z和Y同族,则下列说法正确的是
A.X的单质均为含非极性键的非极性分子
高二化学 第 3 页 共 6 页B.沸点:ZR X>W
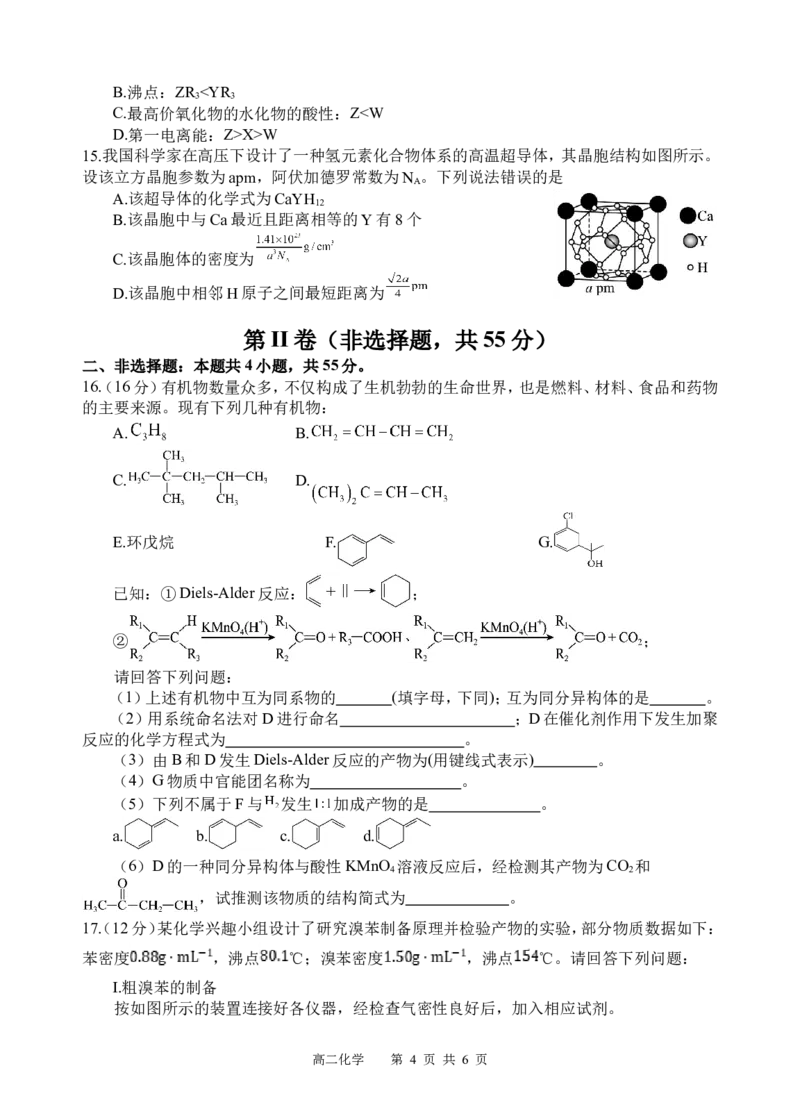
15.我国科学家在高压下设计了一种氢元素化合物体系的高温超导体,其晶胞结构如图所示。
设该立方晶胞参数为apm,阿伏加德罗常数为N 。下列说法错误的是
A
A.该超导体的化学式为CaYH
12
B.该晶胞中与Ca最近且距离相等的Y有8个
C.该晶胞体的密度为
D.该晶胞中相邻H原子之间最短距离为
第 II 卷(非选择题,共 55 分)
二、非选择题:本题共4小题,共55分。
16.(16分)有机物数量众多,不仅构成了生机勃勃的生命世界,也是燃料、材料、食品和药物
的主要来源。现有下列几种有机物:
A. B.
C. D.
E.环戊烷 F. G.
已知:①Diels-Alder反应: ;
② ;
请回答下列问题:
(1)上述有机物中互为同系物的 (填字母,下同);互为同分异构体的是 。
(2)用系统命名法对D进行命名 ;D在催化剂作用下发生加聚
反应的化学方程式为 。
(3)由B和D发生Diels-Alder反应的产物为(用键线式表示) 。
(4)G物质中官能团名称为 。
(5)下列不属于F与 发生 加成产物的是 。
a. b. c. d.
(6)D的一种同分异构体与酸性KMnO 溶液反应后,经检测其产物为CO 和
4 2
,试推测该物质的结构简式为 。
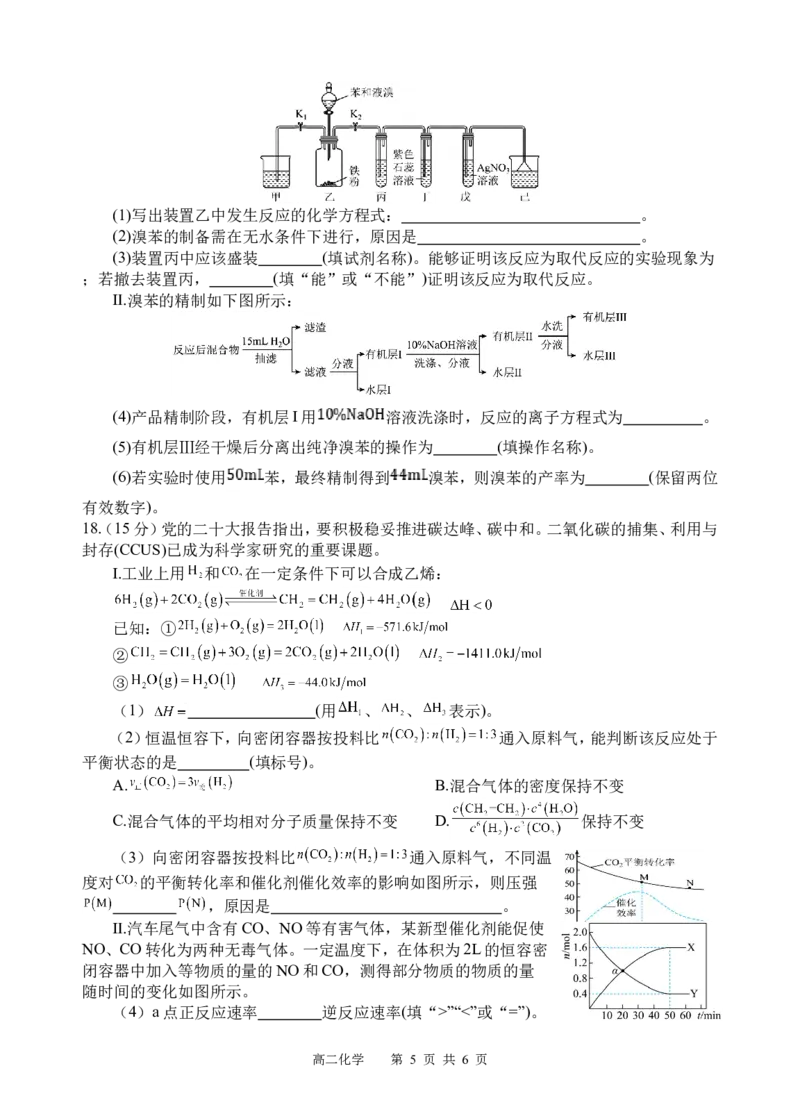
17(. 12分)某化学兴趣小组设计了研究溴苯制备原理并检验产物的实验,部分物质数据如下:
苯密度 ,沸点 ℃;溴苯密度 ,沸点 ℃。请回答下列问题:
I.粗溴苯的制备
按如图所示的装置连接好各仪器,经检查气密性良好后,加入相应试剂。
高二化学 第 4 页 共 6 页(1)写出装置乙中发生反应的化学方程式: 。
(2)溴苯的制备需在无水条件下进行,原因是 。
(3)装置丙中应该盛装 (填试剂名称)。能够证明该反应为取代反应的实验现象为
;若撤去装置丙, (填“能”或“不能”)证明该反应为取代反应。
Ⅱ.溴苯的精制如下图所示:
(4)产品精制阶段,有机层I用 溶液洗涤时,反应的离子方程式为 。
(5)有机层Ⅲ经干燥后分离出纯净溴苯的操作为 (填操作名称)。
(6)若实验时使用 苯,最终精制得到 溴苯,则溴苯的产率为 (保留两位
有效数字)。
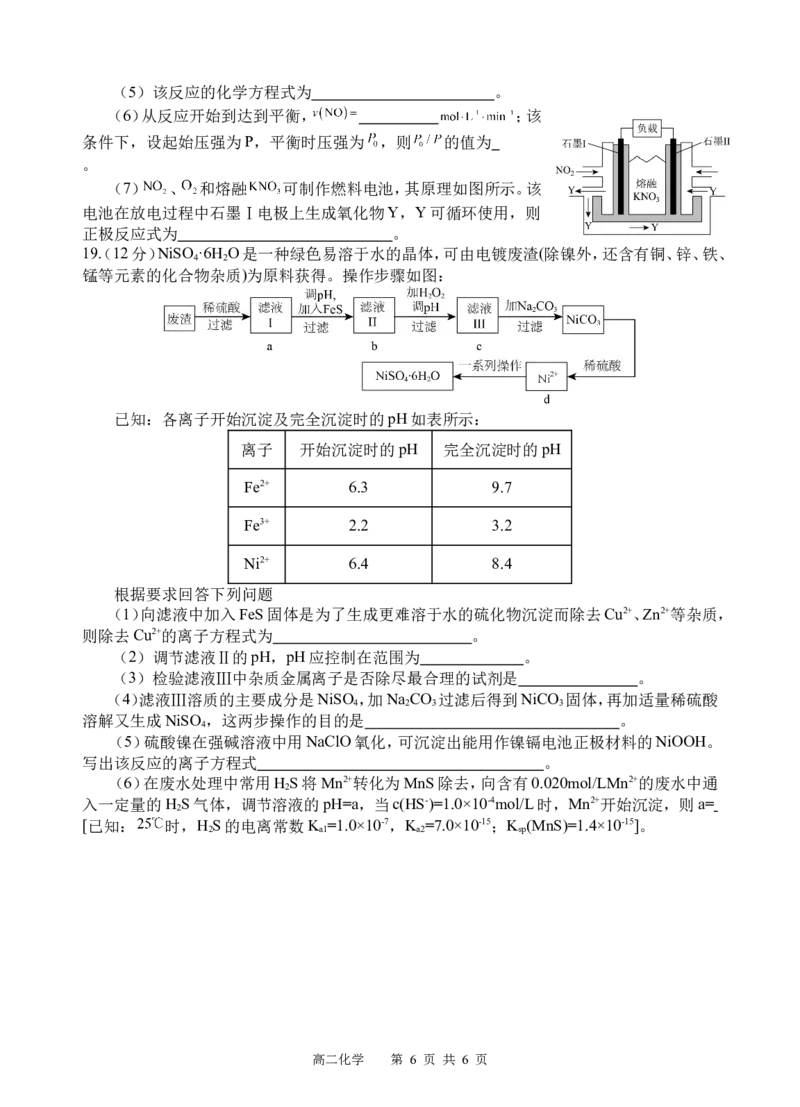
18.(15分)党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与
封存(CCUS)已成为科学家研究的重要课题。
I.工业上用 和 在一定条件下可以合成乙烯:
已知:①
②
③
(1) (用 、 、 表示)。
(2)恒温恒容下,向密闭容器按投料比 通入原料气,能判断该反应处于
平衡状态的是 (填标号)。
A. B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D. 保持不变
(3)向密闭容器按投料比 通入原料气,不同温
度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强
,原因是 。
Ⅱ.汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使
NO、CO转化为两种无毒气体。一定温度下,在体积为2L的恒容密
闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量
随时间的变化如图所示。
(4)a点正反应速率 逆反应速率(填“>”“<”或“=”)。
高二化学 第 5 页 共 6 页(5)该反应的化学方程式为 。
(6)从反应开始到达到平衡, ;该
条件下,设起始压强为P,平衡时压强为 ,则 的值为
。
(7) 、 和熔融 可制作燃料电池,其原理如图所示。该
电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则
正极反应式为 。
19(. 12分)NiSO ·6H O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁、
4 2
锰等元素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的pH如表所示:
离子 开始沉淀时的pH 完全沉淀时的pH
Fe2+ 6.3 9.7
Fe3+ 2.2 3.2
Ni2+ 6.4 8.4
根据要求回答下列问题
(1)向滤液中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,
则除去Cu2+的离子方程式为 。
(2)调节滤液Ⅱ的pH,pH应控制在范围为 。
(3)检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是 。
(4)滤液Ⅲ溶质的主要成分是NiSO ,加Na CO 过滤后得到NiCO 固体,再加适量稀硫酸
4 2 3 3
溶解又生成NiSO ,这两步操作的目的是 。
4
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。
写出该反应的离子方程式 。
(6)在废水处理中常用H S将Mn2+转化为MnS除去,向含有0.020mol/LMn2+的废水中通
2
入一定量的H S气体,调节溶液的pH=a,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则a=
2
[已知: 时,H S的电离常数K =1.0×10-7,K =7.0×10-15;K (MnS)=1.4×10-15]。
2 a1 a2 sp
高二化学 第 6 页 共 6 页