文档内容
2025-2026 学年上学期期末考试
高二年级 化学
本试卷共8页。考试结束后,将答题卡交回。
注意事项:1.答卷前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生
信息条形码粘贴区。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案
无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量: H1 C12 N14 O16 S32 K39 Fe56 Cu64
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项
符合题目要求。
1.化学与人类生产生活密切相关,下列说法不正确的是
A.利用太阳能电池将光能转化为电能,可减少化石燃料的使用,有利于环境保护
B.神舟十八号采用的燃料之一为液态的偏二甲肼[(CH ) NNH ],完全燃烧放出大量的热,
3 2 2
生成二氧化碳、氮气和水,具有产物清洁无污染等优点
C.使用干冰进行人工降雨,固态干冰升华过程会破坏极性键,吸收大量热
D.人体血浆中H CO /HCO -缓冲体系对稳定人体内环境的酸碱度有着重要作用
2 3 3
2.下列化学用语表达正确的是
A.SO 的VSEPR模型为 B.基态硫原子价层电子轨道示意图:
3
C.基态Ge原子简化电子排布式:[Ar]4s24p2 D.基态钛原子价电子排布式:3d24s2
3.N 为阿伏伽德罗常数的值。下列叙述正确的是
A
A.1mol丙烯(CH CH=CH )分子中,sp3杂化的原子个数为N
3 2 A
B.常温时,pH=12的NaOH溶液中含有的Na+数目为0.01N
A
C.由热化学方程式PCl (l)+Cl (g)⇌ PCl (s) ΔH=-123.8kJ·mol-1可知,要使反应放出
3 2 5
123.8kJ的热量,反应前需要投入的PCl (l)与Cl (g)的分子个数均为N
3 2 A
D.68g呋喃( )中含有的键数目为4.5N
A
4.从微观视角探析物质结构及性质是学习化学的有效方法。下列说法正确的是
A.乙醇(CH CH OH)的质谱图中,相对丰度最大的峰归属于CH CH OH+
3 2 3 2
B.水的沸点高于氟化氢的沸点是因为OHO的键能大于FHF的键能
C.Li和Mg两种元素处于周期表的对角线位置,且都属于p区元素,所以有些性质相似
D.臭氧分子为极性分子,其在水中的溶解度小于在四氯化碳中的溶解度
学科网(北京)股份有限公司
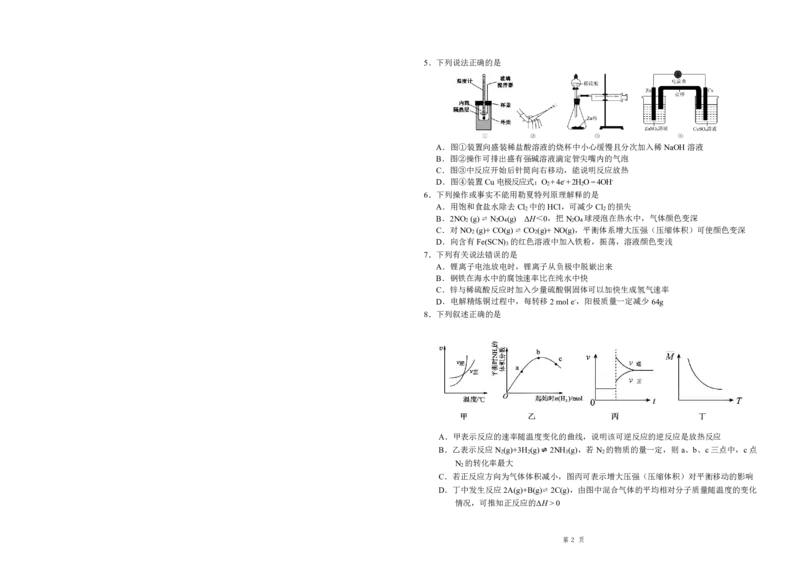
第 1 页5.下列说法正确的是
A.图①装置向盛装稀盐酸溶液的烧杯中小心缓慢且分次加入稀NaOH溶液
B.图②操作可排出盛有强碱溶液滴定管尖嘴内的气泡
C.图③中反应开始后针筒向右移动,能说明反应放热
D.图④装置Cu电极反应式:O +4e-+2HO=4OH-
2 2
6.下列操作或事实不能用勒夏特列原理解释的是
A.用饱和食盐水除去Cl 中的HCl,可减少Cl 的损失
2 2
B.2NO (g)⇌ N O (g) ΔH<0,把N O 球浸泡在热水中,气体颜色变深
2 2 4 2 4
C.对NO (g)+CO(g)⇌ CO (g)+NO(g),平衡体系增大压强(压缩体积)可使颜色变深
2 2
D.向含有Fe(SCN) 的红色溶液中加入铁粉,振荡,溶液颜色变浅
3
7.下列有关说法错误的是
A.锂离子电池放电时,锂离子从负极中脱嵌出来
B.钢铁在海水中的腐蚀速率比在纯水中快
C.锌与稀硫酸反应时加入少量硫酸铜固体可以加快生成氢气速率
D.电解精炼铜过程中,每转移2mole-,阳极质量一定减少64g
8.下列叙述正确的是
A.甲表示反应的速率随温度变化的曲线,说明该可逆反应的逆反应是放热反应
B.乙表示反应N (g)+3H (g)⇌ 2NH (g),若N 的物质的量一定,则a、b、c三点中,c点
2 2 3 2
N 的转化率最大
2
C.若正反应方向为气体体积减小,图丙可表示增大压强(压缩体积)对平衡移动的影响
D.丁中发生反应2A(g)+B(g)⇌ 2C(g),由图中混合气体的平均相对分子质量随温度的变化
情况,可推知正反应的ΔH>0
第 2 页9.下列说法正确的是
A.25℃时,测得0.1mol·L-1一元酸HA溶液pH=b,若将该溶液加水稀释100倍,所得溶
液pH=b+2(且b+2<7),则HA为强酸
B.泡沫灭火器的药品为Na CO (aq)和Al (SO ) (aq),利用了盐类的水解原理
2 3 2 4 3
C.0.1mol/LNH Cl溶液与0.05molL-lNaOH溶液等体积混合后显碱性,则混合溶液中:
4
c(Cl-)>c(Na+)>c(NH +)>c(NH ·H O)>c(OH-)>c(H+)
4 3 2
D.等体积、等pH值的醋酸和盐酸分别与0.1mol/LNaOH溶液恰好反应,前者消耗NaOH
溶液的体积少
10.原子序数依次增大的五种短周期主族元素X、Y、Z、Q、W组成的化合物的结构如图所示,
基态Q原子核外成对电子数是未成对电子数的3倍。下列说法正确的是
A.简单离子半径:W>Q>Z
B.简单气态氢化物的热稳定性:Z>Q
C.X、Y、Q形成的某种化合物中Y元素的化合价可能为+3价
D.只含有X、Z、Q三种元素的物质不可能是离子化合物
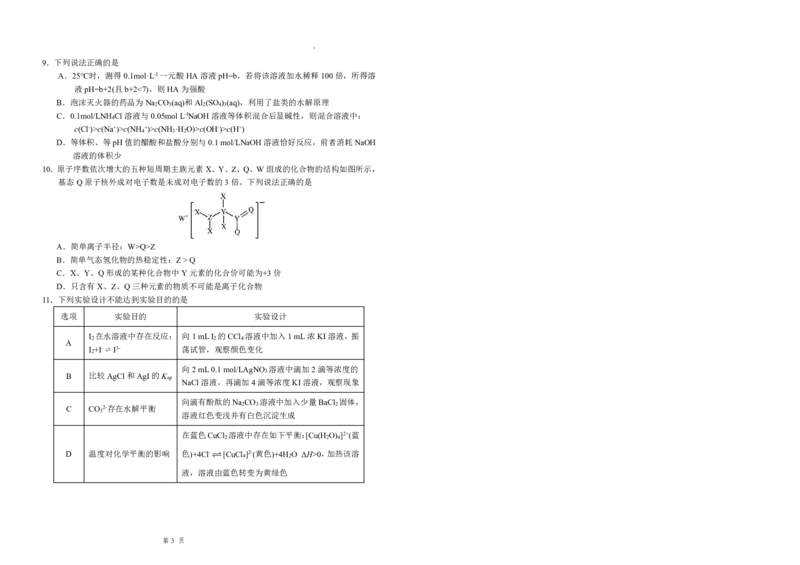
11.下列实验设计不能达到实验目的的是
选项 实验目的 实验设计
I 在水溶液中存在反应: 向1mLI 的CCl 溶液中加入1mL浓KI溶液,振
2 2 4
A
I +I-⇌ I3- 荡试管,观察颜色变化
2
向2mL0.1mol/LAgNO 溶液中滴加2滴等浓度的
3
B 比较AgCl和AgI的K
sp
NaCl溶液,再滴加4滴等浓度KI溶液,观察现象
向滴有酚酞的Na CO 溶液中加入少量BaCl 固体,
2 3 2
C CO 2-存在水解平衡
3
溶液红色变浅并有白色沉淀生成
在蓝色CuCl 溶液中存在如下平衡:[Cu(H O) ]2+(蓝
2 2 4
D 温度对化学平衡的影响 色)+4Cl-[CuCl
4
]2-(黄色)+4H
2
O ΔH>0,加热该溶
液,溶液由蓝色转变为黄绿色
学科网(北京)股份有限公司
第 3 页12.可逆反应2HI(g)⇌ H (g)+I (g)在体积固定的绝热密闭容器中,下列说法能说明反应达到化
2 2
学平衡状态的是
①体系温度不再改变 ②体系压强不再改变 ③混合气体密度不再改变
④混合气体的平均摩尔质量不再改变 ⑤体系内气体颜色不再变化 ⑥v(I ):v(H )=1:1
2 2
⑦2HI(g)的体积分数不再发生变化
A.①②④⑦ B.①②⑤⑦ C.①④⑤⑦ D.②③⑤⑥
13.二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I.CO(g)+2H (g)⇌ CH OH(g)
2 3
II.2CH OH(g)⇌ CH OCH (g)+H O(g)
3 3 3 2
500K时,在2L恒容密闭容器中充入4molCO和8molH ,4min达到平衡,平衡时CO的
2
转化率为80%,且2c(CH OH)=c(CH OCH ),则下列说法不正确的是
3 3 3
A.0~4min,反应I的v(CO)=0.4mol·L-1·min-1
B.反应II中CH OH的转化率为80%
3
C.反应I的平衡常数K=4
D.平衡时压强与初始压强的比为7:15
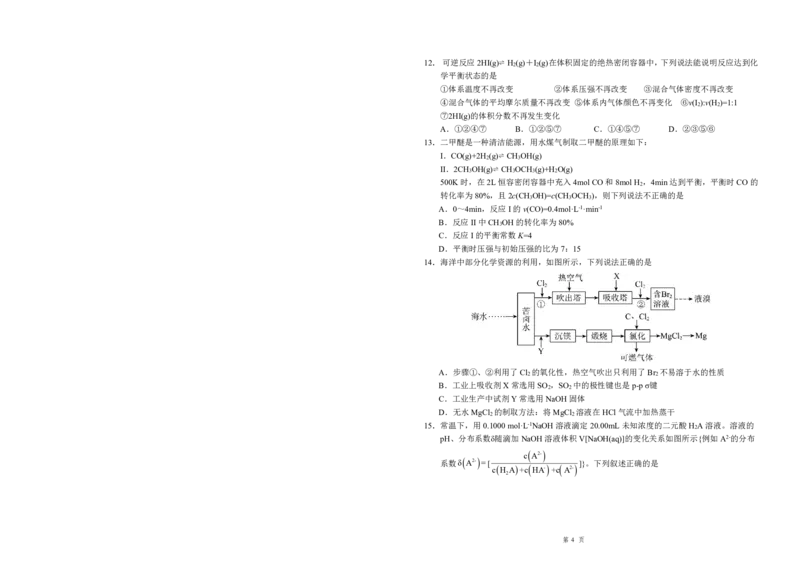
14.海洋中部分化学资源的利用,如图所示,下列说法正确的是
A.步骤①、②利用了Cl 的氧化性,热空气吹出只利用了Br 不易溶于水的性质
2 2
B.工业上吸收剂X常选用SO ,SO 中的极性键也是p-pσ键
2 2
C.工业生产中试剂Y常选用NaOH固体
D.无水MgCl 的制取方法:将MgCl 溶液在HCl气流中加热蒸干
2 2
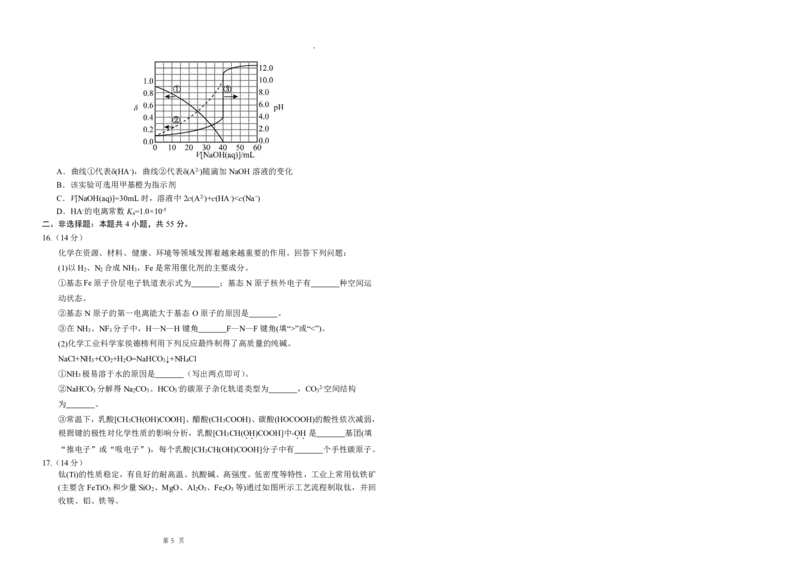
15.常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL未知浓度的二元酸H A溶液。溶液的
2
pH、分布系数δ随滴加NaOH溶液体积V[NaOH(aq)]的变化关系如图所示{例如A2-的分布
c
A2-
系数δ
A2-
=[ ]}。下列叙述正确的是
cH A+c HA- +c A2-
2
第 4 页A.曲线①代表δ(HA-),曲线②代表δ(A2-)随滴加NaOH溶液的变化
B.该实验可选用甲基橙为指示剂
C.V[NaOH(aq)]=30mL时,溶液中2c(A2-)+c(HA-)”或“<”)。
3 3
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH +CO +H O=NaHCO ↓+NH Cl
3 2 2 3 4
①NH 极易溶于水的原因是 (写出两点即可)。
3
②NaHCO 分解得Na CO 。HCO -的碳原子杂化轨道类型为 ,CO 2-空间结构
3 2 3 3 3
为 。
③常温下,乳酸[CH CH(OH)COOH]、醋酸(CH COOH)、碳酸(HOCOOH)的酸性依次减弱,
3 3
根据键的极性对化学性质的影响分析,乳酸[CH
3
CH(O.H.)COOH]中-O.H. 是 基团(填
“推电子”或“吸电子”),每个乳酸[CH CH(OH)COOH]分子中有 个手性碳原子。
3
17.(14分)
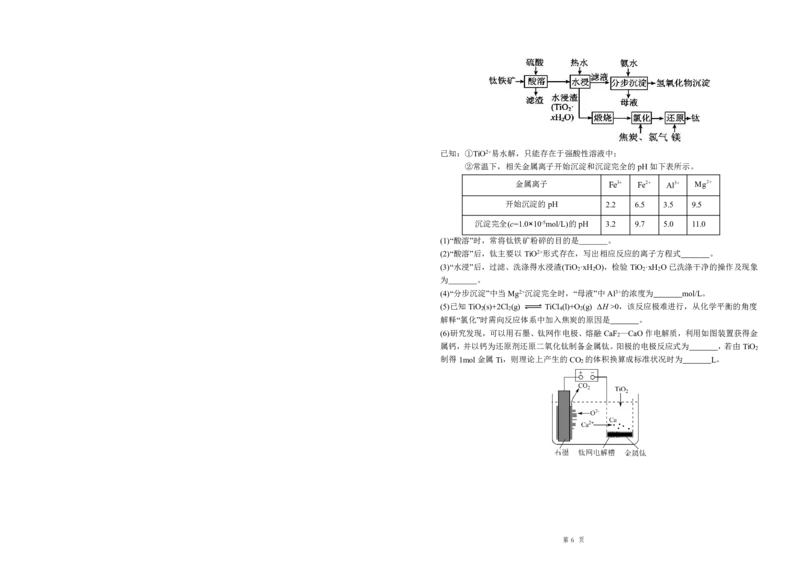
钛(Ti)的性质稳定,有良好的耐高温、抗酸碱、高强度、低密度等特性,工业上常用钛铁矿
(主要含FeTiO 和少量SiO 、MgO、Al O 、Fe O 等)通过如图所示工艺流程制取钛,并回
3 2 2 3 2 3
收镁、铝、铁等。
学科网(北京)股份有限公司
第 5 页已知:①TiO2+易水解,只能存在于强酸性溶液中;
②常温下,相关金属离子开始沉淀和沉淀完全的pH如下表所示。
金属离子 Fe3 Fe2 Al3 Mg2
开始沉淀的pH 2.2 6.5 3.5 9.5
沉淀完全(c=1.0×10-5mol/L)的pH 3.2 9.7 5.0 11.0
(1)“酸溶”时,常将钛铁矿粉碎的目的是 。
(2)“酸溶”后,钛主要以TiO2+形式存在,写出相应反应的离子方程式 。
(3)“水浸”后,过滤、洗涤得水浸渣(TiO ·xH O),检验TiO ·xH O已洗涤干净的操作及现象
2 2 2 2
为 。
(4)“分步沉淀”中当Mg2+沉淀完全时,“母液”中Al3+的浓度为 mol/L。
(5)已知TiO (s)+2Cl (g) TiCl (l)+O (g) ΔH>0,该反应极难进行,从化学平衡的角度
2 2 4 2
解释“氯化”时需向反应体系中加入焦炭的原因是 。
(6)研究发现,可以用石墨、钛网作电极、熔融CaF —CaO作电解质,利用如图装置获得金
2
属钙,并以钙为还原剂还原二氧化钛制备金属钛。阳极的电极反应式为 ,若由TiO
2
制得1mol金属Ti,则理论上产生的CO 的体积换算成标准状况时为 L。
2
第 6 页18.(13分)
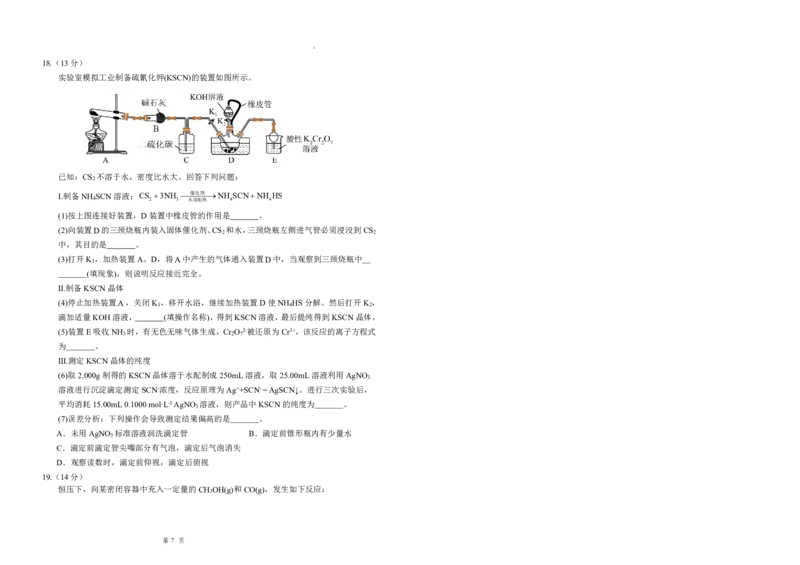
实验室模拟工业制备硫氰化钾(KSCN)的装置如图所示。
已知:CS 不溶于水,密度比水大。回答下列问题:
2
I.制备NH SCN溶液:CS 3NH 催化剂NH SCNNH HS
4 2 3 水浴加热 4 4
(1)按上图连接好装置,D装置中橡皮管的作用是 。
(2)向装置D的三颈烧瓶内装入固体催化剂、CS 和水,三颈烧瓶左侧进气管必须浸没到CS
2 2
中,其目的是 。
(3)打开K ,加热装置A、D,将A中产生的气体通入装置D中,当观察到三颈烧瓶中
1
(填现象),则说明反应接近完全。
Ⅱ.制备KSCN晶体
(4)停止加热装置A,关闭K ,移开水浴,继续加热装置D使NH HS分解。然后打开K ,
1 4 2
滴加适量KOH溶液, (填操作名称),得到KSCN溶液,最后提纯得到KSCN晶体。
(5)装置E吸收NH 时,有无色无味气体生成,Cr O 2-被还原为Cr3+,该反应的离子方程式
3 2 7
为 。
Ⅲ.测定KSCN晶体的纯度
(6)取2.000g制得的KSCN晶体溶于水配制成250mL溶液,取25.00mL溶液利用AgNO
3
溶液进行沉淀滴定测定SCN-浓度,反应原理为Ag++SCN-=AgSCN↓。进行三次实验后,
平均消耗15.00mL0.1000mol∙L-1AgNO 溶液,则产品中KSCN的纯度为 。
3
(7)误差分析:下列操作会导致测定结果偏高的是 。
A.未用AgNO 标准溶液润洗滴定管 B.滴定前锥形瓶内有少量水
3
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
19.(14分)
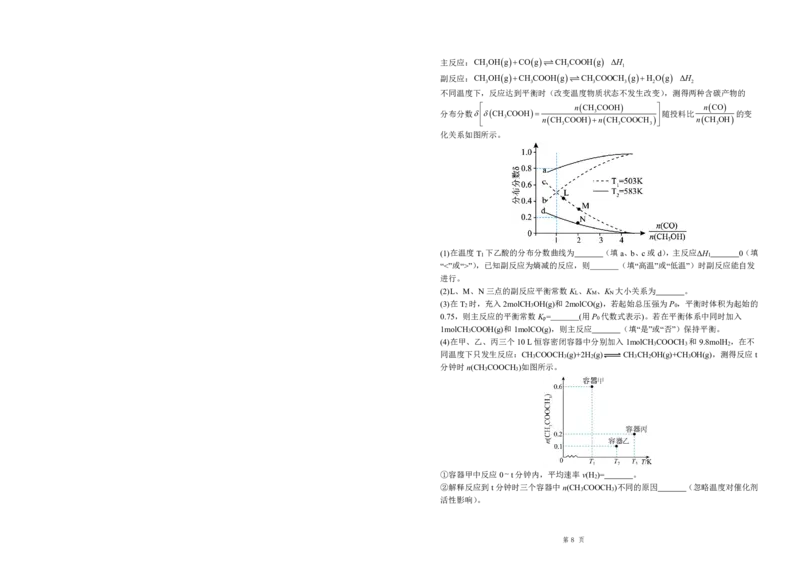
恒压下,向某密闭容器中充入一定量的CH OH(g)和CO(g),发生如下反应:
3
学科网(北京)股份有限公司
第 7 页主反应:CH OHgCOg CH COOHg ΔH
3 3 1
副反应:CH OHgCH COOHg CH COOCH gH Og ΔH
3 3 3 3 2 2
不同温度下,反应达到平衡时(改变温度物质状态不发生改变),测得两种含碳产物的
nCH COOH nCO
分布分数CH COOH 3 随投料比 的变
3 nCH
3
COOHnCH
3
COOCH
3
nCH
3
OH
化关系如图所示。
(1)在温度T 下乙酸的分布分数曲线为 (填a、b、c或d),主反应ΔH 0(填
1 1
“<”或“>”),已知副反应为熵减的反应,则 (填“高温”或“低温”)时副反应能自发
进行。
(2)L、M、N三点的副反应平衡常数K 、K 、K 大小关系为 。
L M N
(3)在T 时,充入2molCH OH(g)和2molCO(g),若起始总压强为P ,平衡时体积为起始的
2 3 0
0.75,则主反应的平衡常数K = (用P 代数式表示)。若在平衡体系中同时加入
p 0
1molCH COOH(g)和1molCO(g),则主反应 (填“是”或“否”)保持平衡。
3
(4)在甲、乙、丙三个10L恒容密闭容器中分别加入1molCH COOCH 和9.8molH ,在不
3 3 2
同温度下只发生反应:CH COOCH (g)+2H (g) CH CH OH(g)+CH OH(g),测得反应t
3 3 2 3 2 3
分钟时n(CH COOCH )如图所示。
3 3
①容器甲中反应0t分钟内,平均速率v(H )= 。
2
②解释反应到t分钟时三个容器中n(CH COOCH )不同的原因 (忽略温度对催化剂
3 3
活性影响)。
第 8 页吉林省普通高中 G8 教考联盟 2024-2025 学年上学期期末考试
高二年级 化学学科参考答案
一、选择题
(每小题3分,共45分)
1. 【
1 2 3 4 5 6 7 8 9 10
解
C D A D B C D B A C
析】
11 12 13 14 15
C项
B B C D A
干冰
升华破坏分子间作用力,而非极性键,是物理变化
2. 【解析】A项SO 的VSEPR模型为平面三角形;B项S价层既有s轨道也有p轨道;C项
3
漏写3d轨道
3. 【解析】B项体积未知,无法求算;C项反应可逆,需要多加原料;D项68g为1mol,键
数目为9N
A
4. 【解析】A项, 在高中阶段所给的乙醇(CH CH OH)的质谱图中,质荷比最大的峰归属于
3 2
CH CH OH+;B项水中氢键键能小于HF,但数量比HF多;C项, Li和Mg两种元素都属于
3 2
s区元素
5. 【解析】A项酸碱混合要迅速,否则热量散失严重;C项产生气体也能是针筒变化;D项应
为Cu2++2e-=Cu
6. 【解析】C项反应前后气体体积不变,加压平衡不移动
7. 【解析】D项阳极为粗铜,放电的金属不一定是铜
8. 【解析】A项v 斜率更大,为吸热方向;C项加压平衡正向移动,应该v >v ;D项有图
逆 正 逆
像可知温度升高,M减小,结合n=m/M推出n增大,平衡逆向移动,正反应放热
9. 【解析】B项应为小苏打和硫酸铝;C项二者混合后得到等浓度的NH Cl、NaCl和NH ·H O
4 3 2
溶液,显碱性,说明NH ·H O电离程度大于NH Cl水解程度,则有
3 2 4
c(Cl-)>c(NH +)>c(Na+)>c(NH ·H O)>c(OH-)>c(H+);D项醋酸浓度更大,耗碱更多
4 3 2
10.【解析】X、Y、Z、Q、W元素分别为H、C、N、O、Na。A项三者为具有相同电子层结
构的离子,核电荷数越大,半径越小,应为N3->O2->Na+;B项应为非金属性O>N,应为H O>NH ;
2 3
C项可以为草酸;D项可以是硝酸铵
11.【解析】B项AgNO 过量,因此不能通过该实验比较AgCl和AgI的Ksp,B符合题意;
3
12.【解析】此反应为恒容绝热体积不变情况,根据PV=nRT及“变量不变”可知选B
学科网(北京)股份有限公司
第 9 页13.【解析】根据题意,采用三段式
CO(g)+2H (g)⇌ CH OH(g) 单位mol
2 3
n 4 8 0
始
∆n 3.2 6.4 3.2
n 0.8 1.6 3.2
末
2CH OH(g)⇌ CH OCH (g)+H O(g)
3 3 3 2
n 3.2 0 0
始
∆n 2x x x
n 3.2-2x x x
末
则2(3.2-x)=x 解得x=1.28
所以A项3.2/(2×4)=0.4mol·L-1·min-1正确;B项2×1.28/3.2=80%正确;C项数据处理
c(CO)=0.4mol/L,c(H )=0.8mol/L,c(CH OH)=0.32mol/L,代入平衡常数表达式,解得
2 3
K=1.25(mol/L)-2,D项压强比等于物质的量之比为(0.8+1.6+3.2)/12=7:15,正确
14.【解析】A.步骤①、②都是将溴离子氧化为溴单质,利用了Cl 的氧化性,热空气吹出也
2
利用了溴的易挥发性,A错误;
B.SO 分子中的硫原子和氧原子之间形成极性键,为sp2-pσ 键,B错误;
2
C.根据分析,工业生产中试剂Y常选用石灰乳,C错误;
D.蒸干时MgCl 水解会生成HCl气体,通入该气体可有效抑制水解程度,D正确
2
15.【解析】A.由分析可知,曲线①代表δ
HA
,曲线②代表δ(A2-),随滴加NaOH溶液的变
化,A正确;
B.由图可知,滴定终点时Na A溶液中A2-发生水解使溶液呈碱性,则选用酚酞为指示剂,B
2
错误;
C.V(NaOH)=30mL时,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒
c(Na⁺)+c(H+)=2c(A2-)+c(HA⁻)+c(OH-),可得c(Na+)<2c(A2-)+c(HA-),C错误;
D.利用曲线①、②的交点可知,c(HA-)=c(A2-),此时V(NaOH)=25mL,pH=2,c(H+)=10-2mol/L,
c
H+
c
A2-
HA的电离常数K
a
=
c
HA-
=c H+ =1.0 102,D错误;
二、非选择题
16.(14分)
【答案】
(1)
第 10 页① (1分) 5 (1分)
② 基态N原子价电子排布为2s22p3是半充满状态,比较稳定,电离能较高,而基态O原
子价电子排布为2s22p4失去一个电子后为半充满状态,易失去电子,电离能较低。(合理即可)
(2分)
③ >(2分)
(2)
① NH 与H O分子间能形成氢键 ; NH 、H O均为极性分子,根据“相似相溶”规律,
3 2 3 2
NH 易溶于水中;NH 与水反应(答出两个即可)(2分)
3 3
②sp2 (2分) 平面三角形(1分)
③吸电子(2分) 1(1分)
【解析】(1)③NH 、NF VSEPR模型相同,孤电子对个数相同,因为F比H电负性大,吸
3 3
引键合电子能力强,NF 中心N原子成键电子对斥力小,键角小。(2)
3
4223
②CO2中C的价层电子对数为3+ =3,无孤电子对,采用sp2杂化,空间构型为平面
3 2
三角形。HCO -中氢原子连接的是氧原子,所以中心C原子价层电子对数与CO2相同。
3 3
③根据键的极性对化学性质的影响分析,乳酸酸性强于醋酸,羧基中的羟基极性要增强,所以
-OH是吸电子基团
17.(14分,每空2分)
【答案】(1) 增大接触面积,加快酸溶速率,使反应更充分(合理即可)
(2) FeTiO 4H TiO2 Fe2 2H O (反应物和生成物均写对且未配平给1分)
3 2
(3) 取少量最后一次洗涤滤液少许于试管中,先加入盐酸,无明显现象后,再加氯化钡溶
液,若没有沉淀生成,则洗净。
(4) 1×10-23 (只写10-23 也给分)
(5) C与O 反应减少了O 的浓度,且C与O 反应放热,温度升高,根据列夏特列原理分
2 2 2
析,均使平衡向正反应方向移动(答出一个视角即可)
(6) C-4e-+2O2-=CO ↑(反应物和生成物均写且对未配平给1分,气体符号不写不扣分)
2
22.4
【解析】(1)“酸溶”时,常将钛铁矿粉碎的目的是增大接触面积,加快酸溶速率,反应更充
分(2)酸溶时发生的是硫酸和FeTiO 反应生成TiO2+的过程,离子方程式为:
3
FeTiO 4H TiO2 Fe2 2H O;
3 2
学科网(北京)股份有限公司
第 11 页(3)水浸后其中含有硫酸根离子,检验硫酸根离子洗涤干净就可以了,检验方法是:取最后一
次洗涤液,用稀盐酸酸化,无明显现象,再滴入几滴BaCl 溶液,没有白色沉淀产生,则证明
2
洗涤干净;
(4)根据Al3+沉淀完全时的 pH=5.0,可知溶液中c(OH-)=10-9mol•L-1时,溶液中
c(Al3+)=1.0×10-5mol•L-1,则K [Al(OH) ]=1.0×10-5×(10-9)3=1×10-32,“分步沉淀”中当Mg2沉淀完
sp 3
全时pH=11.0,即溶液中c(OH-)=10-3.0mol•L-1,则此时溶液中
K [Al(OH) ]
c(Al3+)= sp 3 =1×10-23(mol/L);
c3(OH-)
(5)已知TiO (s)2Cl (g)TiCl (l)O (g) ΔH0,加入焦炭后,C与O 反应减少了O 的
2 2 4 2 2 2
浓度,且C与O 反应放热,温度升高,根据勒夏特列原理分析,均使平衡正向移动;
2
(6)根据图知,阳极上C失电子和氧离子反应生成二氧化碳,电极反应式为C+2O2--4e-═CO ↑,
2
若由TiO 制得1mol金属Ti,电路中转移4mol电子,此时生成的CO 为1mol,标准状况下体积
2 2
为22.4L。
18.(13分,除标记外,每空2分)
【答案】(1)平衡气压,使氢氧化钾溶液顺利滴下 (2)增大反应物的接触面积并防倒吸(答
出一个即可)
(3)液体不再分层 (4)过滤 (1分)
(5)2NH CrO28H 2Cr3 N 7H O(反应物和生成物均写对且未配平给1分,气
3 2 7 2 2
体符号不写不扣分)
(6)72.75% (写成0.7275给分) (7)AC
【分析】A装置为氨气制备装置,经过B干燥后通入二硫化碳,二者在D中发生反应
CS +3NH 水浴加热NH SCN+NH HS,反应结束后停止加热装置A,关闭K ,移开水浴,继
2 3 催化剂 4 4 1
续加热装置D使NH HS分解。然后打开K ,趁热滴加适量KOH溶液即可得到KSCN溶液,
4 2
同时有氨气逸出,E为尾气处理装置。
【解析】(1)整个装置有气体生成并在后续参加反应,需要保证KOH溶液顺利滴下,所
以设计成恒压装置;
(2)氨气和二硫化碳是反应物,充分接触可以加快反应速率并使反应更充分,氨气极易溶于水,
要防倒吸
(3)CS 和水互不相溶,根据分析反应结束后得到的NH SCN、NH HS溶液,因此当反应结
2 4 4
束时液体不再分层;
(4)停止加热装置A,关闭K ,移开水浴,继续加热装置D使分解。然后打开K ,趁热滴加
1 2
第 12 页适量KOH溶液,NH SCN和KOH反应生成KSCN,先滤去三颈烧瓶中的固体催化剂,得到
4
KSCN溶液,最后提纯得到KSCN晶体;
(5)Cr
2
O
7
2被NH
3
还原为Cr3、氨气被氧化为氮气,离子方程式为
2NH +Cr O2-+8H+=2Cr3++N +7H O;
3 2 7 2 2
Ag+ ~ SCN
1mol 1mol
(6)根据化学方程式有 ,可得n(KSCN)=0.015mol,则
25
1510-3L0.1mol/L n KSCN
250
0.01597g
KSCN的纯度为 100%72.75%;
2.000g
(7)A.未用AgNO 标准溶液润洗滴定管导致标准液被稀释,标准液消耗体积偏大,结果偏高;
3
B.滴定前锥形瓶内有少量水不影响滴定结果;
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,把气泡体积误当成标准液体积,标准液
体积偏大,结果偏高;
D.观察读数时,滴定前仰视,滴定后俯视,导致标准液体积读数偏小,结果偏低;选AC。
19.(14分,除标记外,每空2分)
3
【答案】(1)b >(1分) 低温(1分) (2) K =K >K (3) 否
L M N P
0
0.08 2
(4) molL-1min-(1 mol·L-1·min-1 给分,不写单位扣1分,写错单位不得分) 甲、
t 25t
乙、丙容器内温度依次升高,容器乙反应速率大于容器甲,所以乙中n(CH COOCH )剩余
3 3
更少;容器丙速率最快,t分钟时已经达到平衡且平衡向逆反应方向发生了移动,故剩余
n(CH COOCH )比乙多 (叙述合理即可)
3 3
【解析】(1)生成CH COOH为主反应,故曲线a、b为不同温度下乙酸的分布分数曲线,故曲
3
线b为温度T 下乙酸的分布分数曲线;温度升高时,乙酸分布分数曲线升高,故ΔH 0;副反
1 1
应温度升高时,CH COOCH 分布分数曲线降低,故ΔH 0,ΔS <0,低温时ΔG<0,副反应自
3 3 2 2
发进行。
(2)副反应平衡常数仅与温度有关,ΔH 0,故温度越高,K越小,因此K =K >K 。
2 L M N
(3)起始总物质的量:2+2=4mol,恒压下体积与物质的量成正比,平衡时总物质的量为4×0.75=3
mol。主反应反应前后有物质的量减小,CH OHgCOg CH COOHg ,物质的量变化
3 3
为Δn=−1(每反应1molCO,总物质的量减少1mol),而副反应反应前后物质的量没有变化,所
以平衡时:CO为1mol,再根据图像中T 温度下投料比为1时,平衡状态乙酸和乙酸甲酯的分
2
布系数比为4:1,三段式计算可得平衡时,CH COOH为0.8mol
3
学科网(北京)股份有限公司
第 13 页,CH COOCH 为0.2mol,CH OH为0.8mol,总物质的量3mol,各物质分压为:CH COOH
3 3 3 3
3
与CH OH均为0.8P /3,CO为P /3,根据平衡常数表达式可得主反应K =
3 0 0 p P
0
在平衡体系中同时加入1molCH COOH和1molCO,总物质的量5mol,计算各物质分压后得到
3
Q ≠K ,平衡会发生移动;
p p
(4)容器甲中反应0t分钟内,ΔnCH COOCH 0.4mol,ΔnH 0.8mol,V=10L,
3 3 2
0.08
vH molL-1min-1 ;原因是温度影响反应速率和化学平衡, 甲、乙、丙容器内温度
2 t
依次升高,容器乙反应速率大于容器甲,所以乙中n(CH COOCH )剩余更少;容器丙速率最快,
3 3
t分钟时已经达到平衡且向左发生了移动,故剩余n(CH COOCH )比乙多。
3 3
第 14 页