文档内容
2024-2025 学年度第一学期高二年级化学学科期中练习
出题人:高二化学组,审题人:高二化学组,审核人:王静波,考试时间90分钟
已知相对原子质量:H 1 O 16 C 12 S 32 N 14
一、单选题(每小题2分,共44分)
1.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.钠与水反应 B.灼热的炭与二氧化碳反应
C. 与 反应 D.甲烷在氧气中的燃烧反应
2.能量与科学、技术、社会、环境关系密切。下列装置工作时由化学能转化为电能的是( )
A B C D
天然气燃气灶 太阳能电池 氢氧燃料电池 电解熔融NaCl
3.原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是( )
装置① 装置②
A.装置①研究的是电解 溶液,阴极产物有红色固体析出
B.装置②是将化学能转化为电能
C.装置②中 是正极反应物,发生的是氧化反应
D.两个装置中涉及的主要反应都是氧化还原反应
4.下列措施是为了增大化学反应速率的是( )
A.用锌粒代替镁粉制备氢气 B.将食物放进冰箱避免变质
C.自行车车架镀漆避免生锈 D.工业合成氨时加入催化剂
5.下列事实不能用平衡移动原理解释的是( )
A.反应 平衡后,加压,颜色加深
B.实验室可用排饱和食盐水的方法收集氯气C. ,工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
D.血红蛋白(Hb)可与氧气结合: ,CO比 更易和Hb结合,当空气中的CO浓度
大时,易造成人体缺氧,严重时导致死亡
6.下列实验装置(部分夹持装置已略去)不能达到对应实验目的是( )
A B C D
实验 测定锌与稀硫酸反 探究温度对化学平衡移动 验证电解饱和食盐水
铁制品表面镀铜
目的 应速率 的影响 的阳极产物
实验
装置
7.粗铜中含有少量铁、锌、银、金等杂质,工业上可用电解法精炼粗铜制得纯铜,下列说法正确的是(
)
A.精铜做阳极,粗铜做阴极 B.阴极只能是 被还原
C.电解时,阳极反应只有 D.电解后,可用阳极泥来提炼金、银
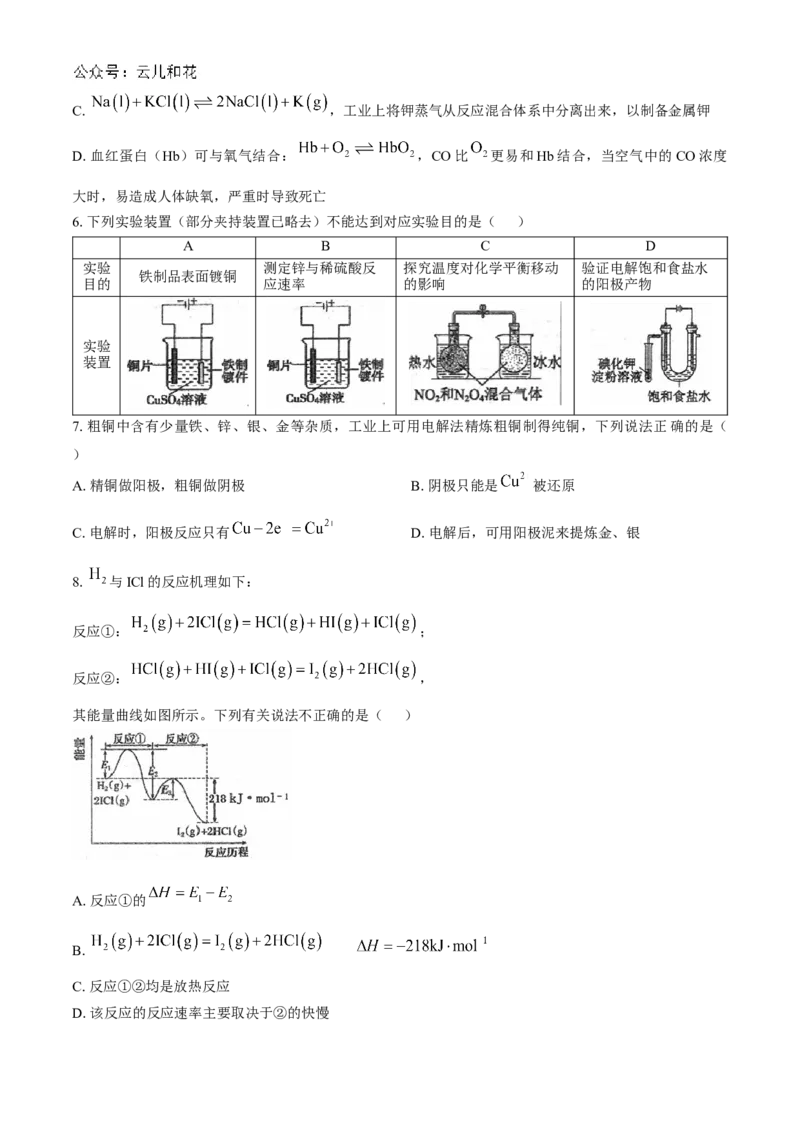
8. 与ICl的反应机理如下:
反应①: ;
反应②: ,
其能量曲线如图所示。下列有关说法不正确的是( )
A.反应①的
B.
C.反应①②均是放热反应
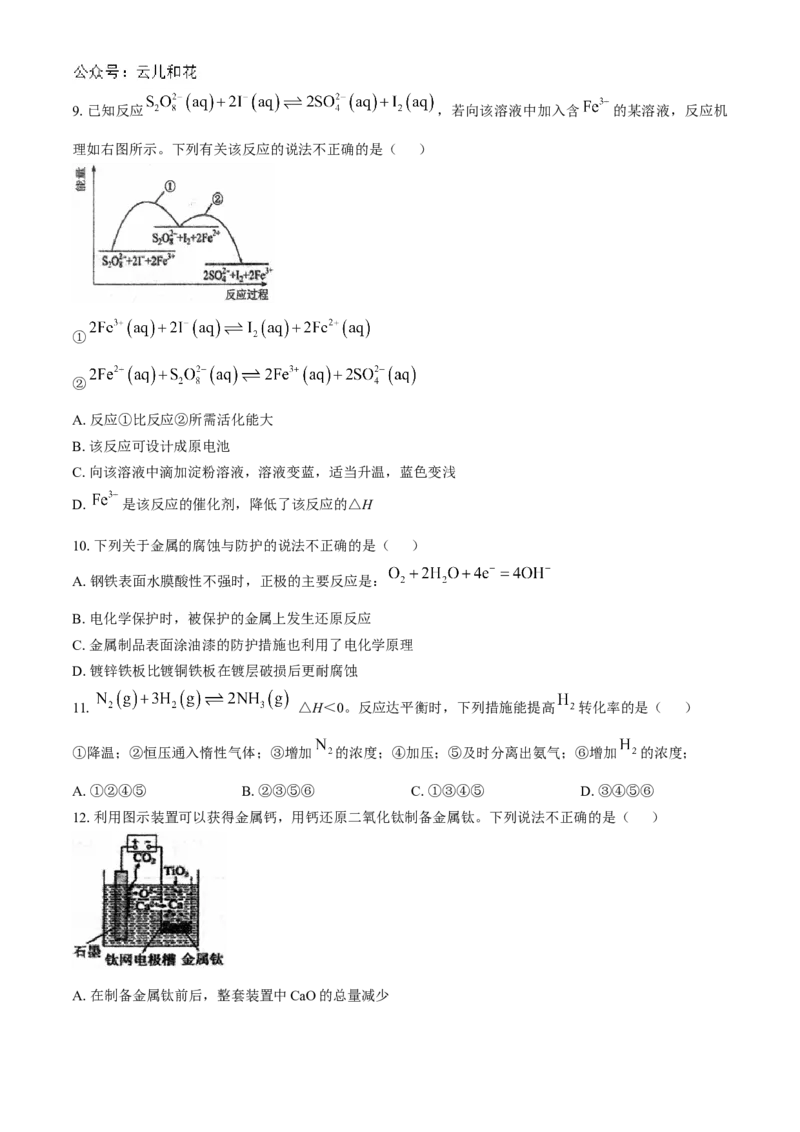
D.该反应的反应速率主要取决于②的快慢9.已知反应 ,若向该溶液中加入含 的某溶液,反应机
理如右图所示。下列有关该反应的说法不正确的是( )
①
②
A.反应①比反应②所需活化能大
B.该反应可设计成原电池
C.向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色变浅
D. 是该反应的催化剂,降低了该反应的△H
10.下列关于金属的腐蚀与防护的说法不正确的是( )
A.钢铁表面水膜酸性不强时,正极的主要反应是:
B.电化学保护时,被保护的金属上发生还原反应
C.金属制品表面涂油漆的防护措施也利用了电化学原理
D.镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀
11. △H<0。反应达平衡时,下列措施能提高 转化率的是( )
①降温;②恒压通入惰性气体;③增加 的浓度;④加压;⑤及时分离出氨气;⑥增加 的浓度;
A.①②④⑤ B.②③⑤⑥ C.①③④⑤ D.③④⑤⑥
12.利用图示装置可以获得金属钙,用钙还原二氧化钛制备金属钛。下列说法不正确的是( )
A.在制备金属钛前后,整套装置中CaO的总量减少B.阳极的电极反应式为
C.用铅蓄电池作为该装置的电源,“-”接线柱应该连接Pb电极
D.阴极的电极反应式为
13.回收利用工业废气中的 和 ,实验原理示意图如下。下列说法不正确的是( )
A.离子交换膜可用阳离子交换膜
B.电源的左端为负极
C.装置a中离子反应方程式为
D.装置b中的总反应为
14. △H。当 (g)和 (g)按一定比例混合时, 平
衡转化率 随温度、压强的变化如下图所示。下列说法不正确的是( )
A.△H<0 B.
C.钒催化剂能降低反应的活化能,提高反应速率 D.增大压强平衡正向移动,反应平衡常数增大
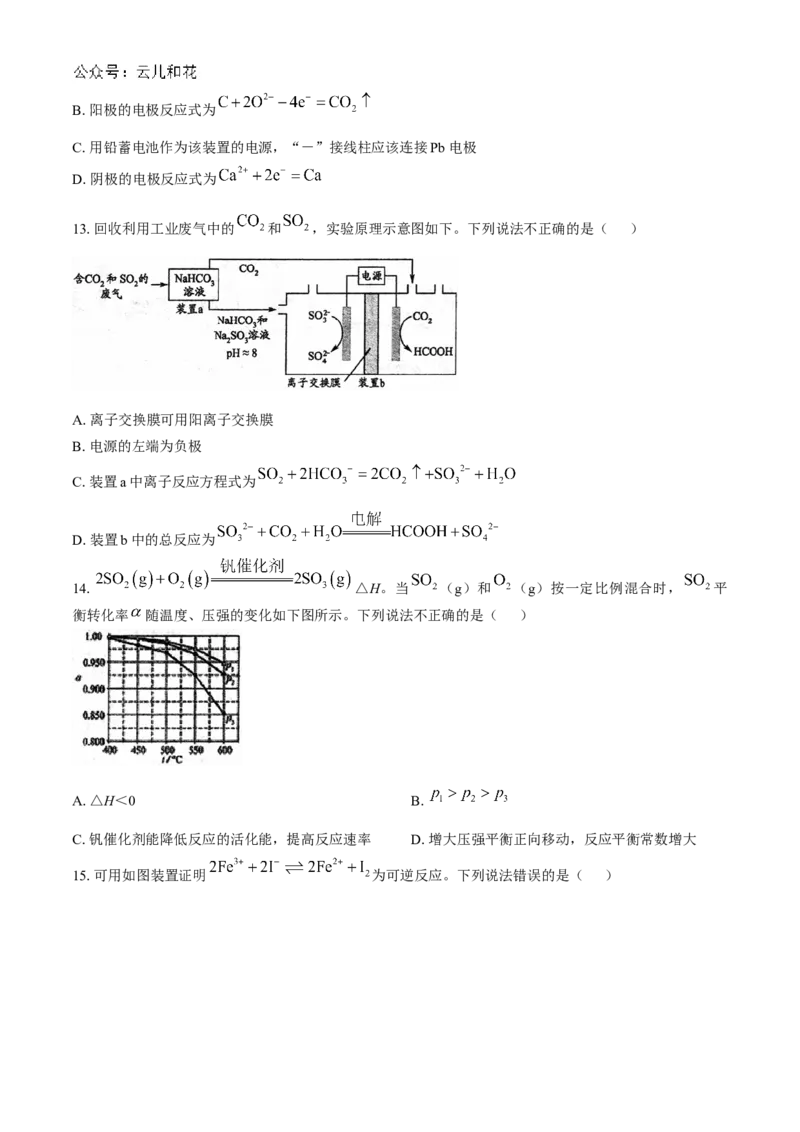
15.可用如图装置证明 为可逆反应。下列说法错误的是( )A.b可用铁钉做电极
B.平衡后,向a极区加入KI固体,a为负极
C.平衡时电流计指针归零
D.平衡后,向b极区加入少量 固体,电流表指针偏转方向与B选项中的偏转方向相反
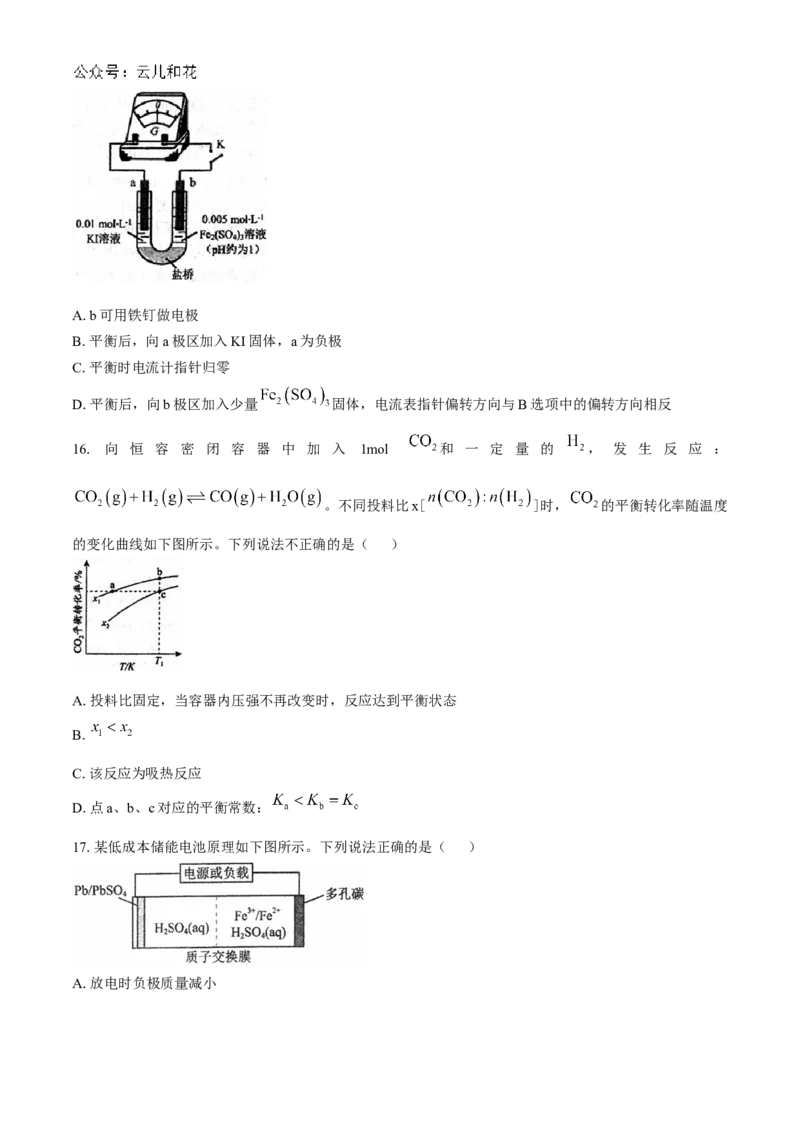
16. 向 恒 容 密 闭 容 器 中 加 入 1mol 和 一 定 量 的 , 发 生 反 应 :
。不同投料比x[ ]时, 的平衡转化率随温度
的变化曲线如下图所示。下列说法不正确的是( )
A.投料比固定,当容器内压强不再改变时,反应达到平衡状态
B.
C.该反应为吸热反应
D.点a、b、c对应的平衡常数:
17.某低成本储能电池原理如下图所示。下列说法正确的是( )
A.放电时负极质量减小B.放电时右侧 通过质子交换膜移向左侧
C.储能过程中电能转变为化学能
D.充电总反应:
18.已知: 。一定温度下,在 2L
恒容密闭容器中,按照下表中甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的
转化率为50%。下列说法中正确的是( )
甲 乙
0.2mol 0.1mol
0.4mol CO 0.2mol CO
A.该反应能完全消除CO污染 B.该温度下,反应的平衡常数为5
C.达平衡时, 的浓度:甲>乙 D.达平衡时, 的体积分数:甲<乙
19. 和CO是环境污染性气体,可在 表面转化为无害气体,有关化学反应的物质变化过程及能
量变化过程分别如图甲、乙所示。下列说法不正确的是( )
A.总反应为
B.为了实现转化,需不断向反应器中补充 和
C.该反应正反应的活化能小于逆反应的活化能
D.总反应的
20.以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
相关反应的热化学方程式为:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
下列说法不正确的是( )
A.该过程实现了太阳能到化学能的转化
B. 和 对总反应起到了催化剂的作用
C.总反应的热化学方程式为:
D.该过程降低了水分解制氢反应的活化能,但总反应的△H不变
21.以粗氧化镍(主要含NiO、CoO等)为原料制备纯镍(装置如下图所示),先用CO还原粗氧化镍制备
羰化镍,羰化后的产物为 、 。
已知反应为:
① ;
② .
已知: 的沸点43.2℃,熔点-19.3℃,分解温度135℃; 沸点72℃,熔点31℃。
下列有关叙述中不正确的是( )
A.①反应在900℃进行,温度升高,K增大,则正反应
B.提纯粗镍若简化为右图装置,则温度
C.蒸馏后采用230℃分解 (g)制取金属镍,所获金属镍中常常含有碳
D.蒸馏提取 应选择的适宜温度范围是43.2℃~72℃22.资料显示,在溶液中,草酸根( )可还原 为 。但向10mL 0.5 溶液中
缓慢加入 0.5 溶液至过量也不发生 与 之间的氧化还原反应,原因是
, ,并且此反应的活化能几乎为零。设计电化学实验证
实草酸根( )可还原 ,装置如图。下列说法不正确的是( )
A.a、b都应该用惰性电极
B.负极反应为
C.只要电流计指针发生偏转,就证实草酸根( )可还原
D.取实验后b极区的溶液,加入 溶液,有蓝色沉淀出现
二、填空题(56分)
23.(10分)
依据以下热化学反应方程式,根据要求,回答问题
①
②
③
④
⑤
⑥
⑦(1)不考虑△H数值正误,上述热化学方程式书写不正确的有 ;(请填写编号,下同)
(2)由上述热化学方程式求得 △H=
(3)上述反应中,在等压条件下,在高温下能正向自发进行的是 ;这样的可逆反应,若温度
一定, (填“增大压强”或“减小压强”),有利于反应正向进行。
(4)上述反应中,可以设计成气体燃料化学电源的是 。
24.(16分)
改进工艺,降低能耗是氯碱工业发展的重要方向。
(1)写出电解饱和食盐水的化学方程式 。
(2)将氢燃料电站应用于氯碱工业,其原理示意图如下:
①a极为 (填“正”或“负”)极,电极反应方程式为 。
②甲装置中, NaOH溶液浓度下降(填“a极区”或“b极区”)。
③下列关于乙装置说法中,正确的是 。
A. 移向c极区
B.在d极区获得的产物,可供甲装置使用
C.随着电解的进行,NaCl溶液浓度下降,若不补充,c电极有可能产生氧气
D.d极区流出的溶液浓度不变
(3)向乙装置中的阴极区通入 ,能够替代水中的 获得电子,降低电解电压,减少电耗。写出 在
阴极区发生反应的电极反应式 。
(4)若乙装置中阳离子交换膜被破坏,可能产生的不利后果是 (任写一点)。
(5)电解效率 的定义:
在标准状况下,当甲中有44.8L氢气放电时,乙装置中c极产生氯气33.6L(忽略氯气在溶液中的溶解),
。25.(16分)
硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
(1)已知上述三个反应都是放热反应。试从能源和资源利用两个角度提出你的建议: 。
(2) 是硝酸生产中氨催化氧化的副产物, 和CO是环境污染性气体。这两种气体会发生反应:
,“ ”常用作该反应的催化剂。其总反应分两步进行:
第一步为: ;
第二步为 (写方程式)。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应的活化能 (填“>”
“<”或“=”)第一步反应活化能。
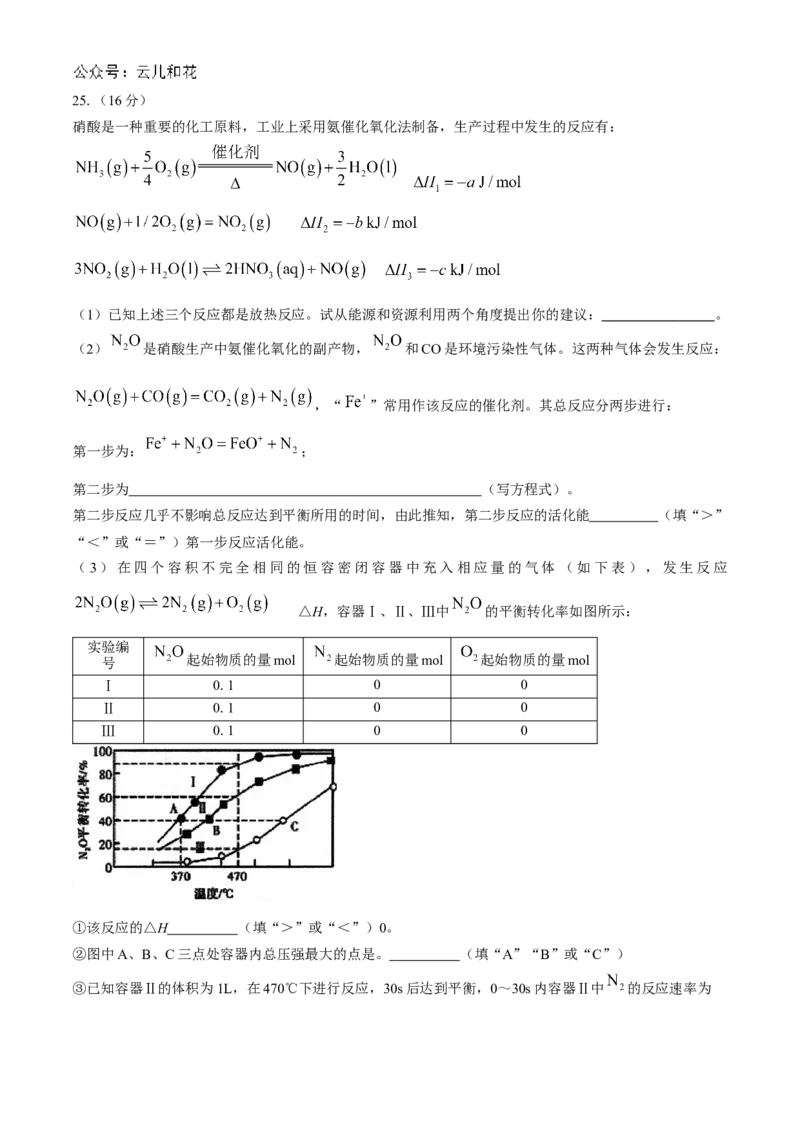
(3)在四个容积不完全相同的恒容密闭容器中充入相应量的气体 (如下表),发生反应
△H,容器Ⅰ、Ⅱ、Ⅲ中 的平衡转化率如图所示:
实验编
号 起始物质的量mol 起始物质的量mol 起始物质的量mol
Ⅰ 0.1 0 0
Ⅱ 0.1 0 0
Ⅲ 0.1 0 0
①该反应的△H (填“>”或“<”)0。
②图中A、B、C三点处容器内总压强最大的点是。 (填“A”“B”或“C”)
③已知容器Ⅱ的体积为1L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中 的反应速率为,该反应的平衡常数K= 。
④若容器Ⅳ与容器Ⅱ的体积相等,则470℃时容器Ⅳ的起始反应速率:
(填“>”“<”或“=”)。
26.(14分)
某小组在验证 氧化 时发现异常现象,并对其进行深入探究。
实验Ⅰ:
装置与操作 现象
溶液立即变红,继续滴加 溶液,红色变浅并逐渐褪去
(1)探究实验Ⅰ中红色褪去的原因:取反应后溶液, (填实验操作和现象),证明溶液
中有 ,而几乎无 。
(2)研究发现,酸性溶液中 能氧化 ,但反应很慢且无明显现象,而实验Ⅰ中褪色相对较快,
由此推测 能加快 与 的反应。通过实验Ⅱ和Ⅲ得到了证实。参照实验Ⅱ的图例,补全实验
Ⅲ中试剂和现象 。
实验Ⅱ:
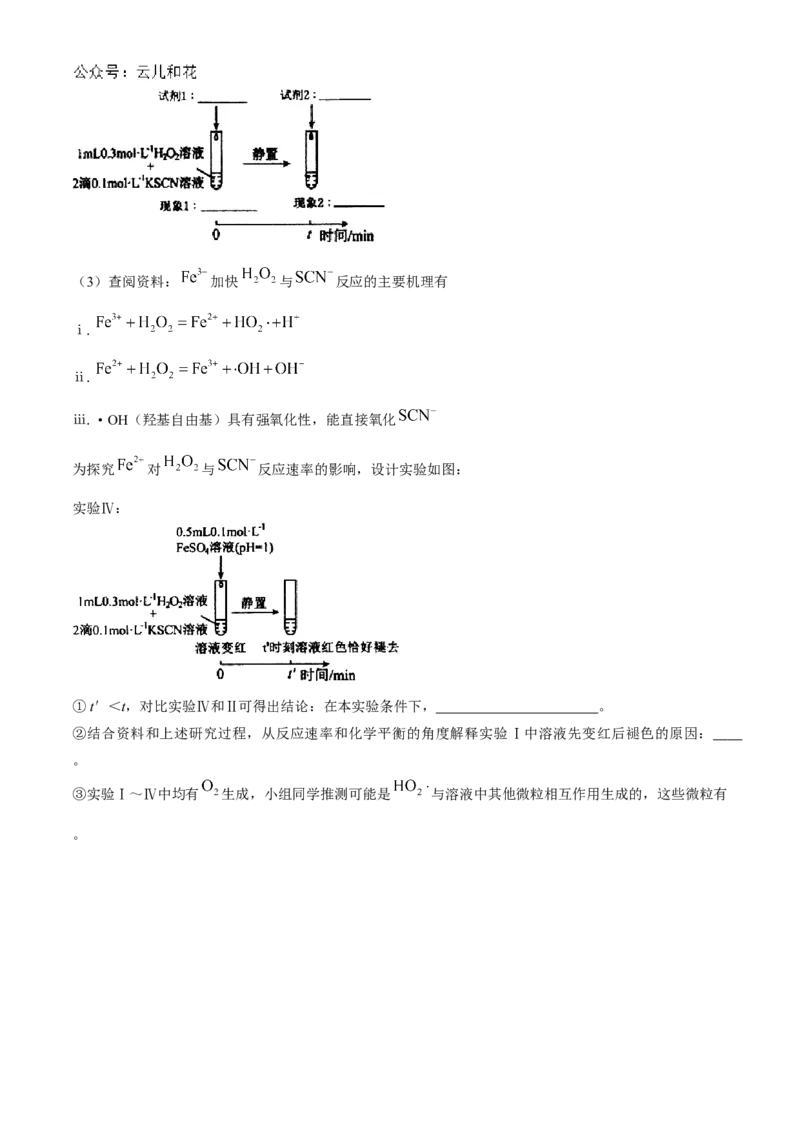
实验Ⅲ:(3)查阅资料: 加快 与 反应的主要机理有
ⅰ.
ⅱ.
ⅲ.·OH(羟基自由基)具有强氧化性,能直接氧化
为探究 对 与 反应速率的影响,设计实验如图:
实验Ⅳ:
①t'<t,对比实验Ⅳ和Ⅱ可得出结论:在本实验条件下, 。
②结合资料和上述研究过程,从反应速率和化学平衡的角度解释实验Ⅰ中溶液先变红后褪色的原因:
。
③实验Ⅰ~Ⅳ中均有 生成,小组同学推测可能是 与溶液中其他微粒相互作用生成的,这些微粒有
。2024-2025 学年度第一学期高二年级化学学科期中练习
参考答案
选择题(每小题2分,共44分)
1-5 BCCDA 6-10 ADDDC 11-15 CABDA 16-20 ACCBC
23.(每空2分,共10分)
(1)①⑥
(2)-41.2
(3)①③ 减小压强
(4)④⑦
24.(每空2分,共16分)【电极反应式得失电子的+/-号写错0分】
(1)
(2)①负极 ②a极区 ③B、C
(3)
(4)阴极生成的氢气与阳极氯气反应有爆炸危险;阳极区NaCl与阴极区NaOH混合使得制得的NaOH不
纯; 迁移至阳极区发生反应: ,生成氧气,使氯气不纯; 迁移至
阳极区与生成的氯气发生反应,减少氯气产量等(合理给分)
(5)75%
25.(每空2分,共16分)
(1)能源角度:利用后两个反应放出的热量对第一个反应加热(热能循环使用);资源利用角度:NO循
环使用;通入过量的 (或空气)提高 、NO转化率;第三个反应在较大的压强下进行,使平衡右
移,提高转化率等。(两个角度各1分,合理即可,但必须结合题意,避免过于笼统套路答题)
(2) <
(3)①> ②C ③0.002 0.0675 ④>
26.[第(2)问现象各1分,其余每空2分,共14分]
(1)滴加KSCN溶液,溶液变红
(2)试剂1:0.5mL pH=1的 溶液 现象1:无明显现象
试剂2:数滴 溶液(写0.5mL不给分) 现象2:溶液变红(试剂各2分,现象各1分)(3)① 也能加速 与 反应,且效果比 更好
②刚滴入 时,生成的 迅速与 结合,溶液立即变红;继续滴加 , 升高,加
快·OH氧化 ,使 降低, ,平衡逆向移动,红色褪去
③·OH、 、