文档内容
绝密★启用前
2025 届新高三学情摸底考 (新高考卷)
化 学
本卷满分100分,考试用时75分钟。
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用
橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3. 考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Cl 35.5 Cs 133 Pb 207
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目
要求。
1. 下列说法正确的是
A. Na₂O₂能与水、二氧化碳反应生成O₂,可作供氧剂
B. NO₂溶于水能生成硝酸,故NO₂为酸性氧化物
C. 根据是否具有丁达尔效应将分散系分为溶液、胶体和浊液
D. 硅酸盐材料二氧化硅可用来生产光导纤维
2. 下列化学用语使用正确的是
A. 中子数为12的钠原子: 12Na
11
B. N₂的电子式:
C. NH₃分子的空间结构模型:
D. 2-丁烯的键线式:
3. 下列物质既能发生加成反应又能发生取代反应的是
A. C₂H₅OH B.CH₂=CHCH₂OH
D.
C. CH₃COOH
4. NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 2gD₂O中含有的中子数为N
A
B.22.4LCH₄中含有的分子数为N
A
C.0.1mol⋅L⁻¹的NH₄NO₃溶液中N原子数目为0.2N
A
D. 1mol单质S与足量铜粉反应,转移电子数目为N
A
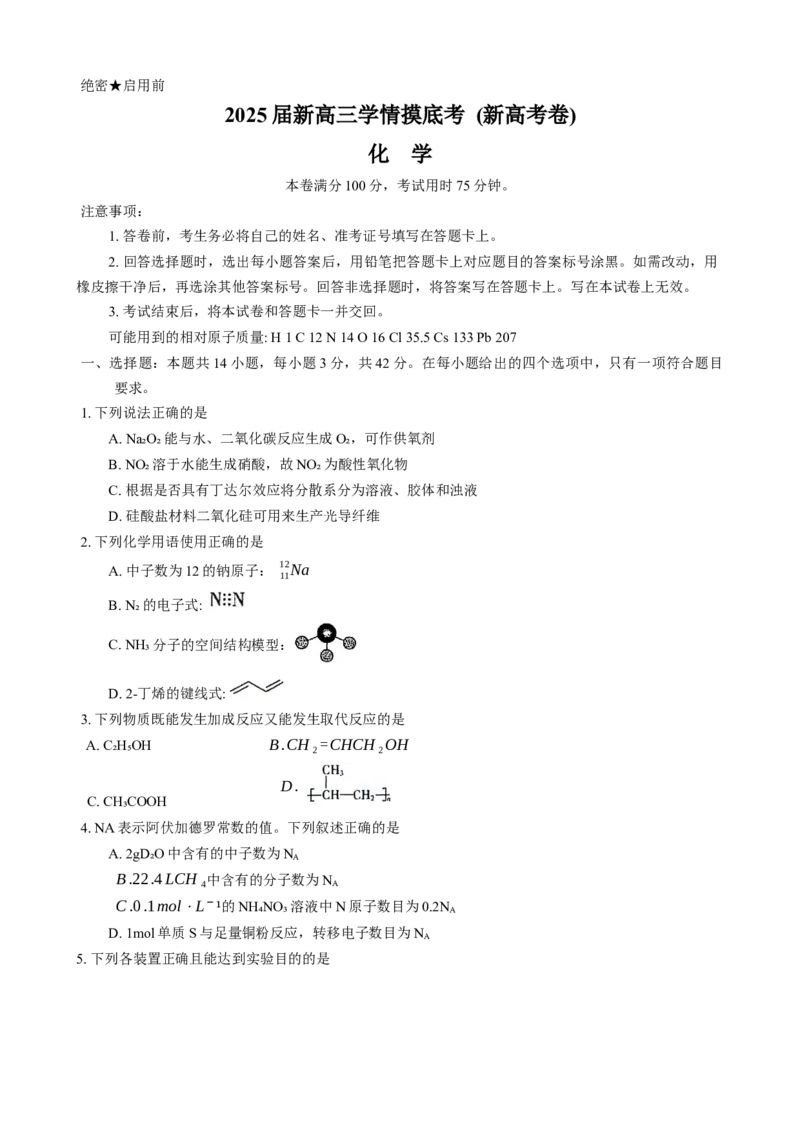
5. 下列各装置正确且能达到实验目的的是A. 探究熔融条件下烧碱的导
B. 提纯 CCl₄, 除去 Br₂ C. 制备并检验乙烯 D. 实验室制乙炔
电性
6. 羟脯氨酸是合成某种降压药的中间体。由羟脯氨酸合成生物化学试剂Y的反应过程如下:
下列说法错误的是
A. 羟脯氨酸分子中含有两种含氧官能团
B. Y可以发生还原反应
C. 羟脯氨酸在水中的溶解度大于 Y
D. 氯甲酸苄酯中碳原子杂化方式为 sp、sp²和sp³
7. 物质结构决定物质性质,下列有关物质的性质差异解释错误的是
选项 性质 解释
A 熔点: NaCl>AlCl₃ 晶体类型不同
B 水中溶解度:HCl>Cl₂ 分子极性不同
C 酸性: CF₃COOH>CH₃COOH 原子半径: F>H
D 键角: CO₂>SO₂ 中心原子杂化类型不同
8. 短周期主族元素 W、X、Y、Z的原子序数依次增大,X为空气中含量最高的元素,Z与X同主族,Z
的质子数等于W与Y的质子数之和,Y与Z同周期,Y的基态原子核外电子排布中s轨道与p轨道
电子数相等。下列说法正确的是
A. 简单离子半径: Y>X>W
B. 电负性: Z>X>Y
C. 化合物 Y₃X₂中含有共价键
D. Z的最高价氧化物对应的水化物属于中强酸
9. 根据实验操作和现象,下列结论中正确的是
选项 实验操作 现象 结论
A Na₂SiO₃溶液中通入适量 HCl 产生白色沉淀 非金属性: Cl> Si
B Na₂CrO₄溶液中加稀硫酸 溶液由黄色变橙色 生成Na₂Cr₂O₇C FeI₂溶液中通入少量Cl₂ 溶液变黄 还原性:Fe²⁺>Γ
D 豆浆中加入MgCl₂溶液 凝聚为“豆腐” MgCl₂使蛋白质变性
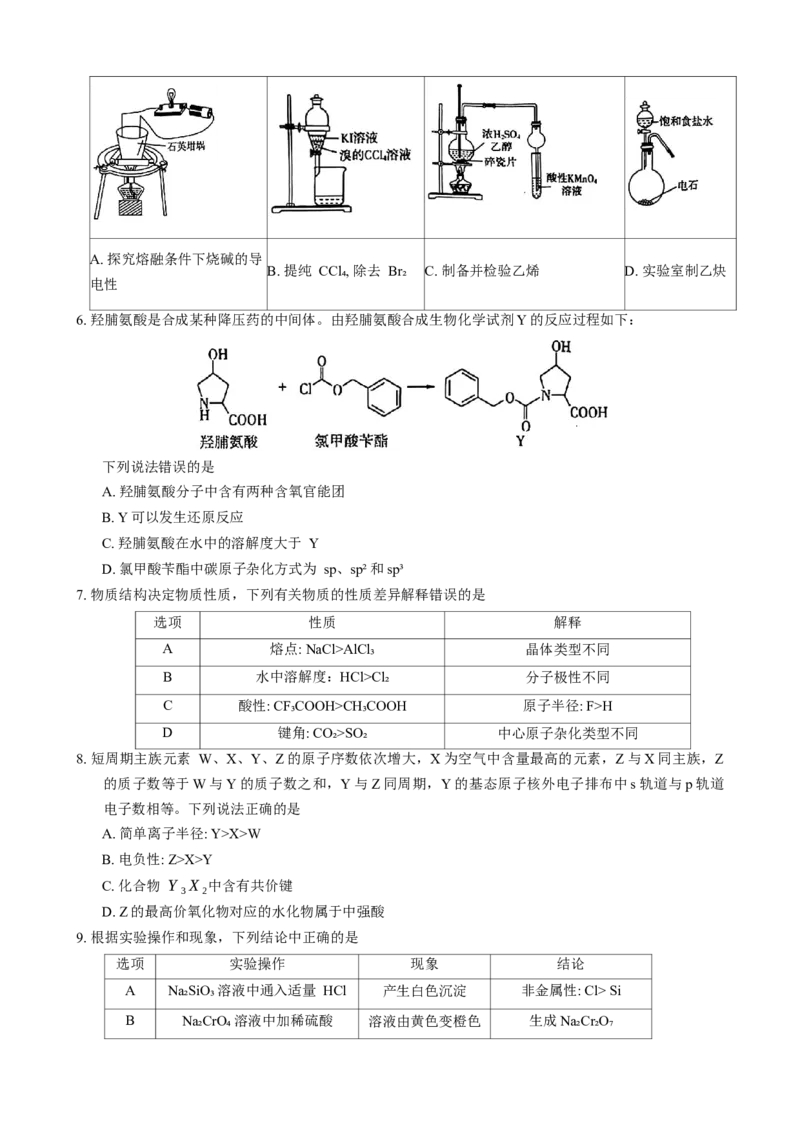
10.CH₃OH(g)在催化剂 Pd/MgO(100)表面的催化反应部分历程如图所示(吸附在催化剂表面的物种用
“*”表示,TS表示过渡态)。
下列说法正确的是
A. 催化剂的使用降低了反应的活化能,提高了活化分子的百分数
B. 催化剂的使用可以改变反应的选择性,提高反应的平衡转化率
C. 该过程决速步骤的反应方程式为 *CHO= *CO+ *H
D. CH₃OH(g)在催化剂 Pd/MgO(100)表面断裂O——H键比断裂C——H键更容易
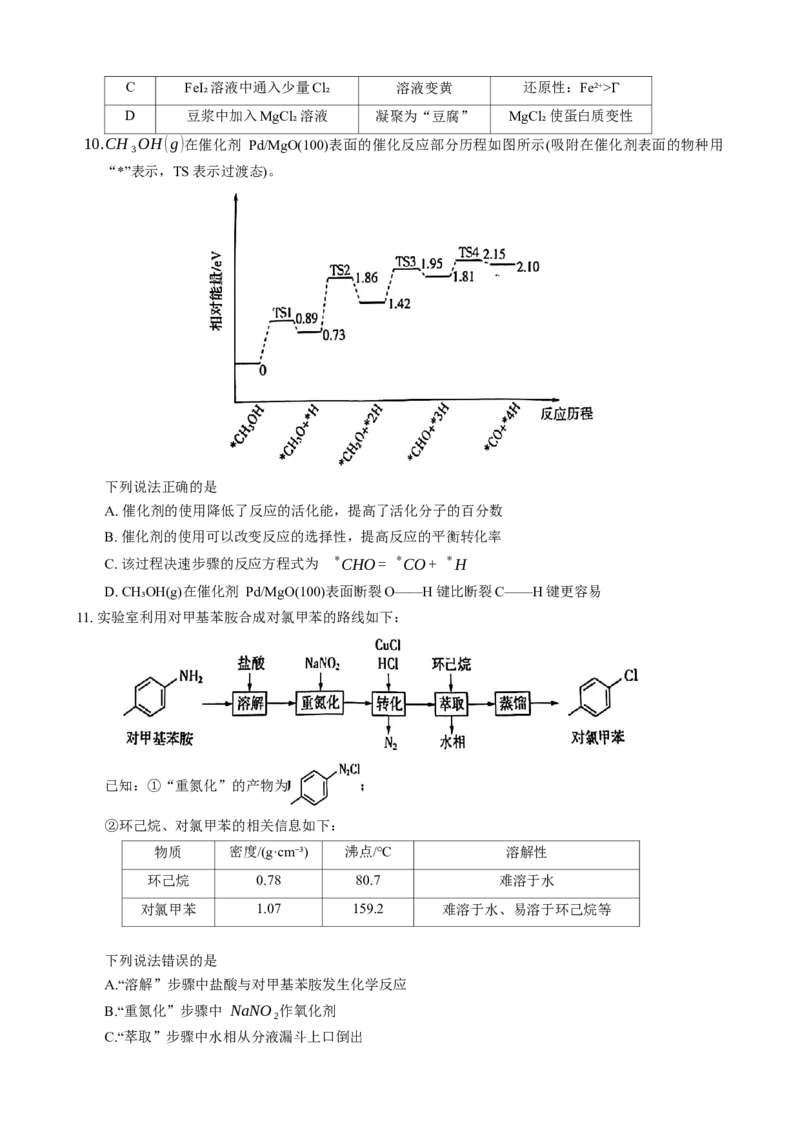
11. 实验室利用对甲基苯胺合成对氯甲苯的路线如下:
已知:①“重氮化”的产物为
②环己烷、对氯甲苯的相关信息如下:
物质 密度/(g·cm⁻³) 沸点/℃ 溶解性
环己烷 0.78 80.7 难溶于水
对氯甲苯 1.07 159.2 难溶于水、易溶于环己烷等
下列说法错误的是
A.“溶解”步骤中盐酸与对甲基苯胺发生化学反应
B.“重氮化”步骤中 NaNO₂作氧化剂
C.“萃取”步骤中水相从分液漏斗上口倒出D.“蒸馏”步骤中先蒸出的物质为环己烷
12. 中国科学院通过非热等离子体驱动空气活化生成 NO ,NO- 电化学还原生成 NH₃,为更环保的合成
x x
氨生产提供了新的前景。c装置中的隔膜只有气体不能通过。
下列有关说法错误的是
A. c装置将电能转化为化学能
B. c装置中 K⁺由右室移向左室
C. 电极d的电极反应为 2H₂O-4e⁻=4H⁺+O₂↑
D. b中可能发生反应: NO+NO₂+2KOH=2KNO₂+H₂O
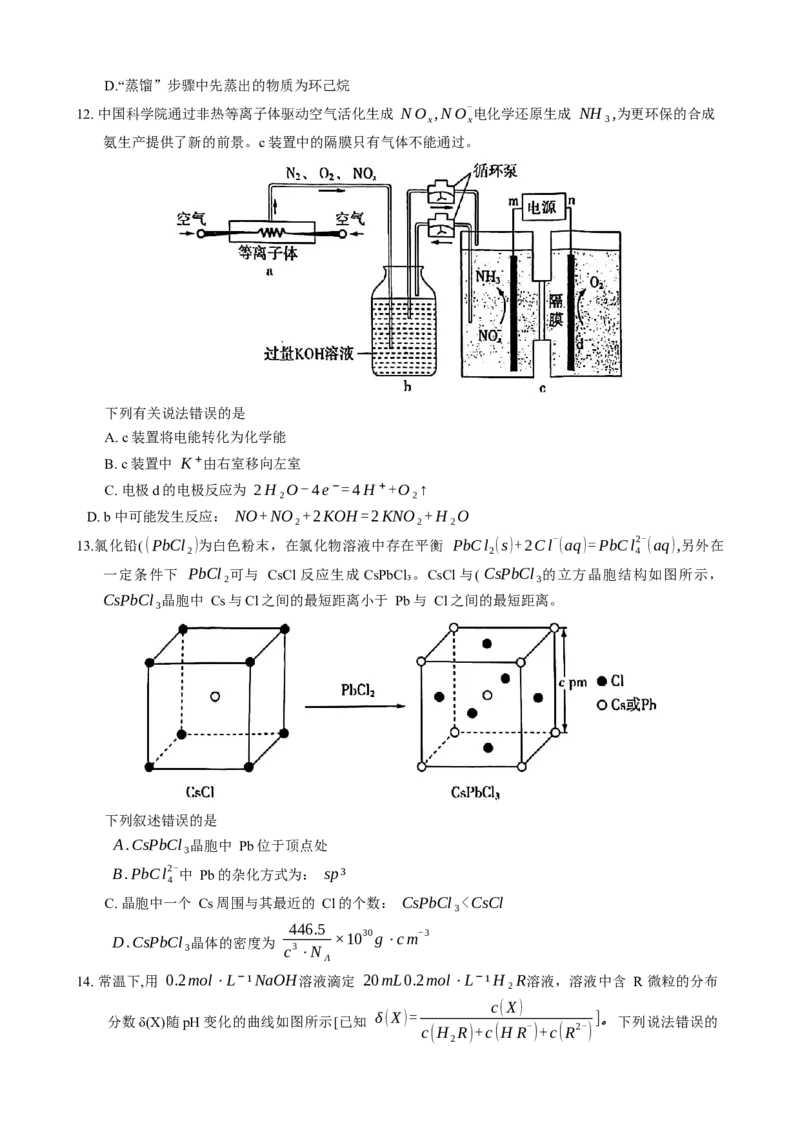
13.氯化铅( (PbCl₂)为白色粉末,在氯化物溶液中存在平衡 PbCl (s)+2Cl- (aq)=PbCl2- (aq),另外在
2 4
一定条件下 PbCl₂可与 CsCl反应生成 CsPbCl₃。CsCl与( CsPbCl₃的立方晶胞结构如图所示,
CsPbCl₃晶胞中 Cs与Cl之间的最短距离小于 Pb与 Cl之间的最短距离。
下列叙述错误的是
A.CsPbCl₃晶胞中 Pb位于顶点处
B.PbCl2- 中 Pb的杂化方式为: sp³
4
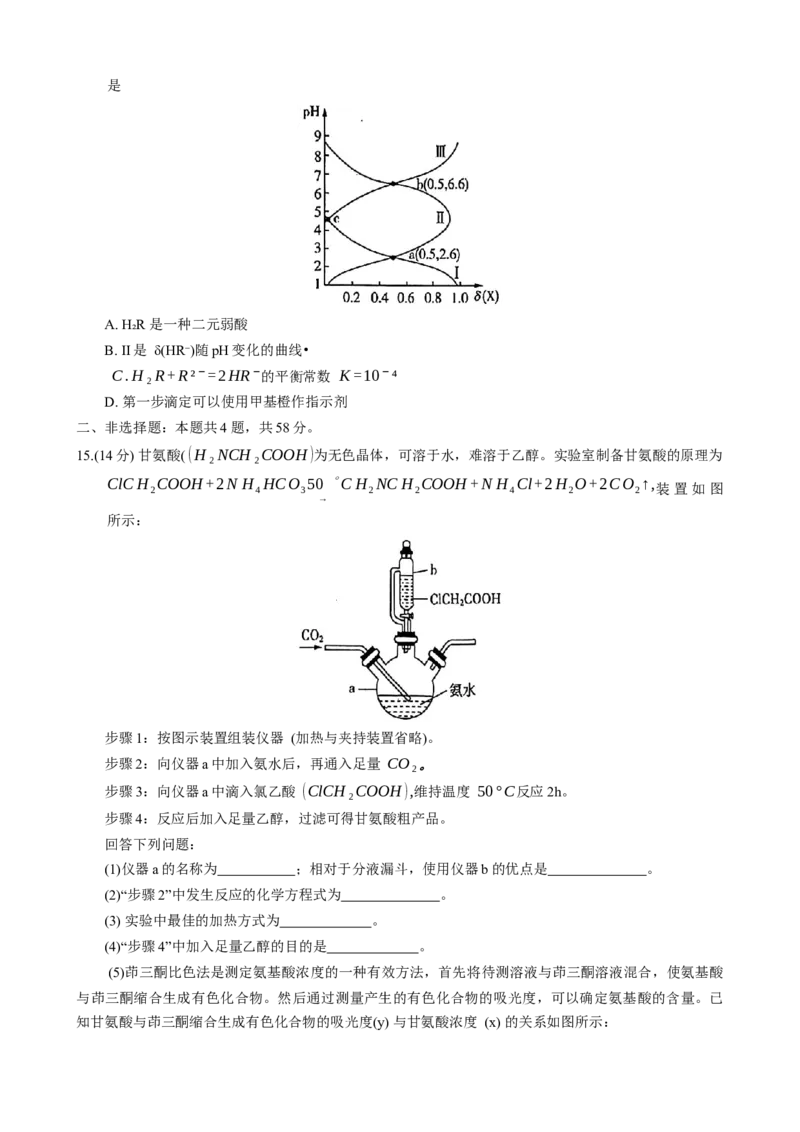
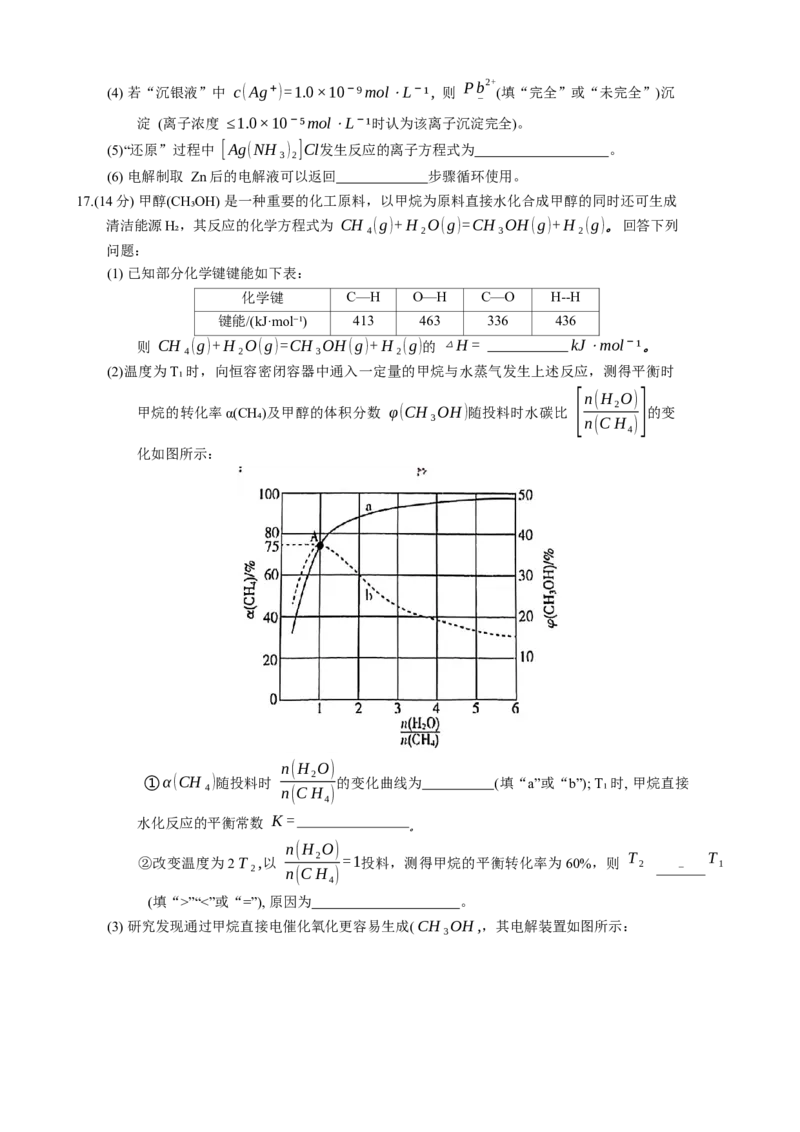
C. 晶胞中一个 Cs周围与其最近的 Cl的个数: CsPbCl₃”“<”或“=”), 原因为 。
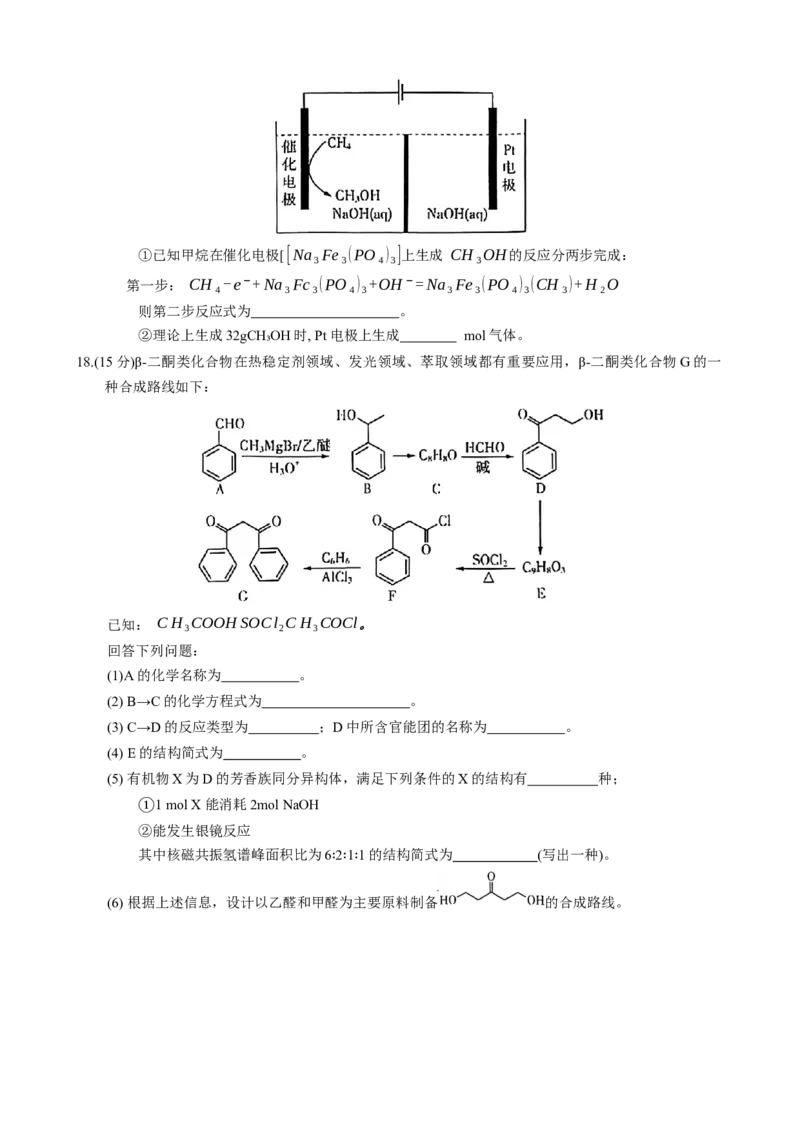
(3) 研究发现通过甲烷直接电催化氧化更容易生成( CH₃OH,,其电解装置如图所示:①已知甲烷在催化电极[ [Na₃Fe₃(PO₄)₃]上生成 CH₃OH的反应分两步完成:
第一步: CH₄-e⁻+Na₃Fc₃(PO₄)₃+OH⁻=Na₃Fe₃(PO₄)₃(CH₃)+H₂O
则第二步反应式为 。
②理论上生成32gCH₃OH时, Pt电极上生成 mol气体。
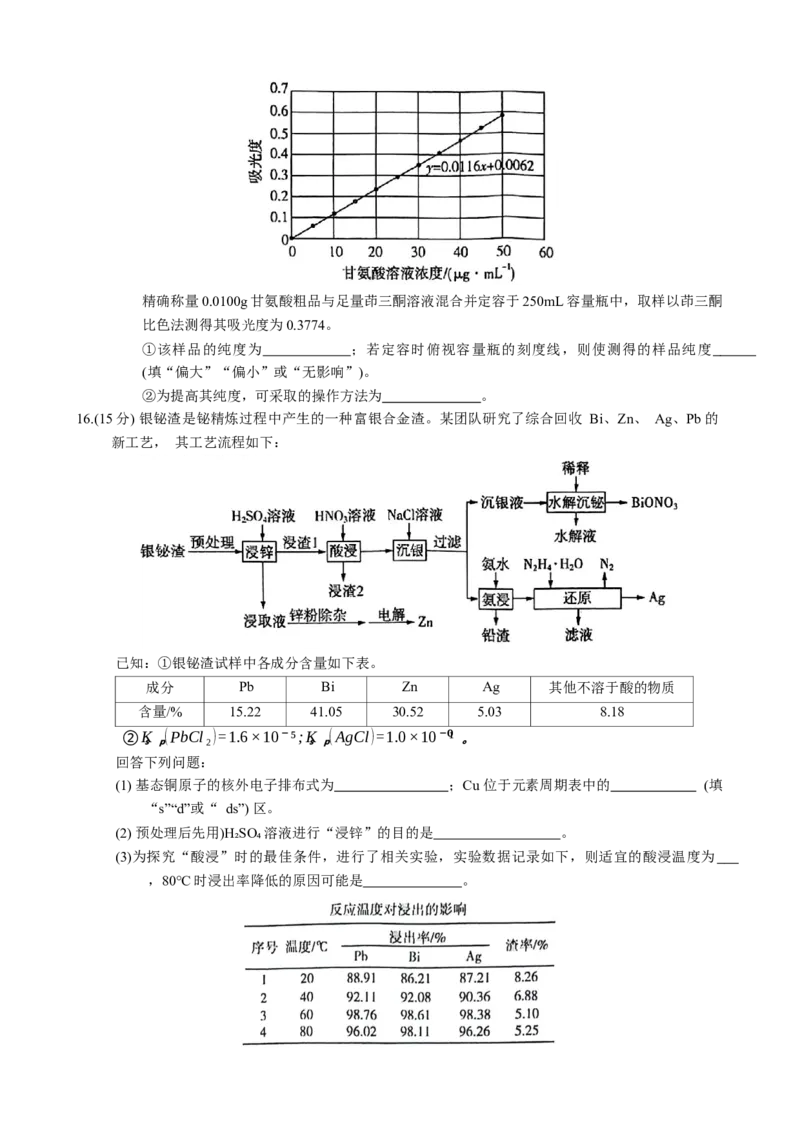
18.(15分)β-二酮类化合物在热稳定剂领域、发光领域、萃取领域都有重要应用,β-二酮类化合物G的一
种合成路线如下:
已知: CH COOHSOCl CH COCl。
3 2 3
回答下列问题:
(1)A的化学名称为 。
(2) B→C的化学方程式为 。
(3) C→D的反应类型为 ;D中所含官能团的名称为 。
(4) E的结构简式为 。
(5) 有机物X为D的芳香族同分异构体,满足下列条件的X的结构有 种;
1 mol X 能消耗2mol NaOH
②能发生银镜反应
①
其中核磁共振氢谱峰面积比为6 2 1 1的结构简式为 (写出一种)。
∶ ∶ ∶
(6) 根据上述信息,设计以乙醛和甲醛为主要原料制备 的合成路线。