文档内容
云南省昆明市五华区 2024-2025 学年高三上学期期中教学质量检测+化
学试题
注意事项:
1.答卷前,考生务必用黑色碳素笔将自己的学校、姓名、准考证号、考场号、座位号填写在答
题卡上,并认真核准条形码上的学校、准考证号、姓名、考场号、座位号,在规定的位置贴好
条形码及填涂准考证号。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写
在本试卷上无效。
3.考试结束后,将答题卡交回。
可能用到的相对原子质量:H1 C12 O 16 Na23 S 32 Mo 96
一、选择题:本大题共14个小题,每小题 3分,共 42分。在每小题给出的四个选项中,只
有一个选项是符合题目要求的。
1.文物代表着国家的历史和文化。下列叙述错误的是
A.图1西周信宜铜盉,其材料的主要成分是合金 B.图2元玉壶春瓶,其材料的主要成分是二氧化硅
C.图3楚国丝绸,其材料的主要成分是蛋白质 D.图4北宋木雕罗汉像,其材料的主要成分是纤维素
2.物质的性质决定用途。下列叙述错误的是
A.液氨汽化时要吸收大量热,可用作制冷剂 B.碳酸钠溶液显碱性,可用作食用碱或工业碱
C.氧化亚铁是一种红棕色粉末,常用作油漆和涂料
D.碳化硅(SiC)具有类似金刚石的结构,硬度很大,可用作砂纸和砂轮的磨料
3.CuSO
4
溶液中滴加氨水,先产生Cu(OH)
2
蓝色沉淀,继续滴加氨水,得到深蓝色的
Cu NH
3
4
(OH)
2
透明溶液,N 为阿伏加德罗常数的值。下列叙述正确的是
A
A.1mol
Cu NH
3
4
2 所含键数为16N
A
B.1mol基态Cu2含有未成对电子数为2N
A
C.0.1mol/LCuSO 溶液中,Cu2数目小于0.1N
4 A
D.标准状况下,22.4L氨气溶于水,溶液中NH 和NH 数目之和为N
3 4 A
4.下列离子方程式中,正确的是
A.将少量SO 通入BaCl 溶液中:SO Ba2 H O BaSO 2H
2 2 2 2 3
B.Fe(OH) 和HI的反应:Fe(OH) 3H Fe3 3H O
3 3 2
学科网(北京)股份有限公司C.向明矾溶液中逐滴加入Ba(OH) 溶液至Al3恰好完全沉淀:
2
2Al3 3SO2 3Ba2 6OH 2Al(OH) 3BaSO
4 3 4
D.用CuSO 溶液除H S气体:Cu2 S2 CuS
4 2
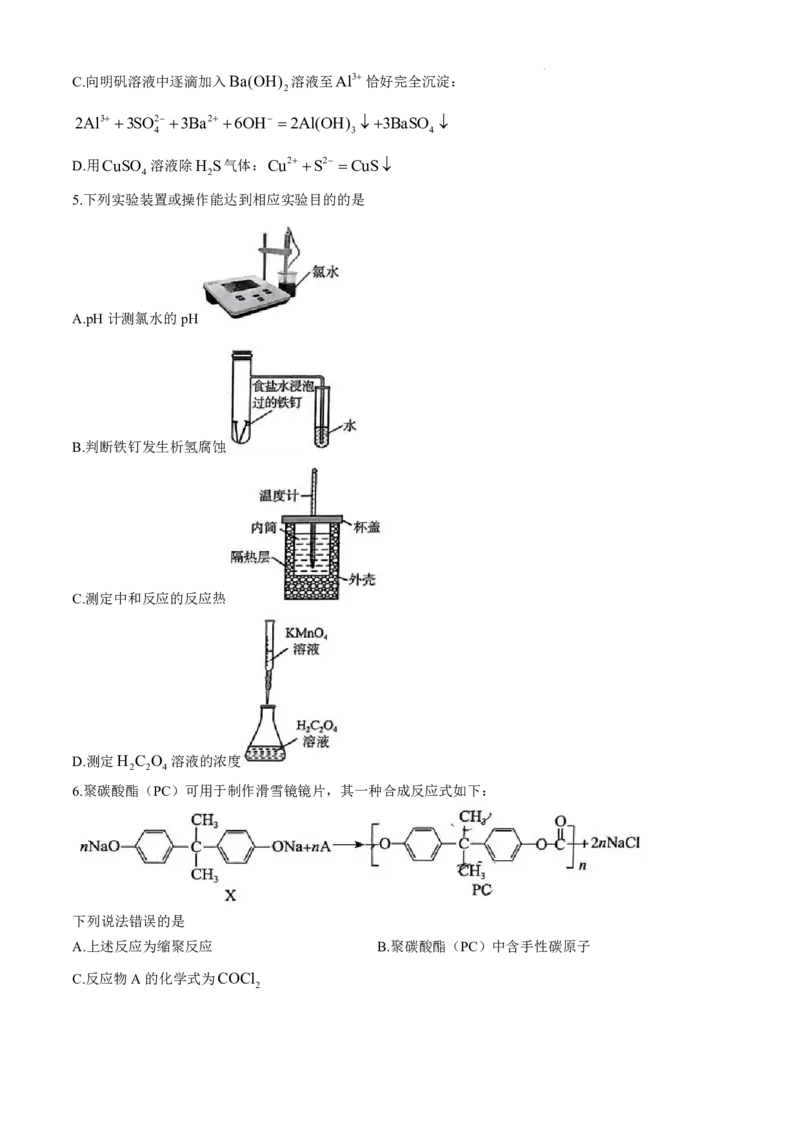
5.下列实验装置或操作能达到相应实验目的的是
A.pH计测氯水的pH
B.判断铁钉发生析氢腐蚀
C.测定中和反应的反应热
D.测定H C O 溶液的浓度
2 2 4
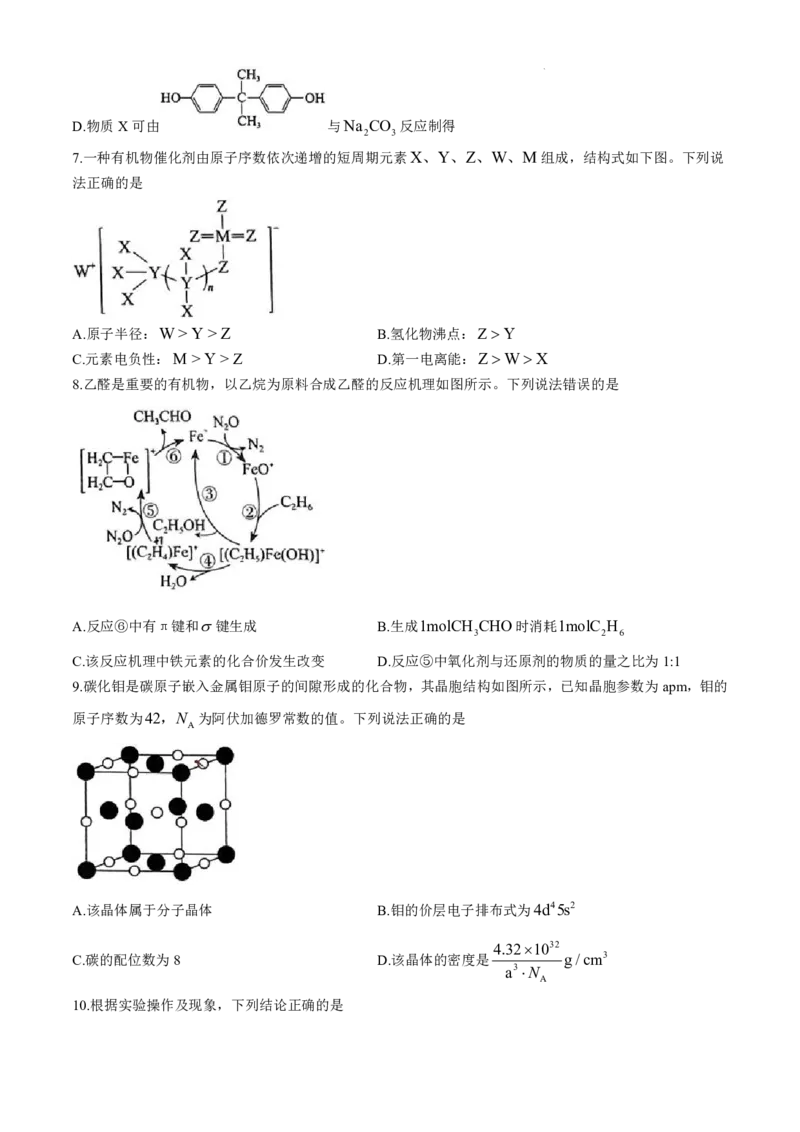
6.聚碳酸酯(PC)可用于制作滑雪镜镜片,其一种合成反应式如下:
下列说法错误的是
A.上述反应为缩聚反应 B.聚碳酸酯(PC)中含手性碳原子
C.反应物A的化学式为COCl
2
学科网(北京)股份有限公司D.物质X可由 与Na CO 反应制得
2 3
7.一种有机物催化剂由原子序数依次递增的短周期元素X、Y、Z、W、M组成,结构式如下图。下列说
法正确的是
A.原子半径:W>Y>Z B.氢化物沸点:Z Y
C.元素电负性:M > Y >Z D.第一电离能:ZWX
8.乙醛是重要的有机物,以乙烷为原料合成乙醛的反应机理如图所示。下列说法错误的是
A.反应⑥中有π键和键生成 B.生成1molCH CHO时消耗1molC H
3 2 6
C.该反应机理中铁元素的化合价发生改变 D.反应⑤中氧化剂与还原剂的物质的量之比为1:1
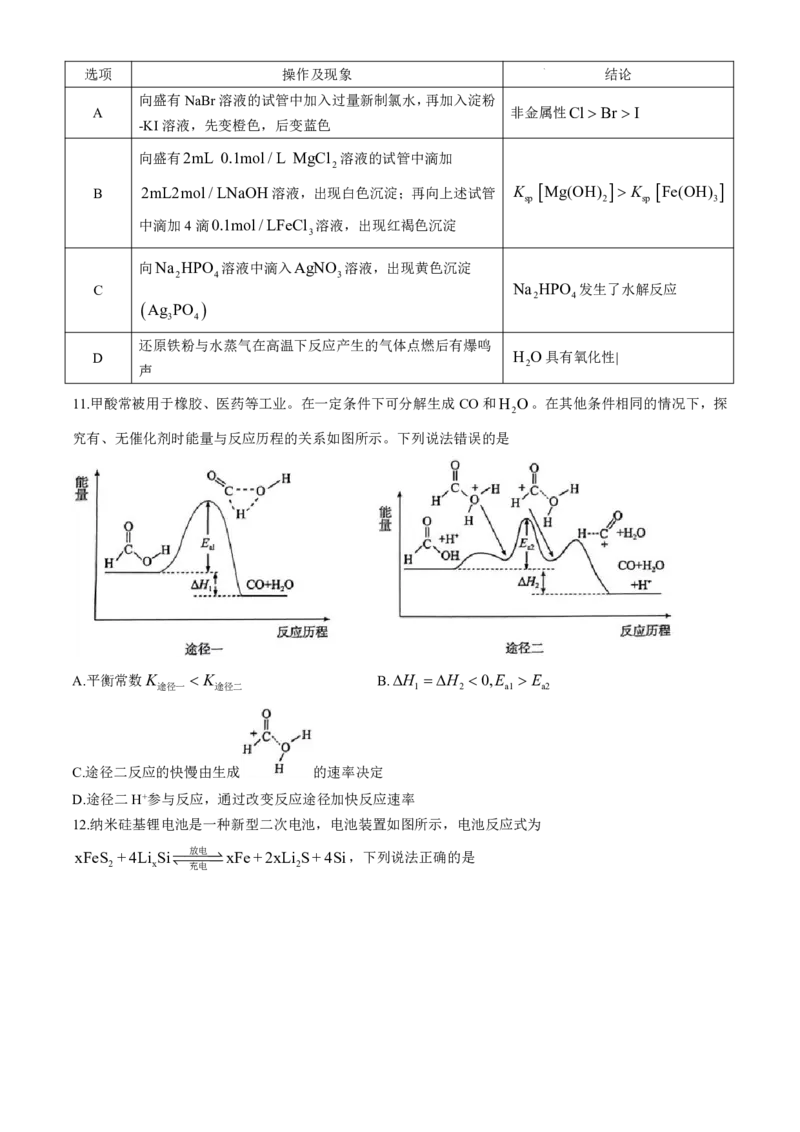
9.碳化钼是碳原子嵌入金属钼原子的间隙形成的化合物,其晶胞结构如图所示,已知晶胞参数为apm,钼的
原子序数为42,N 为阿伏加德罗常数的值。下列说法正确的是
A
A.该晶体属于分子晶体 B.钼的价层电子排布式为4d45s2
4.321032
C.碳的配位数为8 D.该晶体的密度是 g/cm3
a3N
A
10.根据实验操作及现象,下列结论正确的是
学科网(北京)股份有限公司选项 操作及现象 结论
向盛有NaBr溶液的试管中加入过量新制氯水,再加入淀粉
A 非金属性Cl Br I
-KI溶液,先变橙色,后变蓝色
向盛有2mL 0.1mol/L MgCl 溶液的试管中滴加
2
B 2mL2mol/LNaOH溶液,出现白色沉淀;再向上述试管 K
Mg(OH)
K
Fe(OH)
sp 2 sp 3
中滴加4滴0.1mol/LFeCl 溶液,出现红褐色沉淀
3
向Na HPO 溶液中滴入AgNO 溶液,出现黄色沉淀
2 4 3
C Na HPO 发生了水解反应
2 4
Ag PO
3 4
还原铁粉与水蒸气在高温下反应产生的气体点燃后有爆鸣
D H O具有氧化性|
声 2
11.甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成CO和H O。在其他条件相同的情况下,探
2
究有、无催化剂时能量与反应历程的关系如图所示。下列说法错误的是
A.平衡常数K K B.H H 0,E E
途径一 途径二 1 2 a1 a2
C.途径二反应的快慢由生成 的速率决定
D.途径二H+参与反应,通过改变反应途径加快反应速率
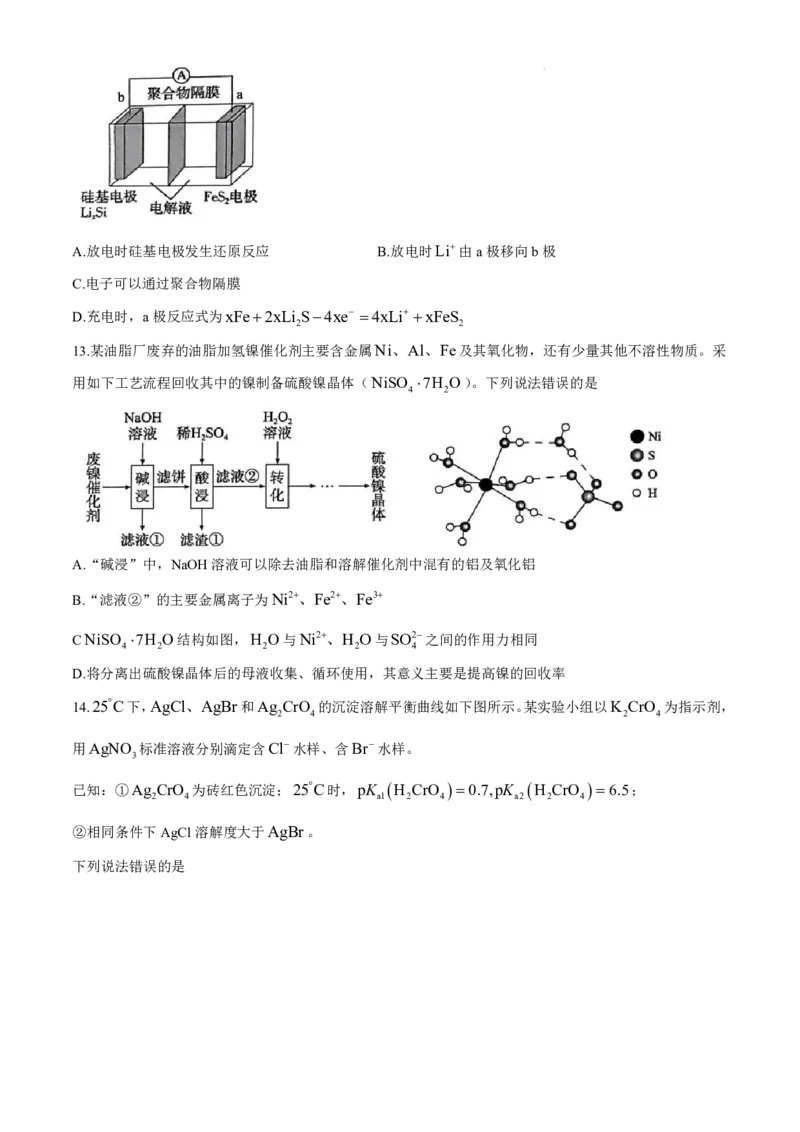
12.纳米硅基锂电池是一种新型二次电池,电池装置如图所示,电池反应式为
放电
xFeS +4Li Si xFe +2xLi S +4Si,下列说法正确的是
2 x 充电 2
学科网(北京)股份有限公司A.放电时硅基电极发生还原反应 B.放电时Li由a极移向b极
C.电子可以通过聚合物隔膜
D.充电时,a极反应式为xFe2xLi S4xe 4xLi xFeS
2 2
13.某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采
用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO 7H O)。下列说法错误的是
4 2
A.“碱浸”中,NaOH溶液可以除去油脂和溶解催化剂中混有的铝及氧化铝
B.“滤液②”的主要金属离子为Ni2、Fe2、Fe3
CNiSO 7H O结构如图,H O与Ni2、H O与SO2之间的作用力相同
4 2 2 2 4
D.将分离出硫酸镍晶体后的母液收集、循环使用,其意义主要是提高镍的回收率
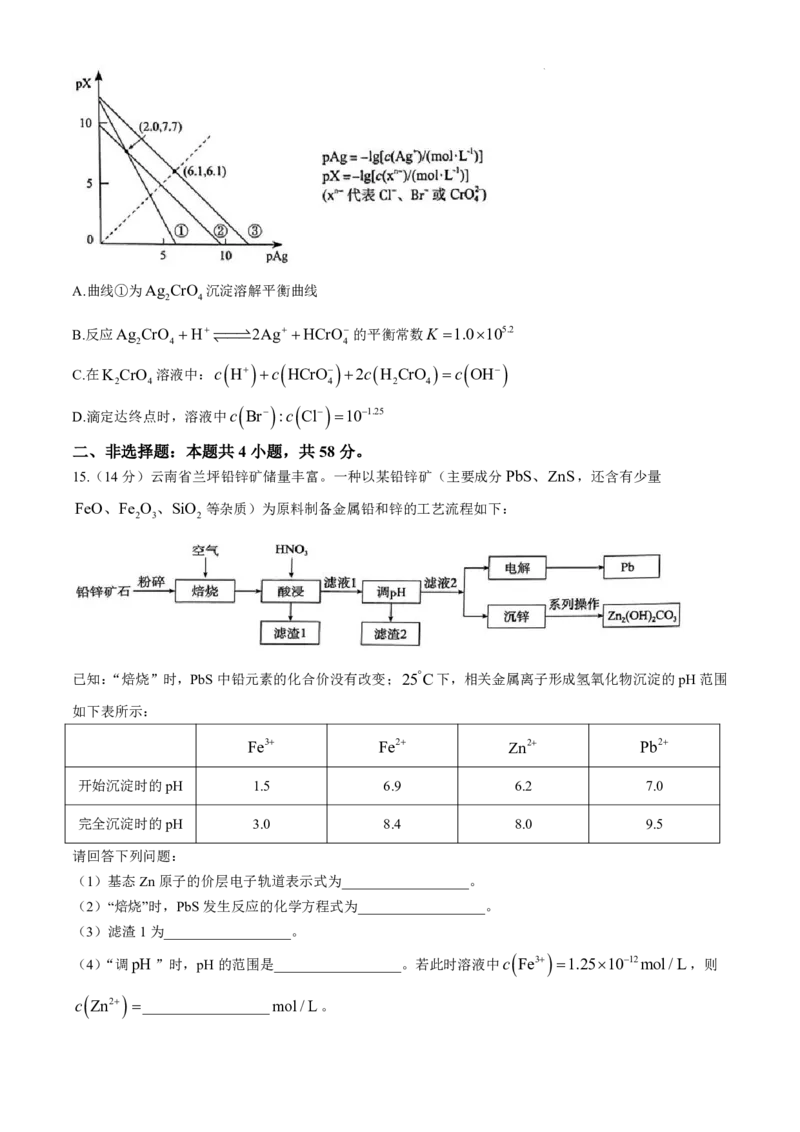
14.25C下,AgCl、AgBr和Ag CrO 的沉淀溶解平衡曲线如下图所示。某实验小组以K CrO 为指示剂,
2 4 2 4
用AgNO 标准溶液分别滴定含Cl水样、含Br水样。
3
已知:①Ag CrO 为砖红色沉淀;25C时,pK H CrO 0.7,pK H CrO 6.5;
2 4 al 2 4 a2 2 4
②相同条件下AgCl溶解度大于AgBr。
下列说法错误的是
学科网(北京)股份有限公司A.曲线①为Ag CrO 沉淀溶解平衡曲线
2 4
B.反应Ag CrO H 2Ag HCrO 的平衡常数K 1.0105.2
2 4 4
C.在K CrO 溶液中:c H c HCrO 2c H CrO c OH
2 4 4 2 4
D.滴定达终点时,溶液中c Br :c Cl 101.25
二、非选择题:本题共4小题,共 58分。
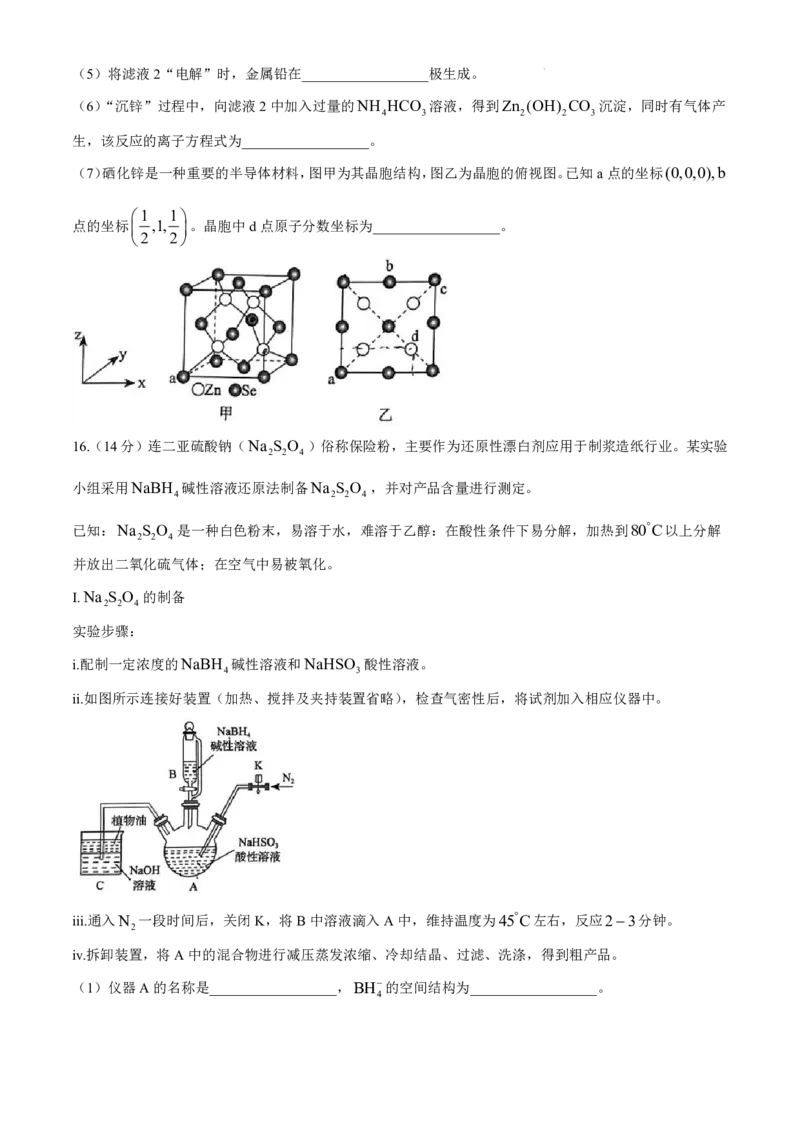
15.(14分)云南省兰坪铅锌矿储量丰富。一种以某铅锌矿(主要成分PbS、ZnS,还含有少量
FeO、Fe O 、SiO 等杂质)为原料制备金属铅和锌的工艺流程如下:
2 3 2
已知:“焙烧”时,PbS中铅元素的化合价没有改变;25C下,相关金属离子形成氢氧化物沉淀的pH范围
如下表所示:
Fe3 Fe2 Zn2 Pb2
开始沉淀时的pH 1.5 6.9 6.2 7.0
完全沉淀时的pH 3.0 8.4 8.0 9.5
请回答下列问题:
(1)基态Zn原子的价层电子轨道表示式为__________________。
(2)“焙烧”时,PbS发生反应的化学方程式为__________________。
(3)滤渣1为__________________。
(4)“调pH”时,pH的范围是__________________。若此时溶液中c Fe3 1.251012mol/L,则
c
Zn2
__________________mol/L。
学科网(北京)股份有限公司(5)将滤液2“电解”时,金属铅在__________________极生成。
(6)“沉锌”过程中,向滤液2中加入过量的NH HCO 溶液,得到Zn (OH) CO 沉淀,同时有气体产
4 3 2 2 3
生,该反应的离子方程式为__________________。
(7)硒化锌是一种重要的半导体材料,图甲为其晶胞结构,图乙为晶胞的俯视图。已知a点的坐标(0,0,0),b
1 1
点的坐标 ,1, 。晶胞中d点原子分数坐标为__________________。
2 2
16.(14分)连二亚硫酸钠(Na S O )俗称保险粉,主要作为还原性漂白剂应用于制浆造纸行业。某实验
2 2 4
小组采用NaBH 碱性溶液还原法制备Na S O ,并对产品含量进行测定。
4 2 2 4
已知:Na S O 是一种白色粉末,易溶于水,难溶于乙醇:在酸性条件下易分解,加热到80C以上分解
2 2 4
并放出二氧化硫气体;在空气中易被氧化。
I.Na S O 的制备
2 2 4
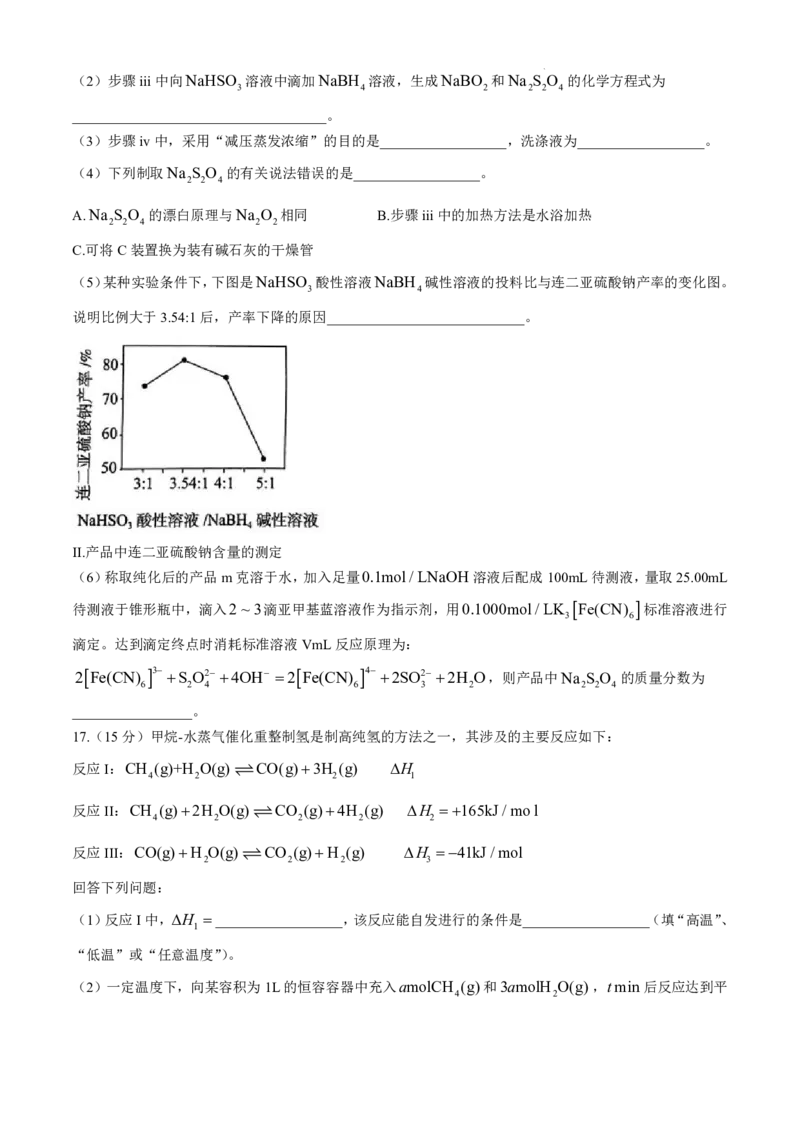
实验步骤:
i.配制一定浓度的NaBH 碱性溶液和NaHSO 酸性溶液。
4 3
ii.如图所示连接好装置(加热、搅拌及夹持装置省略),检查气密性后,将试剂加入相应仪器中。
iii.通入N 一段时间后,关闭K,将B中溶液滴入A中,维持温度为45C左右,反应23分钟。
2
iv.拆卸装置,将A中的混合物进行减压蒸发浓缩、冷却结晶、过滤、洗涤,得到粗产品。
(1)仪器A的名称是__________________,BH的空间结构为__________________。
4
学科网(北京)股份有限公司(2)步骤iii中向NaHSO 溶液中滴加NaBH 溶液,生成NaBO 和Na S O 的化学方程式为
3 4 2 2 2 4
____________________________________。
(3)步骤iv中,采用“减压蒸发浓缩”的目的是__________________,洗涤液为__________________。
(4)下列制取Na S O 的有关说法错误的是__________________。
2 2 4
A.Na S O 的漂白原理与Na O 相同 B.步骤iii中的加热方法是水浴加热
2 2 4 2 2
C.可将C装置换为装有碱石灰的干燥管
(5)某种实验条件下,下图是NaHSO 酸性溶液NaBH 碱性溶液的投料比与连二亚硫酸钠产率的变化图。
3 4
说明比例大于3.54:1后,产率下降的原因____________________________。
II.产品中连二亚硫酸钠含量的测定
(6)称取纯化后的产品m克溶于水,加入足量0.1mol/LNaOH溶液后配成100mL待测液,量取25.00mL
待测液于锥形瓶中,滴入2~3滴亚甲基蓝溶液作为指示剂,用0.1000mol/LK Fe(CN) 标准溶液进行
3 6
滴定。达到滴定终点时消耗标准溶液VmL反应原理为:
2 Fe(CN) 3 S O2 4OH 2 Fe(CN) 4 2SO2 2H O,则产品中Na S O 的质量分数为
6 2 4 6 3 2 2 2 4
_________________。
17.(15分)甲烷-水蒸气催化重整制氢是制高纯氢的方法之一,其涉及的主要反应如下:
反应I:CH (g)+H O(g) CO(g)3H (g) H
4 2 2 1
反应II:CH (g)2H O(g) CO (g)4H (g) H 165kJ/mol
4 2 2 2 2
反应III:CO(g)H O(g) CO (g)H (g) H 41kJ/mol
2 2 2 3
回答下列问题:
(1)反应I中,H __________________,该反应能自发进行的条件是__________________(填“高温”、
1
“低温”或“任意温度”)。
(2)一定温度下,向某容积为1L的恒容容器中充入amolCH (g)和3amolH O(g),t min后反应达到平
4 2
学科网(北京)股份有限公司衡。达到平衡时,容器中CO 为m mol,CO为nmol。
2
①下列说法正确的是__________________。
A.为防止催化剂中毒和安全事故发生,往往对原料气进行净化处理
B.适当提高水碳比
n H O /n CH
,有利于提高H 的产率
2 4 2
C.其他条件不变,若压缩容器体积,反应II的平衡正向移动
D.以Ni/Al O 作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
2 3
②用CH 表示该过程的平均反应速率__________________mol(Lmin),反应III的平衡常数
4
K __________________(用含a、m、n、t的代数式表示)。
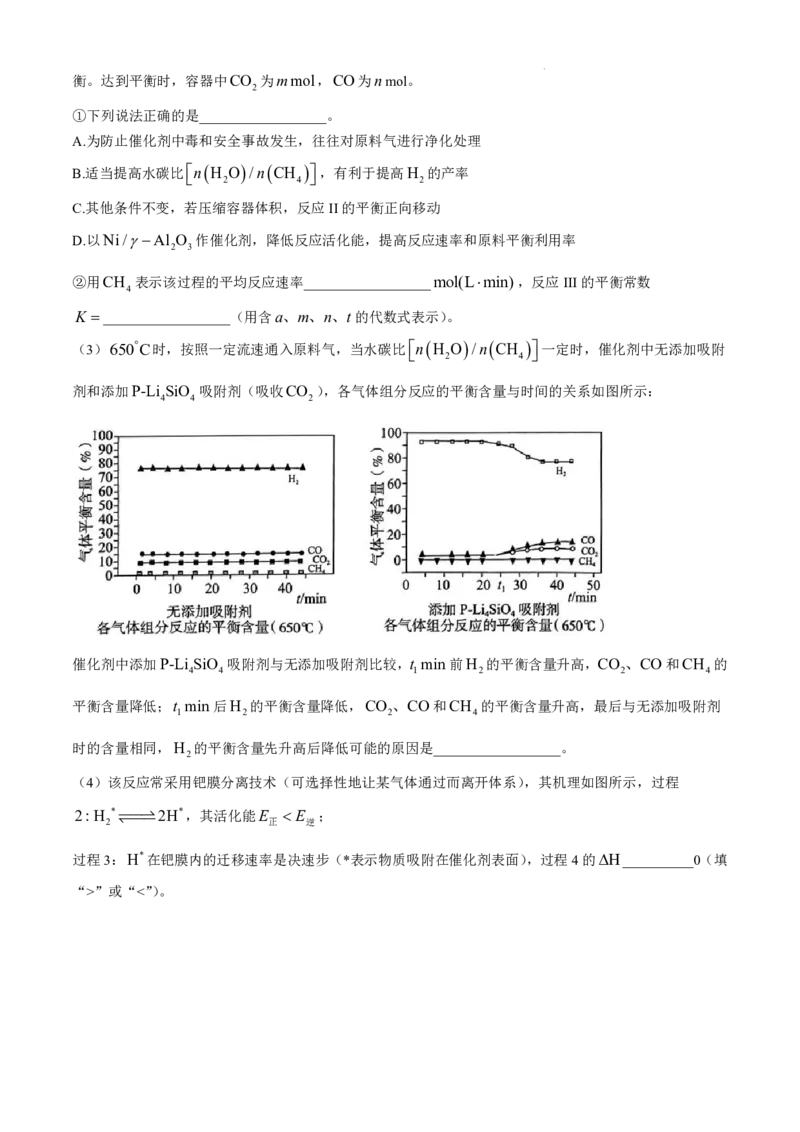
(3)650C时,按照一定流速通入原料气,当水碳比
n H O /n CH
一定时,催化剂中无添加吸附
2 4
剂和添加P-Li SiO 吸附剂(吸收CO ),各气体组分反应的平衡含量与时间的关系如图所示:
4 4 2
催化剂中添加P-Li SiO 吸附剂与无添加吸附剂比较,t min前H 的平衡含量升高,CO 、CO和CH 的
4 4 1 2 2 4
平衡含量降低;t min后H 的平衡含量降低,CO 、CO和CH 的平衡含量升高,最后与无添加吸附剂
1 2 2 4
时的含量相同,H 的平衡含量先升高后降低可能的原因是__________________。
2
(4)该反应常采用钯膜分离技术(可选择性地让某气体通过而离开体系),其机理如图所示,过程
2:H * 2H*,其活化能E E ;
2 正 逆
过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),过程4的H__________0(填
“>”或“<”)。
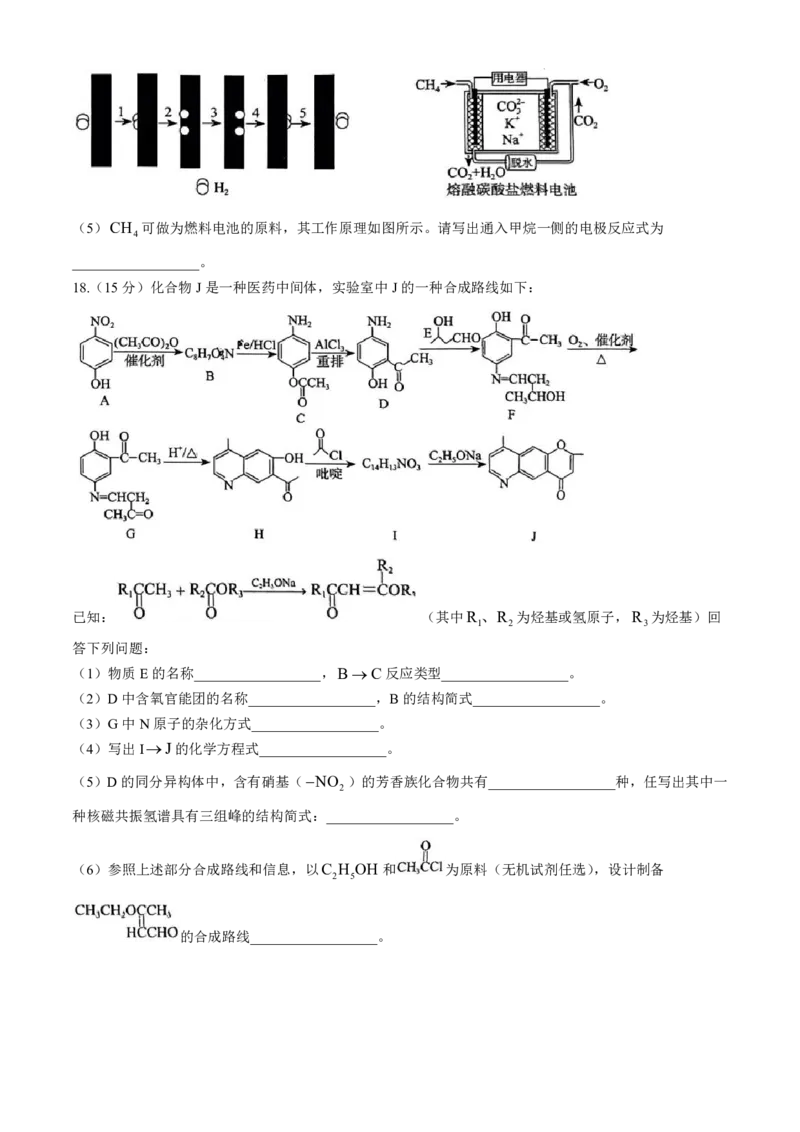
学科网(北京)股份有限公司(5)CH 可做为燃料电池的原料,其工作原理如图所示。请写出通入甲烷一侧的电极反应式为
4
__________________。
18.(15分)化合物J是一种医药中间体,实验室中J的一种合成路线如下:
已知: (其中R、R 为烃基或氢原子,R 为烃基)回
1 2 3
答下列问题:
(1)物质E的名称__________________,BC反应类型__________________。
(2)D中含氧官能团的名称__________________,B的结构简式__________________。
(3)G中N原子的杂化方式__________________。
(4)写出IJ的化学方程式__________________。
(5)D的同分异构体中,含有硝基(NO )的芳香族化合物共有__________________种,任写出其中一
2
种核磁共振氢谱具有三组峰的结构简式:__________________。
(6)参照上述部分合成路线和信息,以C H OH 和 为原料(无机试剂任选),设计制备
2 5
的合成路线__________________。
学科网(北京)股份有限公司