文档内容
广东实验中学2024—2025学年(上)高二级期中考试
化 学
命题:高二备课组 审定: 柳先美 校对:高二备课组
本试卷分选择题和非选择题两部分,共8页,满分100分,考试用时75分钟
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卷上。
2.选择题每小题选出答案后,用2B铅笔把答题卷上对应题目的答案标号涂黑;如需改动,
用橡皮擦干净后,再选涂其它答案;不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内
的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂
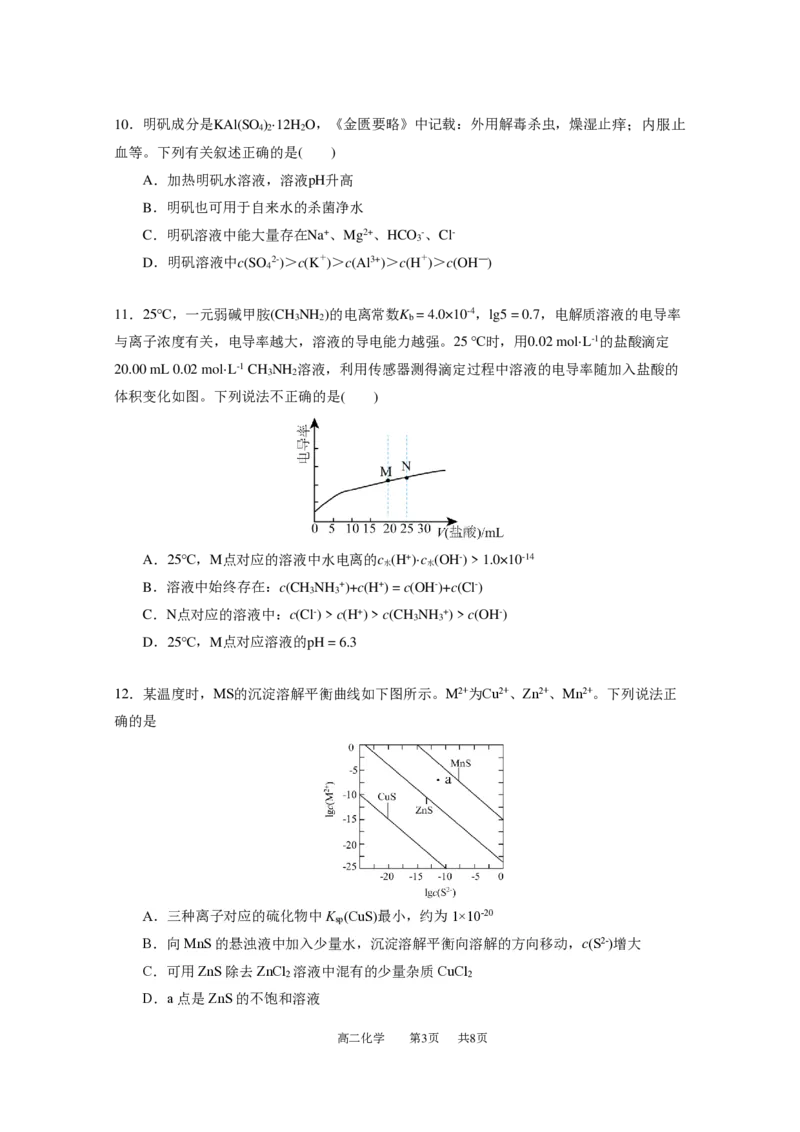
改液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将答题卷收回。
第一部分 选择题(共40分)
单选题(第1~10小题,每题2分;第11~15小题,每题4分;共40分)
1.下列变化中的能量改变方式与其他三项不同的是( )
A.碳酸钙受热分解 B.煤气燃烧 C.氧化钙溶于水 D.钠与水反应
2.下列说法正确的是( )
A.已知C(s)+O (g) = CO (g) ΔH = a kJ·mol-1,
2 2
1
C(s)+ O (g) = CO(g) ΔH = b kJ·mol-1,则a 1.0×10-14
水 水
B.溶液中始终存在:c(CH NH +)+c(H+) = c(OH-)+c(Cl-)
3 3
C.N点对应的溶液中:c(Cl-) > c(H+) > c(CH NH +) > c(OH-)
3 3
D.25℃,M点对应溶液的pH = 6.3
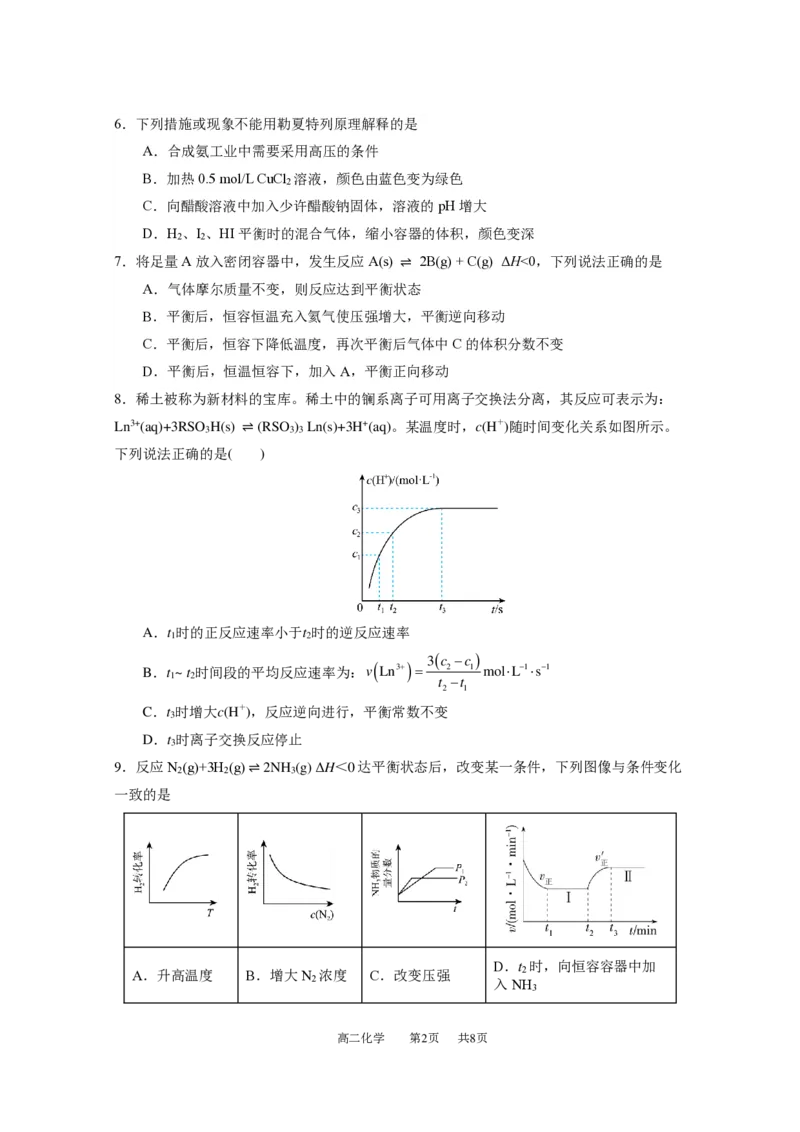
12.某温度时,MS的沉淀溶解平衡曲线如下图所示。M2+为Cu2+、Zn2+、Mn2+。下列说法正
确的是
A.三种离子对应的硫化物中K (CuS)最小,约为1×10-20
sp
B.向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大
C.可用ZnS除去ZnCl 溶液中混有的少量杂质CuCl
2 2
D.a点是ZnS的不饱和溶液
高二化学 第3页 共8页13.常温下测得0.1 mol·L-1 Na A溶液的pH约为13。下列说法或表达正确的是( )
2
已知:K (H A)=1.1×10-7,K (H A)=1.1×10-14,K (CuA)=6.3×10-36。
a1 2 a2 2 sp
A.Na A溶液显碱性的原因: A2− + H O ⇌ H A+2OH-
2 2 2
B.Na A溶液中离子浓度的大小关系:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
2
C.向该溶液中滴加等体积0.1 mol·L-1的HCl溶液,反应后的溶液存在关系:c(Na+)=
2[c(A2-)+c(HA-)+c(H A)]
2
D.由计算可知:H A + Cu2+ ⇌ CuA↓+2H+不能发生
2
14.室温下,下列探究方案能达到实验目的的是( )
选项 探究方案 实验目的
用不同浓度、等体积的H O 溶液分别与相同浓度相
2 2
A 探究浓度对反应速率的影响
同体积的Na SO 溶液反应,观察现象
2 3
用pH试纸测定同浓度NaClO和NaF溶液的pH,比较
B 比较HClO与HF的酸性强弱
溶液pH大小
向10 mL 0.2 mol·L-1NaOH溶液中滴加2滴0.1 mol·L-1
证明在相同温度下K :
sp
C MgCl溶液,产生白色沉淀。再滴加2滴0.1 mol·L-1
2
Mg(OH) >Fe(OH)
2 3
FeCl溶液,又生成红褐色沉淀
3
往等体积、等pH的HA溶液和HB溶液中分别加入足
D 证明K (HA) < K (HB)
a a
量锌粉,充分反应后,HA溶液产生更多的氢气
15.下列实验中,能达到实验目的的是
A.正确读取酸
D.蒸干AlCl 溶
式滴定管的读 B.制备Fe(OH) 胶体 C.测量中和反应反应热 3
3 液获得AlCl 晶体
数为21.40mL 3
高二化学 第4页 共8页第二部分 非选择题(共60分)
16.(22分)减少CO 的排放并利用CO 是我国能源领域的一个重要战略方向。
2 2
Ⅰ.在CO 与H 催化合成甲醇的体系中,同时存在以下反应:
2 2
反应ⅰ:CO (g)+H (g) CO(g)+H O(g) ΔH = +41.1kJ·mol−1
2 2 2 1
反应ⅱ:CO(g)+2H (g) CH OH(g) ΔH = -90.0kJ·mol−1
2 3 2
反应ⅲ:CO (g)+3H (g) CH OH(g)+H O(g) ΔH
2 2 3 2 3
(1)ΔH = kJ·mol-1;若要反应ⅲ正向自发进行, (填“高温”或“低温”)更有利。
3
(2)对于反应ⅰ,𝑣 =𝑣 −𝑣 =𝑘 ∙𝑐(𝐶𝑂 )∙𝑐(𝐻 )−𝑘 ∙𝑐(𝐶𝑂)∙𝑐(𝐻 𝑂),其中k 、k 分别
正 逆 正 2 2 逆 2 正 逆
𝑘
正
为正反应、逆反应的速率常数。若升高温度, (填“增大”“减小”或“不变”)。
𝑘
逆
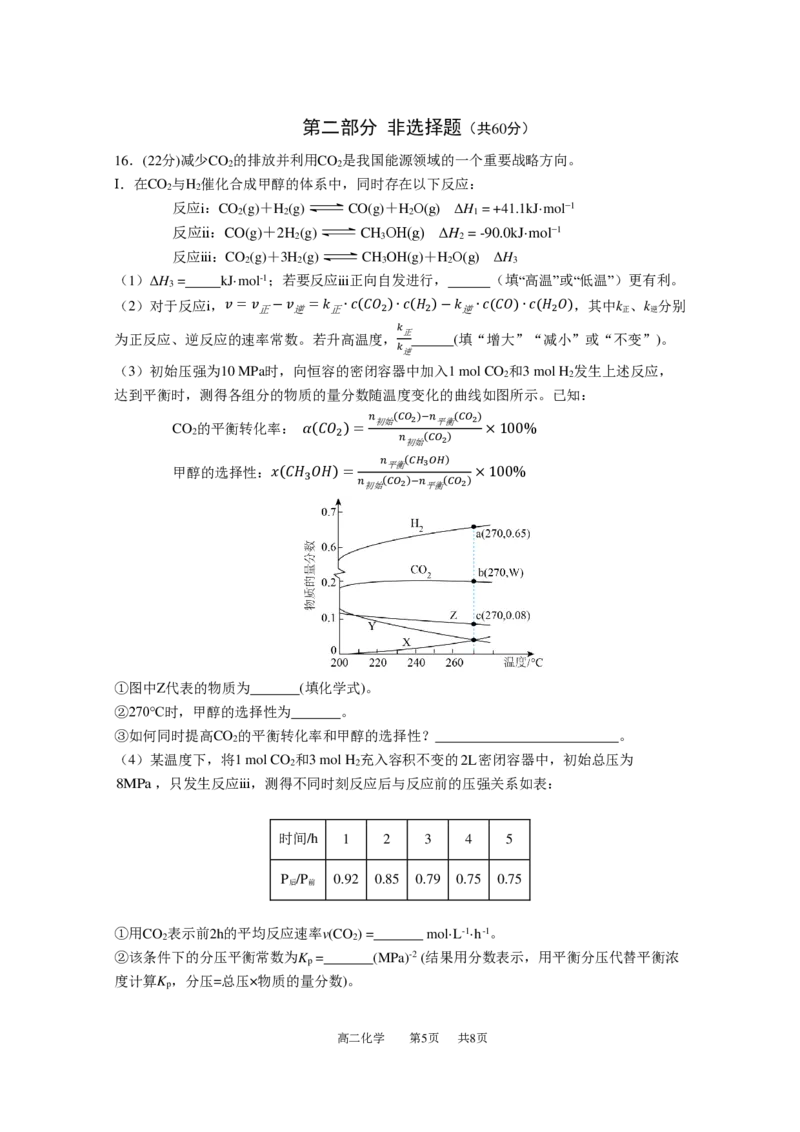
(3)初始压强为10 MPa时,向恒容的密闭容器中加入1 mol CO 和3 mol H 发生上述反应,
2 2
达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。已知:
CO 的平衡转化率: 𝛼(𝐶𝑂 )=
𝑛
初始
(𝐶𝑂2 )−𝑛
平衡
(𝐶𝑂2 )
×100%
2 2 𝑛
初始
(𝐶𝑂2 )
甲醇的选择性:𝑥(𝐶𝐻 𝑂𝐻)=
𝑛
平衡
(𝐶𝐻3𝑂𝐻)
×100%
3 𝑛
初始
(𝐶𝑂2 )−𝑛
平衡
(𝐶𝑂2 )
①图中Z代表的物质为 (填化学式)。
②270℃时,甲醇的选择性为 。
③如何同时提高CO 的平衡转化率和甲醇的选择性? 。
2
(4)某温度下,将1 mol CO 和3 mol H 充入容积不变的2L密闭容器中,初始总压为
2 2
8MPa,只发生反应ⅲ,测得不同时刻反应后与反应前的压强关系如表:
时间/h 1 2 3 4 5
P /P 0.92 0.85 0.79 0.75 0.75
后 前
①用CO 表示前2h的平均反应速率v(CO ) =_______ mol·L-1·h -1。
2 2
②该条件下的分压平衡常数为K = (MPa)-2 (结果用分数表示,用平衡分压代替平衡浓
p
度计算K ,分压=总压×物质的量分数)。
p
高二化学 第5页 共8页Ⅱ.工业上以CO 和NH 为原料在一定温度和压强下合成尿素。反应分两步进行,过程中的能
2 3
量变化如图所示。
反应Ⅰ:CO (l)+2NH (l) NH COONH (l)
2 3 2 4
反应Ⅱ:NH COONH (l) CO(NH ) (l)+H O(l)
2 4 2 2 2
(5)反应速率较快的是 反应(填“第一步”
或“第二步”)。
(6)总反应热化学方程式为 。
Ⅲ.CO 加氢制备CH 的一种催化机理如图。
2 4
(7)下列说法正确的有 (填字母标号)。
A.催化过程使用的催化剂为La O 和La O CO
2 3 2 2 3
B.La O CO 可以释放出CO *(活化分子)
2 2 3 2
C.H 经过Ni活性中心裂解产生活化态H*的过程为放热过程
2
D.CO 加氢制备CH 的过程需要La O 和Ni共同完成
2 4 2 3
17.(12分)工业生产过程中产生的SO 会造成环境问题,可用多种方法脱除。
2
Ⅰ.由次氯酸钠碱性废水(含有杂质Ca2+)处理硫酸工业尾气的流程如下图。控制合适的条件有
利于提高SO 的吸收率(脱硫率)。
2
(1)脱硫时需保持溶液呈碱性,此过程的主要反应有两个,离子方程式分别为:SO + 2OH-
2
= SO2-+H O、 。
3 2
(2)提高脱硫率的可行措施有 (填序号)。
A.加快通入尾气的速率
B.吸收塔中喷淋的碱液与气体逆向接触
C.提高碱液pH
(3)温度控制在40~60 ℃之间,脱硫率较高,原因是 。
(4)滤渣的主要成分是 (填化学式)。
高二化学 第6页 共8页Ⅱ.工业上用氨水吸收废气中的SO 。已知25℃时,NH ·H O的电离平衡常数K = 1.8×10-5,
2 3 2 b
H SO 的电离平衡常数K = 1.3×10-2、K = 6.2×10-8。
2 3 a1 a2
2−
𝑐(SO )
(5)25℃时,将SO 通入氨水中,当c(OH-)降至2.0×10-6mol⋅L-1时,溶液中的 3 = 。
2 −
𝑐(HSO )
3
(6)在NH HSO 溶液中加入少量NaOH溶液,反应的离子方程式为 。
4 3
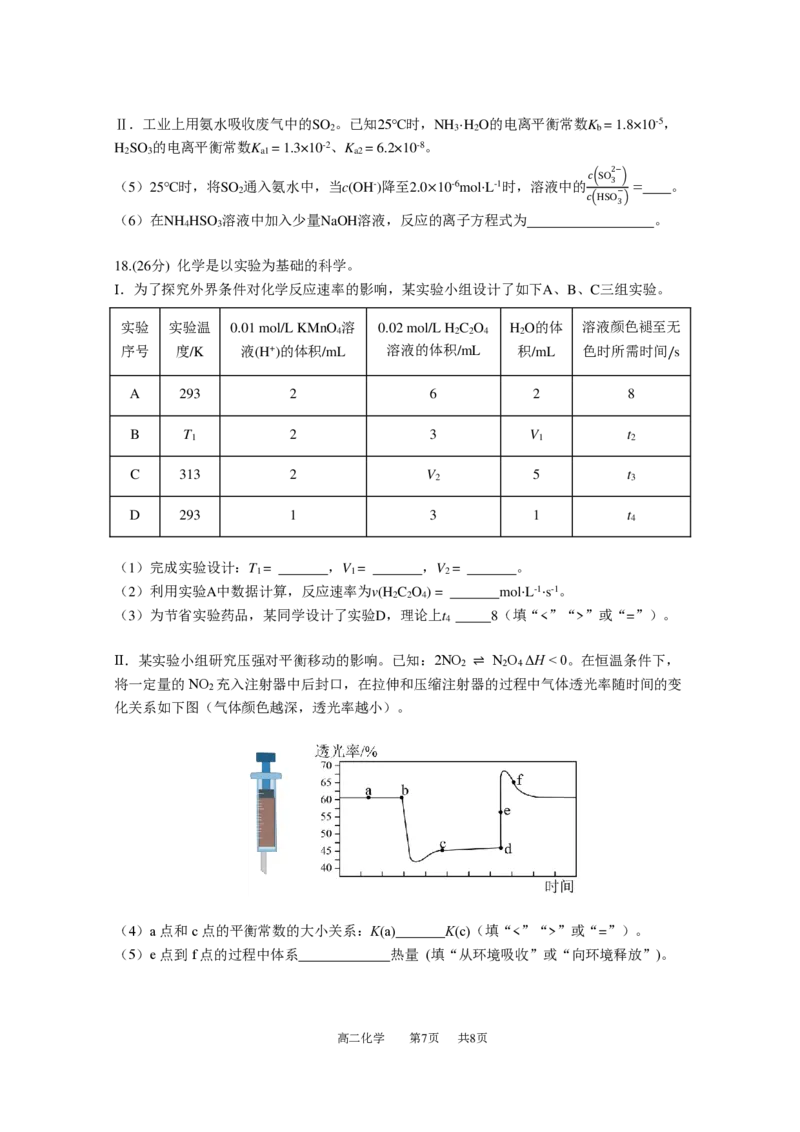
18.(26分) 化学是以实验为基础的科学。
Ⅰ.为了探究外界条件对化学反应速率的影响,某实验小组设计了如下A、B、C三组实验。
实验 实验温 0.01 mol/L KMnO 溶 0.02 mol/L H C O H O的体 溶液颜色褪至无
4 2 2 4 2
序号 度/K 液(H+)的体积/mL 溶液的体积/mL 积/mL 色时所需时间/s
A 293 2 6 2 8
B T 2 3 V t
1 1 2
C 313 2 V 5 t
2 3
D 293 1 3 1 t
4
(1)完成实验设计:T = ,V = ,V = 。
1 1 2
(2)利用实验A中数据计算,反应速率为v(H C O ) = mol⋅L-1⋅s-1。
2 2 4
(3)为节省实验药品,某同学设计了实验D,理论上t 8(填“<”“>”或“=”)。
4
Ⅱ.某实验小组研究压强对平衡移动的影响。已知:2NO ⇌ N O ΔH < 0。在恒温条件下,
2 2 4
将一定量的NO 充入注射器中后封口,在拉伸和压缩注射器的过程中气体透光率随时间的变
2
化关系如下图(气体颜色越深,透光率越小)。
(4)a点和c点的平衡常数的大小关系:K(a) K(c)(填“<”“>”或“=”)。
(5)e点到f点的过程中体系 热量 (填“从环境吸收”或“向环境释放”)。
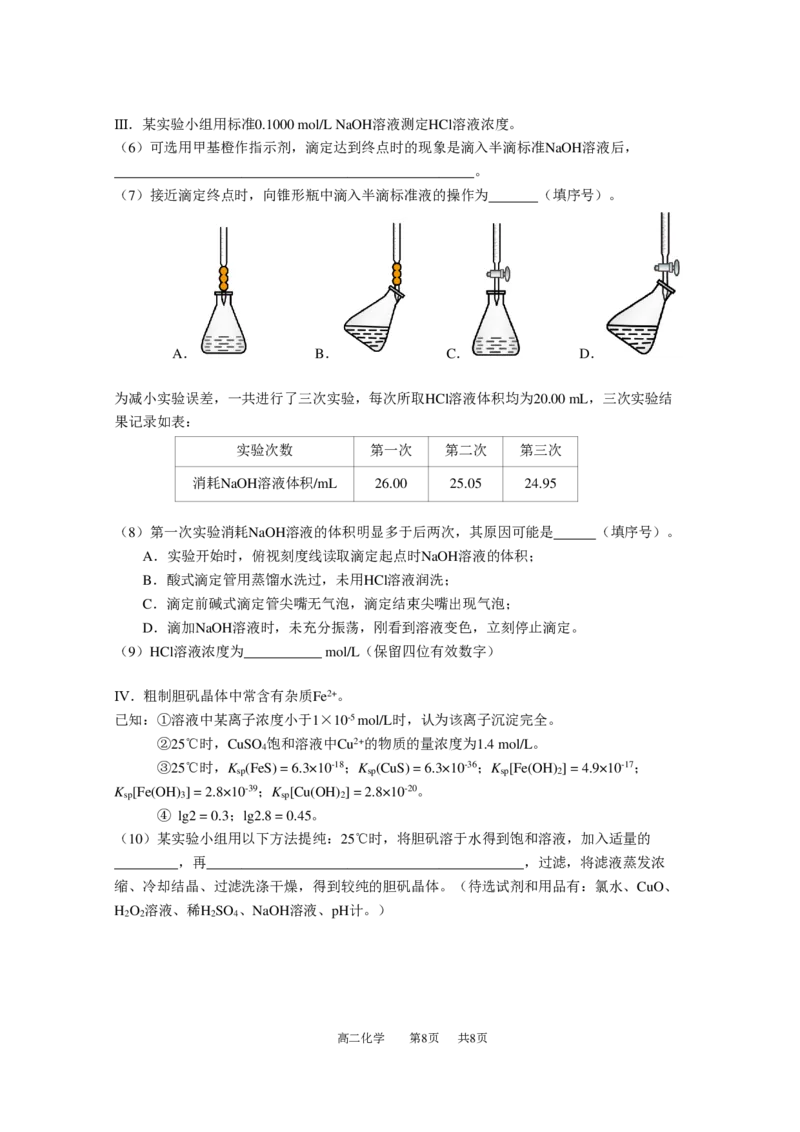
高二化学 第7页 共8页Ⅲ.某实验小组用标准0.1000 mol/L NaOH溶液测定HCl溶液浓度。
(6)可选用甲基橙作指示剂,滴定达到终点时的现象是滴入半滴标准NaOH溶液后,
___________________________________________________。
(7)接近滴定终点时,向锥形瓶中滴入半滴标准液的操作为 (填序号)。
A. B. C. D.
为减小实验误差,一共进行了三次实验,每次所取HCl溶液体积均为20.00 mL,三次实验结
果记录如表:
实验次数 第一次 第二次 第三次
消耗NaOH溶液体积/mL 26.00 25.05 24.95
(8)第一次实验消耗NaOH溶液的体积明显多于后两次,其原因可能是 (填序号)。
A.实验开始时,俯视刻度线读取滴定起点时NaOH溶液的体积;
B.酸式滴定管用蒸馏水洗过,未用HCl溶液润洗;
C.滴定前碱式滴定管尖嘴无气泡,滴定结束尖嘴出现气泡;
D.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(9)HCl溶液浓度为___________ mol/L(保留四位有效数字)
Ⅳ.粗制胆矾晶体中常含有杂质Fe2+。
已知:①溶液中某离子浓度小于1×10-5 mol/L时,认为该离子沉淀完全。
②25℃时,CuSO 饱和溶液中Cu2+的物质的量浓度为1.4 mol/L。
4
③25℃时,K (FeS) = 6.3×10-18;K (CuS) = 6.3×10-36;K [Fe(OH) ] = 4.9×10-17;
sp sp sp 2
K [Fe(OH) ] = 2.8×10-39;K [Cu(OH) ] = 2.8×10-20。
sp 3 sp 2
④ lg2 = 0.3;lg2.8 = 0.45。
(10)某实验小组用以下方法提纯:25℃时,将胆矾溶于水得到饱和溶液,加入适量的
_________,再_____________________________________________,过滤,将滤液蒸发浓
缩、冷却结晶、过滤洗涤干燥,得到较纯的胆矾晶体。(待选试剂和用品有:氯水、CuO、
H O 溶液、稀H SO 、NaOH溶液、pH计。)
2 2 2 4
高二化学 第8页 共8页