文档内容
广东实验中学 2024—2025 学年(下)高二级期中考试
化 学
命题:高二备课组 审定: 柳先美 校对:高二备课组
本试卷分选择题和非选择题两部分,共8页,满分100分,考试用时75分钟
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卷上。
2.选择题每小题选出答案后,用 2B 铅笔把答题卷上对应题目的答案标号涂黑;如需改动,
用橡皮擦干净后,再选涂其它答案;不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内的
相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改
液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将答题卷收回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Cu 64
第一部分 选择题(共45分)
单选题(每题3分;共45分)
1.下列叙述中错误的是
A.测定某一固体是否是晶体可用X射线衍射仪进行实验
B.石墨晶体是层状结构,层间没有化学键相连,是靠范德华力维系的
C.在现代化学中,常利用原子光谱上的特征谱线来鉴定元素
D.1 mol SiO 晶体中含有2 N 个Si-O键(N 表示阿伏加德罗常数的值)
2 A A
2.实验室常用KSCN或K [Fe(CN) ]来检验溶液中Fe3+的存在,下列有关说法正确的是
4 6
A.第一电离:I (N)<I (S) B.电负性:χ(C)>χ(N)
1 1
C.SCN-的空间结构为直线形 D.基态Fe3+的价电子排布式:3d64s2
3.下列表述正确的是
A.醛基的结构简式-COH
B.丙烯的键线式
C.基态N原子的核外电子轨道表示式为
D.HF分子中σ键的形成示意图为:
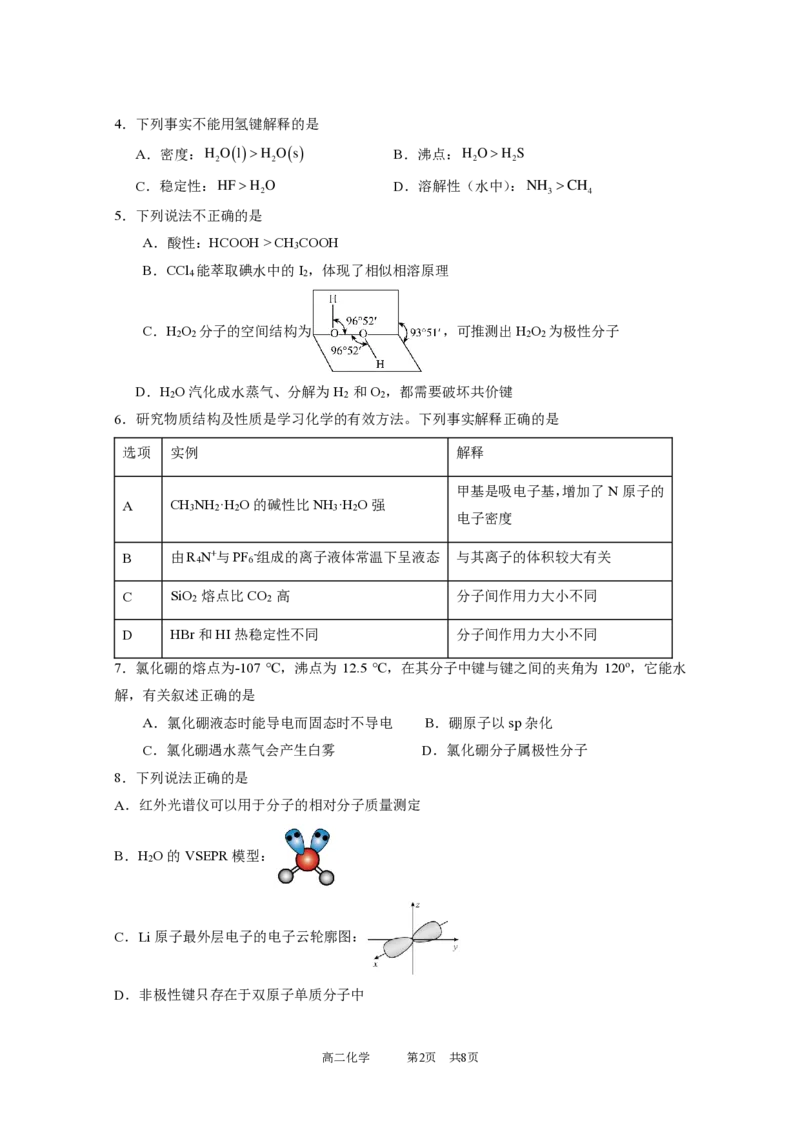
高二化学 第1页 共8页4.下列事实不能用氢键解释的是
A.密度:H O(l)H O(s) B.沸点:H OH S
2 2 2 2
C.稳定性:HFH O D.溶解性(水中):NH CH
2 3 4
5.下列说法不正确的是
A.酸性:HCOOH > CH COOH
3
B.CCl 能萃取碘水中的I ,体现了相似相溶原理
4 2
C.H O 分子的空间结构为 ,可推测出H O 为极性分子
2 2 2 2
D.H O汽化成水蒸气、分解为H 和O ,都需要破坏共价键
2 2 2
6.研究物质结构及性质是学习化学的有效方法。下列事实解释正确的是
选项 实例 解释
甲基是吸电子基,增加了N原子的
A CH NH ·H O的碱性比NH ·H O强
3 2 2 3 2
电子密度
B 由R N+与PF -组成的离子液体常温下呈液态 与其离子的体积较大有关
4 6
C SiO 熔点比CO 高 分子间作用力大小不同
2 2
D HBr和HI热稳定性不同 分子间作用力大小不同
7.氯化硼的熔点为-107 ℃,沸点为 12.5 ℃,在其分子中键与键之间的夹角为 120o,它能水
解,有关叙述正确的是
A.氯化硼液态时能导电而固态时不导电 B.硼原子以sp杂化
C.氯化硼遇水蒸气会产生白雾 D.氯化硼分子属极性分子
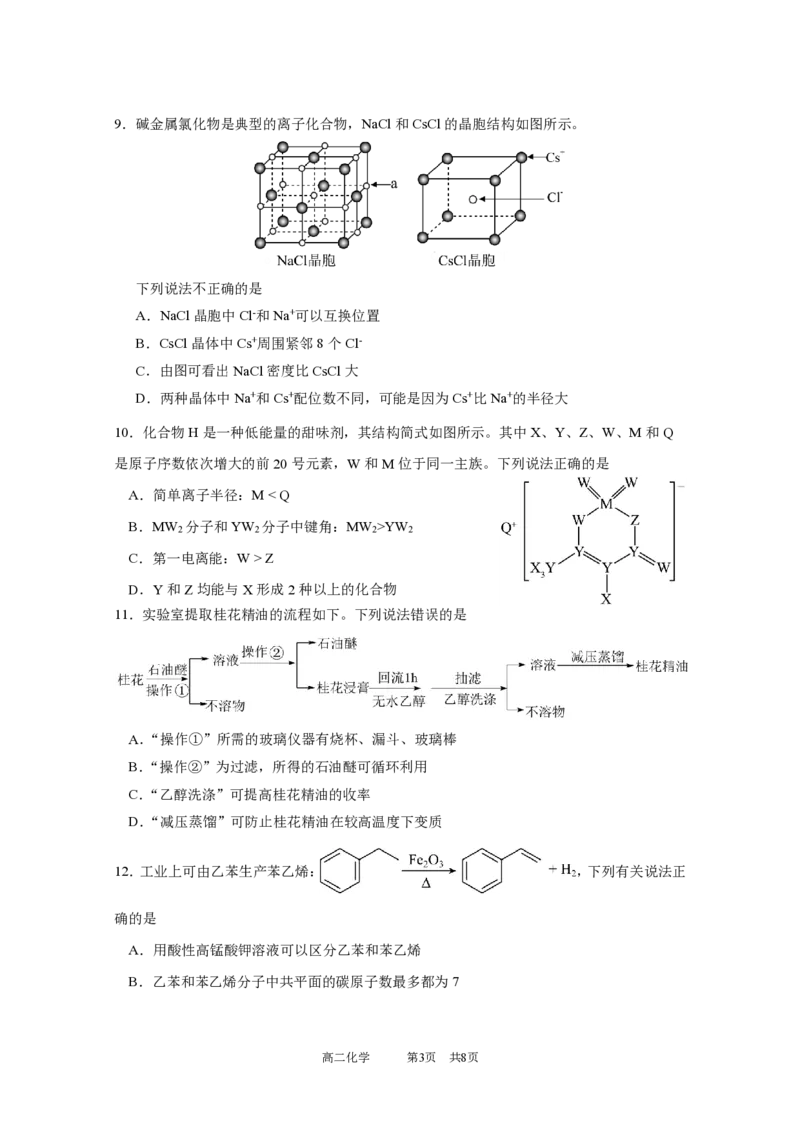
8.下列说法正确的是
A.红外光谱仪可以用于分子的相对分子质量测定
B.H O的VSEPR模型:
2
C.Li原子最外层电子的电子云轮廓图:
D.非极性键只存在于双原子单质分子中
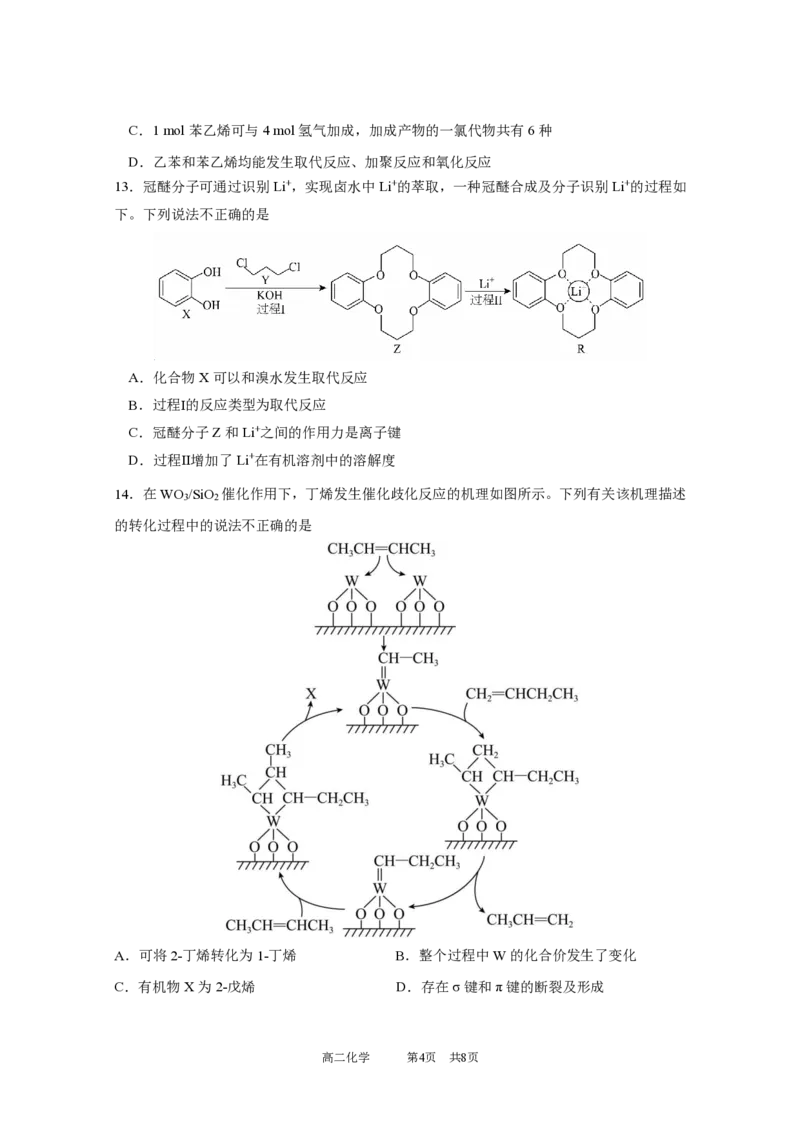
高二化学 第2页 共8页9.碱金属氯化物是典型的离子化合物,NaCl和CsCl的晶胞结构如图所示。
下列说法不正确的是
A.NaCl晶胞中Cl-和Na+可以互换位置
B.CsCl晶体中Cs+周围紧邻8个Cl-
C.由图可看出NaCl密度比CsCl大
D.两种晶体中Na+和Cs+配位数不同,可能是因为Cs+比Na+的半径大
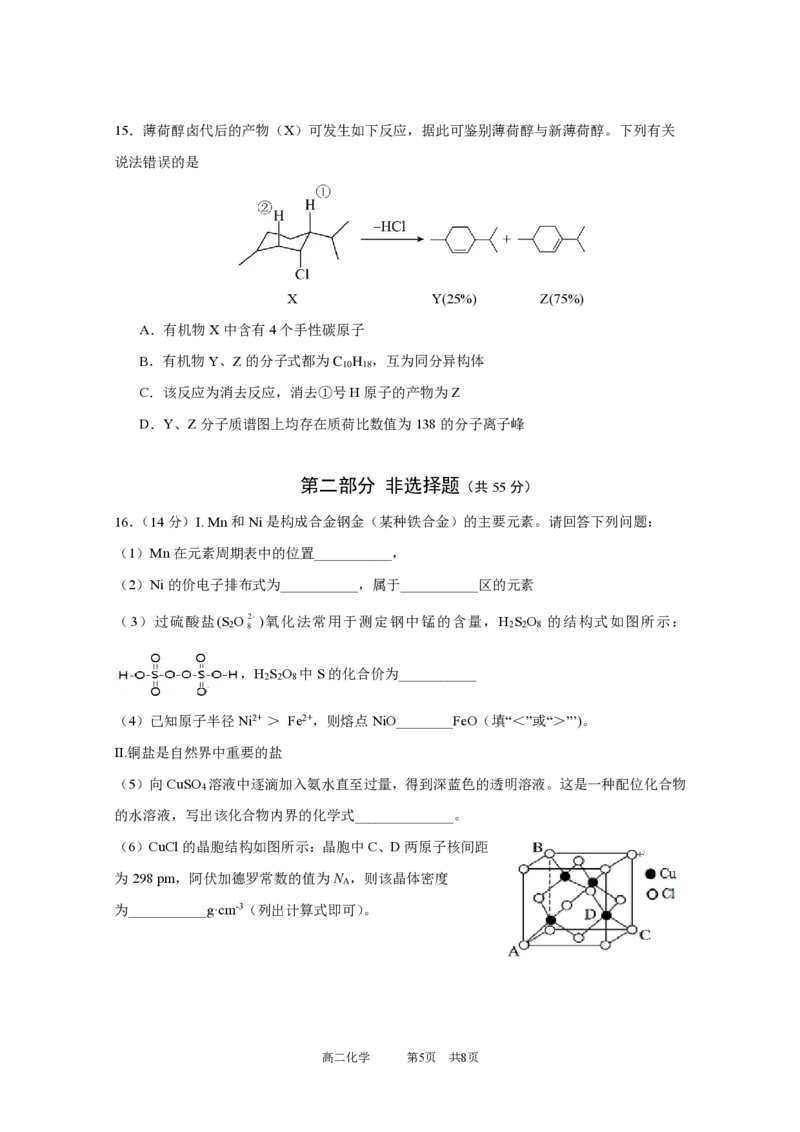
10.化合物H是一种低能量的甜味剂,其结构简式如图所示。其中X、Y、Z、W、M和Q
是原子序数依次增大的前20号元素,W和M位于同一主族。下列说法正确的是
A.简单离子半径:M < Q
B.MW 分子和YW 分子中键角:MW >YW
2 2 2 2
C.第一电离能:W > Z
D.Y和Z均能与X形成2种以上的化合物
11.实验室提取桂花精油的流程如下。下列说法错误的是
A.“操作①”所需的玻璃仪器有烧杯、漏斗、玻璃棒
B.“操作②”为过滤,所得的石油醚可循环利用
C.“乙醇洗涤”可提高桂花精油的收率
D.“减压蒸馏”可防止桂花精油在较高温度下变质
12.工业上可由乙苯生产苯乙烯: ,下列有关说法正
确的是
A.用酸性高锰酸钾溶液可以区分乙苯和苯乙烯
B.乙苯和苯乙烯分子中共平面的碳原子数最多都为7
高二化学 第3页 共8页C.1 mol苯乙烯可与4 mol氢气加成,加成产物的一氯代物共有6种
D.乙苯和苯乙烯均能发生取代反应、加聚反应和氧化反应
13.冠醚分子可通过识别Li+,实现卤水中Li+的萃取,一种冠醚合成及分子识别Li+的过程如
下。下列说法不正确的是
A.化合物X可以和溴水发生取代反应
B.过程Ⅰ的反应类型为取代反应
C.冠醚分子Z和Li+之间的作用力是离子键
D.过程Ⅱ增加了Li+在有机溶剂中的溶解度
14.在WO /SiO 催化作用下,丁烯发生催化歧化反应的机理如图所示。下列有关该机理描述
3 2
的转化过程中的说法不正确的是
A.可将2-丁烯转化为1-丁烯 B.整个过程中W的化合价发生了变化
C.有机物X为2-戊烯 D.存在σ键和π键的断裂及形成
高二化学 第4页 共8页15.薄荷醇卤代后的产物(X)可发生如下反应,据此可鉴别薄荷醇与新薄荷醇。下列有关
说法错误的是
X Y(25%) Z(75%)
A.有机物X中含有4个手性碳原子
B.有机物Y、Z的分子式都为C H ,互为同分异构体
10 18
C.该反应为消去反应,消去①号H原子的产物为Z
D.Y、Z分子质谱图上均存在质荷比数值为138的分子离子峰
第二部分 非选择题(共55分)
16.(14分)Ⅰ. Mn和Ni是构成合金钢金(某种铁合金)的主要元素。请回答下列问题:
(1)Mn在元素周期表中的位置___________,
(2)Ni的价电子排布式为___________,属于___________区的元素
(3)过硫酸盐(S O2- )氧化法常用于测定钢中锰的含量,H S O 的结构式如图所示:
2 8 2 2 8
,H S O 中S的化合价为___________
2 2 8
(4)已知原子半径Ni2+ > Fe2+,则熔点NiO________FeO(填“<”或“>”’)。
Ⅱ.铜盐是自然界中重要的盐
(5)向CuSO 溶液中逐滴加入氨水直至过量,得到深蓝色的透明溶液。这是一种配位化合物
4
的水溶液,写出该化合物内界的化学式______________。
(6)CuCl的晶胞结构如图所示:晶胞中C、D两原子核间距
为298 pm,阿伏加德罗常数的值为N ,则该晶体密度
A
为___________g·cm-3(列出计算式即可)。
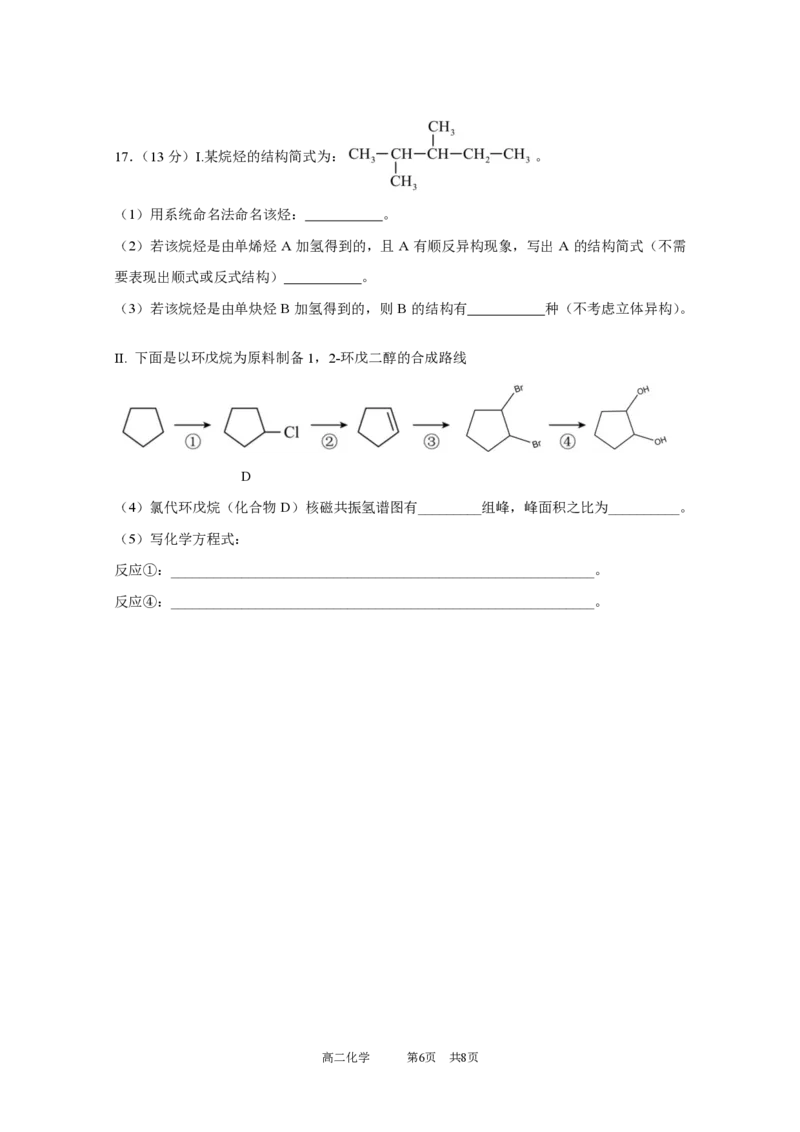
高二化学 第5页 共8页17.(13分)Ⅰ.某烷烃的结构简式为: 。
(1)用系统命名法命名该烃: 。
(2)若该烷烃是由单烯烃 A 加氢得到的,且 A 有顺反异构现象,写出 A 的结构简式(不需
要表现出顺式或反式结构) 。
(3)若该烷烃是由单炔烃 B 加氢得到的,则B 的结构有 种(不考虑立体异构)。
Ⅱ. 下面是以环戊烷为原料制备1,2-环戊二醇的合成路线
D
(4)氯代环戊烷(化合物D)核磁共振氢谱图有_________组峰,峰面积之比为__________。
(5)写化学方程式:
反应①:____________________________________________________________。
反应④:____________________________________________________________。
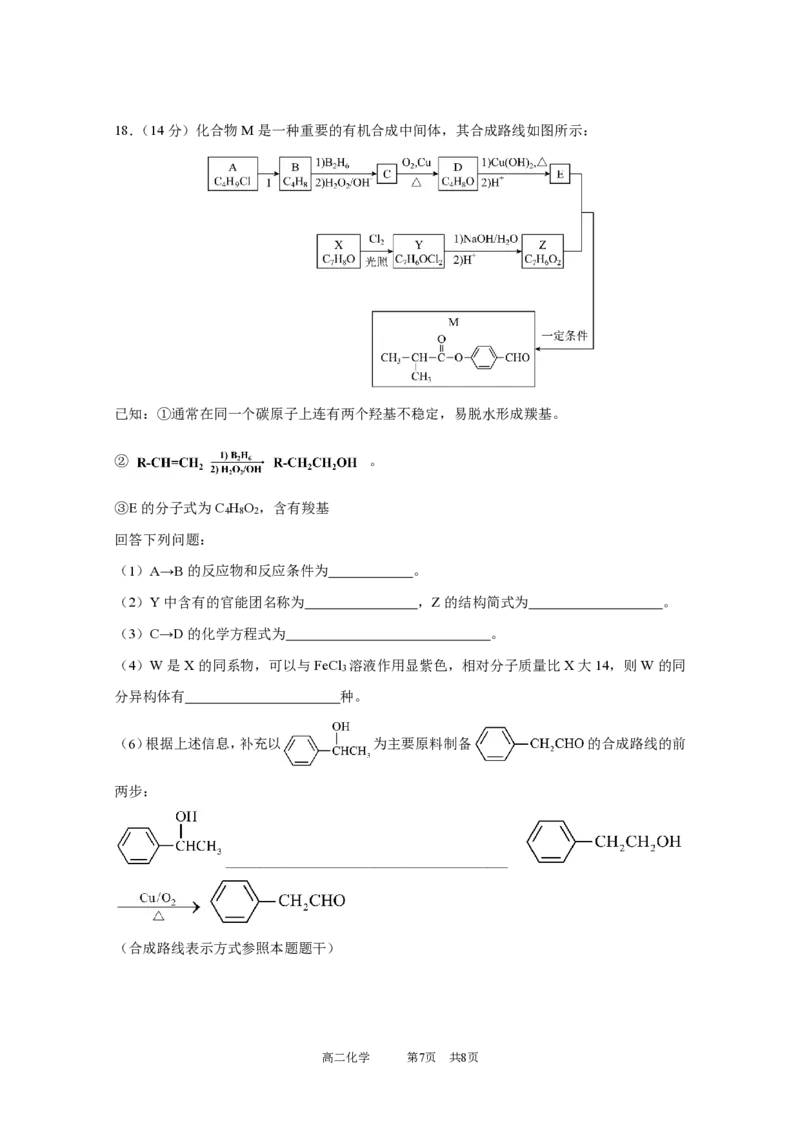
高二化学 第6页 共8页18.(14分)化合物M是一种重要的有机合成中间体,其合成路线如图所示:
已知:①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
② 。
③E的分子式为C H O ,含有羧基
4 8 2
回答下列问题:
(1)A→B的反应物和反应条件为 。
(2)Y中含有的官能团名称为 ,Z的结构简式为 。
(3)C→D的化学方程式为 。
(4)W是X的同系物,可以与FeCl 溶液作用显紫色,相对分子质量比X大14,则W的同
3
分异构体有 种。
(6)根据上述信息,补充以 为主要原料制备 的合成路线的前
两步:
________________________________________
(合成路线表示方式参照本题题干)
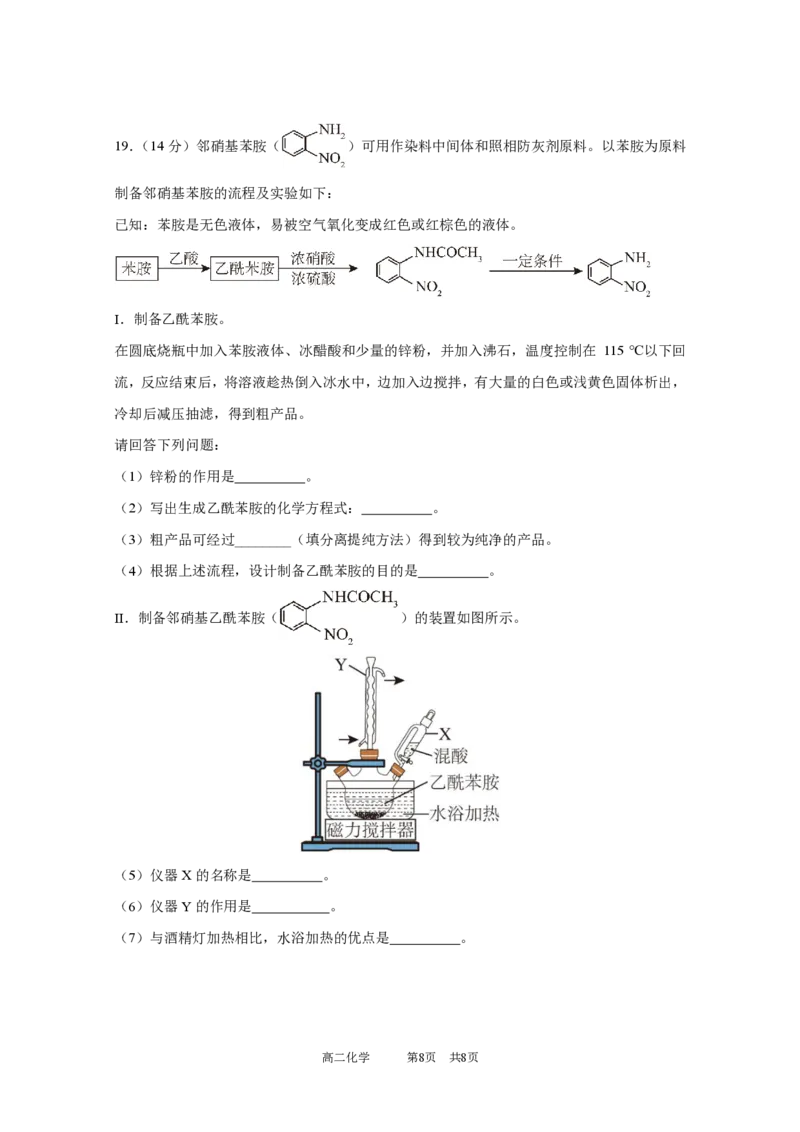
高二化学 第7页 共8页19.(14分)邻硝基苯胺( )可用作染料中间体和照相防灰剂原料。以苯胺为原料
制备邻硝基苯胺的流程及实验如下:
已知:苯胺是无色液体,易被空气氧化变成红色或红棕色的液体。
Ⅰ.制备乙酰苯胺。
在圆底烧瓶中加入苯胺液体、冰醋酸和少量的锌粉,并加入沸石,温度控制在 115 ℃以下回
流,反应结束后,将溶液趁热倒入冰水中,边加入边搅拌,有大量的白色或浅黄色固体析出,
冷却后减压抽滤,得到粗产品。
请回答下列问题:
(1)锌粉的作用是 。
(2)写出生成乙酰苯胺的化学方程式: 。
(3)粗产品可经过________(填分离提纯方法)得到较为纯净的产品。
(4)根据上述流程,设计制备乙酰苯胺的目的是 。
Ⅱ.制备邻硝基乙酰苯胺( )的装置如图所示。
(5)仪器X的名称是 。
(6)仪器Y的作用是 。
(7)与酒精灯加热相比,水浴加热的优点是 。
高二化学 第8页 共8页