文档内容
2025 年华师元一赤壁学校高二年级 9 月月考
化学试卷
考试时间: 202 5 年 9 月 2 6 日 9:00-11:3 0 时长: 7 5 分钟 试卷满分: 10 0 分
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码粘贴在
答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在
试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿
纸和答题卡上的非答题区域均无效。
4.考试结束后,请将答题卡上交。
可能用到的相对原子质量:Na:23 H:1 0:16 N:14 S:32 C:12
一、单选题(每小题3分,共计45分)
1.碳化硅( )被广泛用于制造高温高压半导体。气相反应法制备 发生的反应为:
。已知 晶体中具有与金刚石类似的空间结
构, 与C交替相连。根据以下键能数据, 的值为
键
键能( ) 328 360 436 431 347
A.-340 B.+340 C.+354 D.-354
2.“能源”是人们生活中不可或缺的一部分。下列属于将化学能转化为热能的是
B.自热火锅发热
A.太阳能热水器烧水 C.风力发电机 D.新能源汽车电池
包
A.A B.B C.C D.D
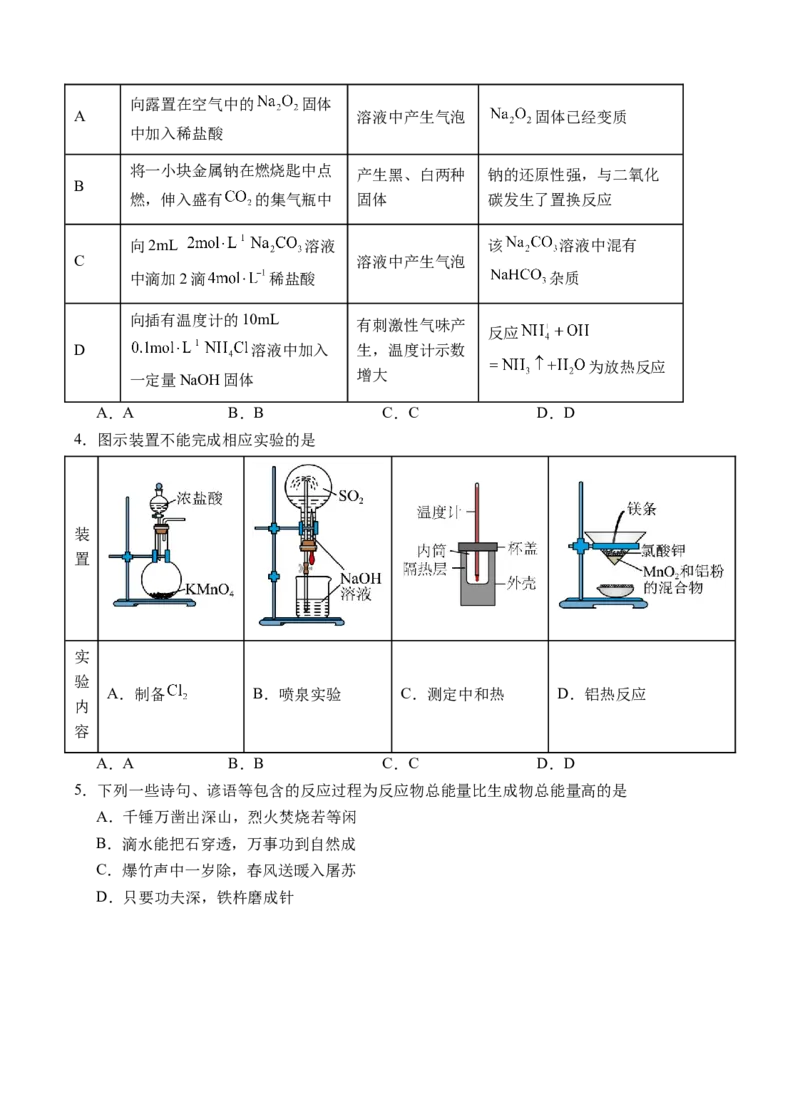
3.探究钠及其化合物的性质,下列方案设计、现象及结论都正确的是
选项 方案设计 现象 结论向露置在空气中的 固体
A 溶液中产生气泡 固体已经变质
中加入稀盐酸
将一小块金属钠在燃烧匙中点 产生黑、白两种 钠的还原性强,与二氧化
B
燃,伸入盛有 的集气瓶中 固体 碳发生了置换反应
向2mL 溶液 该 溶液中混有
C 溶液中产生气泡
中滴加2滴 稀盐酸 杂质
向插有温度计的10mL
有刺激性气味产
反应
D 溶液中加入 生,温度计示数
为放热反应
增大
一定量NaOH固体
A.A B.B C.C D.D
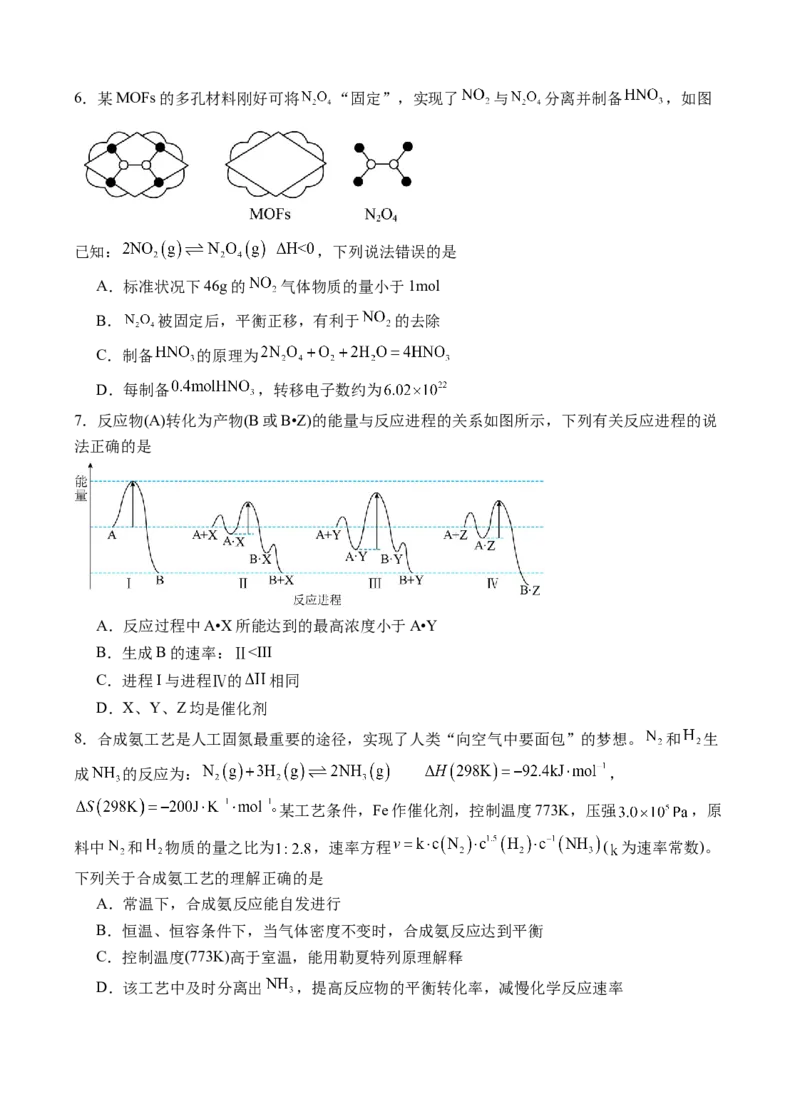
4.图示装置不能完成相应实验的是
装
置
实
验
A.制备 B.喷泉实验 C.测定中和热 D.铝热反应
内
容
A.A B.B C.C D.D
5.下列一些诗句、谚语等包含的反应过程为反应物总能量比生成物总能量高的是
A.千锤万凿出深山,烈火焚烧若等闲
B.滴水能把石穿透,万事功到自然成
C.爆竹声中一岁除,春风送暖入屠苏
D.只要功夫深,铁杵磨成针6.某MOFs的多孔材料刚好可将 “固定”,实现了 与 分离并制备 ,如图
已知: ,下列说法错误的是
A.标准状况下46g的 气体物质的量小于1mol
B. 被固定后,平衡正移,有利于 的去除
C.制备 的原理为
D.每制备 ,转移电子数约为
7.反应物(A)转化为产物(B或B•Z)的能量与反应进程的关系如图所示,下列有关反应进程的说
法正确的是
A.反应过程中A•X所能达到的最高浓度小于A•Y
B.生成B的速率:Ⅱ<Ⅲ
C.进程I与进程Ⅳ的 相同
D.X、Y、Z均是催化剂
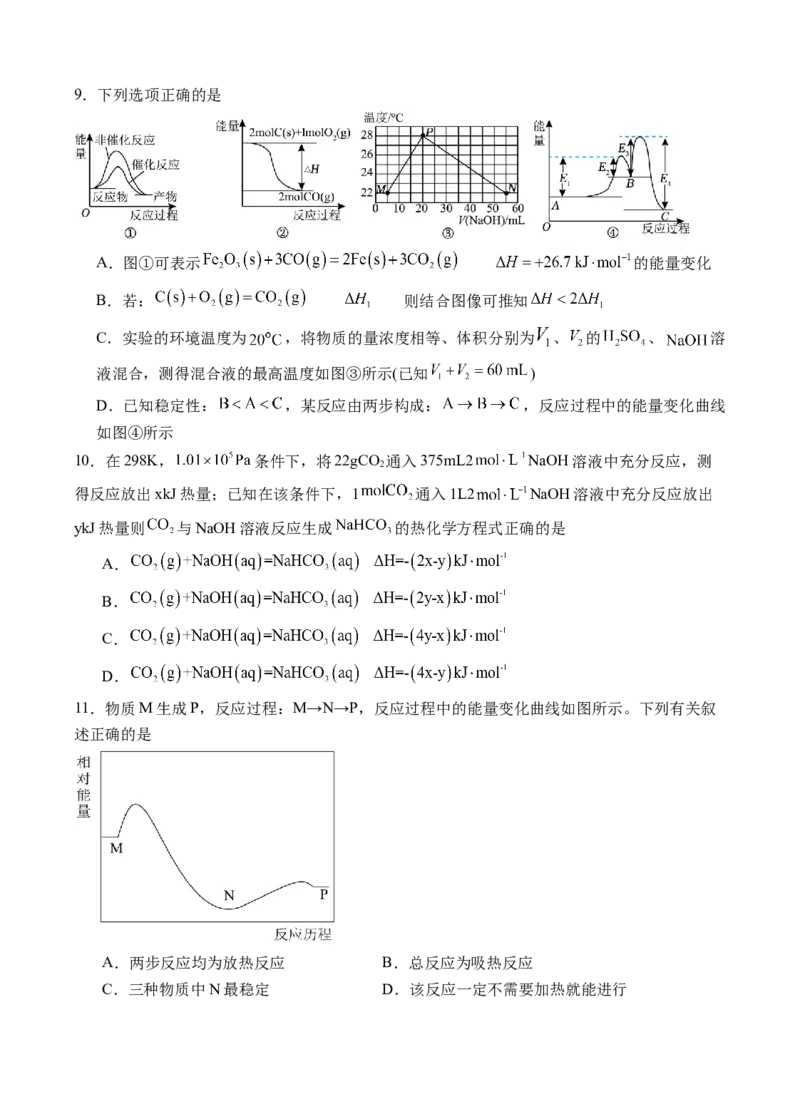
8.合成氨工艺是人工固氮最重要的途径,实现了人类“向空气中要面包”的梦想。 和 生
成 的反应为: ,
某工艺条件,Fe作催化剂,控制温度773K,压强 ,原
料中 和 物质的量之比为 ,速率方程 ( 为速率常数)。
下列关于合成氨工艺的理解正确的是
A.常温下,合成氨反应能自发进行
B.恒温、恒容条件下,当气体密度不变时,合成氨反应达到平衡
C.控制温度(773K)高于室温,能用勒夏特列原理解释
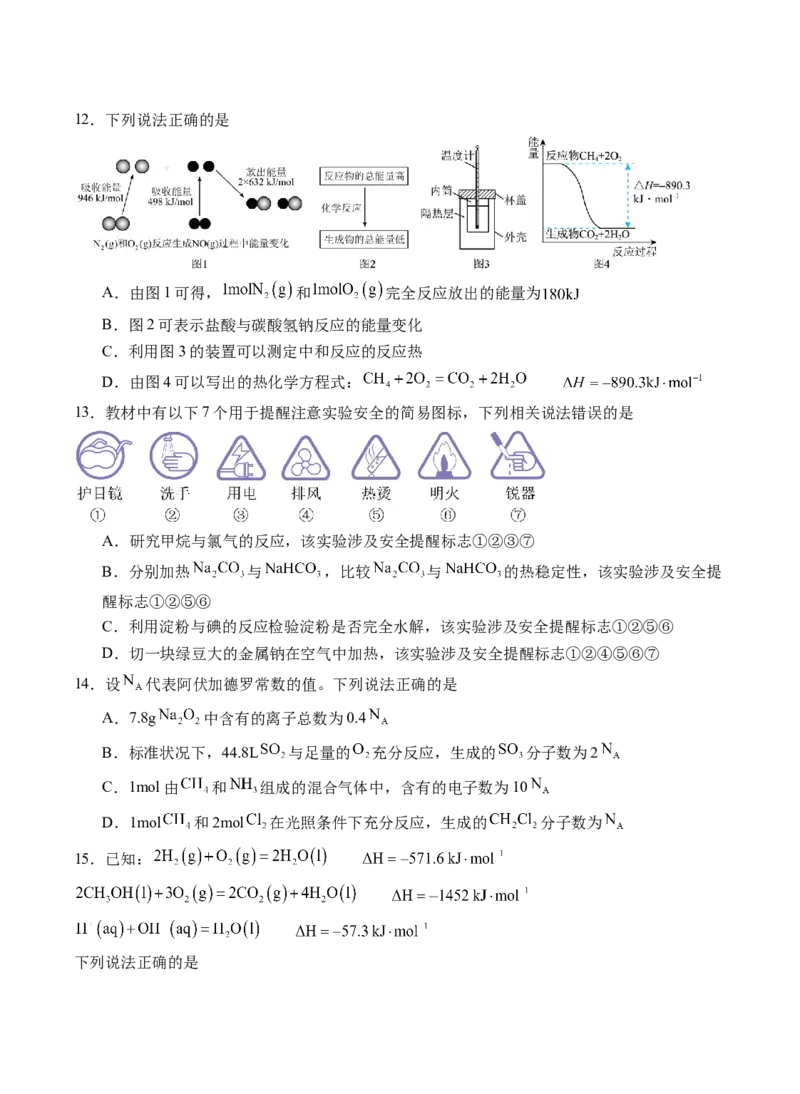
D.该工艺中及时分离出 ,提高反应物的平衡转化率,减慢化学反应速率9.下列选项正确的是
A.图①可表示 的能量变化
B.若: 则结合图像可推知
C.实验的环境温度为 ,将物质的量浓度相等、体积分别为 、 的 、 溶
液混合,测得混合液的最高温度如图③所示(已知 )
D.已知稳定性: ,某反应由两步构成: ,反应过程中的能量变化曲线
如图④所示
10.在298K, 条件下,将22gCO 通入375mL2 NaOH溶液中充分反应,测
2
得反应放出xkJ热量;已知在该条件下,1 通入1L2 NaOH溶液中充分反应放出
ykJ热量则 与NaOH溶液反应生成 的热化学方程式正确的是
A.
B.
C.
D.
11.物质M生成P,反应过程:M→N→P,反应过程中的能量变化曲线如图所示。下列有关叙
述正确的是
A.两步反应均为放热反应 B.总反应为吸热反应
C.三种物质中N最稳定 D.该反应一定不需要加热就能进行12.下列说法正确的是
A.由图1可得, 和 完全反应放出的能量为
B.图2可表示盐酸与碳酸氢钠反应的能量变化
C.利用图3的装置可以测定中和反应的反应热
D.由图4可以写出的热化学方程式:
13.教材中有以下7个用于提醒注意实验安全的简易图标,下列相关说法错误的是
A.研究甲烷与氯气的反应,该实验涉及安全提醒标志①②③⑦
B.分别加热 与 ,比较 与 的热稳定性,该实验涉及安全提
醒标志①②⑤⑥
C.利用淀粉与碘的反应检验淀粉是否完全水解,该实验涉及安全提醒标志①②⑤⑥
D.切一块绿豆大的金属钠在空气中加热,该实验涉及安全提醒标志①②④⑤⑥⑦
14.设 代表阿伏加德罗常数的值。下列说法正确的是
A.7.8g 中含有的离子总数为0.4
B.标准状况下,44.8L 与足量的 充分反应,生成的 分子数为2
C.1mol由 和 组成的混合气体中,含有的电子数为10
D.1mol 和2mol 在光照条件下充分反应,生成的 分子数为
15.已知:
下列说法正确的是A. 的燃烧热为
B.同质量的 和 完全燃烧, 燃烧放出的热量多
C.
D.
二、填空题(共计55分)
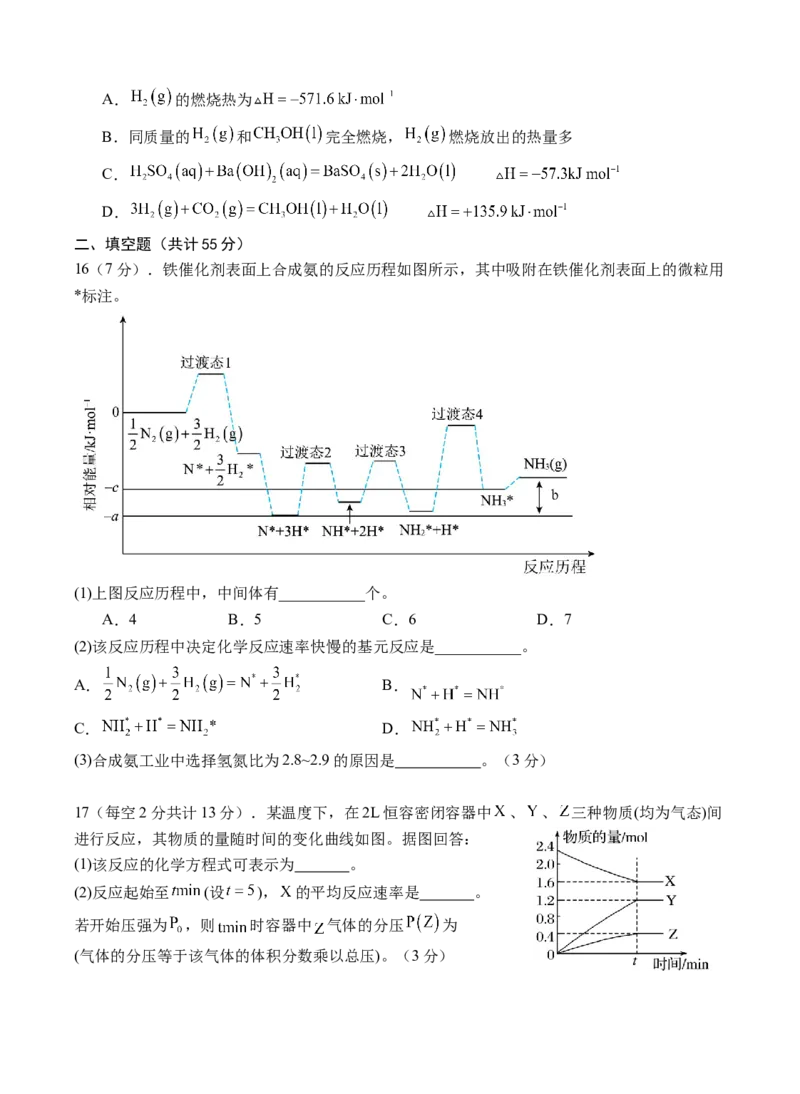
16(7分).铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的微粒用
*标注。
(1)上图反应历程中,中间体有___________个。
A.4 B.5 C.6 D.7
(2)该反应历程中决定化学反应速率快慢的基元反应是___________。
A. B.
C. D.
(3)合成氨工业中选择氢氮比为2.8~2.9的原因是 。(3分)
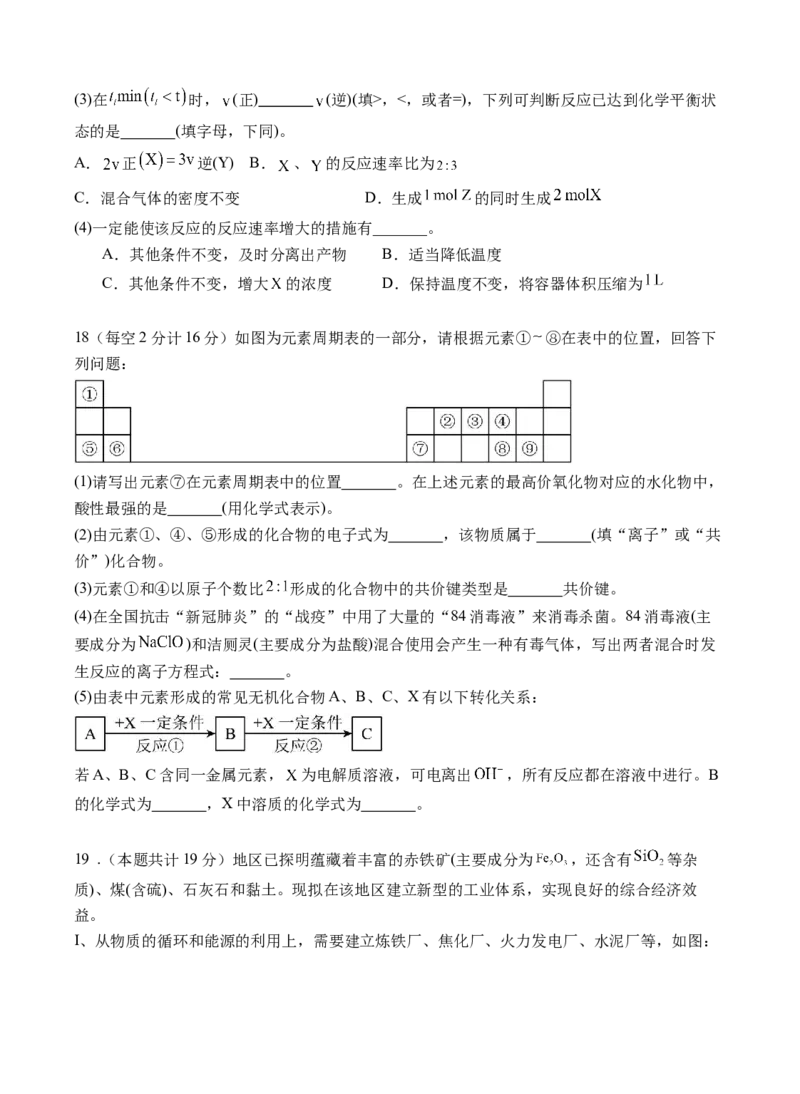
17(每空2分共计13分).某温度下,在2L恒容密闭容器中 、 、 三种物质(均为气态)间
进行反应,其物质的量随时间的变化曲线如图。据图回答:
(1)该反应的化学方程式可表示为 。
(2)反应起始至 (设 ), 的平均反应速率是 。
若开始压强为 ,则 时容器中 气体的分压 为
(气体的分压等于该气体的体积分数乘以总压)。(3分)(3)在 时, (正) (逆)(填>,<,或者=),下列可判断反应已达到化学平衡状
态的是 (填字母,下同)。
A. 正 逆(Y) B. 、 的反应速率比为
C.混合气体的密度不变 D.生成 的同时生成
(4)一定能使该反应的反应速率增大的措施有_______。
A.其他条件不变,及时分离出产物 B.适当降低温度
C.其他条件不变,增大 的浓度 D.保持温度不变,将容器体积压缩为
18(每空2分计16分)如图为元素周期表的一部分,请根据元素① ⑧在表中的位置,回答下
列问题:
(1)请写出元素⑦在元素周期表中的位置 。在上述元素的最高价氧化物对应的水化物中,
酸性最强的是 (用化学式表示)。
(2)由元素①、④、⑤形成的化合物的电子式为 ,该物质属于 (填“离子”或“共
价”)化合物。
(3)元素①和④以原子个数比 形成的化合物中的共价键类型是 共价键。
(4)在全国抗击“新冠肺炎”的“战疫”中用了大量的“84消毒液”来消毒杀菌。84消毒液(主
要成分为 )和洁厕灵(主要成分为盐酸)混合使用会产生一种有毒气体,写出两者混合时发
生反应的离子方程式: 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
若A、B、C含同一金属元素, 为电解质溶液,可电离出 ,所有反应都在溶液中进行。B
的化学式为 ,X中溶质的化学式为 。
19 .(本题共计19分)地区已探明蕴藏着丰富的赤铁矿(主要成分为 ,还含有 等杂
质)、煤(含硫)、石灰石和黏土。现拟在该地区建立新型的工业体系,实现良好的综合经济效
益。
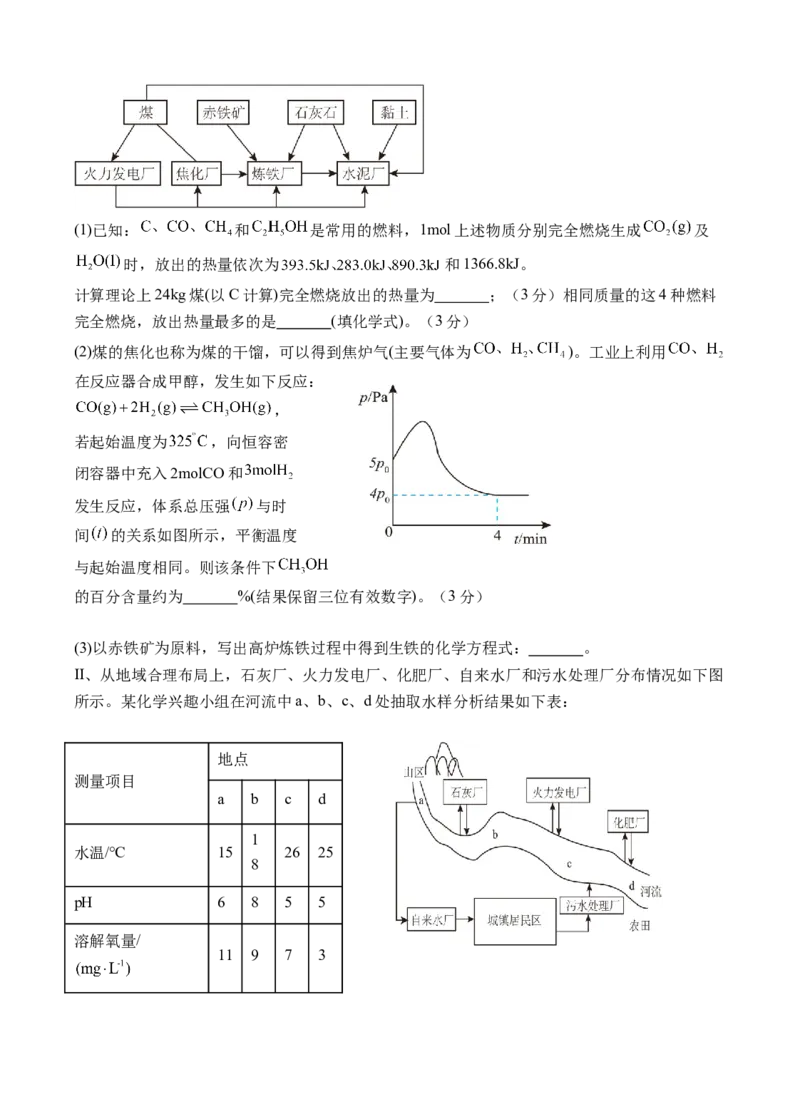
I、从物质的循环和能源的利用上,需要建立炼铁厂、焦化厂、火力发电厂、水泥厂等,如图:(1)已知: 和 是常用的燃料,1mol上述物质分别完全燃烧生成 及
时,放出的热量依次为 和1366.8kJ。
计算理论上24kg煤(以C计算)完全燃烧放出的热量为 ;(3分)相同质量的这4种燃料
完全燃烧,放出热量最多的是 (填化学式)。(3分)
(2)煤的焦化也称为煤的干馏,可以得到焦炉气(主要气体为 )。工业上利用
在反应器合成甲醇,发生如下反应:
,
若起始温度为 ,向恒容密
闭容器中充入2molCO和
发生反应,体系总压强 与时
间 的关系如图所示,平衡温度
与起始温度相同。则该条件下
的百分含量约为 %(结果保留三位有效数字)。(3分)
(3)以赤铁矿为原料,写出高炉炼铁过程中得到生铁的化学方程式: 。
II、从地域合理布局上,石灰厂、火力发电厂、化肥厂、自来水厂和污水处理厂分布情况如下图
所示。某化学兴趣小组在河流中a、b、c、d处抽取水样分析结果如下表:
地点
测量项目
a b c d
1
水温/℃ 15 26 25
8
pH 6 8 5 5
溶解氧量/
11 9 7 3(4)导致b处水样pH变大的原因可能为 ,从环境友好角度出发,可以将石灰厂排放的废
水与火力发电厂排放的废水集中处理再排放,试写出化学方程式: 。
(5)d处水中溶解氧量最少,导致鱼类大量减少,试分析产生这种现象的原因可能为 。
(6)综合上述,要实现人与自然和谐共生,必须践行 发展理念,保护生态环境。