文档内容
惠来一中 2024-2025 学年度第一学期第一次阶段考
高二化学试题卷
第I卷(选择题 共44分)
可能用到的相对原子质量:Fe 56
一、选择题(共16小题,1-10每小题2分,11-16每小题4分,共44分,在每小题给出的
四个选项中,只有一项是符合题目要求。)
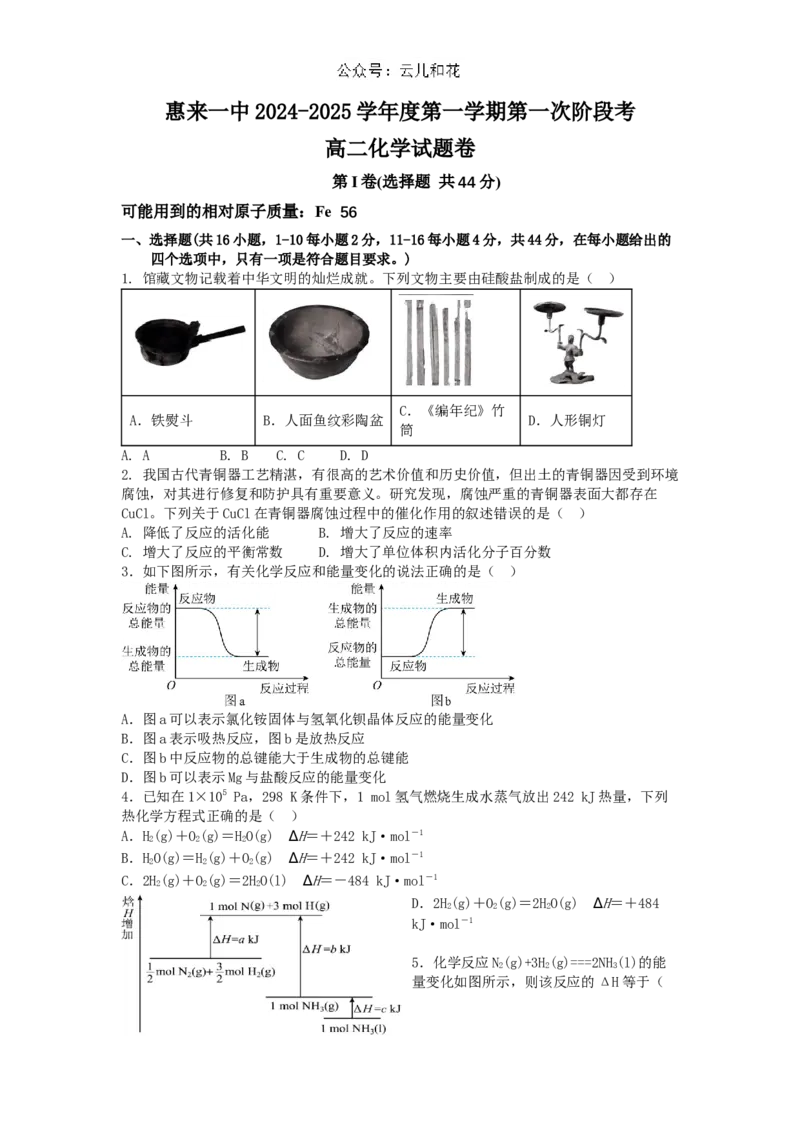
1. 馆藏文物记载着中华文明的灿烂成就。下列文物主要由硅酸盐制成的是( )
C.《编年纪》竹
A.铁熨斗 B.人面鱼纹彩陶盆 D.人形铜灯
筒
A. A B. B C. C D. D
2. 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境
腐蚀,对其进行修复和防护具有重要意义。研究发现,腐蚀严重的青铜器表面大都存在
CuCl。下列关于CuCl在青铜器腐蚀过程中的催化作用的叙述错误的是( )
A. 降低了反应的活化能 B. 增大了反应的速率
C. 增大了反应的平衡常数 D. 增大了单位体积内活化分子百分数
3.如下图所示,有关化学反应和能量变化的说法正确的是( )
A.图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
B.图a表示吸热反应,图b是放热反应
C.图b中反应物的总键能大于生成物的总键能
D.图b可以表示Mg与盐酸反应的能量变化
4.已知在1×105 Pa,298 K条件下,1 mol氢气燃烧生成水蒸气放出242 kJ热量,下列
热化学方程式正确的是( )
A.H(g)+O(g)=HO(g) ∆H=+242 kJ·mol-1
2 2 2
B.HO(g)=H(g)+O(g) ∆H=+242 kJ·mol-1
2 2 2
C.2H(g)+O(g)=2HO(l) ∆H=-484 kJ·mol-1
2 2 2
D.2H(g)+O(g)=2HO(g) ∆H=+484
2 2 2
kJ·mol-1
5.化学反应N(g)+3H(g)===2NH(l)的能
2 2 3
量变化如图所示,则该反应的ΔH等于(
)A.+2(a-b-c) kJ·mol-1
B.+2(b-a) kJ·mol-1
C.+2(b+c-a) kJ·mol-1
D.(a-b-c) kJ·mol-1
6. 设 N 为阿伏加德罗常数的值。下列说法正确的是( )
A
A. 标况下,44.8L甲烷中含有的共用电子对数为8N
A
B. 2L 0.5mol/L乙醇溶液中含有的氧原子数为N
A
C. 5.6g铁粉在0.1molCl 中燃烧,转移电子书为0.3N
2 A
D. 1molNH+所含的质子数为10N
4 A
7.把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H 的速率v与时间t的关系
2
如下图所示,其中影响AB段速率的主要因素是( )
A.H+的浓度
B.反应时溶液的温度
C.体系的压强
D.Cl-的浓度
8.在高温或放电条件下,反应N(g)+O(g)=2NO(g)在密闭容器中进行,下列措施不改变
2 2
化学反应速率的是( )
A.压强增大(通过缩小体积) B.恒压,充入Ne
C.恒容,充入Ar D.恒容,充入N
2
9.在 反应中,表示反应速率最快的是( )
A. mol⋅L-1⋅min-1 B. mol⋅L-1⋅min-1
C. mol⋅L-1⋅s-1 D. mol⋅L-1⋅min-1
10.已知反应:①2H(g)+O(g)=2HO(g) ΔH,
2 2 2 1
②N(g)+2O(g)=2NO(g) ΔH,
2 2 2 2
③N(g)+3H(g)=2NH(g) ΔH,
2 2 3 3
则反应4NH(g)+7O(g)= 4NO(g)+6HO(g)的ΔH为( )
3 2 2 2
A.2△H+2△H-2△H
1 2 3
B.△H+△H-△H
1 2 3
C.3△H+2△H-2△H
1 2 3
D.3△H+2△H+2△H
1 2 3
11.下列实验方案能达到相应目的的是( )
选项 实验方案 目的
常温下,将等质量、等直径的铝粒分别加入 和 比较浓度对化学
A 反应速率的影响
溶液中反应常温下,向某密闭容器中充入 气体,一段时间后压缩容 探究压强对化学
B
平衡的影响
器体积为原来的一半,观察气体颜色变化
向两份等浓度等体积的 溶液中分别加入2滴等浓度的 探究 和
C
的催化能力强弱
和 溶液,观察产生气泡的速率
判断该反应是可
向 溶液中滴加 溶液5~6
D 逆反应
滴,充分反应,测得溶液中除含有 外,还含有
A.A B.B C.C D.D
12. 原电池的应用促进了人类社会的发展,某小组设计的利用化学
电池使LED灯发光的装置如图所示,下列叙述不正确的是( )
A. 锌片为负极
B. 铜片上有气泡产生
C. 电流从锌片经导线流向铜片
D. 装置中存在“化学能→电能→光能”的转化
13.把下列四种NaSO 溶液分别加入四只均盛有20 mL 3 mol·L-1
2 2 3
稀硫酸的烧杯中(稀硫酸的初始温度相同),然后均加入蒸馏水稀释到60 mL,溶液中最先
出现浑浊的是( )
A.20℃,10 mL,5 mol·L-1的NaSO 溶液
2 2 3
B.20℃,20 mL,3 mol·L-1的NaSO 溶液
2 2 3
C.30℃,10 mL,4 mol·L-1的NaSO 溶液
2 2 3
D.30℃,30 mL,2 mol·L-1的NaSO 溶液
2 2 3
14.氢气可通过下列反应制得:CO(g)+HO(g) CO(g)+H(g) H<0,为了提高CO
2 2 2
的平衡转化率,可采取的措施是( )
A.增大压强 B.增大CO的浓度 C.更换催化剂 D.降低温度
15.在恒温恒容的密闭容器中发生
,T℃时,该反应的化学平衡常数为K,下列说法正确的是( )
A. 其他条件相同,升高温度降低正反应速率、提高逆反应速率
B. T℃时,若 时,则
C. 若容器内气体压强保持不变,该可逆反应达到化学平衡状态
D. 一定条件下, 能完全转化为
16.在恒温、恒容的容器中进行反应2HI H+I(正反应为吸热反应),反应物的浓度由
⇌ 2 2
0.1mol·L-1降到0.06mol·L-1需要20s,那么由0.06mol·L-1降到0.036mol·L-1所需时间
为( )
A. 等于10s B. 等于12s C. 大于12s D. 小于12s
第II卷(非选择题 共56分)
二、填空题(共4题,每题14分,共56分)
17(14分)在日常生活和工农业生产中经常涉及到吸热反应和放热反应,回答下面问题:
(1)下列反应一定属于吸热反应的是___________。
A.酸碱中和反应 B.燃烧反应 C.铝热反应 D.C(s)+CO(g)=2CO(g)
2
(2)在101kPa时,H 在1.0 mol O 中完全燃烧,生成2.0 mol液态水,放出571.6 k的
2 2
热量,表示氢气燃烧的热化学方程式为_______________________________________,
氢气的燃烧热为___________。(3)我国科学家利用计算机模拟了甲醇(CHOH)与水在铜基催化剂上的反应机理和能量图
3
如图:
①反应I的∆H________0(填“<”“>”或“=”),反应Ⅱ的活化能是______kJ·mol-
1。
②在相同条件下反应I的反应速率________(填“<”“>”或“=”)反应Ⅱ的反应速率。
③写出反应Ⅱ的热化学方程式_______________________________________________。
(4)取30 mL0.5 mol·L-1 HSO 溶液与50 mL 0.5 mol·L-1 NaOH溶液于小烧杯中,用如
2 4
图所示:装置进行中和反应反应热的测定实验。
①仪器a的名称是___________________________。
②若实验中测得中和热数值总是偏小,可能的原因是
____________________________ _(答出一条即可)。
18.(14分)碘及其化合物在生产生活中有重要作用。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为2∶1的氢气和碘蒸气放入恒
容密闭容器中进行反应:H(g)+I(g) 2HI(g),反应经过5分钟后达平衡,测得碘化
2 2
氢的浓度为0.1 mol·L-1,碘蒸气的浓度为0.05 mol·L-1。
①前5分钟平均反应速率υ(H)=_______________________,
2
H 的初始浓度是___________mol·L-1。
2
②反应分别进行至3 min和7 min时假设容器内气体的密度分别用ρ和ρ表示,则
1 7
其大小为关系为ρ___________ρ(填“>”、“<”或“=”)。
1 7
③下列能说明反应已达平衡状态的是___________(填序号)。
a.混合体系总压强保持不变
b.单位时间内断裂的H—H键数目与断裂的H—I键数目相等
c.c(H)∶c(I)∶c(HI)=1∶1∶2
2 2
d.2υ(I) =υ(HI)
2 正 逆
e.反应混合体系的颜色不再发生变化
(2)某小组同学在室温下进行“碘钟实验”:将浓度均为0.01 mol·L-1的HO、HSO、
2 2 2 4
、NaSO 溶液及淀粉混合,一定时间后溶液变为蓝色。
2 2 3
已知:“碘钟实验”的总反应的离子方程式为HO+2SO2-+2H+=SO2—+2HO
2 2 2 3 4 6 2
反应分两步进行:
反应A:……
反应B:I+2SO2-=2I-+SO2—
2 2 3 4 6
①反应A的离子方程式是__________________________。
对于总反应,I-的作用是______。
②为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、Ⅱ(溶液浓度均为0.01 mol·L-1)
溶液(含淀
用量试剂 HO 溶液 HSO 溶液 NaSO 溶液 HO
2 2 2 4 2 2 3 2
粉)
实验Ⅰ 5 4 8 3 0实验Ⅱ 5 2 x y z
溶液从混合时的无色变为蓝色的时间:实验Ⅰ是30 min、实验Ⅱ是40 min。实验Ⅱ中,
x、y、z所对应的数值是 ;对比实验Ⅰ、Ⅱ可得出的实
验结论是______________________________________________。
19. (14分)铁黄 (FeOOH) 难溶于水,可作颜料,也是制备饮水处理剂高铁酸钾的原料。
以烧渣(主要成分为FeO 、CuO 、SiO 等)为原料出产铁黄的流程如图。
3 4 2
(1)FeOOH 中 Fe的化合价为 ___________,“酸浸”时,使用的酸为 ___________ 。
(2)“滤渣1”成分为___________ (填化学式)。
(3)“还原””涉及的离子方程式有___________、 ___________。
(4)FeSO·7HO 的溶解度曲线如图,从滤液2中获得晶体的另一种方法是 ___________
4 2
、冷却结晶。
(5)“氧化”中Fe2+参与反应的离子方程式为___________。
(6)氢能是一种极具发展潜力的清洁能源。H 可用CO在高温下
2
与水蒸气反应制得,是目前大规模制取氢气的方法之一。
已知:在25℃、101kPa下,
①HO(g)=H(g)+O(g) ∆H=+241.8 kJ·mol-1
2 2 2 1
②C(s)+O(g)=CO(g) ∆H=-110.5 kJ·mol-1
2 2
③C(s)+O(g)=CO (g) ∆H=-393.5 kJ·mol-1
2 2 3
25℃、101kPa下,CO与水蒸气反应转化为H 和CO 的热化学方程式为
2 2
__________________________________________________________________。
20. (14分) 氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N(g)+3H(g) 2NH(g) △H=-92.4kJ•mol-1。
2 2 3
(1)在密闭容器中,投入1molN 和3molH 在催化剂作用下发生反应,测得反应放出的
2 2
热量_______92.4kJ(填“小于”、“大于”或“等于”)。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_______(填“变
大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______移动(填“正向”、“逆
向”或“不移动”)。
(4)已知: 。现将2mol 放入1L恒容密闭容器中,
平衡体系中 的体积分数( )随温度的变化如图所示。①d点v(正)_______v(逆)(填“>”“=”“<”)。
②a、b、c三点中平衡常数 、 、 由小到大是_______。
③在 时, 的平衡转化率为______;平衡常数值为_____(小数点后保留2位数字)