文档内容
高三一轮中期调研考试
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷
上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Co
59 Cu 64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.化学与生活密切相关。下列叙述正确的是( )
A.向煮开的豆浆中加入卤水,可使蛋白质变性,加速凝聚
B.食品包装袋中放入铁粉,可以吸收空气中的水分,防止食品变质
C.对燃煤进行脱硫脱氮,可减少酸雨的形成,改善人们的生活环境
D.5G技术中使用的光导纤维的主要成分 为非极性分子
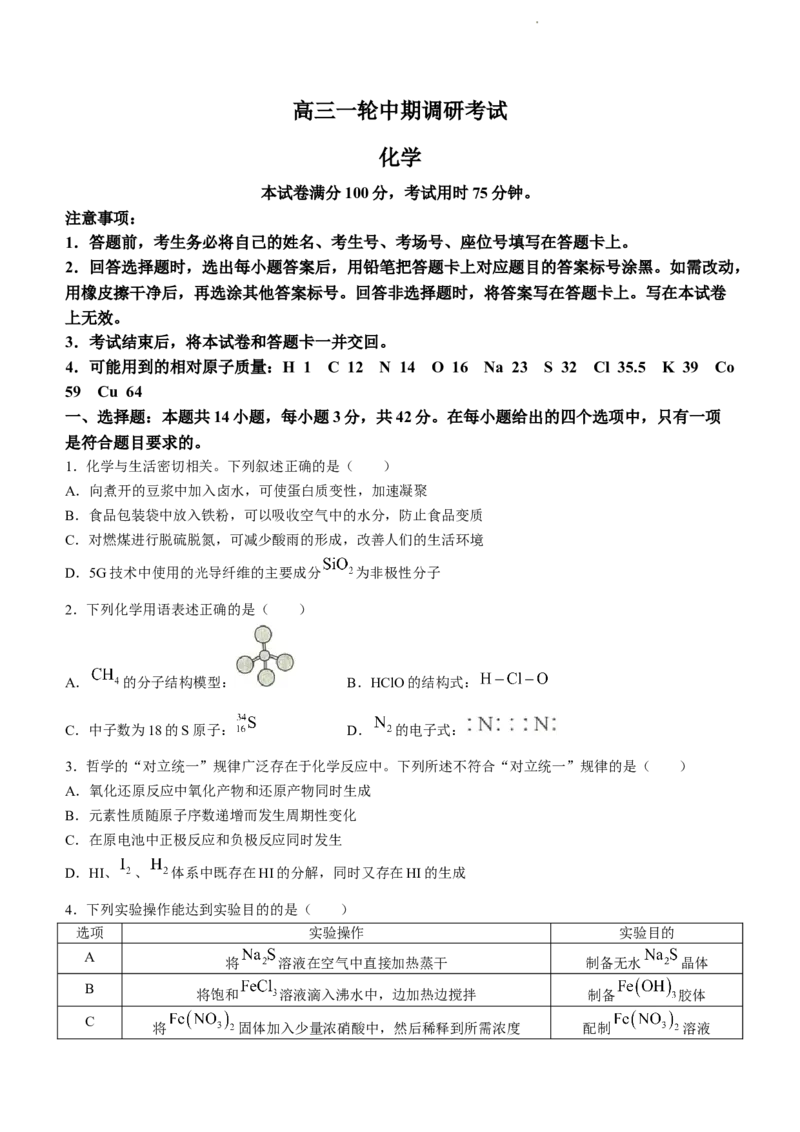
2.下列化学用语表述正确的是( )
A. 的分子结构模型: B.HClO的结构式:
C.中子数为18的S原子: D. 的电子式:
3.哲学的“对立统一”规律广泛存在于化学反应中。下列所述不符合“对立统一”规律的是( )
A.氧化还原反应中氧化产物和还原产物同时生成
B.元素性质随原子序数递增而发生周期性变化
C.在原电池中正极反应和负极反应同时发生
D.HI、 、 体系中既存在HI的分解,同时又存在HI的生成
4.下列实验操作能达到实验目的的是( )
选项 实验操作 实验目的
A
将 溶液在空气中直接加热蒸干 制备无水 晶体
B
将饱和 溶液滴入沸水中,边加热边搅拌 制备 胶体
C
将 固体加入少量浓硝酸中,然后稀释到所需浓度 配制 溶液
学科网(北京)股份有限公司D 将浓氨水滴入盛有氧化钙固体的锥形瓶中 制备氨气
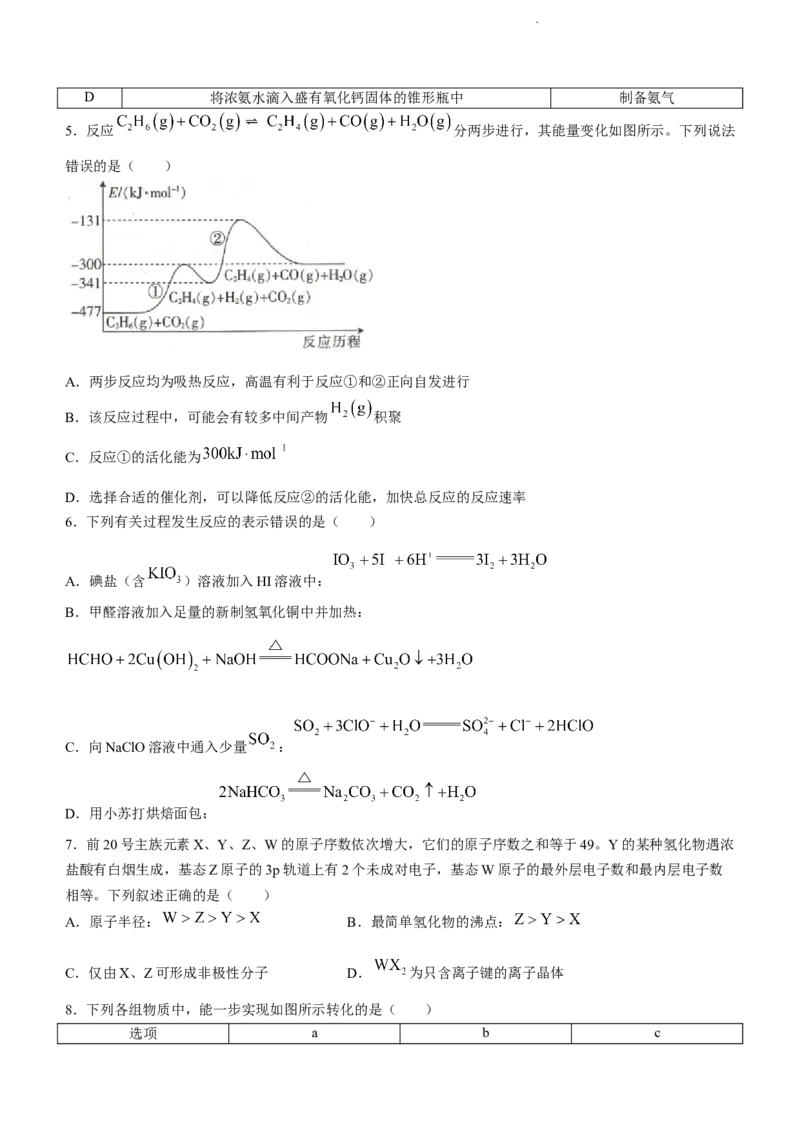
5.反应 分两步进行,其能量变化如图所示。下列说法
错误的是( )
A.两步反应均为吸热反应,高温有利于反应①和②正向自发进行
B.该反应过程中,可能会有较多中间产物 积聚
C.反应①的活化能为
D.选择合适的催化剂,可以降低反应②的活化能,加快总反应的反应速率
6.下列有关过程发生反应的表示错误的是( )
A.碘盐(含 )溶液加入HI溶液中:
B.甲醛溶液加入足量的新制氢氧化铜中并加热:
C.向NaClO溶液中通入少量 :
D.用小苏打烘焙面包:
7.前20号主族元素X、Y、Z、W的原子序数依次增大,它们的原子序数之和等于49。Y的某种氢化物遇浓
盐酸有白烟生成,基态Z原子的3p轨道上有2个未成对电子,基态W原子的最外层电子数和最内层电子数
相等。下列叙述正确的是( )
A.原子半径: B.最简单氢化物的沸点:
C.仅由X、Z可形成非极性分子 D. 为只含离子键的离子晶体
8.下列各组物质中,能一步实现如图所示转化的是( )
选项 a b c
学科网(北京)股份有限公司A Fe
B NO
C NaOH
D Al
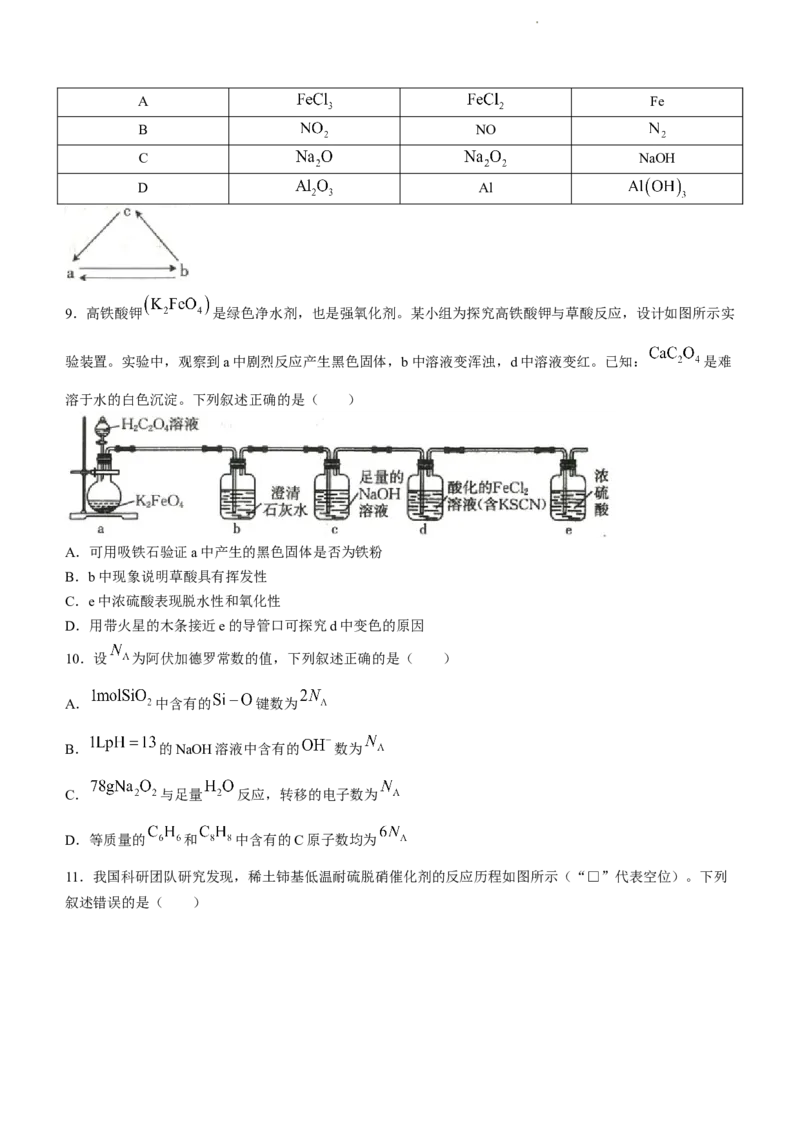
9.高铁酸钾 是绿色净水剂,也是强氧化剂。某小组为探究高铁酸钾与草酸反应,设计如图所示实
验装置。实验中,观察到a中剧烈反应产生黑色固体,b中溶液变浑浊,d中溶液变红。已知: 是难
溶于水的白色沉淀。下列叙述正确的是( )
A.可用吸铁石验证a中产生的黑色固体是否为铁粉
B.b中现象说明草酸具有挥发性
C.e中浓硫酸表现脱水性和氧化性
D.用带火星的木条接近e的导管口可探究d中变色的原因
10.设 为阿伏加德罗常数的值,下列叙述正确的是( )
A. 中含有的 键数为
B. 的NaOH溶液中含有的 数为
C. 与足量 反应,转移的电子数为
D.等质量的 和 中含有的C原子数均为
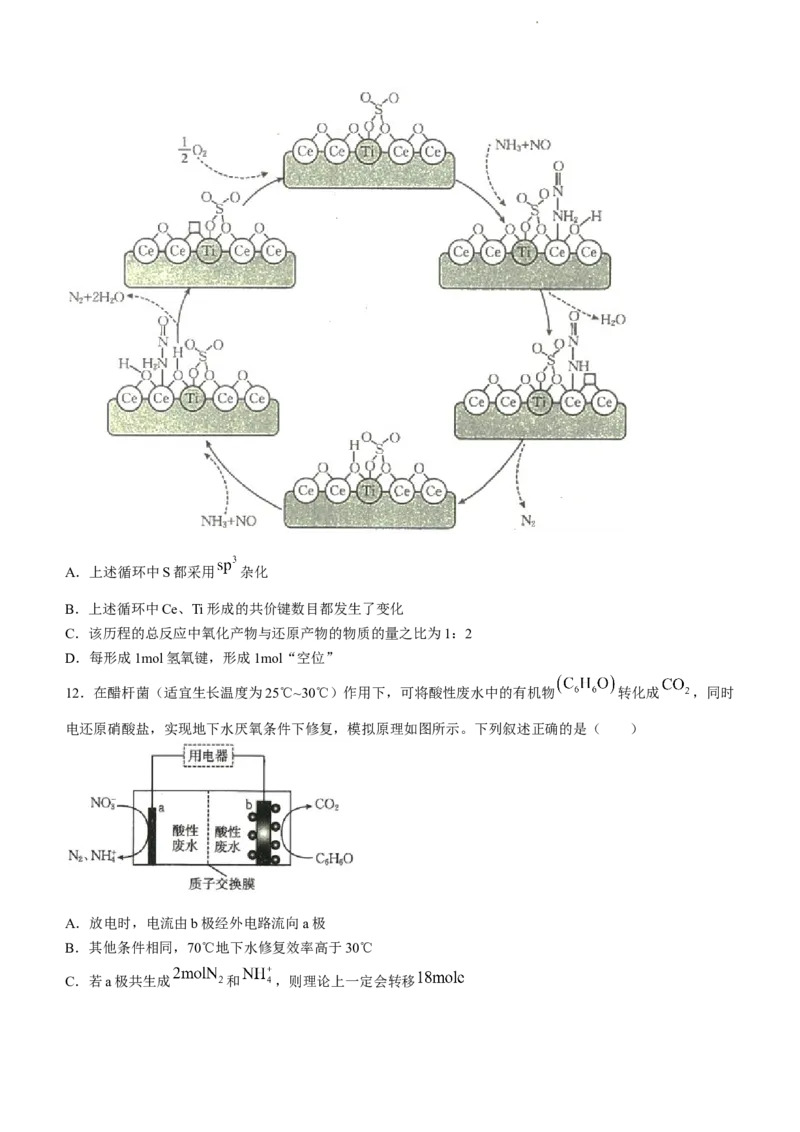
11.我国科研团队研究发现,稀土铈基低温耐硫脱硝催化剂的反应历程如图所示(“□”代表空位)。下列
叙述错误的是( )
学科网(北京)股份有限公司A.上述循环中S都采用 杂化
B.上述循环中Ce、Ti形成的共价键数目都发生了变化
C.该历程的总反应中氧化产物与还原产物的物质的量之比为1:2
D.每形成1mol氢氧键,形成1mol“空位”
12.在醋杆菌(适宜生长温度为25℃~30℃)作用下,可将酸性废水中的有机物 转化成 ,同时
电还原硝酸盐,实现地下水厌氧条件下修复,模拟原理如图所示。下列叙述正确的是( )
A.放电时,电流由b极经外电路流向a极
B.其他条件相同,70℃地下水修复效率高于30℃
C.若a极共生成 和 ,则理论上一定会转移
学科网(北京)股份有限公司D.b极的电极反应式为
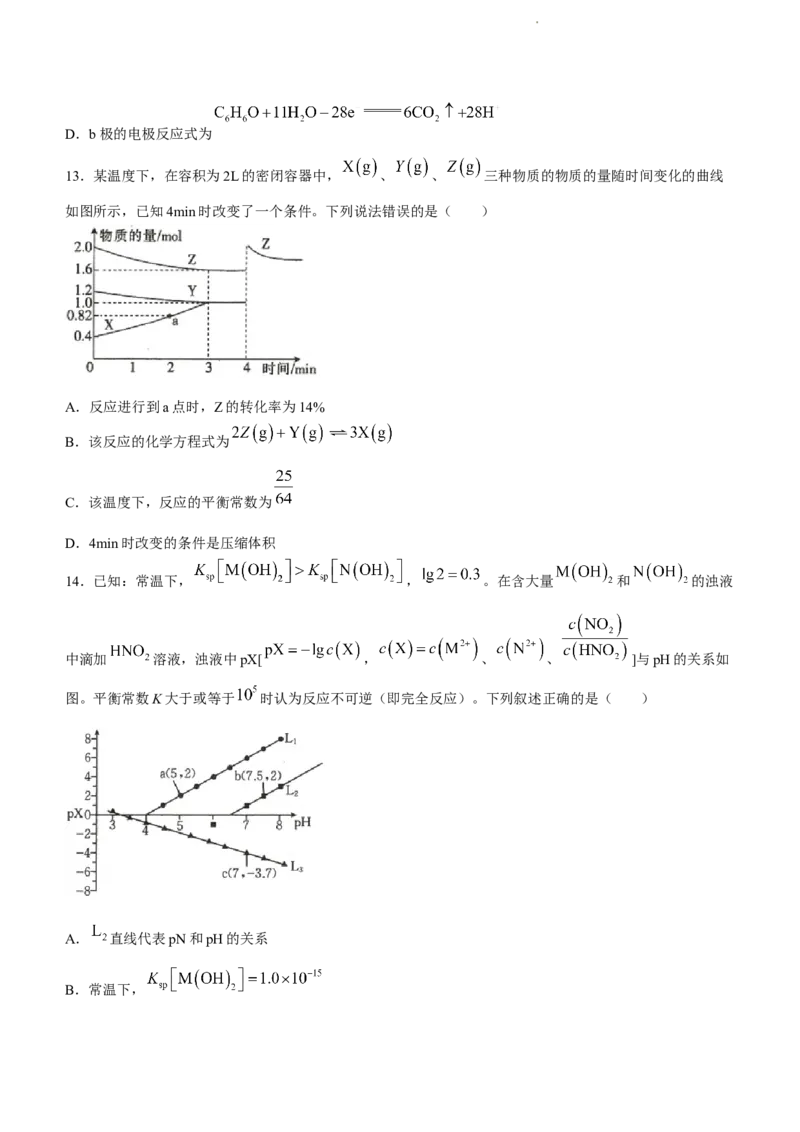
13.某温度下,在容积为2L的密闭容器中, 、 、 三种物质的物质的量随时间变化的曲线
如图所示,已知4min时改变了一个条件。下列说法错误的是( )
A.反应进行到a点时,Z的转化率为14%
B.该反应的化学方程式为
C.该温度下,反应的平衡常数为
D.4min时改变的条件是压缩体积
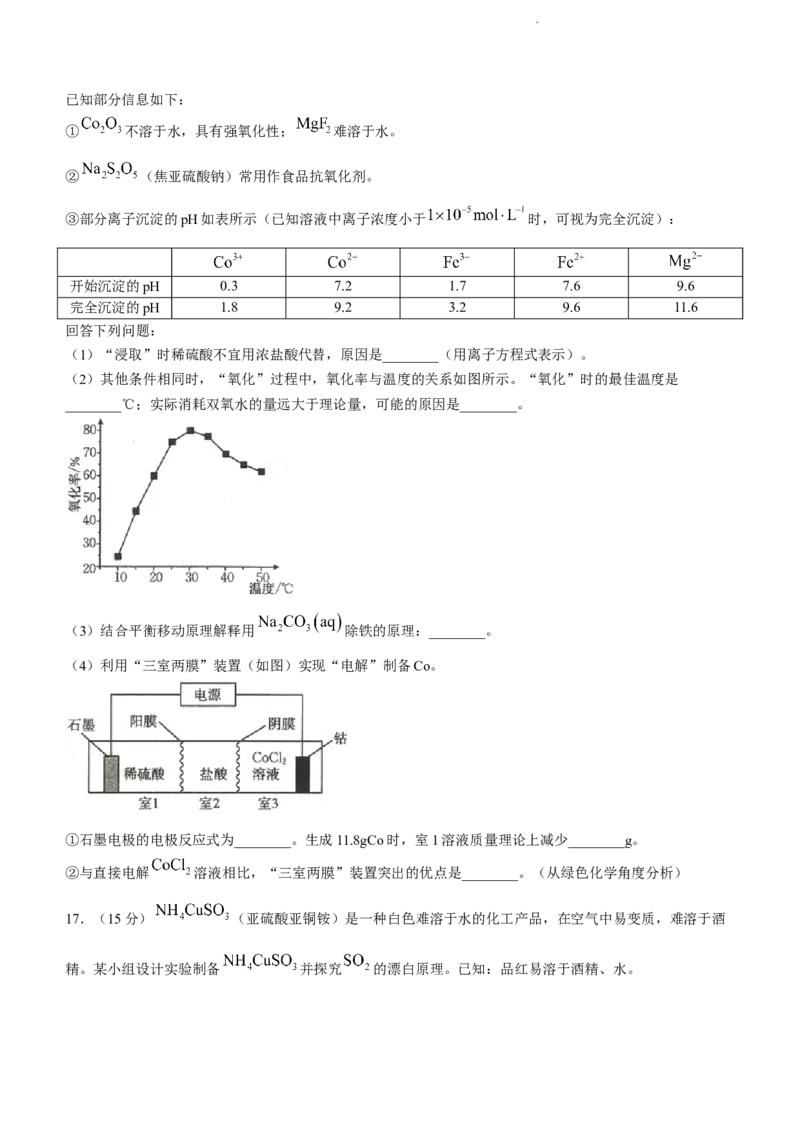
14.已知:常温下, , 。在含大量 和 的浊液
中滴加 溶液,浊液中pX[ , 、 、 ]与pH的关系如
图。平衡常数K大于或等于 时认为反应不可逆(即完全反应)。下列叙述正确的是( )
A. 直线代表pN和pH的关系
B.常温下,
学科网(北京)股份有限公司C.当 、 共存时
D. 、 都能完全溶于亚硝酸溶液中
二、非选择题:本题共4小题,共58分。
15.(15分)某澄清水样中可能含有的离子如表:
阳离子 、 、 、 、
阴离子
、 、 、 、
为检测其成分,某化学兴趣小组用3个小试管分别取少许水样,记作水样①、水样②、水样③,做了如下实
验:
i.向水样①中加入几滴KSCN溶液,无明显变化。
ii.向水样②中加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色;再向反应后所得的溶液
中加入 溶液,有白色沉淀生成;将上述无色气体通入足量 溶液中,无明显变化。
iii.向水样③中加入过量NaOH溶液,仅有白色沉淀生成,静置一段时间,白色沉淀最终变为红褐色,取上
层无色透明溶液,逐滴加入稀盐酸,开始无明显现象,后产生白色沉淀,继续滴加稀盐酸,白色沉淀又全部
溶解。
请回答下列问题:
(1)由以上实验可判断,该水样中一定不含有的阳离子是________(写离子符号,下同),一定不含有的阴
离子是________。
(2)在水样②的实验过程中生成无色气体的氧化还原反应的离子方程式为________。无色气体遇空气变成红
棕色的原因为________(用化学方程式表示),该反应属于四种基本反应类型中的________反应。
(3)水样③的实验中,滴加稀盐酸时生成白色沉淀的离子方程式为________。
(4)实验室中检验 存在的方法为________。
(5)若水样中存在的阳离子的浓度均为 ,阴离子浓度相等且为整数,则溶液中________(填“存
在”或“不存在”) ,理由是________。
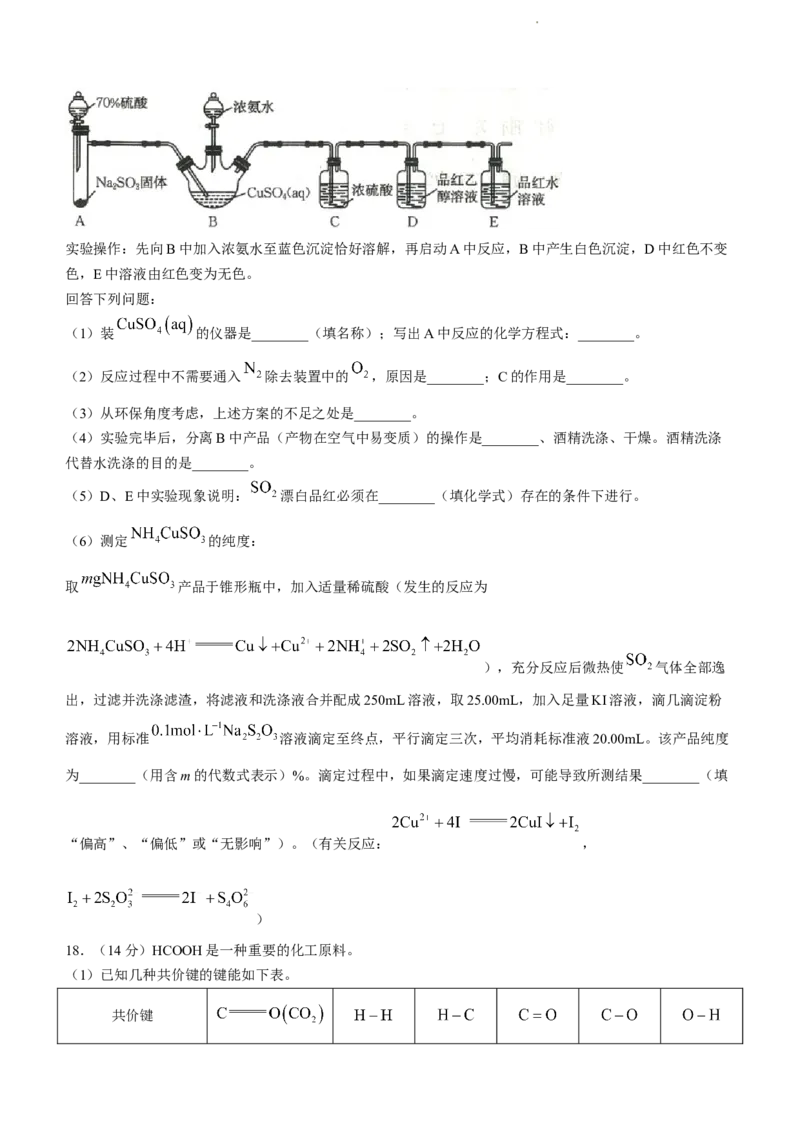
16.(14分)钴广泛应用于电池、合金等领域。以含钴废料(主要含 和CoO,还含有Fe、Mg等元素
以及 、C、有机物)为原料制备钴的流程如图:
学科网(北京)股份有限公司已知部分信息如下:
① 不溶于水,具有强氧化性; 难溶于水。
② (焦亚硫酸钠)常用作食品抗氧化剂。
③部分离子沉淀的pH如表所示(已知溶液中离子浓度小于 时,可视为完全沉淀):
开始沉淀的pH 0.3 7.2 1.7 7.6 9.6
完全沉淀的pH 1.8 9.2 3.2 9.6 11.6
回答下列问题:
(1)“浸取”时稀硫酸不宜用浓盐酸代替,原因是________(用离子方程式表示)。
(2)其他条件相同时,“氧化”过程中,氧化率与温度的关系如图所示。“氧化”时的最佳温度是
________℃;实际消耗双氧水的量远大于理论量,可能的原因是________。
(3)结合平衡移动原理解释用 除铁的原理:________。
(4)利用“三室两膜”装置(如图)实现“电解”制备Co。
①石墨电极的电极反应式为________。生成11.8gCo时,室1溶液质量理论上减少________g。
②与直接电解 溶液相比,“三室两膜”装置突出的优点是________。(从绿色化学角度分析)
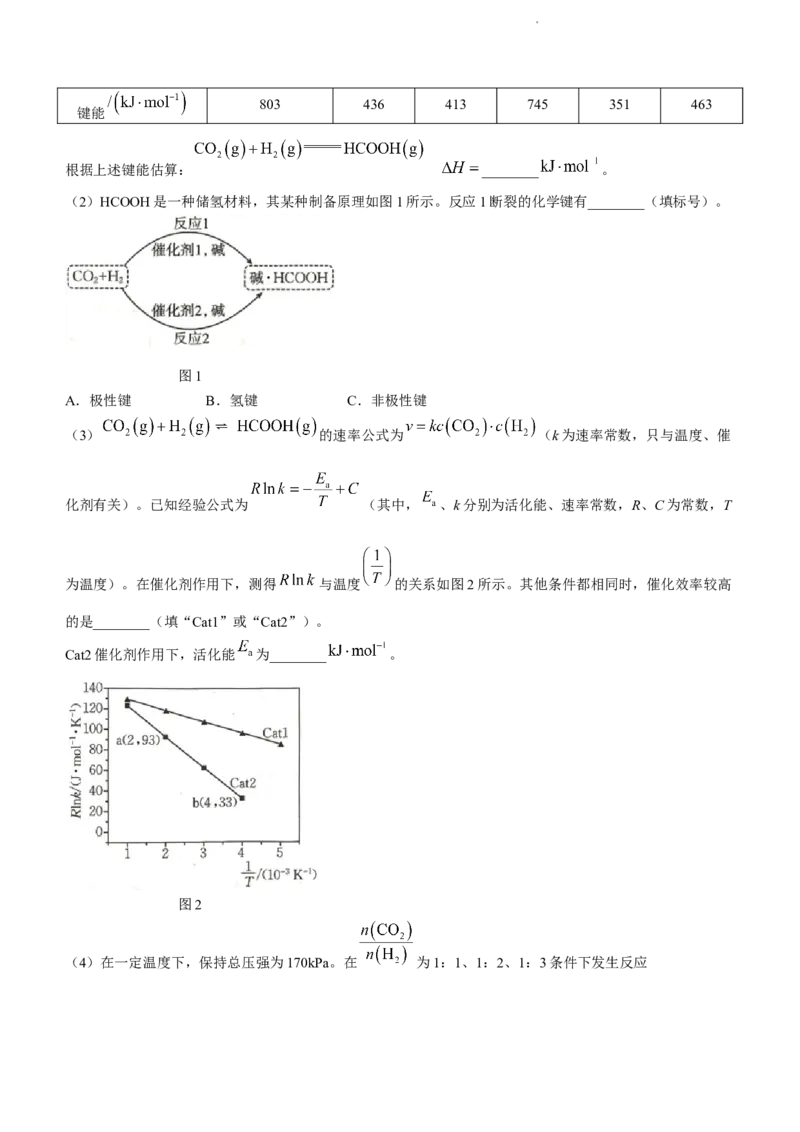
17.(15分) (亚硫酸亚铜铵)是一种白色难溶于水的化工产品,在空气中易变质,难溶于酒
精。某小组设计实验制备 并探究 的漂白原理。已知:品红易溶于酒精、水。
学科网(北京)股份有限公司实验操作:先向B中加入浓氨水至蓝色沉淀恰好溶解,再启动A中反应,B中产生白色沉淀,D中红色不变
色,E中溶液由红色变为无色。
回答下列问题:
(1)装 的仪器是________(填名称);写出A中反应的化学方程式:________。
(2)反应过程中不需要通入 除去装置中的 ,原因是________;C的作用是________。
(3)从环保角度考虑,上述方案的不足之处是________。
(4)实验完毕后,分离B中产品(产物在空气中易变质)的操作是________、酒精洗涤、干燥。酒精洗涤
代替水洗涤的目的是________。
(5)D、E中实验现象说明: 漂白品红必须在________(填化学式)存在的条件下进行。
(6)测定 的纯度:
取 产品于锥形瓶中,加入适量稀硫酸(发生的反应为
),充分反应后微热使 气体全部逸
出,过滤并洗涤滤渣,将滤液和洗涤液合并配成250mL溶液,取25.00mL,加入足量KI溶液,滴几滴淀粉
溶液,用标准 溶液滴定至终点,平行滴定三次,平均消耗标准液20.00mL。该产品纯度
为________(用含m的代数式表示)%。滴定过程中,如果滴定速度过慢,可能导致所测结果________(填
“偏高”、“偏低”或“无影响”)。(有关反应: ,
)
18.(14分)HCOOH是一种重要的化工原料。
(1)已知几种共价键的键能如下表。
共价键
学科网(北京)股份有限公司803 436 413 745 351 463
键能
根据上述键能估算: ________ 。
(2)HCOOH是一种储氢材料,其某种制备原理如图1所示。反应1断裂的化学键有________(填标号)。
图1
A.极性键 B.氢键 C.非极性键
(3) 的速率公式为 (k为速率常数,只与温度、催
化剂有关)。已知经验公式为 (其中, 、k分别为活化能、速率常数,R、C为常数,T
为温度)。在催化剂作用下,测得 与温度 的关系如图2所示。其他条件都相同时,催化效率较高
的是________(填“Cat1”或“Cat2”)。
Cat2催化剂作用下,活化能 为________ 。
图2
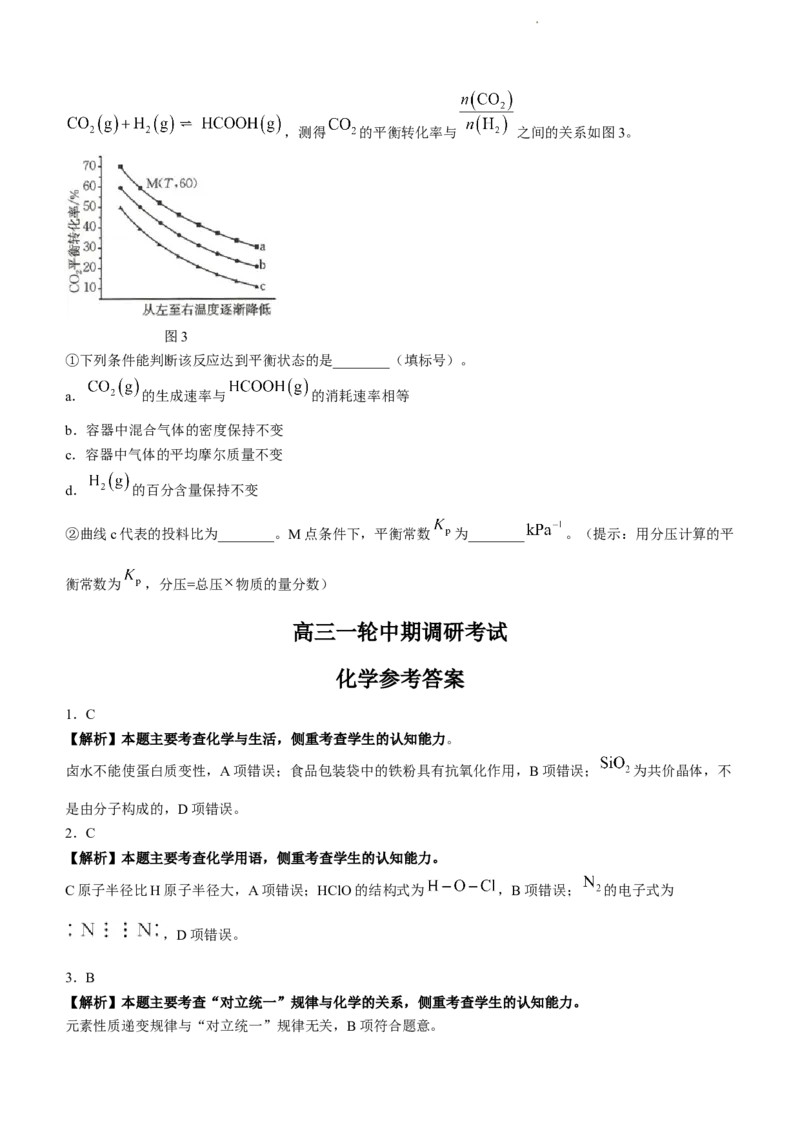
(4)在一定温度下,保持总压强为170kPa。在 为1:1、1:2、1:3条件下发生反应
学科网(北京)股份有限公司,测得 的平衡转化率与 之间的关系如图3。
图3
①下列条件能判断该反应达到平衡状态的是________(填标号)。
a. 的生成速率与 的消耗速率相等
b.容器中混合气体的密度保持不变
c.容器中气体的平均摩尔质量不变
d. 的百分含量保持不变
②曲线c代表的投料比为________。M点条件下,平衡常数 为________ 。(提示:用分压计算的平
衡常数为 ,分压=总压 物质的量分数)
高三一轮中期调研考试
化学参考答案
1.C
【解析】本题主要考查化学与生活,侧重考查学生的认知能力。
卤水不能使蛋白质变性,A项错误;食品包装袋中的铁粉具有抗氧化作用,B项错误; 为共价晶体,不
是由分子构成的,D项错误。
2.C
【解析】本题主要考查化学用语,侧重考查学生的认知能力。
C原子半径比H原子半径大,A项错误;HClO的结构式为 ,B项错误; 的电子式为
,D项错误。
3.B
【解析】本题主要考查“对立统一”规律与化学的关系,侧重考查学生的认知能力。
元素性质递变规律与“对立统一”规律无关,B项符合题意。
学科网(北京)股份有限公司4.D
【解析】本题主要考查物质制备,侧重考查学生的实验设计能力。
易被氧化,易水解,A项不符合题意;搅拌会使胶体聚沉,B项不符合题意;浓硝酸具有强氧化性,
可被氧化,C项不符合题意。
5.C
【解析】本题主要考查化学反应历程,侧重考查学生的认知能力。
反应①的活化能为 ,C项错误。
6.B
【解析】本题主要考查反应方程式的正误判断,侧重考查学生对基础知识的理解和应用能力。
该反应中,HCHO的氧化产物为 ,B项错误。
7.C
【解析】本题主要考查元素推断,侧重考查学生的分析推理能力。
由题意可知,Y的某种氢化物遇浓盐酸有白烟生成,则Y为N元素;基态Z原子的3p轨道上有2个未成对电
子,则Z为Si元素或者S元素;基态W原子的最外层电子数和最内层电子数相等,则W为Ca元素;又因四
种元素的原子序数之和等于49,则X只能为C元素,Z只能为S元素。C的原子半径大于N,A项错误;最
简单氢化物的沸点最高的为 ,B项错误; 中含有共价键,D项错误。
8.A
9.D
【解析】本题主要考查化学实验,侧重考查学生对化学实验的设计能力及对实验现象的分析能力。
也能被吸铁石吸引,A项错误;澄清石灰水变浑浊的原因也可能是 与澄清石灰水反应生成
,B项错误;浓硫酸起吸水作用,干燥气体,C项错误;d中变色的原因是有氧气生成,
,用带火星的木条可以检验 ,D项正确。
10.C
【解析】本题主要考查阿伏加德罗常数的计算,侧重考查学生对基础知识的认知能力和计算能力。
中每个Si原子形成4个 键,A项错误;未指明溶液的温度,B项错误;未指明 和 的
质量,D项错误。
11.D
【解析】本题主要考查化学反应历程,侧重考查学生获取信息并解决化学问题的能力。
学科网(北京)股份有限公司由反应历程图可知总反应为 ,反应每生成 ,则其中有
是由 氧化得到的,有 是由NO还原得到的, 中只有 是还原产物,
C项正确;形成1mol铈、铈之间“空位”时形成1mol氢氧键,形成1mol钛、铈之间“空位”时至少形成
3mol氢氧键,D项错误。
12.D
【解析】本题主要考查原电池原理,侧重考查学生对基础知识的理解和运用能力。
根据物质转化及元素化合价变化可知,a极为正极,b极为负极,电流由正极流向负极,A项错误。题述地下
水修复的关键物质是醋杆菌,其适宜生长温度为25℃~30℃,故温度过高,会导致醋杆菌失活,甚至死亡,B
项错误。a极的电极反应式有 、
,根据平均值原理:若生成 ,则转移20mol电子,若生成
,则转移16mol电子,即转移的电子介于16mol和20mol之间,C项错误。
13.D
【解析】本题主要考查化学反应速率与平衡,侧重考查学生对基础知识的应用能力。
该反应为 ,压缩体积, 的物质的量不会瞬间增大且平衡不会移动,D项错误。
14.B
【解析】本题主要考查电解质溶液,侧重考查学生分析和解决问题的能力。
由于 、 组成类型相同,故pX与pH呈线性关系,观察图像可知, 、 斜率相同,代
表pN、pM,故 代表 。根据a、b、c点数据计算溶度积和电离常数, ,
, ,由于 ,所以 ,
,A项错误、B项正确;当 和 共存时, ,C
项错误; 的平衡常数
学科网(北京)股份有限公司, 不能完全
溶于亚硝酸中,D项错误。
15.(1) 、 (每个1分,写错不得分,共2分); 、 (每个1分,写错不得分,共2
分)
(2) (2分); (2分);化合
(1分)
(3) [或 ,2分]
(4)焰色试验(1分)
(5)不存在(1分);溶液呈电中性(答电荷守恒也给分,2分)
【解析】本题主要考查溶液中的离子推断,考查学生的分析推理能力。
(5)由实验可知水样中一定存在 、 、 、 ,阳离子的浓度均为 ,设水样体积为
VL,则 、 所带正电荷总数为 ,阴离子浓度相等且为整数,若水样中阴离子仅有 、
,不符合条件,故水样中一定还含有 的 , 、 的浓度均为 才符合题
设条件,故不存在 。
16.(1) (2分)
(2)30(30℃左右即可给分,2分);生成的 会催化 分解(或其他合理答案,2分)
(3) 消耗了溶液中的 ,促使 的水解平衡正向移动生成 沉淀(或其他合理答案,2
分)
(4)① (2分);3.6(2分)
②回收高浓度盐酸,不产生氯气,体现绿色化学理念(答案合理即可,2分)
【解析】本题主要考查制备Co的工艺流程,考查学生对元素化合物知识和反应原理知识的理解和综合运用
能力。
(1)三氧化二钴具有强氧化性,用焦亚硫酸钠还原+3价钴。如果加入浓盐酸,会产生氯气。
学科网(北京)股份有限公司(4)②石墨电极为阳极,钴电极为阴极,采用“三室两膜”装置电解,可以回收盐酸,避免氯离子在阳极上
被氧化生成有毒气体。
17.(1)三颈烧瓶(或三口烧瓶,1分); (2分)
(2) 具有较强的还原性,可作抗氧化剂(2分);吸收挥发出来的 ,干燥 (2分)
(3)尾气排入空气中,会污染环境(1分)
(4)在保护气 下过滤(1分);减少产品损失(或其他合理答案,1分)
(5) (1分)
(6) (2分);偏高(2分)
【解析】本题主要考查化学实验,考查学生对化学实验的设计、评价等综合能力。
(5)比较实验现象和条件可知,在水存在下 才能漂白品红。
(6)由反应方程式可得关系式: ,
。
18.(1)+70(2分)
(2)AC(2分)
(3)Cat1(2分);30.0(2分)
(4)①bcd(选对2个给1分,选对1个或选错不给分,全对给2分)
②1:1(2分); (或 ,2分)
【解析】本题主要考查化学反应原理,考查学生对基础知识的理解和综合应用能力。
(3)根据经验公式可知,温度变化相同时 变化值与活化能成比例,活化能越大,变化值越大。故斜率
越小,活化能越小,催化剂Cat1催化效率较高,代入a、b点数据可知, ,
,解得: 。
(4)②相同温度下,增大氢气、 的投料比, 平衡转化率增大,观察图3知,曲线c在相同条件下
学科网(北京)股份有限公司转化率最小,故投料比为1:1。曲线a投料比为1:3。由M点 的平衡转化率列三段式如下:
起始/mol 1 3 0
变化/mol 0.6 0.6 0.6
平衡/mol 0.4 2.4 0.6
故平衡时, 、 、 的分压分别为 、
、 , 。
学科网(北京)股份有限公司