文档内容
安宁河联盟2023~2024学年度下期高中2022级期末联考
化学参考答案及评分细则
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
题号 1 2 3 4 5 6 7
答案 C A B C A C D
题号 8 9 10 11 12 13 14
答案 C D C C C C A
二、非选择题:本题共4小题,共58分。
注意:1.本试卷中其他合理答案,可参照此评分标准酌情给分。
2.方程式未写条件或条件不完全、不写“↓”或“↑”均扣一分,不配平不得分。
15. (14分每空均为2分)
(1)(球形)冷凝管 吸收有害尾气,防止污染环境
(2) ❑
CH CH CH CH OH+HBr→CH CH CH CH Br+H O
3 2 2 2 3 2 2 2 2
(3)1-丁烯(或CH =CHCH CH )、CO (答到1-丁烯给满分,只答给CO 一分)
2 2 3 2 2
(4)下口放出
(5)70.2
(6)⑤④①③②
16.(15分)(除标记外,每空2分)
(1)29(1分); Cu+价电子排布为3d10(1分), Cu2+为3d9,3d10全满结构更稳定。(1分)
(2)平面三角形;O>N>H>Cu
(3)sp3;其中含有羟基、氨基等亲水基团,可以与水分子形成分子间氢键;
√3 1152
(4) a; ×1030
4 NA×a3
17.(共15分)(除标记外,每空2分)
电解
(1)2ScCl (熔融)=2 Sc+3Cl
3 2
(2)10、 K [Fe(CN) ]
3 6
(3)0.06(1分)
(4)2Sc (C O ) +3O 2Sc O +12CO
2 2 4 3 2 2 3 2
(5)抑制Sc3+水解
(6)阴、 907℃~1541℃
18.【答案】(14分,除标记外,每空2分)
(1)醛基(1分) 光照(1分)
(2) 氧化反应 取代反应(或水解反应)
(3)
1
学科网(北京)股份有限公司(4)
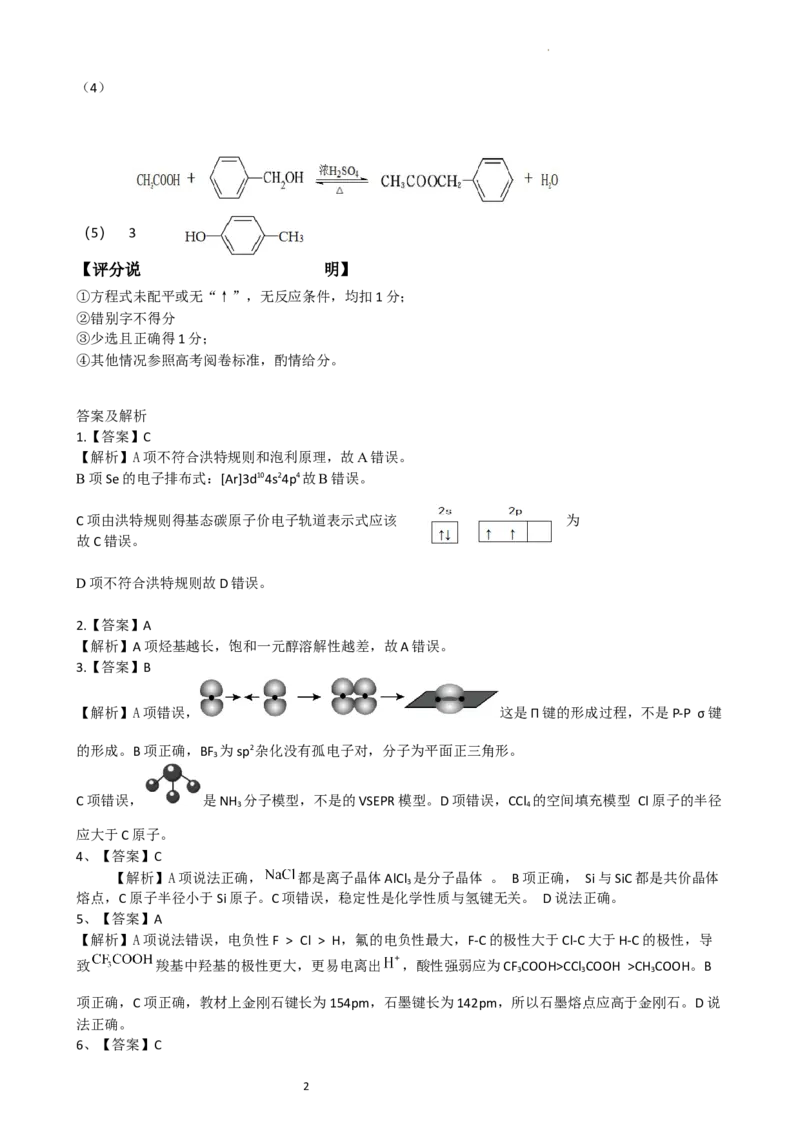
(5) 3
【评分说 明】
①方程式未配平或无“↑”,无反应条件,均扣1分;
②错别字不得分
③少选且正确得1分;
④其他情况参照高考阅卷标准,酌情给分。
答案及解析
1.【答案】C
【解析】A项不符合洪特规则和泡利原理,故A错误。
B项Se的电子排布式:[Ar]3d104s24p4故B错误。
C项由洪特规则得基态碳原子价电子轨道表示式应该 为
故C错误。
D项不符合洪特规则故D错误。
2.【答案】A
【解析】A项烃基越长,饱和一元醇溶解性越差,故A错误。
3.【答案】B
【解析】A项错误, 这是Π键的形成过程,不是P-P σ键
的形成。B项正确,BF 为sp2杂化没有孤电子对,分子为平面正三角形。
3
C项错误, 是NH 分子模型,不是的VSEPR模型。D项错误,CCl 的空间填充模型 Cl原子的半径
3 4
应大于C原子。
4、【答案】C
【解析】A项说法正确, 都是离子晶体AlCl 是分子晶体 。 B项正确, Si与SiC都是共价晶体
3
熔点,C原子半径小于Si原子。C项错误,稳定性是化学性质与氢键无关。 D说法正确。
5、【答案】A
【解析】A项说法错误,电负性F > Cl > H,氟的电负性最大,F-C的极性大于Cl-C大于H-C的极性,导
致 羧基中羟基的极性更大,更易电离出 ,酸性强弱应为CF COOH>CCl COOH >CH COOH。B
3 3 3
项正确,C项正确,教材上金刚石键长为154pm,石墨键长为142pm,所以石墨熔点应高于金刚石。D说
法正确。
6、【答案】C
2
学科网(北京)股份有限公司【解析】A项正确,由图一可知Cu2+与2个H O和4个NH 分子形成了配位键 ,配位原子为O和N原子。
2 3
B项正确,因为电负性O>N,配位原子O给电子能力小于N原子,所以NH 与Cu2+形成的配位键稳定性大
3
于H O与Cu2+形成的配位键,加热配位键弱的先失去。C项错误,杯酚不是超分子,杯酚与C 相互以范
2 60
德华力作用形成的分子聚集体才叫超分子。D项说法正确。
7、【答案】D
A项正确。B项正确。C项正确。D项错误,K O 和Cs O都属于离子晶体,Cs与O的电负性之差大于K与
2 2
O的电负性之差,电负性差越大形成的离子键比例就越大。K O 晶体的离子键百分比小于Cs O晶体。根
2 2
据离子半径越小离子晶体的熔点越高,离子所带的电荷越多离子晶体的熔点越高,K O 和Cs O所带的电
2 2
荷一样,但K+半径小于Cs+,所以K O 晶体的熔点大于Cs O晶体。
2 2
8.【答案】C
【解析】A选项中CHCHCOOCH 与CHCOOCHCH 均为含四个碳的酯,不互为同系物。
3 2 3 3 2 3
B选项中顺-2-丁烯的分子结构模型
CH OH CH OH
2 OH 2 OH
CH3 CH3
D 选项中 与 互为同分异构体, 是醇, 是酚。
9.【答案】D
【解析】因为未知物的相对分子质量是46,红外光谱图中有羟基,核磁共振氢谱中有三组
峰且为3:2:1,故未知物A为乙醇。D选项中分离乙醇和水应采用蒸馏操作。
10.【答案】C
【解析】由题干信息得,X的价电子排布式为2s22p2,则X为元素碳;Y的2P能级为半满结构,则Y为元素氮;
Z为地壳中含量最高的元素,则Z为元素氧;Z与Q同主族,则Q为元素硫;W为原子序数依次增大的短
周期主族元素,则W是元素硫。A选项中X的最高价氧化物为CO ,碳原子的杂化轨道类型是sp杂化。B
2,
选项中Z与Q能形成化合物 SO ,其分子的空间结构为V形。C选项中 X与W形成的五原子分子CCl 中
2 4
只有σ键,且为非极性分子,故C 选项正确。D选项中Y的简单气态氢化物为NH ,其VSEPR模型三角锥形,
3
键角为107。。
11.【答案】C
A:根据白藜芦醇结构简式,可知其分子式是C H O ,A正确
14 12 3
B:分子中含有2个苯环,1个碳碳双键,则1mol该化合物可与7mol氢气发生加成反应,B正确
C:白藜芦醇中的-OH直接连接在苯环上,属于酚类,性质类似苯酚,难溶于水,其中的官能团-OH和碳
碳双键均有还原性,是一种天然的抗氧化剂,C错误;
D:苯环、双键均为平面结构,且直接相连,则该分子中所有原子可能同在一个平面上,D正确
12.【答案】C
【解析】A选项,醛基也能使溴水褪色,故溴水褪色不能证明该有机物含有碳碳双键,A错误;B选项,
1mol该有机物能与最多4molH 发生加成反应,B错误;C选项,酚羟基具有酸性,能与NaOH溶液反应,
2
酯基能在NaOH溶液中水解,生成酚羟基与乙酸,故1mol该有机物能与3molNaOH发生反应,C正确;D
选项,该有机物含有酚羟基,能与FeCl 发生显色反应,D错误。
3
13.【答案】C
【解析】A选项,直接取上清液滴入硝酸银溶液,生成白色沉淀可能为AgOH,不能证明发生了取代反应,
故A错误;B选项,NaOH溶液的作用为出去挥发的乙醇和可能产生的SO 等杂质,避免干扰后续现象的
2
3
学科网(北京)股份有限公司观察,替换为蒸馏水后无法达到相同效果,故B错误;C选项,乙醛被新制Cu(OH) 悬浊液氧化,证明乙
2
醛具有还原性,故C正确;D选项,乙酸乙酯在碱性环境下水解趋于完全,故试管内溶液不分层,现象不
同,故D错误。
14.【答案】A
【解析】A选项,若R为醛基0.1mol乙发生银镜反应生成0.4mol银单质,质量为43.2g,A正确;B选项,
若R为甲基,对甲基苯酚与甲组成上相差1个CH 原子团,但结构不相似,故不为同系物,B错误;C选
2
项,若R为乙基,甲中所有C原子均可共面,故最多有9个碳原子共平面,C错误;D选项,若R为乙烯
基,碳碳双键也能使酸性高锰酸钾溶液褪色,故不能证明乙中含有醛基D错误。
15.【解析】【解析】(1)仪器A的名称是(球形)冷凝管,作用为导气、冷凝、回流。正丁醇、溴化钠、
硫酸反应时,会有挥发出来的HBr和生成的SO,用氢氧化钠溶液吸收,所以装置B的作用是吸收有害尾
2
气,防止污染环境(或防倒吸)。
(2)本实验制备 1- 溴丁烷的原理为: NaBr(s)+H 2 SO 4 ( 浓 ) ❑ = HBr↑+NaHSO 4 ,
❑ ,总反应为:
CH CH CH CH OH+HBr→CH CH CH CH Br+H O
3 2 2 2 3 2 2 2 2
CH
3
CH
2
CH
2
CH
2
OH+NaBr+H
2
SO
4
( 浓 )→ ❑ CH
3
CH
2
CH
2
CH
2
Br+NaHSO
4
+H
2
O ;
(3)浓硫酸具有强氧化性,能将HBr氧化成Br ,本身还原为SO,1-丁醇在浓硫酸作用下,会发生取代反
2 2
应生成丁醚,也会消去反应生成1—丁烯,所以可能产生的副产物有 、 、丁醚和1-丁烯。
2 2
(4)有机层在下层,所以从下口放出。 SO Br
(5)已知无水溴化钠和浓硫酸均过量,所以用正丁醇的质量进行计算。
△
CH CH CH CH OH+NaBr+H SO →CH CH CH CH Br+NaHSO +H O
3 2 2 2 2 4 3 2 2 2 4 2
74 137
5g m
m(溴丁烷) 6.5
137×5 = 实际×100%= ×100%≈70.2%
m= g 产率 m(溴丁烷) 137×5
74 理论
74
(6)1-溴丁烷中的溴元素以溴原子的形式存在,不能直接检验,应先通过水解反应转化为溴离子再检验,
正确顺序为:⑤④①③②。
【评分细则】
①“球形”不写不扣分,错别字不得分。 吸收有害尾气,防止污染环境(或防倒吸),未说明是HBr
和SO 均得分
2
②方程式中无反应条件,扣1分;用“==”等号连接扣1分
(6)中顺序错一个不得分
④其他情况参照高考阅卷标准,酌情给分。
4
学科网(北京)股份有限公司16、【解析】(1)Cu的原子序数为29,核外电子的运动状态均不相同,故核外电子运动状态有29种;
Cu的价电子排布为3d104s1,失去一个电子后Cu+价电子排布为3d10,失去两个电子后Cu2+为3d9,3d10全满
结构更稳定。
(2)NO-价层电子对数为3,孤电子对数为0,所以其空间结构为平面三角形;所含元素有:N、O、Cu、
3
H,根据电负性规律:同周期从左往右依次递增,同主族从上往下递减,得出电负性:O>N>H>Cu。
(3)碳原子均形成单键,故碳原子杂化方式为sp3;壳聚糖极易溶于水,是由于其中含有羟基、氨基等
亲水基团,可以与水分子形成分子间氢键;
√3
(4)氧原子以金刚石方法堆积,其中氧原子之间的最短距离为体对角线的四分之一,故最短距离为 a;
4
64×16+16×8 1152
晶胞中含Cu个数为16,O个数为8,则晶胞质量为: = ;晶胞体积为:a3×10-
NA NA
1152
30cm3,故密度为: ×1030。
NA×a3
17、【解析】
(1)类比电解氧化铝书写
(2)萃取时分离出Sc3+,由图可知,萃取时适宜的振荡时间为10min,萃取率较高水相废液中主要的金
属阳离子为Fe2+,可用K[Fe(CN) ]溶液检验
3 6
(3)反萃取后分离出Sc3+,加草酸生成Sc (C O) ,饱和溶液浓度为2×10-4mol/L,则c(Sc3+)=4×10-4mol/L
2 2 4 3
c(C O2-)=6×10-4mol/L,Ksp=(4×10-4)2×(6×10-4)3若c(Sc3+)=4×10-6mol/L,则c(C O2-)=0.06mol/L
2 4 2 4
(4)根据流程图灼烧发生2Sc (C O)+3O 2Sc O+12CO
2 2 4 3 2 2 3 2
(5)结晶脱水时ScCl 会水解生成HCl,其挥发会使Sc3+水解程度增大,生成Sc(OH) ,因此在HCl气流
3 3
中可以抑制其水解
(6)电解时由于锌是活性电极,应该作阴极材料,根据熔沸点大小并考虑要将锌蒸出和经济成本,只需
将温度控制在907℃~1541℃即可,无需控制到2836℃,
18、【解析】由题干信息得A是CHCHOH ,B是CHCHO ,C是CHCOOH ,D 是 E
3 2 3 3
是 。(5)满足条件的同分异构为酚类,苯环上有酚羟基和甲基两个取代基,
所以有邻间对3种。
5
学科网(北京)股份有限公司