文档内容
六安一中 2025 届高三年级第四次月考 C.电解 溶液,转移的电子数最多为
D. 溶液中 、 、 数目之和小于
化学试卷
4.固态或气态碘分别与氢气反应的热化学方程式如下:
亮亮 贾娟娟
①
时间:75分钟 满分:100分 ②
相对原子质量:H 1 O 16 Ni 59 Cu 64 下列判断正确的是( )
一、选择题(每题3分)
A.①中的 为固态,②中的 为气态
1.各类材料的应用推动了科技发展,下列说法正确的是( )
B.②的反应物总能量比①的反应物总能量高
A.废电池必须进行集中处理,因为电池外壳为贵重金属材料,需要回收利用
C.反应②化学键断裂时吸收的能量比化学键形成时释放的能量少
B.天舟六号货运飞船主体材料铝合金的硬度高于金属铝
D.1mol固态碘升华时将吸收35.96kJ的热量
C.纸电池是近年来电池研发领域的新成果,原电池的电极必须使用金属材料
5.下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )
D.“长征一号”运载火箭使用的是液氧煤油发动机,煤油主要由煤的干馏获得
选项 陈述Ⅰ 陈述Ⅱ
2.NCl 常用于漂白,也用于柠檬等水果的熏蒸处理,易水解,发生反应
3
在水晶柱面上滴一滴融化的石蜡,用一根红热的铁针刺中
A 水晶导热性具有各向异性
,下列说法正确的是( ) 在凝固的石蜡,融化的石蜡形成一个椭圆形
取 加稀盐酸至全部溶解,滴加少量 后紫色褪
B 中含有Fe(Ⅱ)
A.HClO的电子式为 B.NH 的键角大于NCl 的键角
3 3 去
向熔融氯化钾中加入钠单质,有钾单质蒸汽放出,同时生
C 高温下活泼性Na>K
成氯化钠
C.H O中含有s-p σ键 D.NCl 的VSEPR模型为
2 3
D 将打磨后的铝箔直接在酒精灯上加热,铝箔融化滴落 熔点:Al O >Al
2 3
3.设 是阿伏加德罗常数的值,下列说法中不正确的是( )
6.下列叙述对应的方程式书写错误的是( )
A.在 的 溶液中加入氨水至溶液呈中性,此时 数目为 A.漂白粉溶液吸收 后产生白色沉淀:
B. 和 在密闭容器中充分反应,体系中的分子总数为 B.泡沫灭火器灭火的原理:
C.将SO 通入酸性NaClO 溶液中制备 :
2 3
1
学科网(北京)股份有限公司D.向稀硫酸溶液中加入 固体出现黄色沉淀:
7.一定温度下,反应CH (g)+H O(g) CO(g)+3H (g) ΔH=-206.3 kJ/mol,下列说法正确的是(
4 2 2
)
A.反应中,4E(C-H) + 2E(O-H)<E(C O) + 3E(H-H) (E表示键能,CO中为 键)
B.向容器中充入1mol 和1mol ,充分反应放出的热量等于206.3kJ
下列说法正确的是( )
C.CH 与H O合成CO的反应原子利用率达100%
4 2
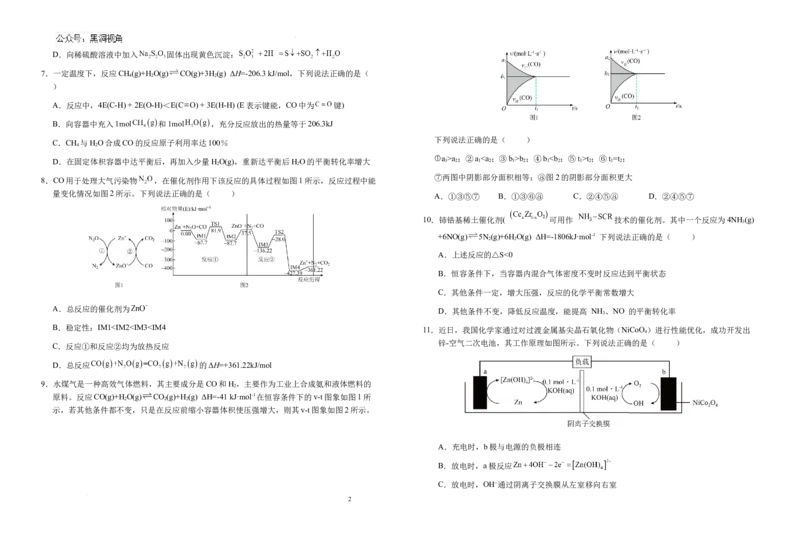
①a >a ;②a b ;④b t ;⑥t =t ;
D.在固定体积容器中达平衡后,再加入少量H O(g),重新达平衡后H O的平衡转化率增大 1 2 1 2 1 2 1 2 1 2 1 2
2 2
⑦两图中阴影部分面积相等;⑧图2的阴影部分面积更大
8.CO用于处理大气污染物 ,在催化剂作用下该反应的具体过程如图1所示,反应过程中能
量变化情况如图2所示。下列说法正确的是( )
A.①③⑤⑦ B.①③⑥⑧ C.②④⑤⑧ D.②④⑤⑦
10.铈锆基稀土催化剂( 可用作 技术的催化剂。其中一个反应为4NH (g)
3
+6NO(g) 5N (g)+6H O(g) ΔH=-1806kJ·mol-1 下列说法正确的是( )
2 2
A.上述反应的△S<0
B.恒容条件下,当容器内混合气体密度不变时反应达到平衡状态
C.其他条件一定,增大压强,反应的化学平衡常数增大
A.总反应的催化剂为
D.其他条件不变,降低反应温度,能提高 NH 、NO 的平衡转化率
3
B.稳定性:IM1W >X
B.隔膜1为阳离子交换膜
C.E和Y的简单氢化物沸点:E >Y
C.装置B中q口流出液中主要的溶质为
D.简单离子半径:W>E>Y
D.若有0.2 mol电子转移,A中质子交换膜左侧电解液质量减少0.2g
二、填空题(每空2分)
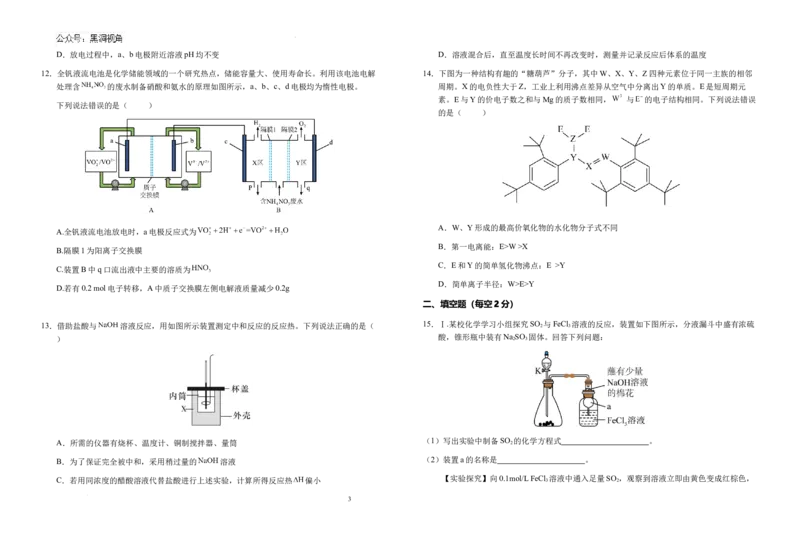
13.借助盐酸与 溶液反应,用如图所示装置测定中和反应的反应热。下列说法正确的是( 15.Ⅰ.某校化学学习小组探究SO 2 与FeCl 3 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫
) 酸,锥形瓶中装有Na 2 SO 3 固体。回答下列问题:
A.所需的仪器有烧杯、温度计、铜制搅拌器、量筒 (1)写出实验中制备SO 2 的化学方程式 。
B.为了保证完全被中和,采用稍过量的 溶液 (2)装置a的名称是 。
C.若用同浓度的醋酸溶液代替盐酸进行上述实验,计算所得反应热 偏小 【实验探究】向0.1mol/L FeCl 3 溶液中通入足量SO 2 ,观察到溶液立即由黄色变成红棕色,
3
学科网(北京)股份有限公司放置12小时后,红棕色消失,溶液变为浅绿色。 A.澄清石灰水 B.品红溶液 C.酚酞试液 D.浓硫酸
结合已有知识,针对溶液呈红棕色学习小组提出以下猜想: (5)根据吸硫过程中的现象,可推测硫化碱法制备 的反应可以分为如下三步:
猜想1:Fe3+水解产生了红棕色的Fe(OH) 胶体; 第一步: (同时还发生 )
3
猜想2:Fe3+与溶液中某种+4价含硫微粒形成了红棕色的配合物。 第二步:
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液, (描 第三步: (用化学方程式表示)。
述有或没有某种现象),证明猜想1不成立。
反应完成后,装置A中的溶液经蒸发浓缩,冷却结晶可析出 ,其中可能含有
乙同学查阅文献得知猜想2正确,并设计了下表3组实验(实验均在常温下进行)。 少量 等杂质。
溶液 (6)设计实验方案,检测产品中是否存在 。
组别 溶液2(2mL) 现象
1(1mL)
已知:① 微溶; 难溶;②Na S O +2HCl=S↓+SO ↑ H O+NaCl。
2 2 3 2 + 2
a SO 的饱和溶液
2
16.镍及其化合物广泛用于生产不锈钢、电池以及催化剂领域。
b 0 L . F 1 e m C o l l 3 / S 体 O 调 2 的 节 饱 溶 和 液 溶 p 液 H= , 5. 用 0 NaOH固 溶液1和溶液2混合后,组别a、b、c (1)①Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同的元素是
所得溶液红棕色依次加深 。
溶液
SO 的饱和溶液,用NaOH固 ②比较基态原子的第二电离能I₂的大小:Ni Cu,说明理由: 。
c 2
体调节溶液pH=10.0
(2)镍常用作工业催化剂。下列关于基态镍原子的核外电子排布描述错误的是__________。
已知:常温下,溶液中+4价含硫微粒物质的量分数随pH变化曲线如图所示。
A.核外电子有15种空间运动状态 B.位于元素周期表第四周期第ⅧB族
C.能量相同的电子有10个 D.未成对电子的自旋方向均相同
(3)实验室用石墨电极电解 溶液,以获得制镍铜合金所需的精铜。当电路中通
过0.4N 电子时,阴极增重6.4g。欲使电解液恢复原状,可向电解后的溶液中加入
A
_________。
A. B.0.1molCuO
C.0.2molCuO D.0.1molCuO和0.1molH O
2
分析以上实验结果及有关信息可知,红棕色配合物中的配体是 (填微粒符号)。
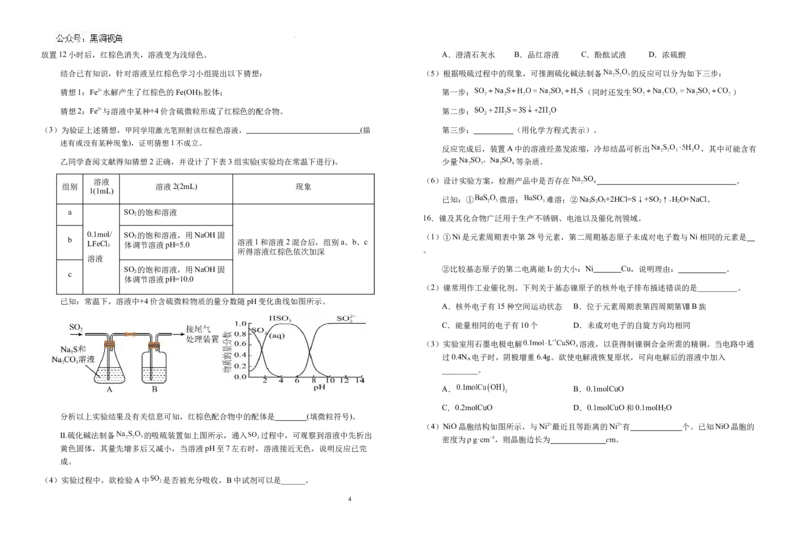
(4)NiO晶胞结构如图所示,与Ni2+最近且等距离的Ni2+有 个。已知NiO晶胞的
Ⅱ.硫化碱法制备 的吸硫装置如上图所示,通入 过程中,可观察到溶液中先析出
密度为ρ g·cm−3,则晶胞边长为 cm。
黄色固体,其量先增多后又减小,当溶液pH至7左右时,溶液接近无色,说明反应已完
成。
(4)实验过程中,欲检验A中 是否被充分吸收,B中试剂可以是______。
4
学科网(北京)股份有限公司D.容器内气体的平均相对分子质量不再变化
(2)近年来,有研究者发现若将上述生产过程中通入N 改为通入CO ,在CO 气氛中乙苯催化
2 2 2
脱氢制苯乙烯更容易进行,反应历程如图(历程中的微粒均为气态):
(5)硫酸镍溶液在强碱性环境中用 氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。
写出该反应的离子方程式 。
①该过程中发生的总反应化学方程式为 。
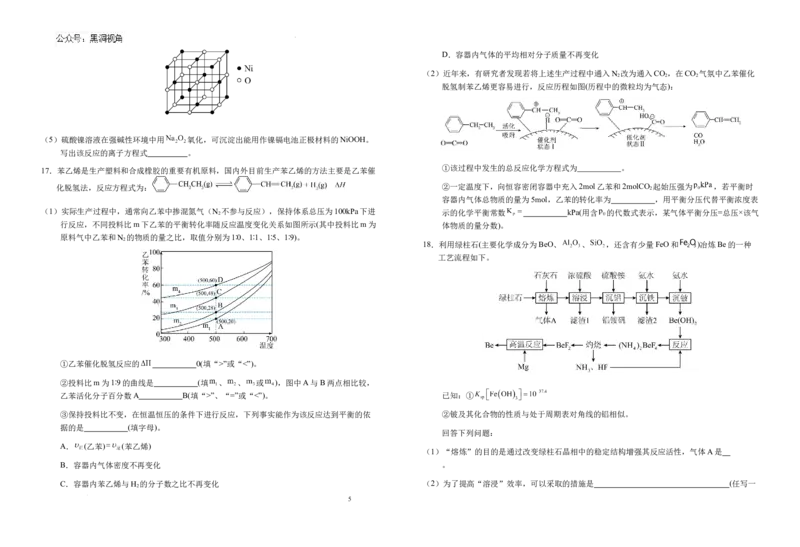
17.苯乙烯是生产塑料和合成橡胶的重要有机原料,国内外目前生产苯乙烯的方法主要是乙苯催
化脱氢法,反应方程式为: ②一定温度下,向恒容密闭容器中充入2mol乙苯和2molCO 起始压强为 ,若平衡时
2
容器内气体总物质的量为5mol,乙苯的转化率为 ,用平衡分压代替平衡浓度表
(1)实际生产过程中,通常向乙苯中掺混氮气(N 2 不参与反应),保持体系总压为100kPa下进 示的化学平衡常数 kPa(用含 的代数式表示,某气体平衡分压=总压×该气
行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为 体物质的量分数)。
原料气中乙苯和N 的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。
2
18.利用绿柱石(主要化学成分为BeO、 、 ,还含有少量FeO和 )冶炼Be的一种
工艺流程如下。
①乙苯催化脱氢反应的 0(填“>”或“<”)。
②投料比m为1∶9的曲线是 (填 、 、 或 ),图中A与B两点相比较,
乙苯活化分子百分数A B(填“>”、“=”或“<”)。 已知:①
③保持投料比不变,在恒温恒压的条件下进行反应,下列事实能作为该反应达到平衡的依 ②铍及其化合物的性质与处于周期表对角线的铝相似。
据的是 (填字母)。
回答下列问题:
A. (乙苯) (苯乙烯)
(1)“熔炼”的目的是通过改变绿柱石晶相中的稳定结构增强其反应活性,气体A是
B.容器内气体密度不再变化 。
C.容器内苯乙烯与H 的分子数之比不再变化 (2)为了提高“溶浸”效率,可以采取的措施是 (任写一
2
5
学科网(北京)股份有限公司种)。 (6)取少量产品溶于足量稀盐酸,静置,取上层清液,滴加 BaCl 溶液,若出现沉淀,说明含有
2
NaSO 杂质
2 4
(3)“沉铁”时需加氨水调pH为5.2,此时滤液中 为 。
16.(1) ①C、O ② 铜失去一个电子后变为3d10,为全充满的稳定状态,因此再失去一个电
(4)“沉铍”时若使用过量的NaOH溶液,将导致铍的产率降低,用离子方程式解释原因 子(即第二电离)需要更高的能量。而镍失去一个电子后变为3d84s1,其4s轨道上只有一个电子,相
。 对较不稳定,因此第二电离能较低
(5)“灼烧”的化学方程式为 。 (2)BC
(3)AD
(6)“高温反应”需在氩气氛围中进行,必须隔绝空气的理由是 。
(7)该流程中能循环使用的物质有HF、NH 和 (填化学式)。
3
(4) 12
(5)
17.(1) > = ABD
(2) (g)+CO (g) (g)+CO(g)+HO(g) 50%
2 2
六安一中 2025 届高三年级第四次月考
化学试卷参考答案
18.(1)CO
2
题号 1 2 3 4 5 6 7 8 (2)搅拌、升高温度或适当提高酸的浓度,合理即可
答案 B B C D A A A B
(3)
题号 9 10 11 12 13 14
答案 C D B D B C
(4) 或Be2++4OH-=BeO 2-+2H O或Be(OH) +2OH-=BeO2-+2H O
2 2 2 2 2
15.Ⅰ(1)Na 2 SO 3 +H 2 SO 4 (浓)=Na 2 SO 4 +H 2 O+SO 2 ↑ (5)
(2)干燥管(或球形干燥管)
(6)高温下空气中的氧气等物质可与镁或铍反应,从而降低产率
(3)未出现丁达尔效应或未观察到明显光路
(7)(NH )SO
4 2 4
(4)B
(5)Na SO +S=Na SO
2 3 2 2 3
6
学科网(北京)股份有限公司