文档内容
姓名 座位号
(在此卷上答题无效)
绝密 ★ 启用前
2025 年“江南十校”高二年级 5 月份阶段联考
化 学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号框涂黑。如
需改动,用橡皮擦干净后,再选涂其他答案标号框。回答非选择题时,将答案写在答题卡上,写
在本试卷上无效。
3.考试结束后,将答题卡交回。
可能用到的相对分子质量:H1 C12 O16 F19 Na23 S32 K39 Ni59
一、选择题:本大题共14小题,每小题3分,共42分,在每小题给出的四个选项中,只有一个
选项符合题目要求。
1.化学与生活、科技及环境密切相关。下列说法正确的是
A.利用二氧化碳为原料人工合成淀粉,有助于实现“碳达峰”和“碳中和”
B.粗铜提纯采用电解法,电解精炼铜时精铜作阳极
C.太阳电池采用的碳纤维框架和玻璃纤维网,二者均为有机物
D.二氧化硫和氯水都有漂白性,两者混用漂白效果更好
2.下列化学用语或表述正确的是
A.反-2-丁烯的键线式:
B.乙醚的结构简式:CH OCH
3 3
C.BF 的空间结构:平面三角形
3
D.一元酸次磷酸(H PO )的结构简式:
3 2
3.锗酸盐(如NaGeO)用于制备特种玻璃、半导体材料或催化剂载体。下列说法正确的是
2 3
A.半径:r(Na+)>r(O2-)
B.Ge位于元素周期表中p区
C.第一电离能:I (Na)>I (O)
1 1
D.沸点:NaHH SO
0.1mol/L的CH COONa的溶液的pH值 3 2 3
3
向5mL0.1mol/LNaOH溶液中依次滴加5滴同浓度
C 0.1mol/L的MgCl 溶液和CuCl 溶液,先产生白色沉 Ksp[Mg(OH) ]>Ksp[Cu(OH) ]
2 2 2 2
淀,再产生蓝色沉淀
向0.05mol/LCuSO 溶液中加入少量NaCl固体, 溶液 发生了[Cu(H O) ]2+到[CuCl ]2-
4 2 4 4
D
由蓝色变为黄绿色。 的转化
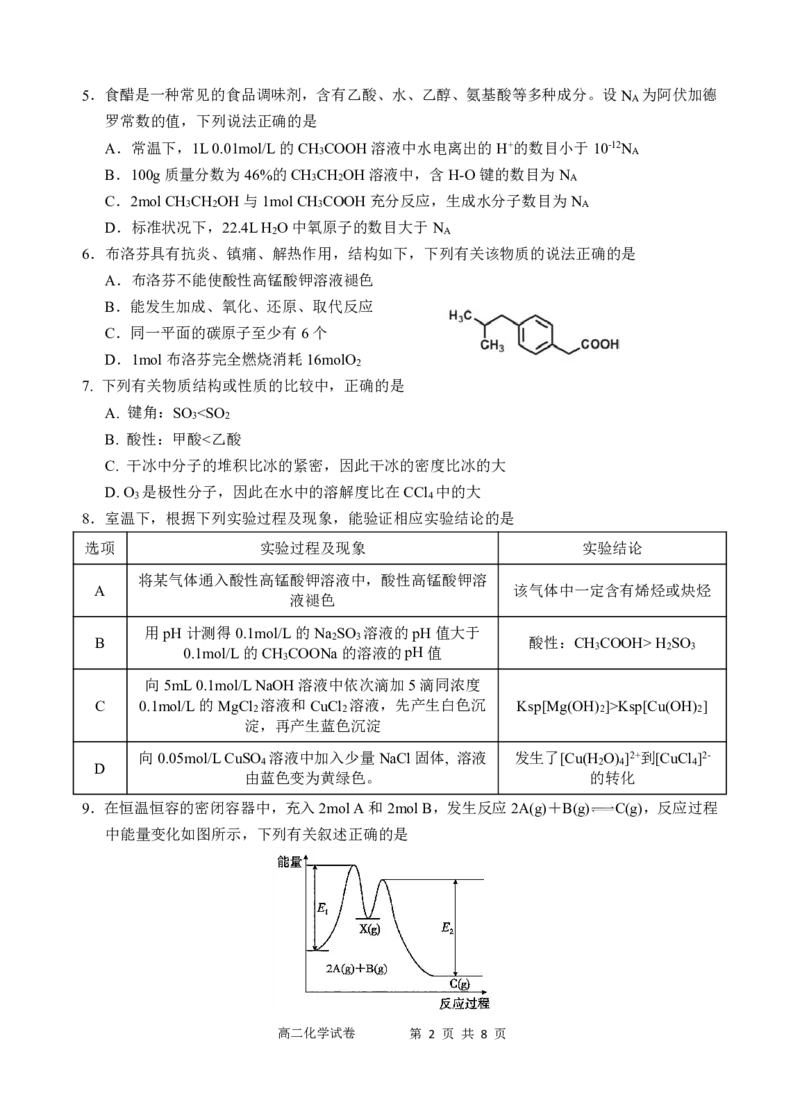
9.在恒温恒容的密闭容器中,充入2molA和2molB,发生反应2A(g)+B(g) C(g),反应过程
中能量变化如图所示,下列有关叙述正确的是
高二化学试卷 第 2 页 共 8 页A.当B的体积分数不变,2A(g)+B(g) C(g)反应达到平衡状态
B.X是反应2A(g)+B(g) C(g)的催化剂
C.平衡后,再充入1molA和1molB,再次平衡C的浓度大于原平衡C的浓度1.5倍
D.平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
10.下列有关电解质溶液的说法正确的是
已知H C O 的电离常数K =5.6×10-2、K =1.5×10-4,K (HCN)=4.9×10-10,K (HF)=6.6×10-4,
2 2 4 a1 a2 a a
K (NH ·H O)=1.8×10-5
b 3 2
A. 物质的量浓度均为0.1mol/L的下列溶液中:①NH Cl、②NH F、③NH ·H O、④(NH ) SO 、
4 4 3 2 4 2 4
⑤(NH ) Fe(SO ) ,c(NH+)大小⑤>④>①>③>②
4 2 4 2 4
B.pH相等的KF溶液与NaCN溶液:c(K+)-c(F-)=c(Na+)-c(CN-)
C.浓度相等的HF、NaF的混合溶液:c(F-)+c(OH-)<c(H+)+c(HF)
D.NaHC O 的溶液中存在c(Na+)>c(HC O -)>c(OH-)>c(C O 2-)
2 4 2 4 2 4
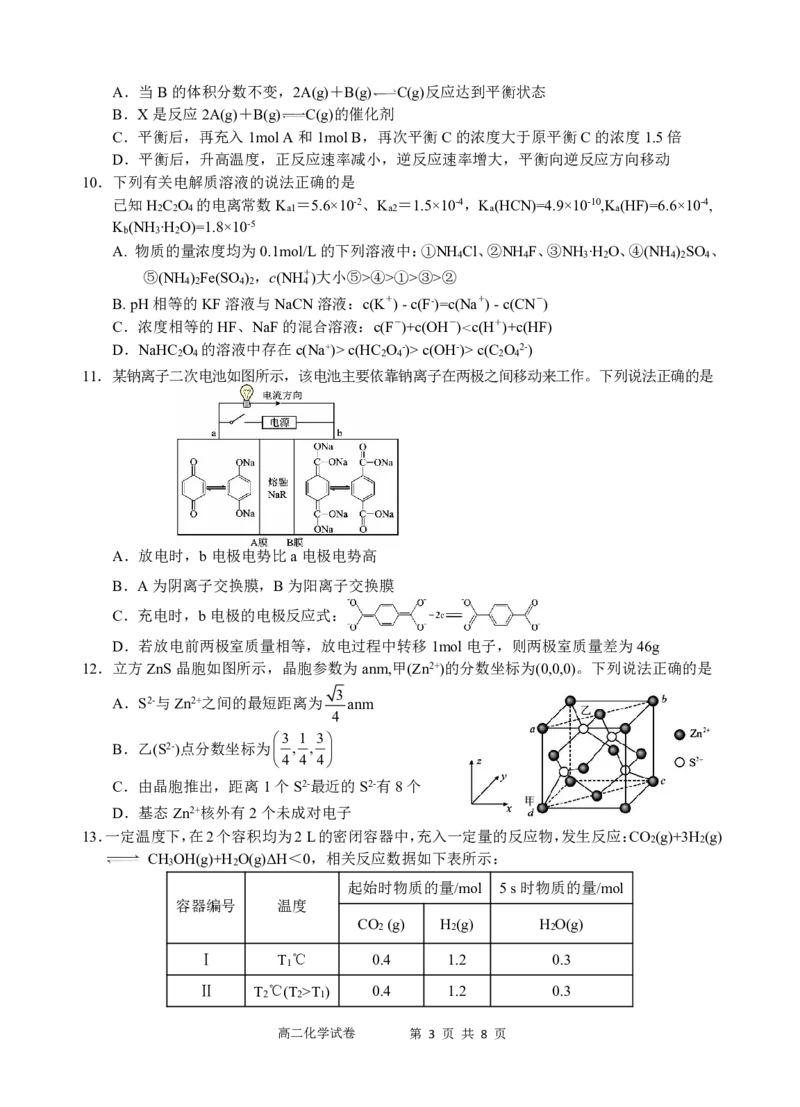
11.某钠离子二次电池如图所示,该电池主要依靠钠离子在两极之间移动来工作。下列说法正确的是
A.放电时,b电极电势比a电极电势高
B.A为阴离子交换膜,B为阳离子交换膜
C.充电时,b电极的电极反应式:
D.若放电前两极室质量相等,放电过程中转移1mol电子,则两极室质量差为46g
12.立方ZnS晶胞如图所示,晶胞参数为anm,甲(Zn2+)的分数坐标为(0,0,0)。下列说法正确的是
3
A.S2-与Zn2+之间的最短距离为 anm
4
3 1 3
B.乙(S2-)点分数坐标为 , ,
4 4 4
C.由晶胞推出,距离1个S2-最近的S2-有8个
D.基态Zn2+核外有2个未成对电子
13.一定温度下,在2个容积均为2L的密闭容器中,充入一定量的反应物,发生反应:CO (g)+3H (g)
2 2
CH OH(g)+H O(g)ΔH<0,相关反应数据如下表所示:
3 2
起始时物质的量/mol 5s时物质的量/mol
容器编号 温度
CO (g) H (g) H O(g)
2 2 2
Ⅰ T ℃ 0.4 1.2 0.3
1
Ⅱ T ℃(T >T ) 0.4 1.2 0.3
2 2 1
高二化学试卷 第 3 页 共 8 页下列说法正确的是( )
A.5s时,容器Ⅰ中化学反应速率v(CO )=0.03mol/(L·s)
2
B.反应过程中相同时间内容器Ⅰ中CO 转化率可能大于H 转化率
2 2
C.化学平衡常数:K >K
Ⅱ Ⅰ
D.若起始时,向容器Ⅱ中充入0.1molCO (g)、0.2molH (g)、0.2molCH OH(g)和0.3mol
2 2 3
H O(g),反应将向逆反应方向进行
2
14.25℃时,向20.00mL0.1mol·L-1CH COOH溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水
3
电离出的c (H+)的负对数[-lgc (H+)]与所加NaOH溶液体积的关系如图所示。下列说法中
水 水
正确的是
A.常温下,K (CH COOH)约为10-6
a 3
B.图中M、N、P三点对应溶液中 逐渐减小
C.M点溶液中c(Na+)=c(CH COO-)+c(CH COOH)
3 3
D.P点溶液中c(Na+)=c(CH COO-)
3
二、非选择题:本大题共4个小题,共58分。
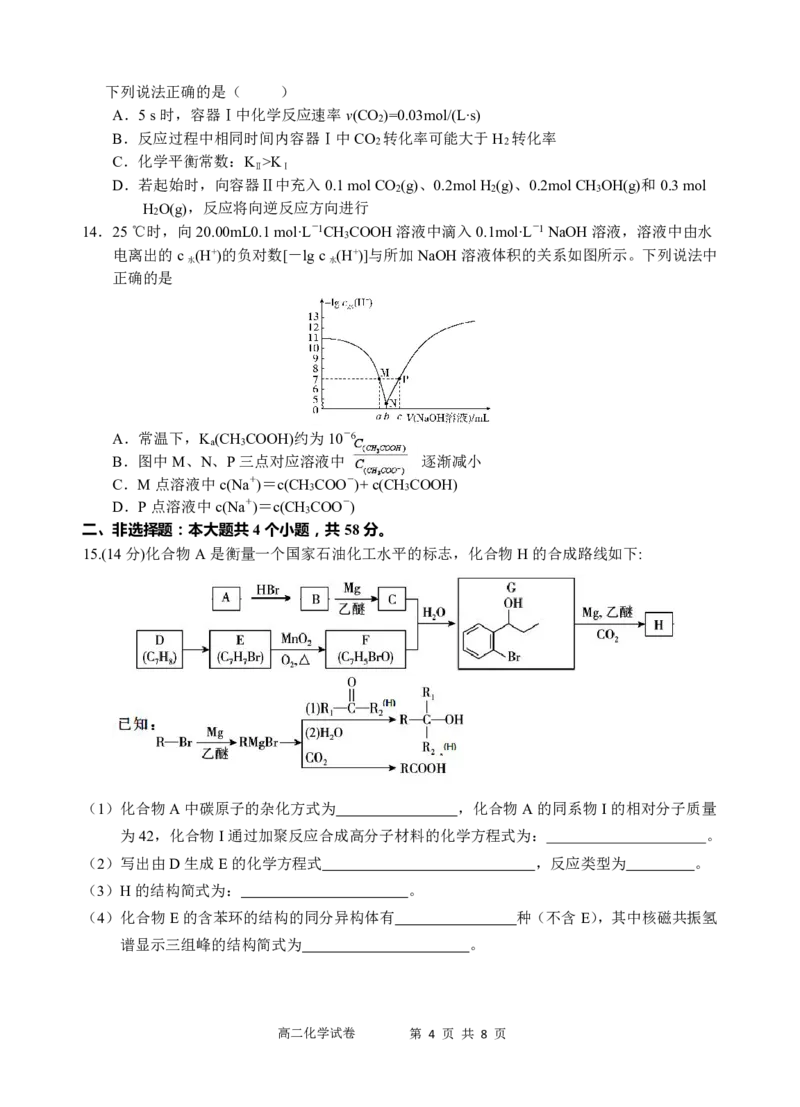
15.(14分)化合物A是衡量一个国家石油化工水平的标志,化合物H的合成路线如下:
(1)化合物A中碳原子的杂化方式为 ,化合物A的同系物I的相对分子质量
为42,化合物I通过加聚反应合成高分子材料的化学方程式为: 。
(2)写出由D生成E的化学方程式 ,反应类型为 。
(3)H的结构简式为: 。
(4)化合物E的含苯环的结构的同分异构体有 种(不含E),其中核磁共振氢
谱显示三组峰的结构简式为 。
高二化学试卷 第 4 页 共 8 页16. (14分)氮氧化物是大气主要污染物之一,富氧条件下甲烷催化还原氮氧化物具有广阔前景。
已知:
反应1:CH (g)+4NO(g) 2N (g)+CO (g)+2H O(g) ∆H =-1160kJ·mol-1
4 2 2 2 1
反应2:CH (g)+2O (g) CO (g)+2H O(g) ∆H
4 2 2 2 2
回答下列问题:
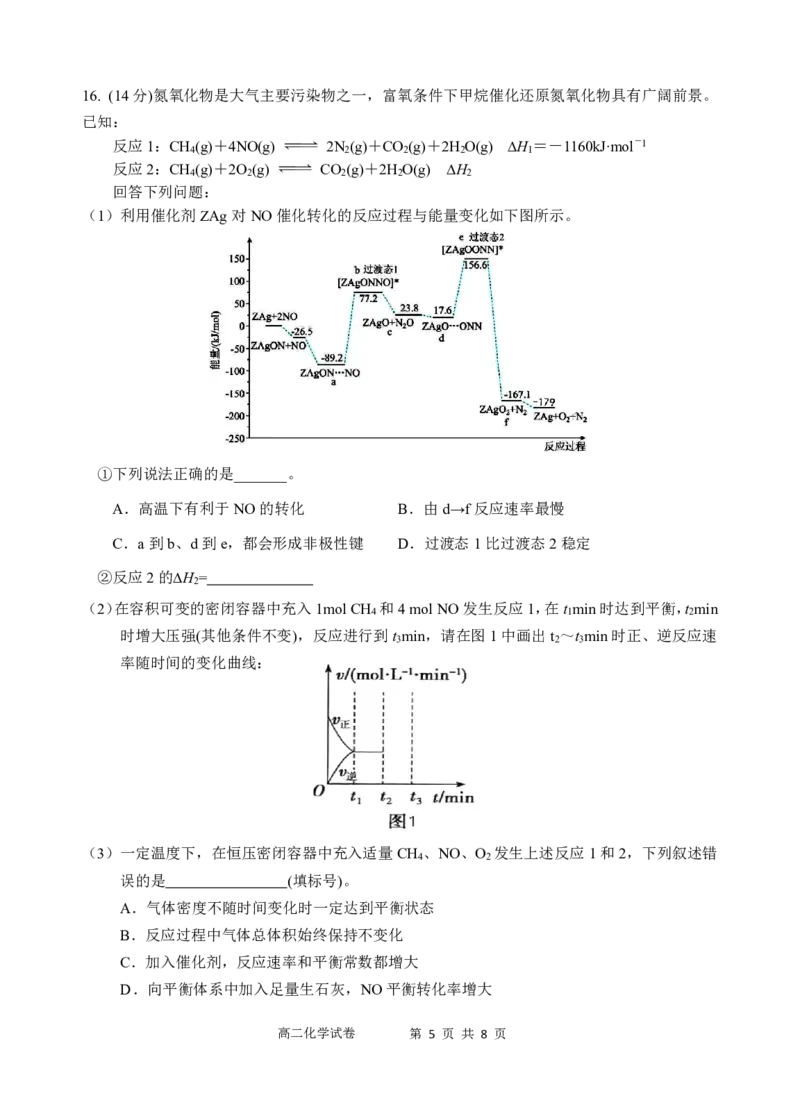
(1)利用催化剂ZAg对NO催化转化的反应过程与能量变化如下图所示。
①下列说法正确的是_______。
A.高温下有利于NO的转化 B.由d→f反应速率最慢
C.a到b、d到e,都会形成非极性键 D.过渡态1比过渡态2稳定
②反应2的∆H =
2
(2)在容积可变的密闭容器中充入1molCH 和4molNO发生反应1,在t min时达到平衡,t min
4 1 2
时增大压强(其他条件不变),反应进行到t min,请在图1中画出t ~t min时正、逆反应速
3 2 3
率随时间的变化曲线:
(3)一定温度下,在恒压密闭容器中充入适量CH 、NO、O 发生上述反应1和2,下列叙述错
4 2
误的是 (填标号)。
A.气体密度不随时间变化时一定达到平衡状态
B.反应过程中气体总体积始终保持不变化
C.加入催化剂,反应速率和平衡常数都增大
D.向平衡体系中加入足量生石灰,NO平衡转化率增大
高二化学试卷 第 5 页 共 8 页(4)甲烷燃烧反应对甲烷还原氮氧化物有一定的影响。在一定条件下,某实验小组模拟CH 选
4
择性催化还原大气中的NO,起始按 n(NO) =4充入NO、CH 和适量O ,在催化剂作用下
4 2
n(CH )
4
充分反应,相同时间内CH 转化率及NO去除率随温度变化关系如图2所示。
4
表示CH 转化率的是 (填“L ”或“L ”)。温度高于550℃时,L 曲线随着温度升
4 1 2 2
高而下降的原因可能是 (写出一条即可)。
(5)在压强为akPa下,向密闭反应器中按 n(NO) =4充入NO和CH ,发生反应1,测得平衡
4
n(CH )
4
时CH 、NO、N 和CO 的物质的量分数与温度关系如图3所示。
4 2 2
L 曲线代表的物质是 (填化学式)。350℃时反应1的甲烷的平衡转化率
3
为50%,该温度下反应1平衡常数K 为 。(用平衡分压表示平衡常数)
p
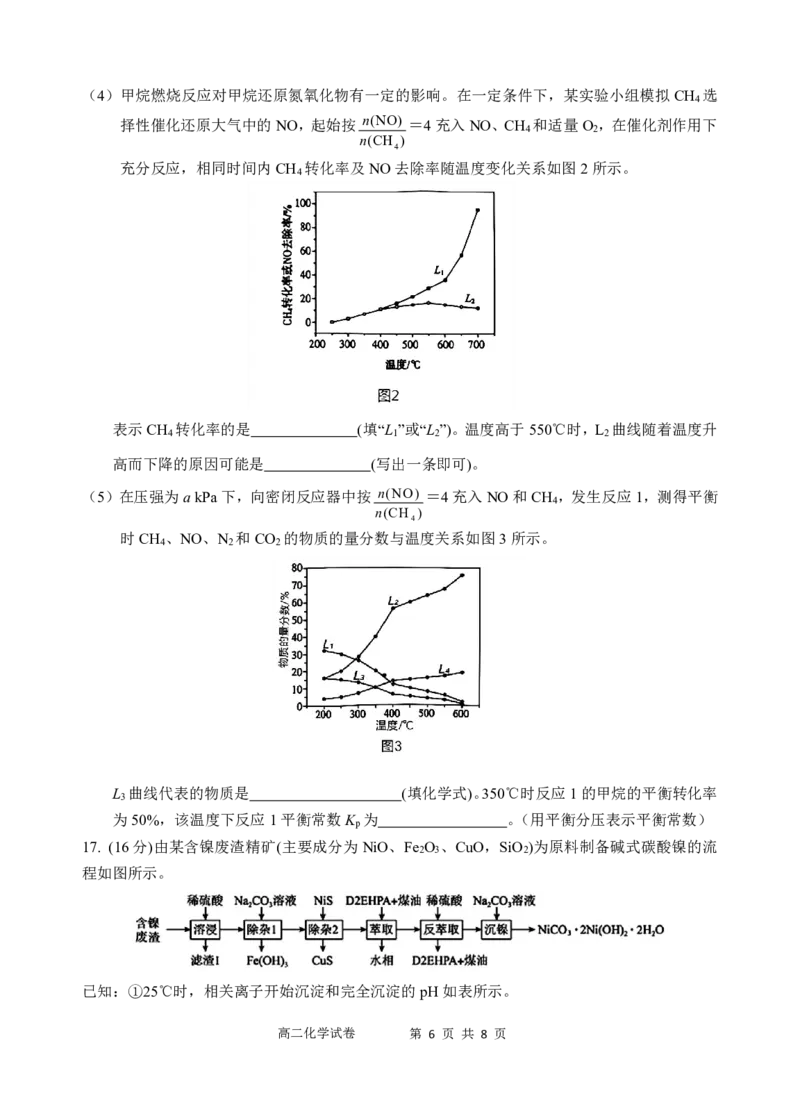
17. (16分)由某含镍废渣精矿(主要成分为NiO、Fe O 、CuO,SiO )为原料制备碱式碳酸镍的流
2 3 2
程如图所示。
已知:①25℃时,相关离子开始沉淀和完全沉淀的pH如表所示。
高二化学试卷 第 6 页 共 8 页离子 Fe3+ Ni2+ Cu2+
开始沉淀时的pH 2.2 6.4 4.4
完全沉淀时的pH 3.5 8.4 6.7
②25℃Ksp(NiS)=1.0×10-27;Ksp(CuS)=8.0×10-35;K>105时反应几乎完全进行。
回答下列问题:
(1)提升“溶浸”速率的方法有 (任写两种)。
(2)“除杂1”时应调节溶液的pH范围为 。
(3)用化学用语及必要的文字说明“除杂2”时NiS能去除Cu2+的原因 。
(4)“萃取”和“反萃取”的最终目的是富集获得含有 (填化学式)的水溶液。
(5)“沉镍”时应控制温度为95℃,反应除生成NiCO ·2Ni(OH) ·2H O沉淀外,还有一种无色
3 2 2
气体生成,写出该反应的化学方程式: 。
(6)配合物 Ni(CO) 能够和 PCl 发生配体置换反应:Ni(CO) +4PCl =Ni(PCl ) +4CO↑
4 3 4 3 3 4
①Ni(CO) 为无色挥发性液体,可推测Ni(CO) 的晶体类型是 ,
4 4
Ni(CO) 中δ键与π键的个数比为 。
4
②与CO互为等电子体且带 1 个单位的负电荷的阴离子的
电子式为 。
③PCl 分子空间构型为 _°
3
④Ni、K、F三种元素组成的一种晶体的长方体晶胞如图所示,若
该晶体的密度为ρg/cm3,则阿伏伽德罗常数N = 。
A
(用abρ的式子表示)
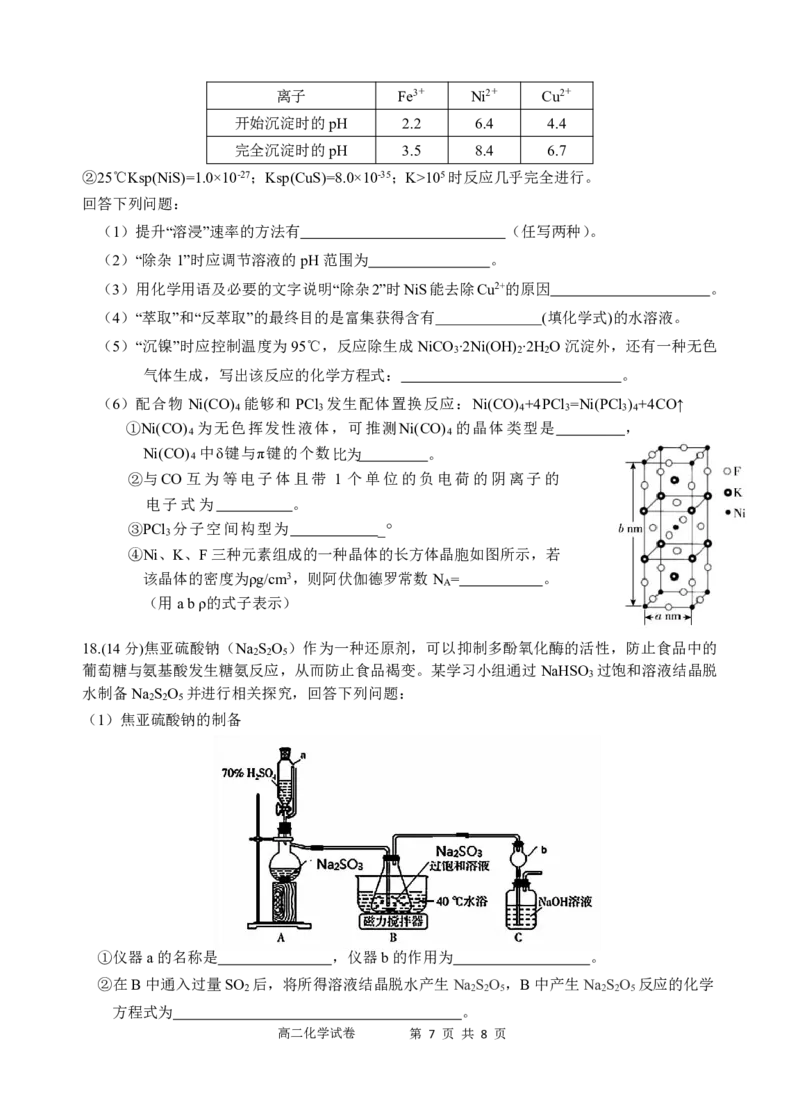
18.(14分)焦亚硫酸钠(Na
2
S
2
O
5
)作为一种还原剂,可以抑制多酚氧化酶的活性,防止食品中的
葡萄糖与氨基酸发生糖氨反应,从而防止食品褐变。某学习小组通过NaHSO 过饱和溶液结晶脱
3
水制备Na S O 并进行相关探究,回答下列问题:
2 2 5
(1)焦亚硫酸钠的制备
①仪器a的名称是 ,仪器b的作用为 。
②在B中通入过量SO 后,将所得溶液结晶脱水产生Na S O ,B中产生Na S O 反应的化学
2 2 2 5 2 2 5
方程式为 。
高二化学试卷 第 7 页 共 8 页③将粗品依次用SO 饱和溶液、无水乙醇洗涤、干燥,制得Na S O 粗品,其中使用无水乙醇
2 2 2 5
的优点为 。
(2)测定产品的纯度
此方法制得的Na S O 粗品因分解混有Na SO 杂质,为了测定粗品中Na S O 的含量,称量
2 2 5 2 3 2 2 5
4.430g粗品配成250mL溶液,量取25.00mL所配溶液,滴入几滴淀粉溶液,用0.2000mol/L
标准I 溶液滴定(氧化产物为SO 2-)。
2 4
①滴定管盛装好I 标准溶液后需排气泡,下列排气泡的操作正确的是 (填序号)。
2
②滴定终点的现象为 。
③下列操作中,使测定的产品中含量数值偏低的是 (填字母)。
a.滴定过程中振荡时有液滴溅出
b.配制I 标准溶液,定容时仰视刻度线读数
2
c.盛装I 标准溶液的滴定管用水洗涤后未润洗就直接注入I 标准溶液
2 2
d.读取I 标准溶液体积时,开始时仰视读数,滴定结束时俯视读数
2
④若达到滴定终点时测得消耗标准溶液的体积平均为22.50mL,则粗品中Na S O 的质量分数
2 2 5
分数为 。(保留三位有效数字)
高二化学试卷 第 8 页 共 8 页