文档内容
优高联考
高三化学试题
2024.11
主考学校:庆云一中
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷
上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 K 39 Fe 56 Ce 140
第Ⅰ卷(选择题共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.下列过程中涉及氧化还原反应的是( )
A.大理石制砚台 B.乙醚浸取青蒿素 C.石膏溶液点制豆腐 D.松木闷烧制墨
2.化学品在食品工业中也有重要应用,下列说法错误的是( )
A.生石灰可用作食品干燥剂 B.活性炭可用作食品脱色剂
C. 可用作食品单一膨松剂 D.维生素C可用作食品抗氧化剂
3.下列实验操作或处理方法正确的是( )
A.金属K着火,用湿抹布灭火
B.用干燥的pH试纸测定NaClO溶液的pH
C.大量氯气泄漏时,用小苏打水浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D.浓硫酸沾到皮肤上时,先立即用大量水冲洗,再涂上3%~5%的NaOH溶液
4.下列物质的鉴别方法中,不可行的是( )
A. 和 澄清石灰水B.氯化钠和氯化钾:焰色试验
C.过氧化钠和硫黄:加水,振荡 D.含石蕊的烧碱溶液和 溶液:盐酸
5.对于下列过程中发生的化学反应,相应方程式正确的是( )
A.铅蓄电池放电时的负极反应:
B.硫化钠溶液在空气中氧化变质:
C.用 溶液将水垢中的 转化为溶于酸的
D.试管壁上的银镜用稀硝酸清洗:6.物质性质决定用途,下列两者对应关系正确的是( )
A.液氨断键需要吸收大量的热,可用作制冷剂
B.纳米 具有磁性,可用作磁性材料
C.钠钾合金密度小,可用作核反应堆的导热剂
D.铁比铜金属性强,用 溶液腐蚀Cu刻制电路板
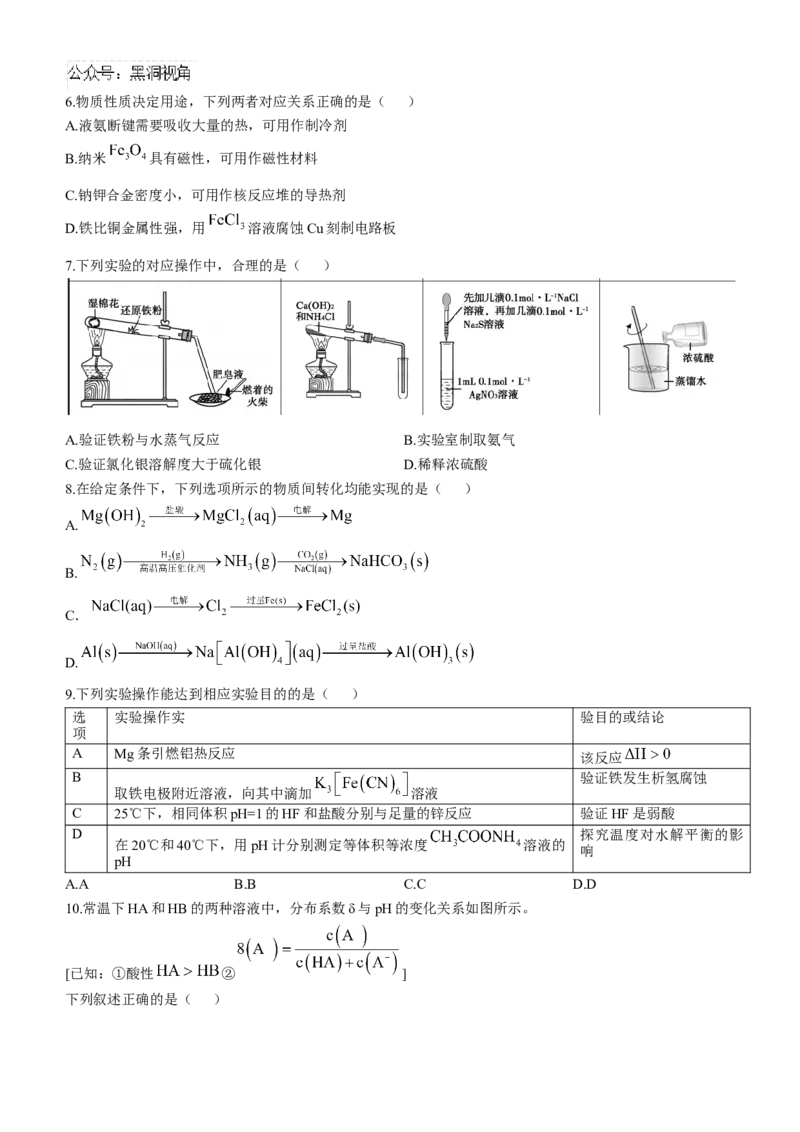
7.下列实验的对应操作中,合理的是( )
A.验证铁粉与水蒸气反应 B.实验室制取氨气
C.验证氯化银溶解度大于硫化银 D.稀释浓硫酸
8.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.
B.
C.
D.
9.下列实验操作能达到相应实验目的的是( )
选 实验操作实 验目的或结论
项
A Mg条引燃铝热反应
该反应
B 验证铁发生析氢腐蚀
取铁电极附近溶液,向其中滴加 溶液
C 25℃下,相同体积pH=1的HF和盐酸分别与足量的锌反应 验证HF是弱酸
D 探究温度对水解平衡的影
在20℃和40℃下,用pH计分别测定等体积等浓度 溶液的
响
pH
A.A B.B C.C D.D
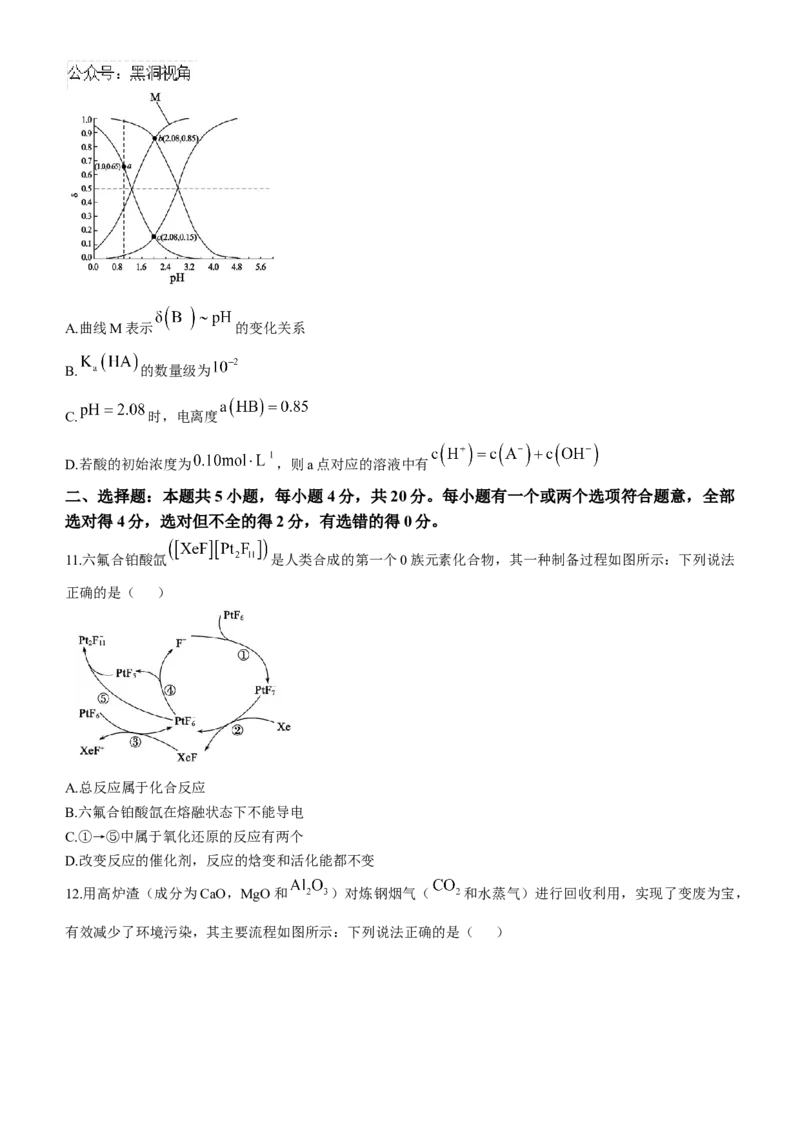
10.常温下HA和HB的两种溶液中,分布系数δ与pH的变化关系如图所示。
[已知:①酸性 ② ]
下列叙述正确的是( )A.曲线M表示 的变化关系
B. 的数量级为
C. 时,电离度
D.若酸的初始浓度为 ,则a点对应的溶液中有
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部
选对得4分,选对但不全的得2分,有选错的得0分。
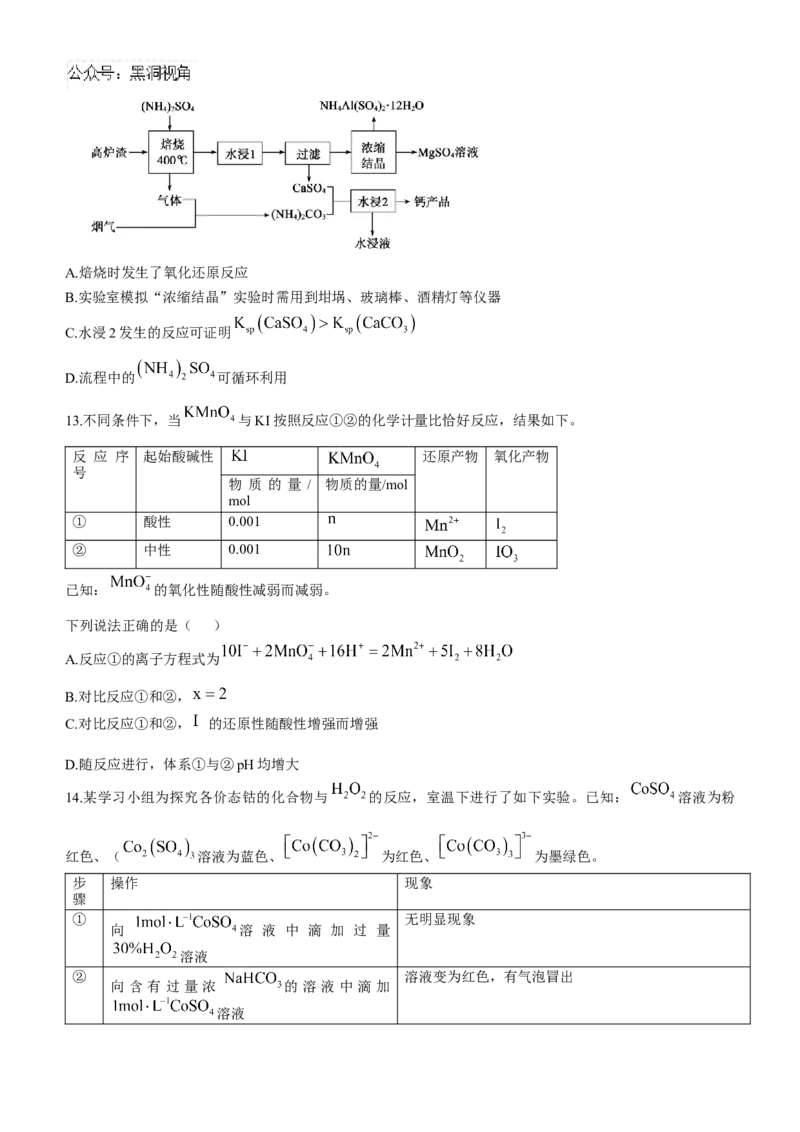
11.六氟合铂酸氙 是人类合成的第一个0族元素化合物,其一种制备过程如图所示:下列说法
正确的是( )
A.总反应属于化合反应
B.六氟合铂酸氙在熔融状态下不能导电
C.①→⑤中属于氧化还原的反应有两个
D.改变反应的催化剂,反应的焓变和活化能都不变
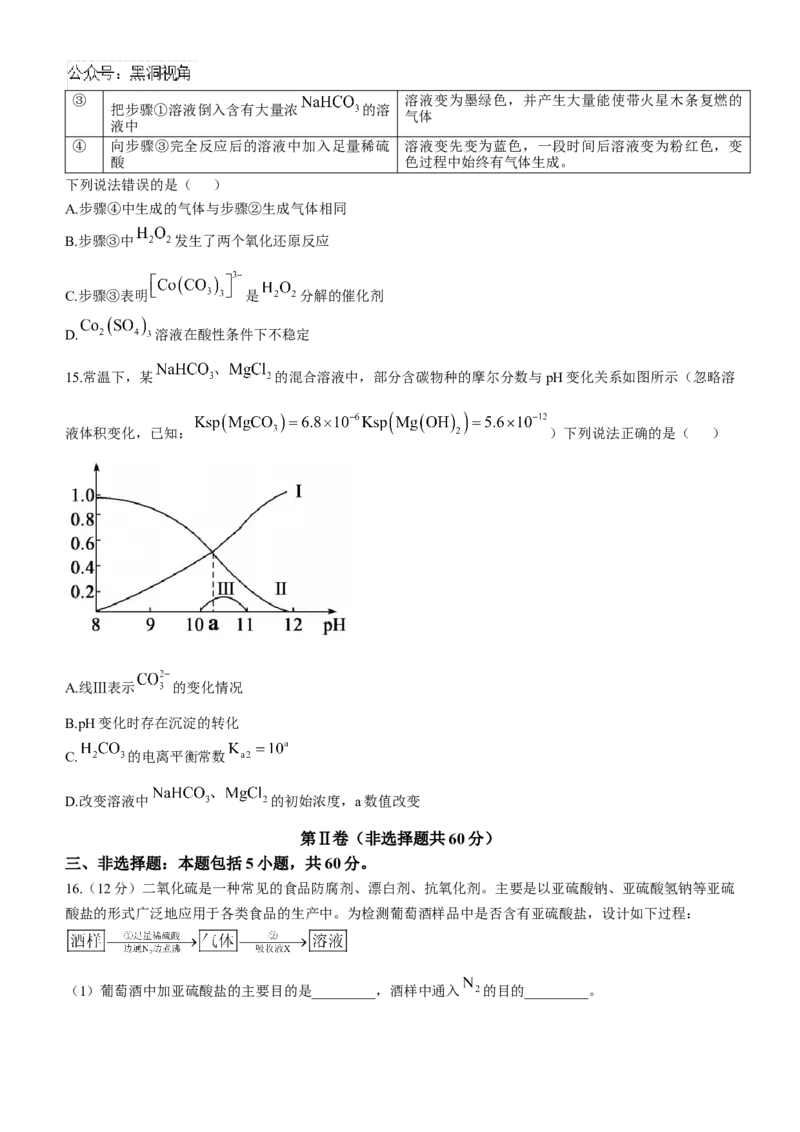
12.用高炉渣(成分为CaO,MgO和 )对炼钢烟气( 和水蒸气)进行回收利用,实现了变废为宝,
有效减少了环境污染,其主要流程如图所示:下列说法正确的是( )A.焙烧时发生了氧化还原反应
B.实验室模拟“浓缩结晶”实验时需用到坩埚、玻璃棒、酒精灯等仪器
C.水浸2发生的反应可证明
D.流程中的 可循环利用
13.不同条件下,当 与KI按照反应①②的化学计量比恰好反应,结果如下。
反 应 序 起始酸碱性 还原产物 氧化产物
号
物 质 的 量 / 物质的量/mol
mol
① 酸性 0.001
② 中性 0.001
已知: 的氧化性随酸性减弱而减弱。
下列说法正确的是( )
A.反应①的离子方程式为
B.对比反应①和②,
C.对比反应①和②, 的还原性随酸性增强而增强
D.随反应进行,体系①与②pH均增大
14.某学习小组为探究各价态钴的化合物与 的反应,室温下进行了如下实验。已知: 溶液为粉
红色、( 溶液为蓝色、 为红色、 为墨绿色。
步 操作 现象
骤
① 无明显现象
向 溶 液 中 滴 加 过 量
溶液
② 溶液变为红色,有气泡冒出
向 含 有 过 量 浓 的 溶 液 中 滴 加
溶液③ 溶液变为墨绿色,并产生大量能使带火星木条复燃的
把步骤①溶液倒入含有大量浓 的溶
气体
液中
④ 向步骤③完全反应后的溶液中加入足量稀硫 溶液变先变为蓝色,一段时间后溶液变为粉红色,变
酸 色过程中始终有气体生成。
下列说法错误的是( )
A.步骤④中生成的气体与步骤②生成气体相同
B.步骤③中 发生了两个氧化还原反应
C.步骤③表明 是 分解的催化剂
D. 溶液在酸性条件下不稳定
15.常温下,某 的混合溶液中,部分含碳物种的摩尔分数与pH变化关系如图所示(忽略溶
液体积变化,已知: )下列说法正确的是( )
A.线Ⅲ表示 的变化情况
B.pH变化时存在沉淀的转化
C. 的电离平衡常数
D.改变溶液中 的初始浓度,a数值改变
第Ⅱ卷(非选择题共60分)
三、非选择题:本题包括5小题,共60分。
16.(12分)二氧化硫是一种常见的食品防腐剂、漂白剂、抗氧化剂。主要是以亚硫酸钠、亚硫酸氢钠等亚硫
酸盐的形式广泛地应用于各类食品的生产中。为检测葡萄酒样品中是否含有亚硫酸盐,设计如下过程:
(1)葡萄酒中加亚硫酸盐的主要目的是_________,酒样中通入 的目的_________。(2)检验气体中是否含有 的基本操作是_________。
(3)若吸收液用NaOH溶液,当溶液 时溶液中的离子浓度大小关系为_________,过程中发生的主
要反应有_________、_________。(已知: , )
(4)若吸收液用 溶液,吸收过程中产生了 沉淀,请计算 的
平衡常数 _________。(已知: )
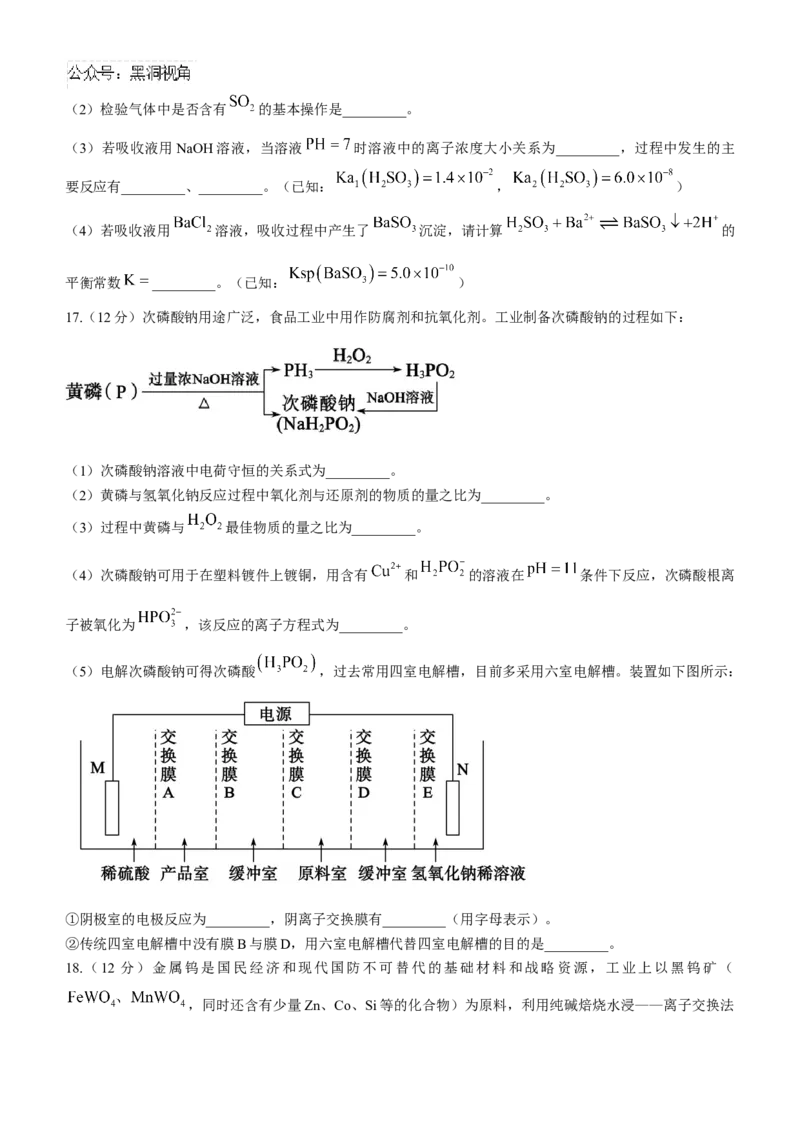
17.(12分)次磷酸钠用途广泛,食品工业中用作防腐剂和抗氧化剂。工业制备次磷酸钠的过程如下:
(1)次磷酸钠溶液中电荷守恒的关系式为_________。
(2)黄磷与氢氧化钠反应过程中氧化剂与还原剂的物质的量之比为_________。
(3)过程中黄磷与 最佳物质的量之比为_________。
(4)次磷酸钠可用于在塑料镀件上镀铜,用含有 和 的溶液在 条件下反应,次磷酸根离
子被氧化为 ,该反应的离子方程式为_________。
(5)电解次磷酸钠可得次磷酸 ,过去常用四室电解槽,目前多采用六室电解槽。装置如下图所示:
①阴极室的电极反应为_________,阴离子交换膜有_________(用字母表示)。
②传统四室电解槽中没有膜B与膜D,用六室电解槽代替四室电解槽的目的是_________。
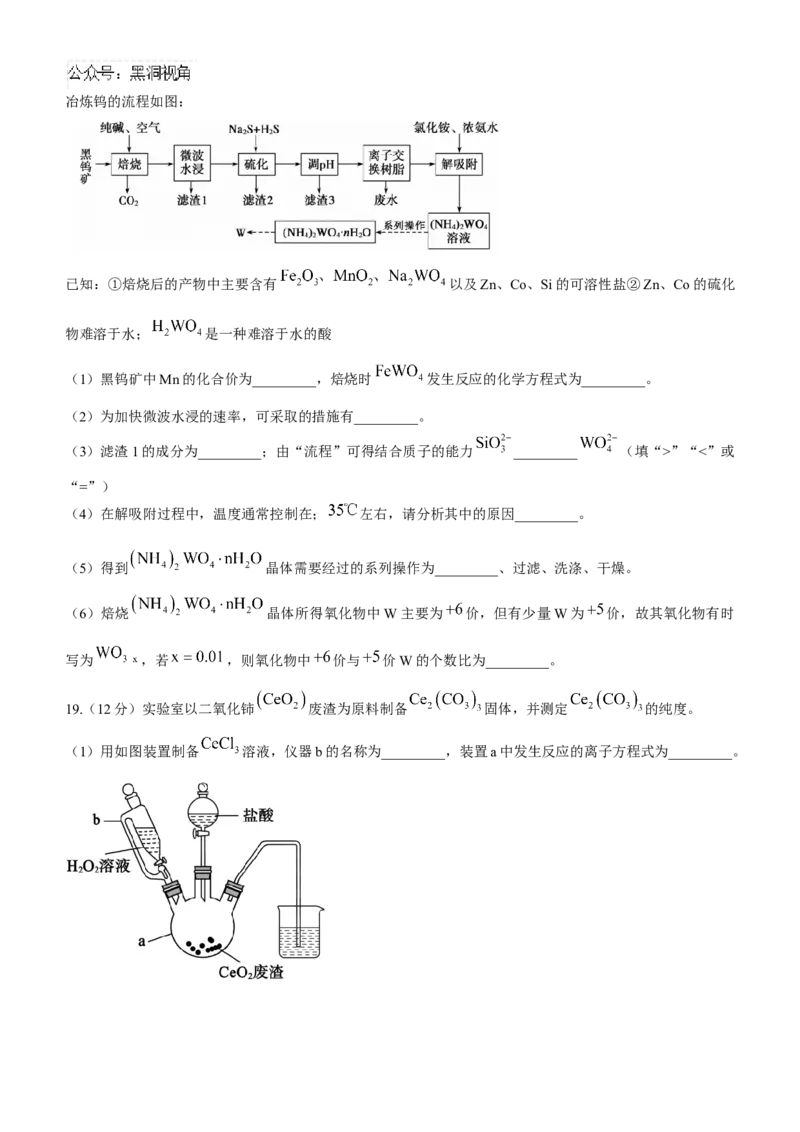
18.(12 分)金属钨是国民经济和现代国防不可替代的基础材料和战略资源,工业上以黑钨矿(
,同时还含有少量Zn、Co、Si等的化合物)为原料,利用纯碱焙烧水浸——离子交换法冶炼钨的流程如图:
已知:①焙烧后的产物中主要含有 以及Zn、Co、Si的可溶性盐②Zn、Co的硫化
物难溶于水; 是一种难溶于水的酸
(1)黑钨矿中Mn的化合价为_________,焙烧时 发生反应的化学方程式为_________。
(2)为加快微波水浸的速率,可采取的措施有_________。
(3)滤渣1的成分为_________;由“流程”可得结合质子的能力 _________ (填“>”“<”或
“=”)
(4)在解吸附过程中,温度通常控制在; 左右,请分析其中的原因_________。
(5)得到 晶体需要经过的系列操作为_________、过滤、洗涤、干燥。
(6)焙烧 晶体所得氧化物中W主要为 价,但有少量W为 价,故其氧化物有时
写为 ,若 ,则氧化物中 价与 价W的个数比为_________。
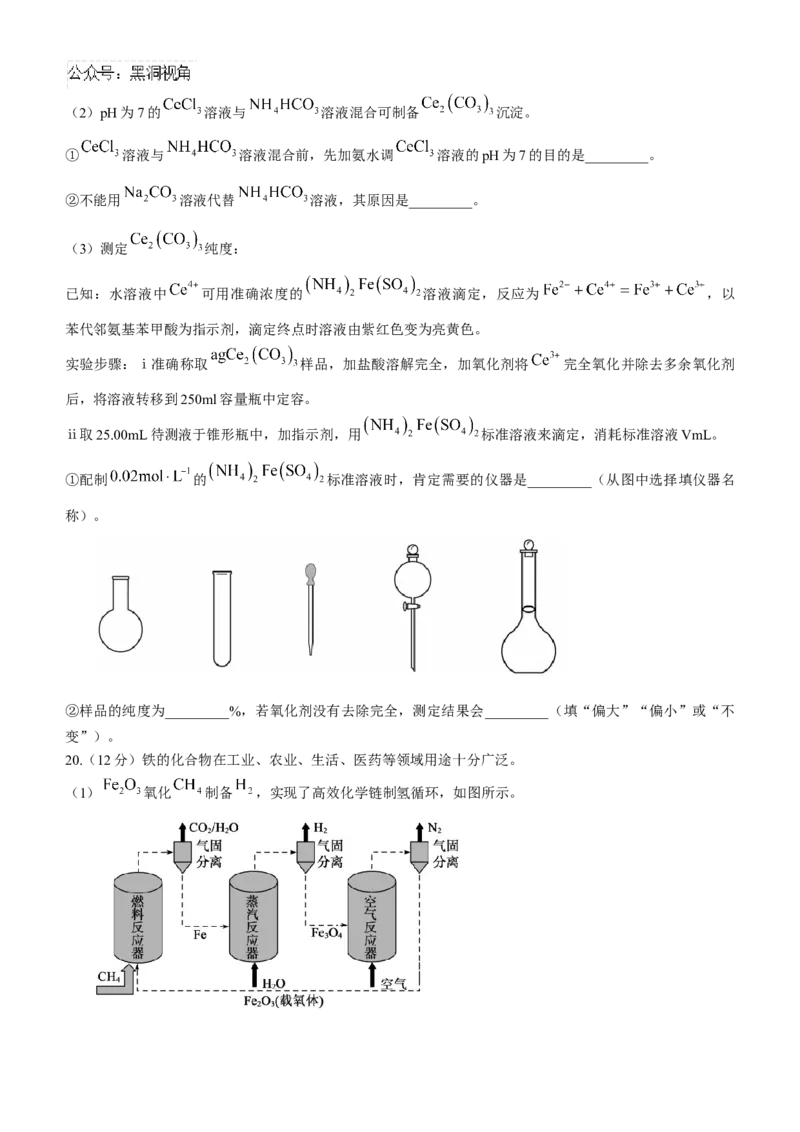
19.(12分)实验室以二氧化铈 废渣为原料制备 固体,并测定 的纯度。
(1)用如图装置制备 溶液,仪器b的名称为_________,装置a中发生反应的离子方程式为_________。(2)pH为7的 溶液与 溶液混合可制备 沉淀。
① 溶液与 溶液混合前,先加氨水调 溶液的pH为7的目的是_________。
②不能用 溶液代替 溶液,其原因是_________。
(3)测定 纯度:
已知:水溶液中 可用准确浓度的 溶液滴定,反应为 ,以
苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色。
实验步骤:ⅰ准确称取 样品,加盐酸溶解完全,加氧化剂将 完全氧化并除去多余氧化剂
后,将溶液转移到250ml容量瓶中定容。
ⅱ取25.00mL待测液于锥形瓶中,加指示剂,用 标准溶液来滴定,消耗标准溶液VmL。
①配制 的 标准溶液时,肯定需要的仪器是_________(从图中选择填仪器名
称)。
②样品的纯度为_________%,若氧化剂没有去除完全,测定结果会_________(填“偏大”“偏小”或“不
变”)。
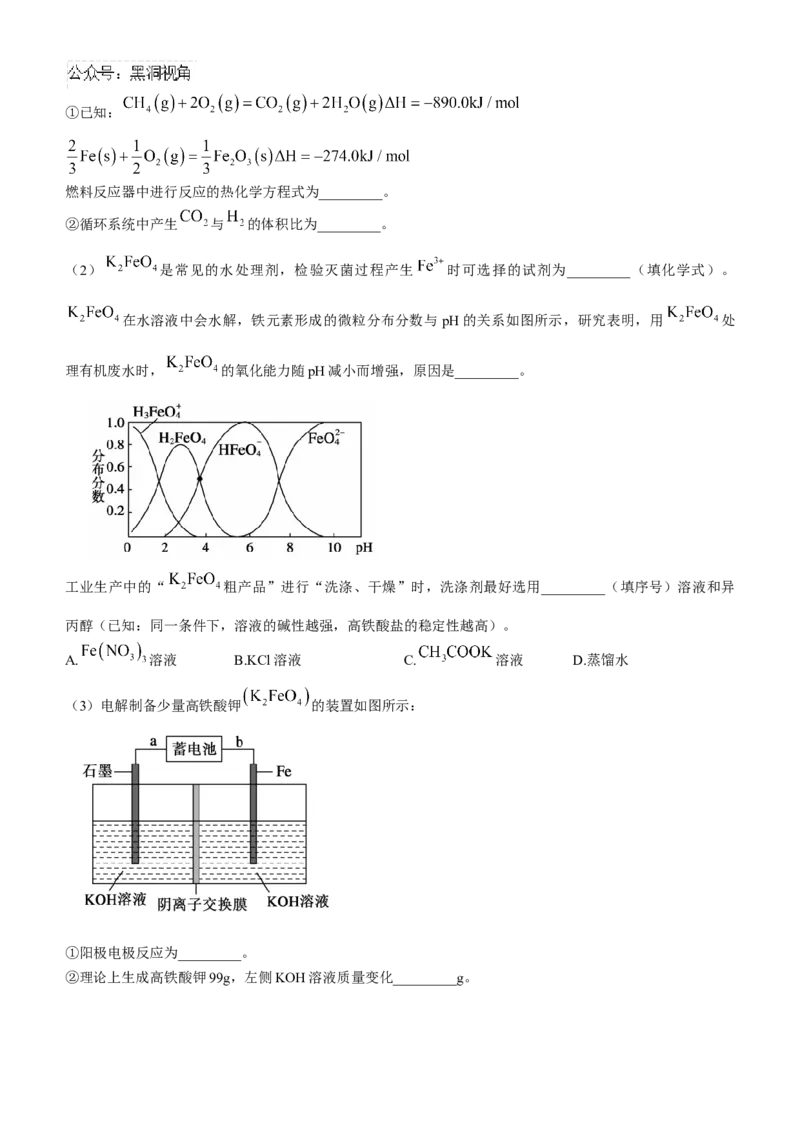
20.(12分)铁的化合物在工业、农业、生活、医药等领域用途十分广泛。
(1) 氧化 制备 ,实现了高效化学链制氢循环,如图所示。①已知:
燃料反应器中进行反应的热化学方程式为_________。
②循环系统中产生 与 的体积比为_________。
(2) 是常见的水处理剂,检验灭菌过程产生 时可选择的试剂为_________(填化学式)。
在水溶液中会水解,铁元素形成的微粒分布分数与 pH的关系如图所示,研究表明,用 处
理有机废水时, 的氧化能力随pH减小而增强,原因是_________。
工业生产中的“ 粗产品”进行“洗涤、干燥”时,洗涤剂最好选用_________(填序号)溶液和异
丙醇(已知:同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高)。
A. 溶液 B.KCl溶液 C. 溶液 D.蒸馏水
(3)电解制备少量高铁酸钾 的装置如图所示:
①阳极电极反应为_________。
②理论上生成高铁酸钾99g,左侧KOH溶液质量变化_________g。高三化学试题参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.D 2.C 3.C 4.A 5.A 6.B 7.D 8.B 9.C 10.B
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部
选对得4分,选对但不全的得2分,有选错的得0分。
11.AC 12.CD 13.AD 14.A 15.B
三、非选择题:本题共5小题,共60分
16.(1)防止葡萄酒被氧化(杀菌、防腐等合理答案也得分) 赶出
(2)将气体通入品红溶液中,溶液褪色,受热后又恢复红色,则说明有二氧化硫
(3)
;
或 (后两个方程式写出任意一个即得2分)
(4)1.68
17.(1)
(2)1:3
(3)
(4)
(2)① (或 ) B、C
②提高产品纯度
18.(1)
(2)将焙烧产物粉碎、搅拌、或提高水浸温度等。(写出一条即可得1分)
(3) >
(4)温度过低解吸附速率太慢,温度过高氯化铵与浓氨水受热分解。
(5)蒸发浓缩、冷却结晶
(6)49:1
19.(1)恒压滴液漏斗
(2)①降低溶液中 浓度,防止溶液中的 与 生成 气体。(降低溶液中 浓度,便于的电离,易于生成 固体。)
②碳酸钠碱性过强,会有 沉淀生成
(3)①胶头滴管、容量瓶 ② 偏大
20.(1)①
②9:32
(2)KSCN pH越低,越有利于生成 ,而这些微粒的氧化能力强于
C
(3)① ②54