文档内容
绝密★使用前
辽宁省实验中学 2023-2024 学年度高考适应性测试(二)
高 三 化 学
考生注意:
1.本试卷共100分,考试时间75分钟。共三大题,20小题,共9页
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:高考全部内容
一、选择题(本题共12小题,每小题3分,共36分.在每小题给出的四个选项中,只有一项是符合题目要
求的)
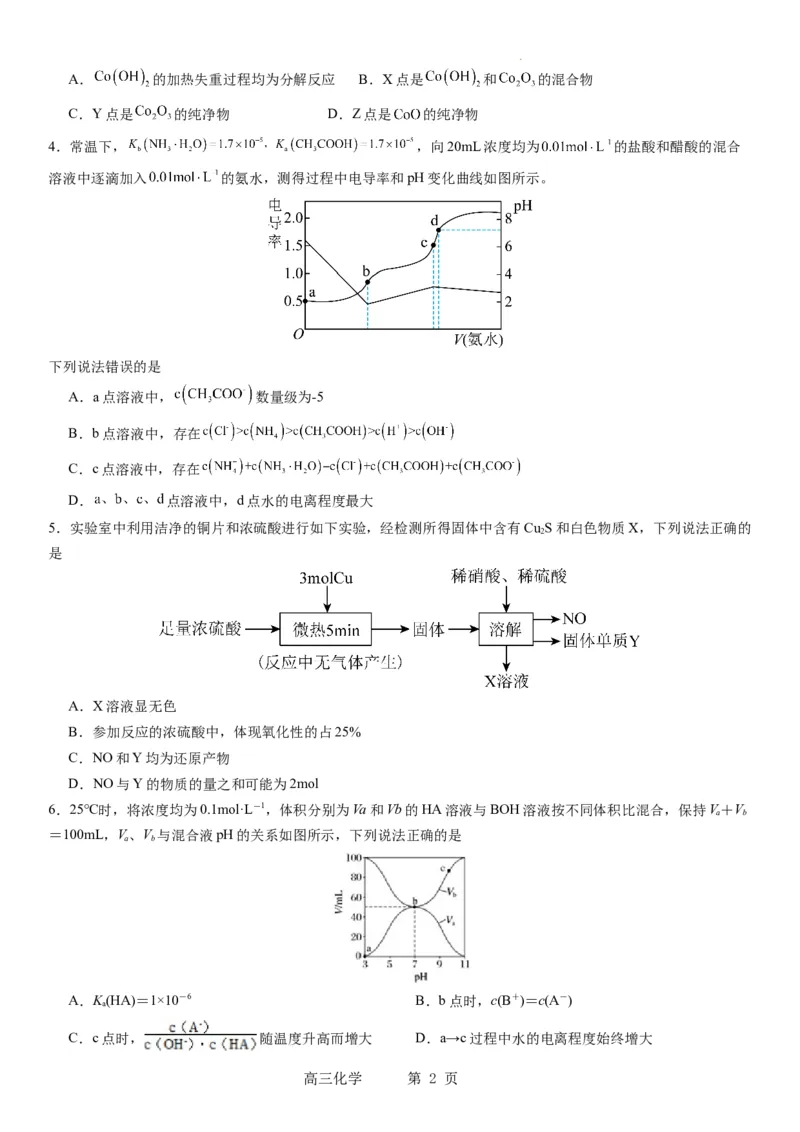
1.向10 mL0.1 mol·L-1NH Al(SO ) 溶液中,滴加等浓度Ba(OH) 溶液x mL。下列叙述正确的是
4 4 2 2
A.x=10时, 溶液中有NH +、AlO-、SO 2-, 且c(NH +)>c(SO 2-)
4 2 4 4 4
B.x=10时, 溶液中有NH +、Al3+、SO 2-, 且c(NH +)>c(Al3+)
4 4 4
C.x=30时, 溶液中有Ba2+、AlO-、OH-, 且c(OH-)c(HCO )
3 2
D.反应HCO +NH·H O NH +CO +H O的平衡常数为K,lgK=—0.9
3 2 2
14.应用电解法对煤进行脱硫处理具有脱硫效率高、经济效益好等优点。电解脱硫的基本原理如图所示,下列说
法错误的是
A.FeS 化学名称为二硫化亚铁
2
B.阳极反应为Mn2+﹣e﹣= Mn3+
C.随着电解,混合液pH逐渐增大
D.混合液中每增加1molSO ,理论上通过电路的电子数为7N
A
高三化学 第 4 页
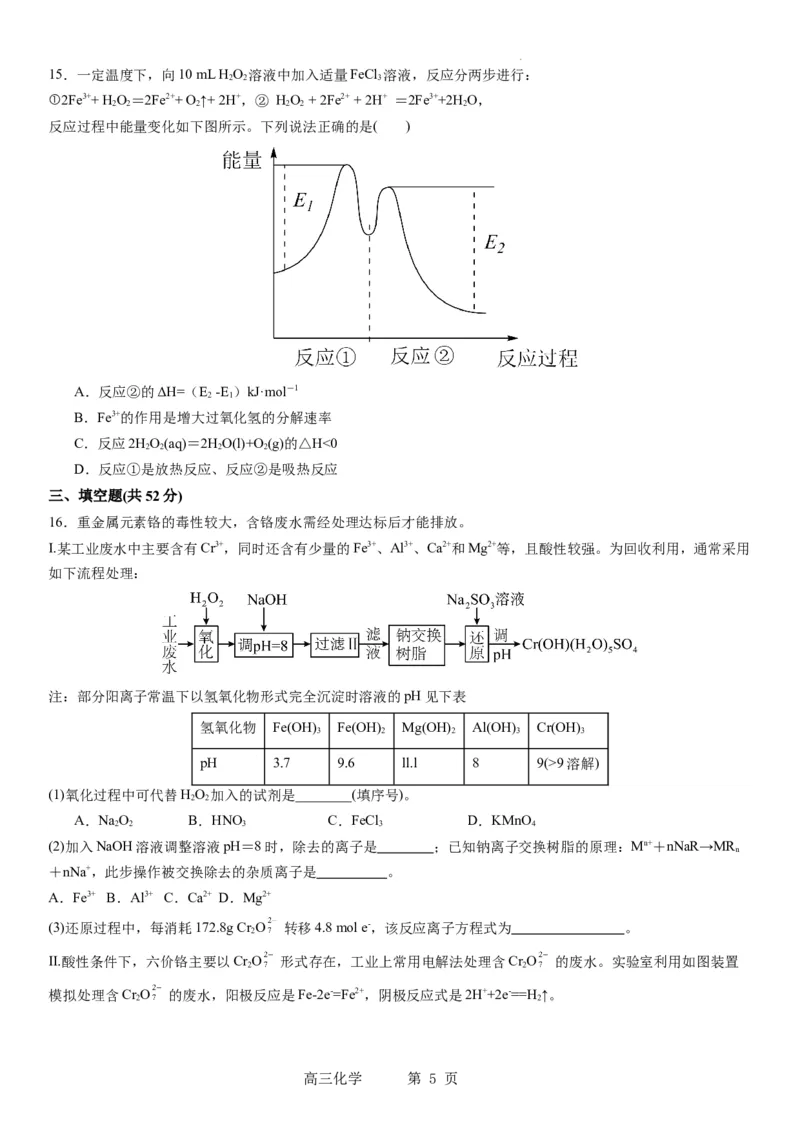
学科网(北京)股份有限公司15.一定温度下,向10 mL H O 溶液中加入适量FeCl 溶液,反应分两步进行:
2 2 3
①2Fe3++ H O=2Fe2++ O ↑+ 2H+,② HO + 2Fe2+ + 2H+ =2Fe3++2H O,
2 2 2 2 2 2
反应过程中能量变化如下图所示。下列说法正确的是( )
A.反应②的ΔH=(E -E )kJ·mol-1
2 1
B.Fe3+的作用是增大过氧化氢的分解速率
C.反应2HO(aq)=2HO(l)+O(g)的△H<0
2 2 2 2
D.反应①是放热反应、反应②是吸热反应
三、填空题(共52分)
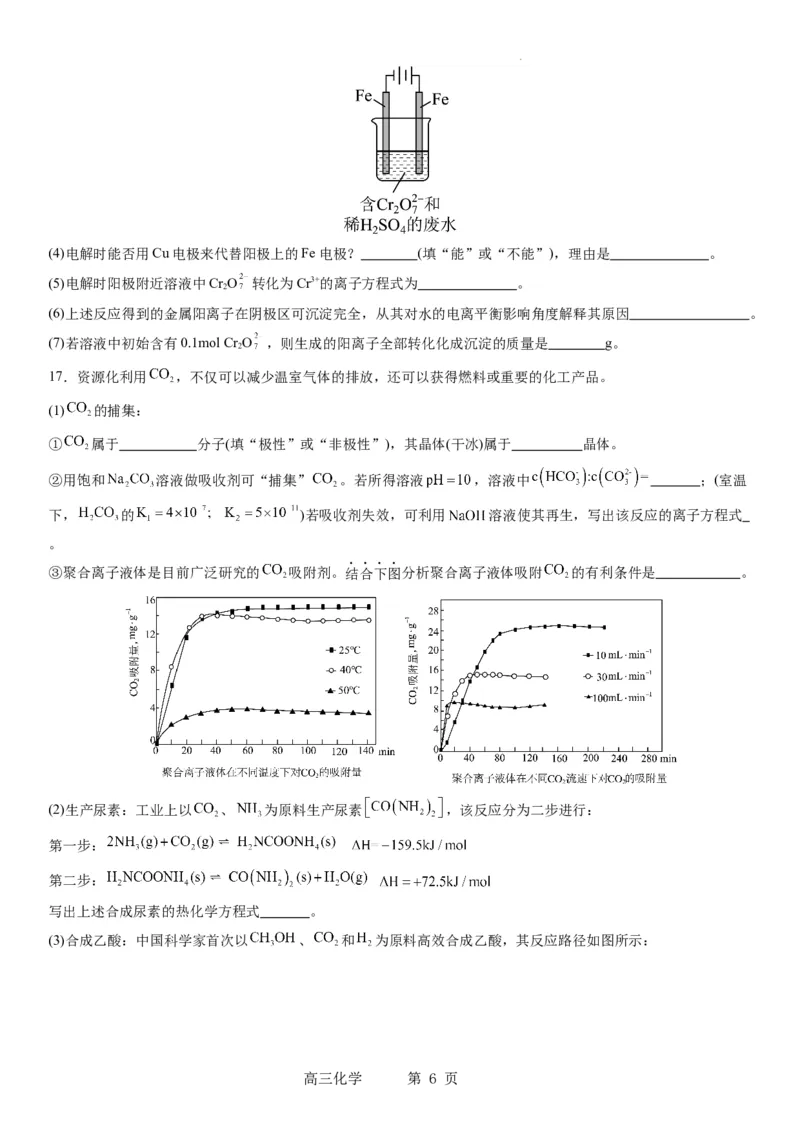
16.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用
如下流程处理:
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 Fe(OH) Fe(OH) Mg(OH) Al(OH) Cr(OH)
3 2 2 3 3
pH 3.7 9.6 ll.l 8 9(>9溶解)
(1)氧化过程中可代替HO 加入的试剂是________(填序号)。
2 2
A.NaO B.HNO C.FeCl D.KMnO
2 2 3 3 4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是 ;已知钠离子交换树脂的原理:Mn++nNaR→MR
n
+nNa+,此步操作被交换除去的杂质离子是 。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8g Cr O 转移4.8 mol e-,该反应离子方程式为 。
2
Ⅱ.酸性条件下,六价铬主要以Cr O 形式存在,工业上常用电解法处理含Cr O 的废水。实验室利用如图装置
2 2
模拟处理含Cr O 的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-==H ↑。
2 2
高三化学 第 5 页
学科网(北京)股份有限公司(4)电解时能否用Cu电极来代替阳极上的Fe电极? (填“能”或“不能”),理由是 。
(5)电解时阳极附近溶液中Cr O 转化为Cr3+的离子方程式为 。
2
(6)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因 。
(7)若溶液中初始含有0.1mol Cr O ,则生成的阳离子全部转化化成沉淀的质量是 g。
2
17.资源化利用 ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1) 的捕集:
① 属于 分子(填“极性”或“非极性”),其晶体(干冰)属于 晶体。
②用饱和 溶液做吸收剂可“捕集” 。若所得溶液 ,溶液中 ;(室温
下, 的 )若吸收剂失效,可利用 溶液使其再生,写出该反应的离子方程式
。
③聚合离子液体是目前广泛研究的 吸附剂。结合下图分析聚合离子液体吸附 的有利条件是 。
(2)生产尿素:工业上以 、 为原料生产尿素 ,该反应分为二步进行:
第一步:
第二步:
写出上述合成尿素的热化学方程式 。
(3)合成乙酸:中国科学家首次以 、 和 为原料高效合成乙酸,其反应路径如图所示:
高三化学 第 6 页
学科网(北京)股份有限公司①原料中的 可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
。
②根据图示,写出总反应的化学方程式: 。
18.地壳中含量排在前七位的元素分别是O、Si、Al、Fe、Ca、Na、K,占到地壳总质量的95%以上。回答下列问
题:
(1)铁元素的基态原子价电子排布式为 。
(2)“棕色环”现象是检验溶液中 的一种方法。向含有 溶液的试管中加入 、随后沿管壁加入浓硫酸,
在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
① 中S元素采取 杂化,其立体构型为 (填名称)。
② 中含有的作用力类型有(填序号) 。
a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键
③ 中Fe元素的化合价为+1,则铁的配体为 (填化学式)。
④ 易被氧化成 ,试从原子结构角度解释: 。
(3)硅酸盐中的硅酸根通常以[ ]四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅
酸根离子,写出其化学式: 。
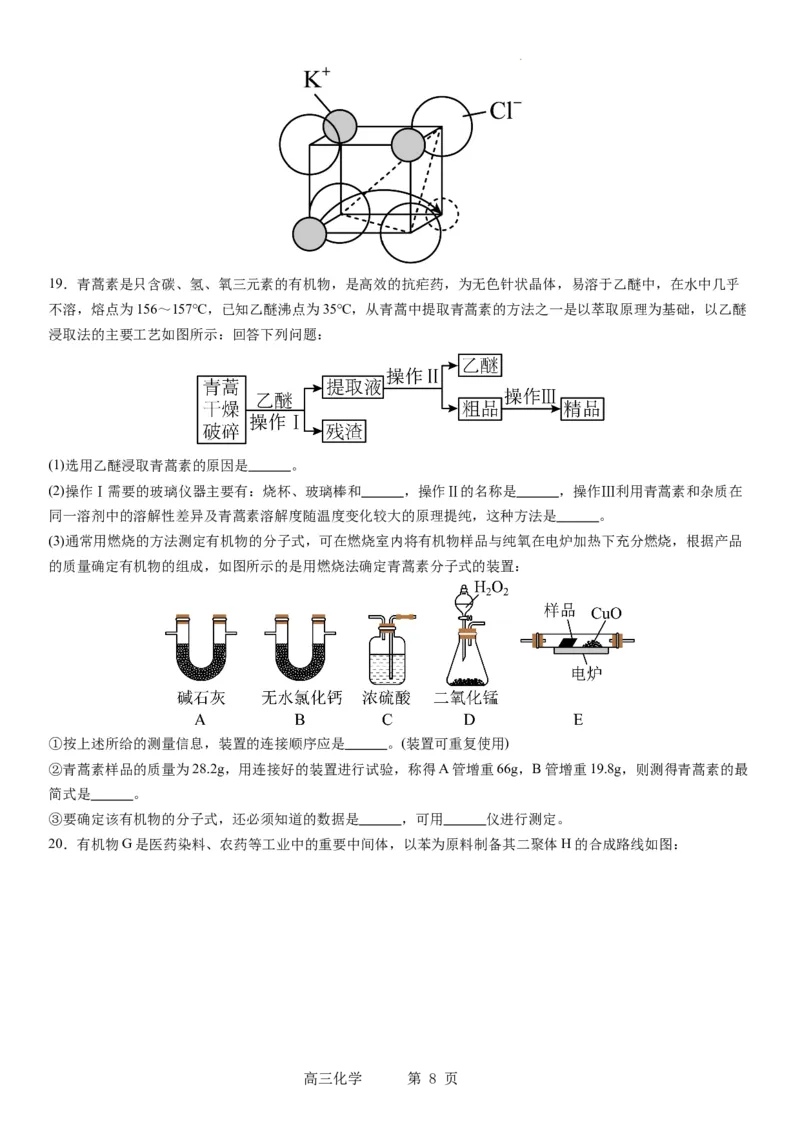
(4)离子晶体能否成为快离子导体取决于离子能否离开原位迁移到距离最近的空位上去,迁移过程中必须经过由其
他离子围成的最小窗孔。KCl属于NaCl型晶体, 占据由 围成的八面体空隙。已知 和 的半径分别为
0.130nm和0.170nm,晶体中阴阳离子紧密相切。若KCl晶体产生了阳离子空位(如图丙),请计算 围成的最小窗
孔的半径为 nm,则KCl晶体 (填“能”或“不能”)成为快离子导体。(已知: )
高三化学 第 7 页
学科网(北京)股份有限公司19.青蒿素是只含碳、氢、氧三元素的有机物,是高效的抗疟药,为无色针状晶体,易溶于乙醚中,在水中几乎
不溶,熔点为156~157℃,已知乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础,以乙醚
浸取法的主要工艺如图所示:回答下列问题:
(1)选用乙醚浸取青蒿素的原因是 。
(2)操作Ⅰ需要的玻璃仪器主要有:烧杯、玻璃棒和 ,操作Ⅱ的名称是 ,操作Ⅲ利用青蒿素和杂质在
同一溶剂中的溶解性差异及青蒿素溶解度随温度变化较大的原理提纯,这种方法是 。
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品
的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:
①按上述所给的测量信息,装置的连接顺序应是 。(装置可重复使用)
②青蒿素样品的质量为28.2g,用连接好的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最
简式是 。
③要确定该有机物的分子式,还必须知道的数据是 ,可用 仪进行测定。
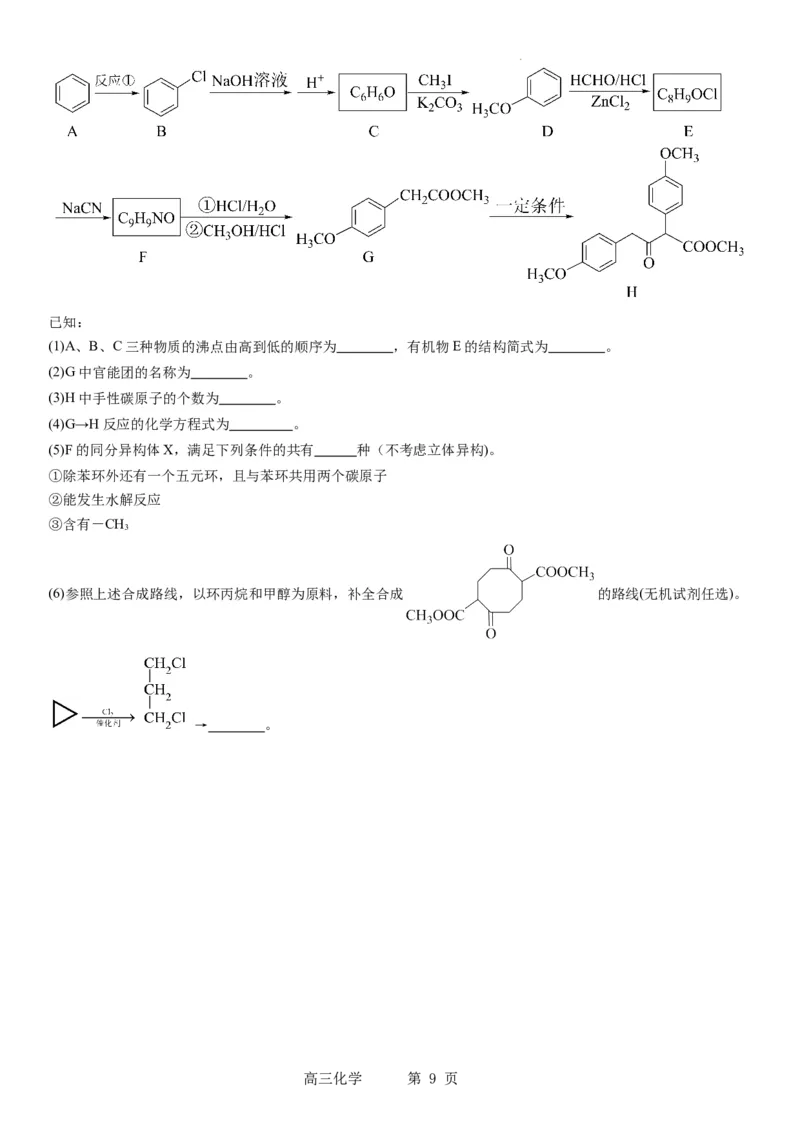
20.有机物G是医药染料、农药等工业中的重要中间体,以苯为原料制备其二聚体H的合成路线如图:
高三化学 第 8 页
学科网(北京)股份有限公司已知:
(1)A、B、C三种物质的沸点由高到低的顺序为 ,有机物E的结构简式为 。
(2)G中官能团的名称为 。
(3)H中手性碳原子的个数为 。
(4)G→H反应的化学方程式为 。
(5)F的同分异构体X,满足下列条件的共有 种(不考虑立体异构)。
①除苯环外还有一个五元环,且与苯环共用两个碳原子
②能发生水解反应
③含有-CH
3
(6)参照上述合成路线,以环丙烷和甲醇为原料,补全合成 的路线(无机试剂任选)。
→ 。
高三化学 第 9 页
学科网(北京)股份有限公司