文档内容
2025-2026学年度(上)阶段性考试(一)
化学
高2024级
可能用到的相对原子质量:S-32 H-1 O-16
一、单项选择题(本题共15小题,每小题3分,共45分)
1. 社会的发展、科技的进步离不开化学。下列说法中不正确的是
A. “玉兔号”月球车上的太阳能电池可将太阳能转化为电能
B. 除去工业废水中的Cu2+、Hg2+可用NaS溶液作沉淀剂
2
C. 二氧化硅的半导体性能在芯片中提升了AI技术的表现
D. 用TiCl 制备TiO 时,需加入大量的水同时加热
4 2
2. 下列表示或说法不正确的是
A. 图标 的含义是:防止锋利物品扎伤或割伤
B. 依据相同温度下可逆反应的Q与K大小的比较,可推断反应进行的方向
C. 用电子式表示KCl的形成过程:
D. HO 的电子式:
2 2
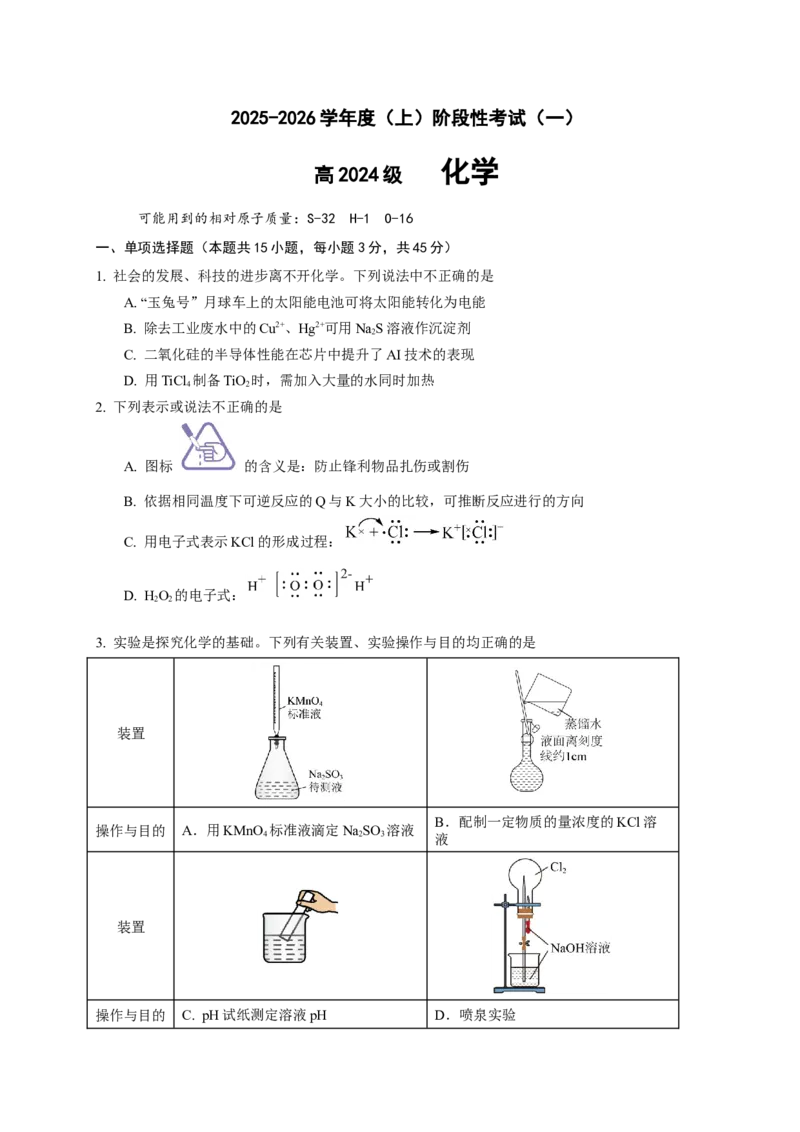
3. 实验是探究化学的基础。下列有关装置、实验操作与目的均正确的是
装置
B.配制一定物质的量浓度的KCl溶
操作与目的 A.用KMnO 标准液滴定NaSO 溶液
4 2 3 液
装置
操作与目的 C. pH试纸测定溶液pH D.喷泉实验4. 硫及其化合物部分转化关系如图。设N 为阿伏加德罗常数的值,下列说法正确的是
A
A. 标准状况下,11.2L SO 中原子总数为0.5N
2 A
B. 100 mL 0.1 mol·L-1 NaSO 溶液中,SO 2-数目为0.01N
2 3 3 A
C. 反应①每消耗3.4 g HS,生成物中硫原子数目为0.1N
2 A
D. 反应②每生成1mol还原产物,转移电子数目为2N
A
5.下列叙述正确的是
A.用CHCOOH 溶液做导电性实验,灯泡很暗,能证明 CHCOOH 是弱电解质
3 3
B.两种醋酸溶液的物质的量浓度分别c 和c,pH分别为a和a+1,则c = 10 c
1 2 1 2
C.常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.常温下,pH均为8的氢氧化钠溶液和CHCOONa溶液中,由水电离出的c(OH-)之比为1:1
3
6. X、Y、Z、W、Q为短周期元素,原子序数依次增大,最外层电子数之和为18。X元素的原子
失去一个电子后成为一个裸露的质子,Z和Q同族,Z的原子序数是Q的一半,W元素焰色试验呈
黄色。下列说法错误的是
A. X、Y组成的最简单的化合物有可燃性 B. X、Q组成的化合物有还原性
C. Z、W组成的化合物含有离子键 D. W、Q组成的化合物溶于水呈酸性
7. 下列选项中的物质能按图示路径在自然界中转化,且甲和水可以直接生成乙的是
选
甲 乙 丙
项
A Cl NaClO NaCl
2
B SO HSO CaSO
2 2 4 4
C Fe O Fe(OH) FeCl
2 3 3 3
D CO HCO Ca(HCO )
2 2 3 3
8. 亚磷酸(H PO )是二元弱酸,常温下电离常数K =1.0×10-2,K =2.6×10-7。下列说法正确的是
3 3 a1 a2
A.HPO 与足量的NaOH溶液反应生成NaPO
3 3 3 3B.对亚磷酸溶液升温,溶液的pH值变小
C.向亚磷酸溶液中加入少量NaOH固体,则变小
D.对0.01 mol/L的HPO 溶液加水稀释,溶液中各离子浓度均减小
3 3
9. 室温下,根据下列实验过程及现象,能验证相应实验结论的是
选项 实验过程及现象 实验结论
用 0.1 mol·L-1 NaOH溶液分别中和等体积的0.1 mol·L-1
酸性:
A HSO 溶液和0.1 mol·L-1 CHCOOH 溶液,HSO 消耗的NaOH
2 4 3 2 4 HSO > CHCOOH
溶液多 2 4 3
向2 mL 0.1 mol·L-1 NaS溶液溶液中滴加几滴溴水,振荡,产 氧化性:
B 2
生淡黄色沉淀 Br > S
2
C 测定KHS溶液中c(S2-) 用AgNO 溶液滴定
3
水解能力:
用pH试纸分别测定溶液CHCOONa和NaNO 溶液pH,
D 3 2
CH 3 COONa溶液pH大 CH 3 COO - > NO 2 -
10. 已知25℃时有关弱酸的电离平衡常数如下表,下列有关说法正确的是
弱酸化学式 CHCOOH HCN HCO
3 2 3
K =4.5×10-7
a1
电离平衡常数 1.75×10-5 6.2×10-10
K =4.7×10-11
a2
A. NaCN溶液中通入少量CO 发生的化学反应为 NaCN+HO+CO===HCN+NaHCO
2 2 2 3
B. 醋酸溶液加水稀释,其电离程度先增大后减小
C. 等物质的量浓度的各溶液中c( H+)大小关系为CHCOOH溶液 < HCO 溶液 < HCN溶液
3 2 3
D. 稀释HCN溶液过程中, 减小
11. 将一定质量的冰醋酸加水稀释过程中,溶液中c(H+)变化如图所示,下列说法不正确的是( )
A. 若使b点对应的溶液中c(CHCOO-)增大、c(H+)减小,
3
可采用加入NaOH固体的方法
B. a、b、c三点对应溶液的导电能力:c z ,则 P > P
1 2
B.在II中,若实现a→b只能加入合适的催化剂
C.在III中,m点反应物A与B的起始投料的物质的量之比为x:y
D.在IV中,若T> T 则该反应的平衡常数 K >K
1 2 1 2
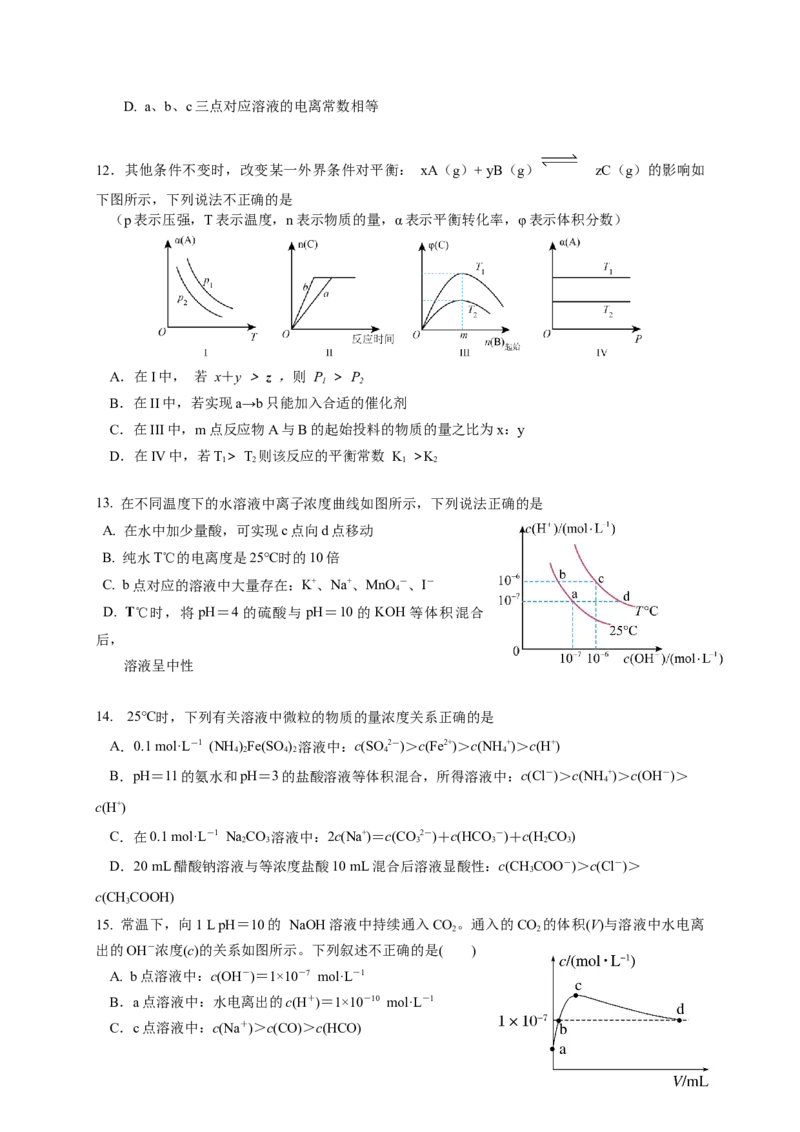
13. 在不同温度下的水溶液中离子浓度曲线如图所示,下列说法正确的是
A. 在水中加少量酸,可实现c点向d点移动
B. 纯水T℃的电离度是25℃时的10倍
C. b点对应的溶液中大量存在:K+、Na+、MnO -、I-
4
D. T℃时,将pH=4的硫酸与pH=10的KOH等体积混合
后,
溶液呈中性
14. 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH )Fe(SO ) 溶液中:c(SO 2-)>c(Fe2+)>c(NH +)>c(H+)
4 2 4 2 4 4
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH +)>c(OH-)>
4
c(H+)
C.在0.1 mol·L-1 Na CO 溶液中:2c(Na+)=c(CO2-)+c(HCO -)+c(H CO)
2 3 3 3 2 3
D.20 mL醋酸钠溶液与等浓度盐酸10 mL混合后溶液显酸性:c(CHCOO-)>c(Cl-)>
3
c(CHCOOH)
3
15. 常温下,向1 L pH=10的 NaOH溶液中持续通入CO 。通入的CO 的体积(V)与溶液中水电离
2 2
出的OH-浓度(c)的关系如图所示。下列叙述不正确的是( )
A. b点溶液中:c(OH-)=1×10-7 mol·L-1
B.a点溶液中:水电离出的c(H+)=1×10-10 mol·L-1
C.c点溶液中:c(Na+)>c(CO)>c(HCO)D.d点溶液中:溶液是NaHCO 和HCO 的混合液
3 2 3
二、填空题(本题共4题,每空2分,共55分)
16.( 14分)过氧化氢是重要的氧化剂,也可作还原剂,它的水溶液称为双氧水,常用于消毒剂、
杀菌、漂白等。某化学研究性学习小组取一定量的市售过氧化氢溶液, 测定其中HO 的质量分数。
2 2
(1)量取10.00 mL 密度为ρ g/mL的市售过氧化氢溶液,应选用的滴定管是________ (填“酸式”
或“碱式”)滴定管。
(2)将上述溶液配制成 250.00 mL,配制的过程需要用到的玻璃仪器是烧杯、玻璃棒、
(填名称), 移取配置后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。
用高锰酸钾标准溶液来滴定该过氧化氢溶液, 滴定到达终点的现象是:当滴入最后半滴高锰酸钾,
。
(3)若滴定开始和结束时,滴定管中的液面如图所示,则终点读数为________mL。
(4)①完成滴定过程中反应的离子方程式 。
②重复滴定三次,平均耗用 cmol/L KMnO 标准溶液VmL,则原过氧化氢溶液中过氧化氢的
4
质量分数为 。(用字母表示)
③下列操作会导致测定结果偏高的是_________(填序号)。
A.滴定前滴定管未用 KMnO 溶液润洗
4
B.移取25.00 mL过氧化氢待测液注入有少量蒸馏水的锥形瓶中
C.滴定开始时,装KMnO 溶液的滴定管有气泡未排出,滴定结束气泡消失
4
D. 将HO 溶液配制成250.00 mL溶液时,仰视刻度线定容
2 2
17.(12分)磷酸铁锂电池是我国新能源汽车产业发展初期的主流电池,具有安全性能好、循环寿
命长、成本低等突出优点。一种以废磷酸铁锂正极渣(主要含有LiFePO 、炭黑、铝粉、有机黏结
4
剂)为原料,回收制备电池级磷酸铁锂的流程如图所示:已知1:常温下,Fe(OH) 沉淀在pH ≥ 2.8可稳定存在。
3
已知2:常温下,HPO 的电离常数 、 、 。
3 4
回答下列问题:
(1)浸出前,需将结块的废磷酸铁锂正极渣粉碎成粉,目的是 。
(2)常温下,NaH PO 溶液呈 (填“酸性”“碱性”或“中性”)。
2 4
(3)加入HO 的离子反应方程式: ;
2 2
在实际操作中 的用量约为理论量的1.2倍,其原因可能是 。
(4) 沉淀过程中,控制pH不大于2的原因是 。
(5)写出浸出过程中LiFePO 发生反应生成Fe(H PO ) 的化学方程式: 。
4 2 4 2
18.( 15分)MgCl 在金属冶炼、食品添加等行业应用广泛,熔点为714℃,易水解和形成结晶水
2
合物。学习小组在实验室对MgCl 的制备进行探究。
2
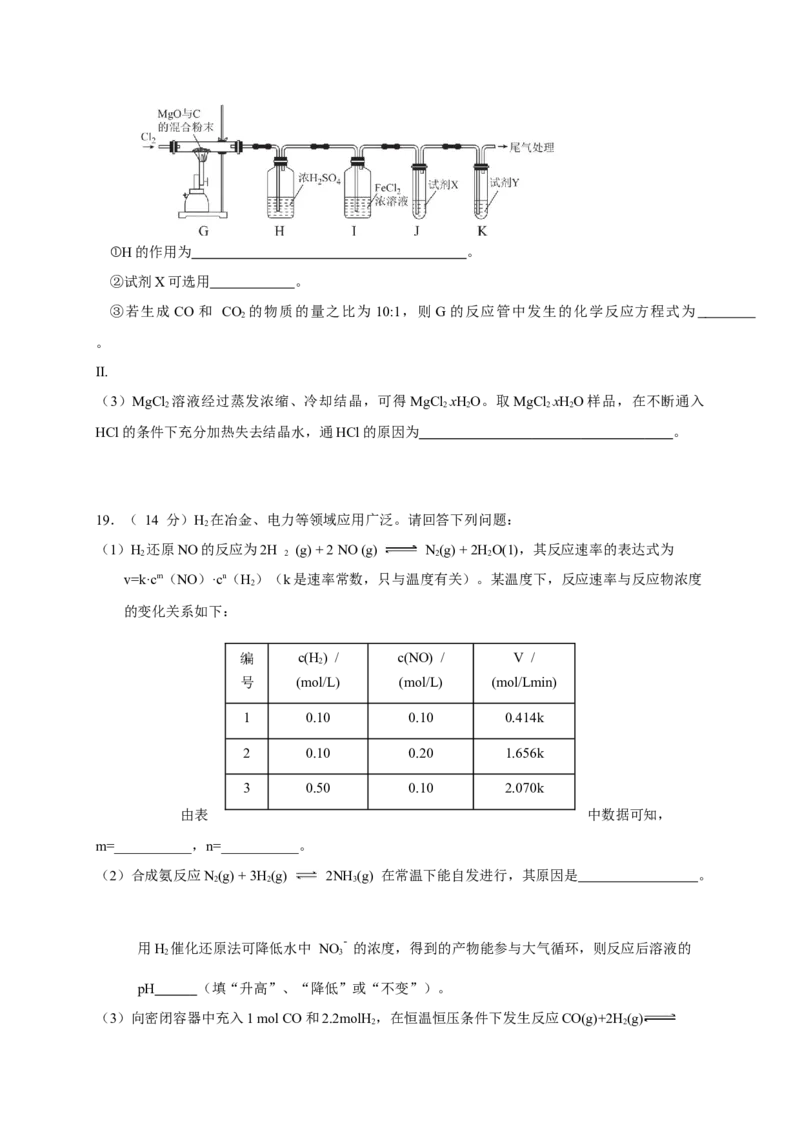
I. 由 MgO、C和Cl 制备MgCl 并验证生成气体产物中有CO和 CO
2 2 2
(1)制备氯气
①m的名称为 。
②氯气的发生装置可选择图中的 (填大写字母),反应的化学方程式为 。
③欲收集一瓶纯净的氯气,按气流从左到右的方向,上述装置的合理连接顺序为:a→
(用小写字母表示,部分装置可重复使用)。
(2)制备MgCl 并验证生成气体产物中有CO和 CO 。将上述制得的Cl 持续充入如图所示装置中
2 2 2
进行实验。 ( 已知:PdCl + CO + H O===Pd↓(黑色)+ 2HCl + CO )
2 2 2①H的作用为 。
②试剂X可选用 。
③若生成 CO 和 CO 的物质的量之比为 10:1,则 G 的反应管中发生的化学反应方程式为
2
。
Ⅱ.
(3)MgCl 溶液经过蒸发浓缩、冷却结晶,可得MgCl xHO。取MgCl xHO样品,在不断通入
2 2· 2 2· 2
HCl的条件下充分加热失去结晶水,通HCl的原因为 。
19.( 14 分)H 在冶金、电力等领域应用广泛。请回答下列问题:
2
(1)H 还原NO的反应为2H (g) + 2 NO (g) N(g) + 2HO(1),其反应速率的表达式为
2 2 2 2
v=k·cm(NO)·cn(H)(k是速率常数,只与温度有关)。某温度下,反应速率与反应物浓度
2
的变化关系如下:
编 c(H) / c(NO) / V /
2
号 (mol/L) (mol/L) (mol/Lmin)
1 0.10 0.10 0.414k
2 0.10 0.20 1.656k
3 0.50 0.10 2.070k
由表 中数据可知,
m=___________,n=___________。
(2)合成氨反应N(g) + 3H(g) 2NH (g) 在常温下能自发进行,其原因是 。
2 2 3
-
用H 催化还原法可降低水中 NO 的浓度,得到的产物能参与大气循环,则反应后溶液的
2 3
pH (填“升高”、“降低”或“不变”)。
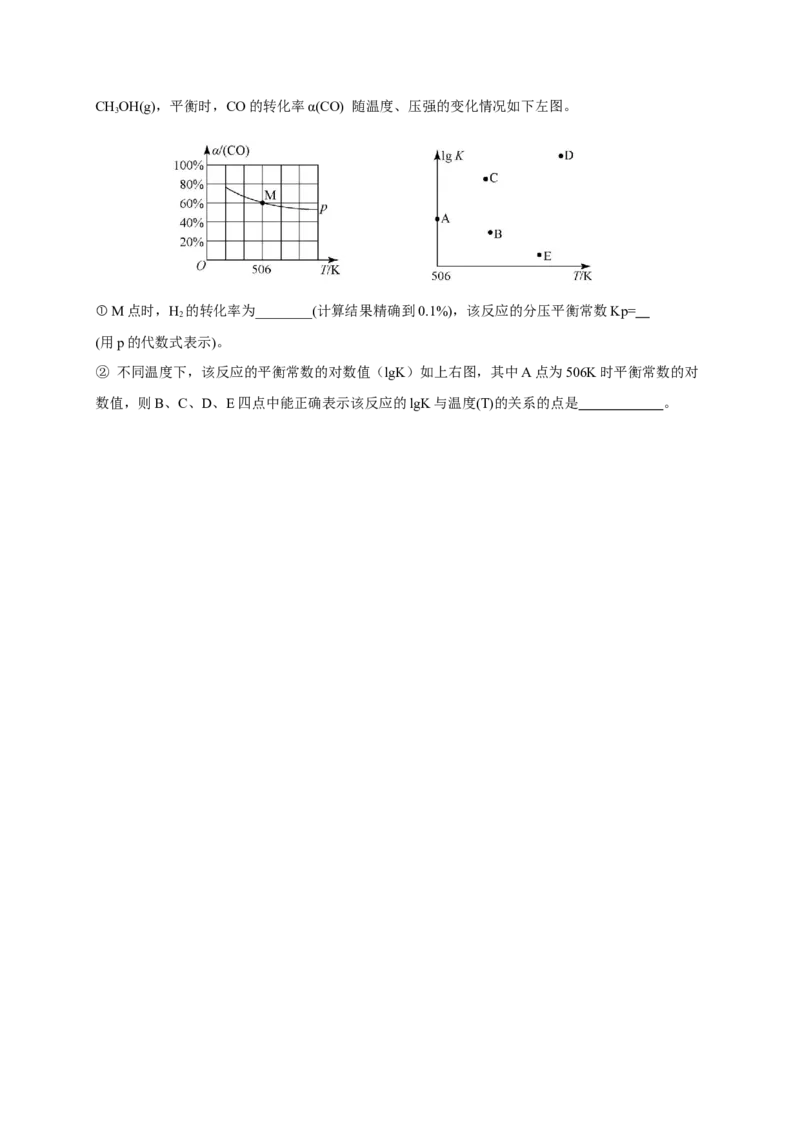
(3)向密闭容器中充入1 mol CO和2.2molH,在恒温恒压条件下发生反应CO(g)+2H(g)
2 2CHOH(g),平衡时,CO的转化率α(CO) 随温度、压强的变化情况如下左图。
3
① M点时,H 的转化率为________(计算结果精确到0.1%),该反应的分压平衡常数Kp=
2
(用p的代数式表示)。
② 不同温度下,该反应的平衡常数的对数值(lgK)如上右图,其中A点为506K时平衡常数的对
数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的点是 。