文档内容
哈尔滨师范大学附属中学 2025~2026 学年度上学期 C.通入少量HCl,将抑制石蕊的电离 D.加水稀释过程中,c(HIn)逐渐减小
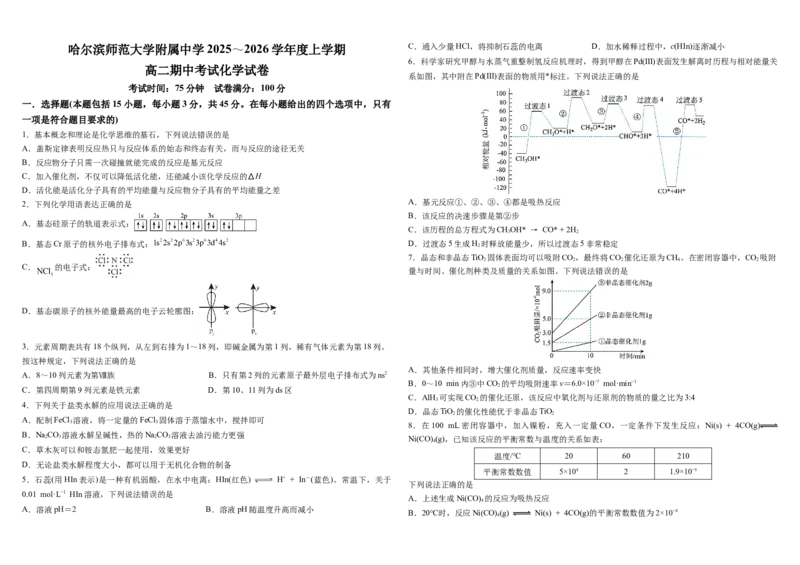
6.科学家研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时历程与相对能量关
高二期中考试化学试卷
系如图,其中附在Pd(Ⅲ)表面的物质用*标注。下列说法正确的是
考试时间:75分钟 试卷满分:100分
一.选择题(本题包括15小题,每小题3分,共45分。在每小题给出的四个选项中,只有
一项是符合题目要求的)
1.基本概念和理论是化学思维的基石,下列说法错误的是
A.盖斯定律表明反应热只与反应体系的始态和终态有关,而与反应的途径无关
B.反应物分子只需一次碰撞就能完成的反应是基元反应
C.加入催化剂,不仅可以降低活化能,还能减小该化学反应的∆H
D.活化能是活化分子具有的平均能量与反应物分子具有的平均能量之差
2.下列化学用语表达正确的是 A.基元反应①、②、③、④都是吸热反应
B.该反应的决速步骤是第②步
A.基态硅原子的轨道表示式:
C.该历程的总方程式为CHOH* → CO* + 2H
3 2
B.基态Cr原子的核外电子排布式: D.过渡态5生成H 时释放能量少,所以过渡态5非常稳定
2
7.晶态和非晶态TiO 固体表面均可以吸附CO,最终将CO 催化还原为CH。在密闭容器中,CO 吸附
2 2 2 4 2
C. 的电子式:
量与时间、催化剂种类及质量的关系如图。下列说法错误的是
D.基态碳原子的核外能量最高的电子云轮廓图:
3.元素周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列。
按这种规定,下列说法正确的是
A.其他条件相同时,增大催化剂质量,反应速率变快
A.8~10列元素为第Ⅷ族 B.只有第2列的元素原子最外层电子排布式为ns2
B.0~10 min内③中CO 的平均吸附速率v=6.0×10−7 mol·min−1
2
C.第四周期第9列元素是铁元素 D.第10、11列为ds区
C.AlH 可实现CO 的催化还原,该反应中氧化剂与还原剂的物质的量之比为3:4
3 2
4.下列关于盐类水解的应用说法正确的是
D.晶态TiO 的催化性能优于非晶态TiO
2 2
A.配制FeCl 溶液,将一定量的FeCl 固体溶于蒸馏水中,搅拌即可
3 3 8.在100 mL密闭容器中,加入镍粉,充入一定量CO,一定条件下发生反应:Ni(s) + 4CO(g)
B.NaCO 溶液水解呈碱性,热的NaCO 溶液去油污能力更强
2 3 2 3 Ni(CO) (g),已知该反应的平衡常数与温度的关系如表:
4
C.草木灰可以和铵态氮肥一起使用,效果更好
温度/℃ 20 60 210
D.无论盐类水解程度大小,都可以用于无机化合物的制备
平衡常数数值 5×104 2 1.9×10−5
5.石蕊(用HIn表示)是一种有机弱酸,在水中电离:HIn(红色) H+ + In-(蓝色)。常温下,关于
下列说法正确的是
0.01 mol·L−1 HIn溶液,下列说法错误的是
A.上述生成Ni(CO) 的反应为吸热反应
4
A.溶液pH=2 B.溶液pH随温度升高而减小
B.20℃时,反应Ni(CO) (g) Ni(s) + 4CO(g)的平衡常数数值为2×10−4
4C.60℃时,测得某时刻Ni(CO) 、CO的物质的量均为0.05 mol,则此时v >v
4 正 逆
A.L
2
表示−lg c(F-)与 的变化关系
D.60℃达到平衡时,测得c(CO)=1 mol·L−1,则Ni(CO) 的平衡浓度为2 mol·L−1
4
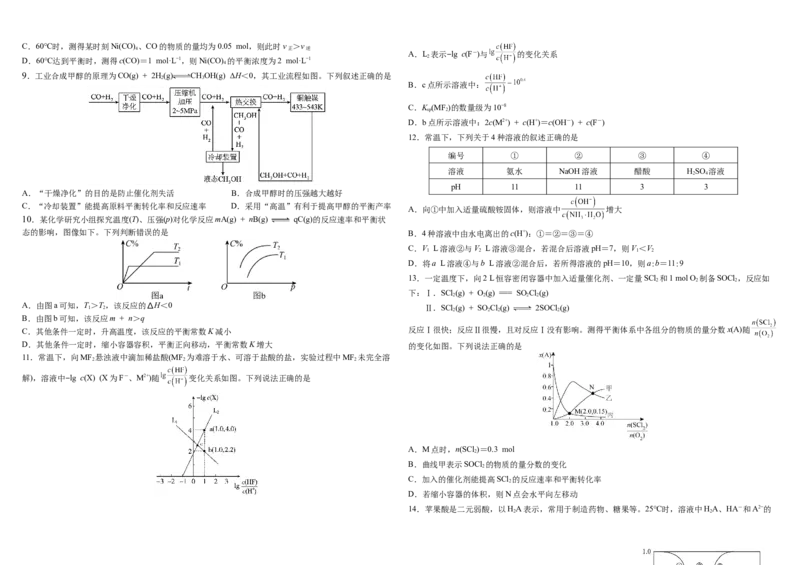
9.工业合成甲醇的原理为CO(g) + 2H(g) CHOH(g) ∆H<0,其工业流程如图。下列叙述正确的是
2 3
B.c点所示溶液中:
C.K (MF )的数量级为10−8
sp 2
D.b点所示溶液中:2c(M2+) + c(H+)=c(OH-) + c(F-)
12.常温下,下列关于4种溶液的叙述正确的是
编号 ① ② ③ ④
溶液 氨水 NaOH溶液 醋酸 HSO 溶液
2 4
pH 11 11 3 3
A.“干燥净化”的目的是防止催化剂失活 B.合成甲醇时的压强越大越好
C.“冷却装置”能提高原料平衡转化率和反应速率 D.采用“高温”有利于提高甲醇的平衡产率
A.向①中加入适量硫酸铵固体,则溶液中 增大
10.某化学研究小组探究温度(T)、压强(p)对化学反应mA(g) + nB(g) qC(g)的反应速率和平衡状
态的影响,图像如下。下列判断错误的是 B.4种溶液中由水电离出的c(H+):①=②=③=④
C.V L溶液②与V L溶液③混合,若混合后溶液pH=7,则V<V
1 2 1 2
D.将a L溶液④与b L溶液②混合后,若所得溶液的pH=10,则a:b=11:9
13.一定温度下,向2 L恒容密闭容器中加入适量催化剂、一定量SCl 和1 mol O 制备SOCl ,反应如
2 2 2
下:Ⅰ.SCl (g) + O(g) === SO Cl(g)
2 2 2 2
A.由图a可知,T
1
>T
2
,该反应的∆H<0
Ⅱ.SCl (g) + SO Cl(g) 2SOCl (g)
2 2 2 2
B.由图b可知,该反应m + n>q
C.其他条件一定时,升高温度,该反应的平衡常数K减小 反应Ⅰ很快;反应Ⅱ很慢,且对反应Ⅰ没有影响。测得平衡体系中各组分的物质的量分数x(A)随
D.其他条件一定时,缩小容器容积,平衡正向移动,平衡常数K增大 的变化如图。下列说法正确的是
11.常温下,向MF 悬浊液中滴加稀盐酸(MF 为难溶于水、可溶于盐酸的盐,实验过程中MF 未完全溶
2 2 2
解),溶液中−lg c(X) (X为F-、M2+)随 变化关系如图。下列说法正确的是
A.M点时,n(SCl )=0.3 mol
2
B.曲线甲表示SOCl 的物质的量分数的变化
2
C.加入的催化剂能提高SCl 的反应速率和平衡转化率
2
D.若缩小容器的体积,则N点会水平向左移动
14.苹果酸是二元弱酸,以HA表示,常用于制造药物、糖果等。25℃时,溶液中HA、HA-和A2−的
2 2分布系数δ(x)随溶液pH的变化如图[例如A2−的分布系数 ]。下列说法错
误的是
A.曲线①是HA的分布系数曲线
2
B.HA的K =10−3.46
2 a1
C.反应HA + A2− 2HA-的平衡常数K=10−1.59
2 ①上述NaOH溶液中的c(H+)= 。将该溶液稀释到原体积的100倍后,水电离出的
D.当4.26<pH<5.05时,溶液中c(HA-)>c(A2−)>c(H A)
2 c(OH-) = ;将该NaOH溶液由25℃升温至95℃,溶液的pH (填“增
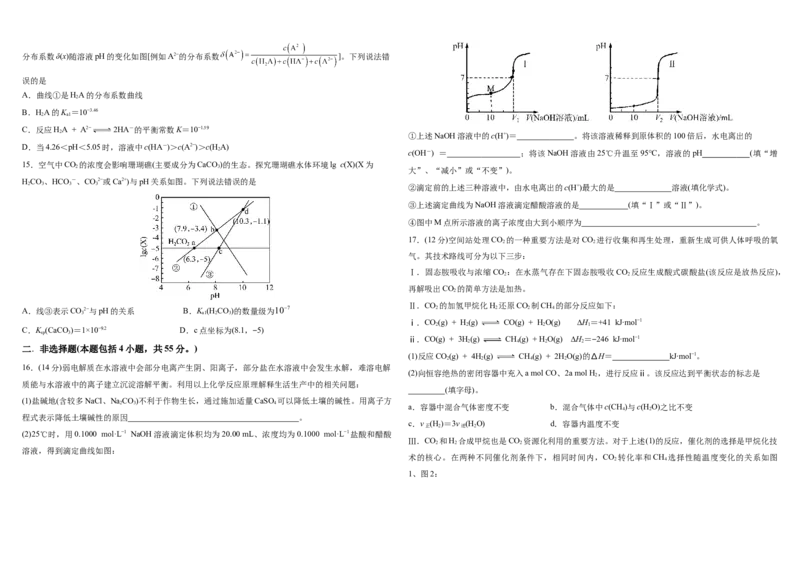
15.空气中CO 的浓度会影响珊瑚礁(主要成分为CaCO )的生态。探究珊瑚礁水体环境lg c(X)(X为
2 3 大”、“减小”或“不变”)。
HCO、HCO -、CO2−或Ca2+)与pH关系如图。下列说法错误的是
2 3 3 3 ②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是 溶液(填化学式)。
③上述滴定曲线为NaOH溶液滴定醋酸溶液的是 (填“Ⅰ”或“Ⅱ”)。
④图中M点所示溶液的离子浓度由大到小顺序为 。
17.(12分)空间站处理CO 的一种重要方法是对CO 进行收集和再生处理,重新生成可供人体呼吸的氧
2 2
气。其技术路线可分为以下三步:
Ⅰ.固态胺吸收与浓缩CO :在水蒸气存在下固态胺吸收CO 反应生成酸式碳酸盐(该反应是放热反应),
2 2
再解吸出CO 的简单方法是加热。
2
Ⅱ.CO 的加氢甲烷化H 还原CO 制CH 的部分反应如下:
A.线③表示CO2−与pH的关系 B.K (H CO)的数量级为107 2 2 2 4
3 a1 2 3
ⅰ.CO
2
(g) + H
2
(g) CO(g) + H
2
O(g) ∆H
1
=+41 kJ∙mol−1
C.K
sp
(CaCO
3
)=1×10−9.2 D.c点坐标为(8.1,−5)
ⅱ.CO(g) + 3H
2
(g) CH
4
(g) + H
2
O(g) ∆H
2
=−246 kJ∙mol−1
二.非选择题(本题包括4小题,共55分。)
(1)反应CO
2
(g) + 4H
2
(g) CH
4
(g) + 2H
2
O(g)的∆H= kJ∙mol−1。
16.(14分)弱电解质在水溶液中会部分电离产生阴、阳离子,部分盐在水溶液中会发生水解,难溶电解
(2)向恒容绝热的密闭容器中充入a mol CO、2a mol H
2
,进行反应ⅱ。该反应达到平衡状态的标志是
质能与水溶液中的离子建立沉淀溶解平衡。利用以上化学反应原理解释生活生产中的相关问题:
(填字母)。
(1)盐碱地(含较多NaCl、NaCO)不利于作物生长,通过施加适量CaSO 可以降低土壤的碱性。用离子方
2 3 4
a.容器中混合气体密度不变 b.混合气体中c(CH)与c(H O)之比不变
4 2
程式表示降低土壤碱性的原因 。
c.v (H )=3v (H O) d.容器内温度不变
正 2 逆 2
(2)25℃时,用0.1000 mol·L−1 NaOH溶液滴定体积均为20.00 mL、浓度均为0.1000 mol·L−1盐酸和醋酸
Ⅲ.CO 和H 合成甲烷也是CO 资源化利用的重要方法。对于上述(1)的反应,催化剂的选择是甲烷化技
2 2 2
溶液,得到滴定曲线如图:
术的核心。在两种不同催化剂条件下,相同时间内,CO 转化率和CH 选择性随温度变化的关系如图
2 4
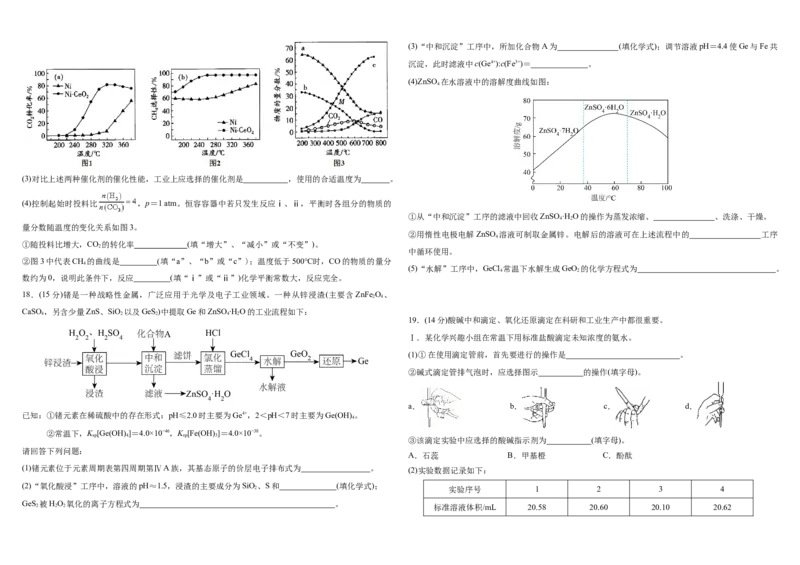
1、图2:(3)“中和沉淀”工序中,所加化合物A为 (填化学式);调节溶液pH=4.4使Ge与Fe共
沉淀,此时滤液中c(Ge4+):c(Fe3+)= 。
(4)ZnSO 在水溶液中的溶解度曲线如图:
4
(3)对比上述两种催化剂的催化性能,工业上应选择的催化剂是 ,使用的合适温度为 。
(4)控制起始时投料比 ,p=1 atm。恒容容器中若只发生反应ⅰ、ⅱ,平衡时各组分的物质的
①从“中和沉淀”工序的滤液中回收ZnSO·H O的操作为蒸发浓缩、 、洗涤、干燥。
4 2
量分数随温度的变化关系如图3。
②用惰性电极电解ZnSO 溶液可制取金属锌。电解后的溶液可在上述流程中的 工序
4
①随投料比增大,CO 的转化率 (填“增大”、“减小”或“不变”)。
2
中循环使用。
②图3中代表CH 的曲线是 (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分
4
(5)“水解”工序中,GeCl 常温下水解生成GeO 的化学方程式为 。
4 2
数约为0,说明此条件下,反应 (填“ⅰ”或“ⅱ”)化学平衡常数大,反应完全。
18.(15分)锗是一种战略性金属,广泛应用于光学及电子工业领域。一种从锌浸渣(主要含ZnFe O 、
2 4
CaSO,另含少量ZnS、SiO 以及GeS )中提取Ge和ZnSO∙H O的工业流程如下:
4 2 2 4 2
19.(14分)酸碱中和滴定、氧化还原滴定在科研和工业生产中都很重要。
Ⅰ.某化学兴趣小组在常温下用标准盐酸滴定未知浓度的氨水。
(1)①在使用滴定管前,首先要进行的操作是 。
②碱式滴定管排气泡时,应选择图示 的操作(填字母)。
a. b. c. d.
已知:①锗元素在稀硫酸中的存在形式:pH≤2.0时主要为Ge4+,2<pH<7时主要为Ge(OH) 。
4
②常温下,K [Ge(OH)]=4.0×10−46,K [Fe(OH) ]=4.0×10−38。
sp 4 sp 3
③该滴定实验中应选择的酸碱指示剂为 (填字母)。
请回答下列问题:
A.石蕊 B.甲基橙 C.酚酞
(1)锗元素位于元素周期表第四周期第ⅣA族,其基态原子的价层电子排布式为 。 (2)实验数据记录如下:
(2)“氧化酸浸”工序中,溶液的pH≈1.5,浸渣的主要成分为SiO、S和 (填化学式);
2 实验序号 1 2 3 4
GeS 被HO 氧化的离子方程式为 。
2 2 2 标准溶液体积/mL 20.58 20.60 20.10 20.62其中一次滴定所用盐酸体积有明显偏差,其可能的原因是 (填字母)。
a.用蒸馏水洗净碱式滴定管后,直接注入待测液
b.接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下
c.滴定结束时,仰视读数
d.达到滴定终点时,发现滴定管尖嘴内有气泡生成
Ⅱ.为了测定草酸(H C O)溶液的浓度,进行如下实验:取25.00 mL HC O 溶液于锥形瓶内,加入适量
2 2 4 2 2 4
稀HSO ,用0.0100 mol·L−1 KMnO 溶液滴定,实验数据如下:
2 4 4
锥形瓶中草酸溶液体
实验序号 滴定管初始读数 滴定管终点读数
积
1 25.00 mL 0.22 mL 20.34 mL
2 25.00 mL 0.25 mL 21.75 mL
3 25.00 mL 0.20 mL 20.28 mL
请回答以下问题:
(3)滴定时,发生反应的离子方程式为 。
(4)判断滴定终点时的现象是 。
(5)计算c(H C O)= 。
2 2 4