文档内容
绝密★启用前
2025-2026 学年度第一学期高二年级期末教学质量监测
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、班级和考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑,如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试
卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C 12 O 16 S32 Ca 40 Cd 112 Ba 137
一、选择题:本题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
1.物质发生化学变化必然伴随有能量转化,以下说法错误的是
A.无人机的续航电池属于二次电池,充电时化学能转化为电能
B.使用家用天然气灶炒菜时,只有部分化学能转化为热能
C.碱性氢氧燃料电池工作时,化学能直接转化为电能且转化率很高
D.触摸 Ba OH �8H O晶体与 NH₄Cl 晶体反应后的烧杯外壁,手感冰凉,说明此反应为吸热反应
2 2
2.化学与生产、生活紧密相关,下列说法错误的是
( )
A.金属焊接时可用 NH₄Cl溶液作除锈剂
B.草木灰与铵态氮肥混用会降低肥效
C.用氯气处理水中的 Cu2+、Hg2+等重金属离子
D.钢闸门接外加电源的负极可防止其被腐蚀
3.氢气是具有发展前景的绿色能源,科研人员研究通过多种途径获取氢气,以下是其中三种途径:
①光照催化水分解: H O(l)=2H (g)+O (g) �H =+571.6kJ·mol -1
2 2 2 1
②焦炭与水高温反应:C(s)+H₂O(g)══CO(g)+H₂(g) ΔH₂=+131.3kJ·mol⁻¹
③甲烷与水高温反应: CH (g)+H O(g)=CO(g)+3H (g) �H =+206.1kJ·mol -1
4 2 2 3
下列说法或热化学方程式正确的是
A.已知H₂O(l)═H₂O(g) �H=+44 kJ·mol⁻¹,则 2H g +O g =2H O g △H=-659.6 kJ·mol⁻¹
2 2 2
B.2CH₄(g)+2H₂O(g)═2CO(g)+6H₂(g)ΔH=+206.1kJ·mol⁻¹
( ) ( ) ( )
C.反应③如果使用催化剂,△H₃减小
D.反应C(s) +2H₂(g)═CH₄(g) �H=-74.8kJ·mol⁻¹
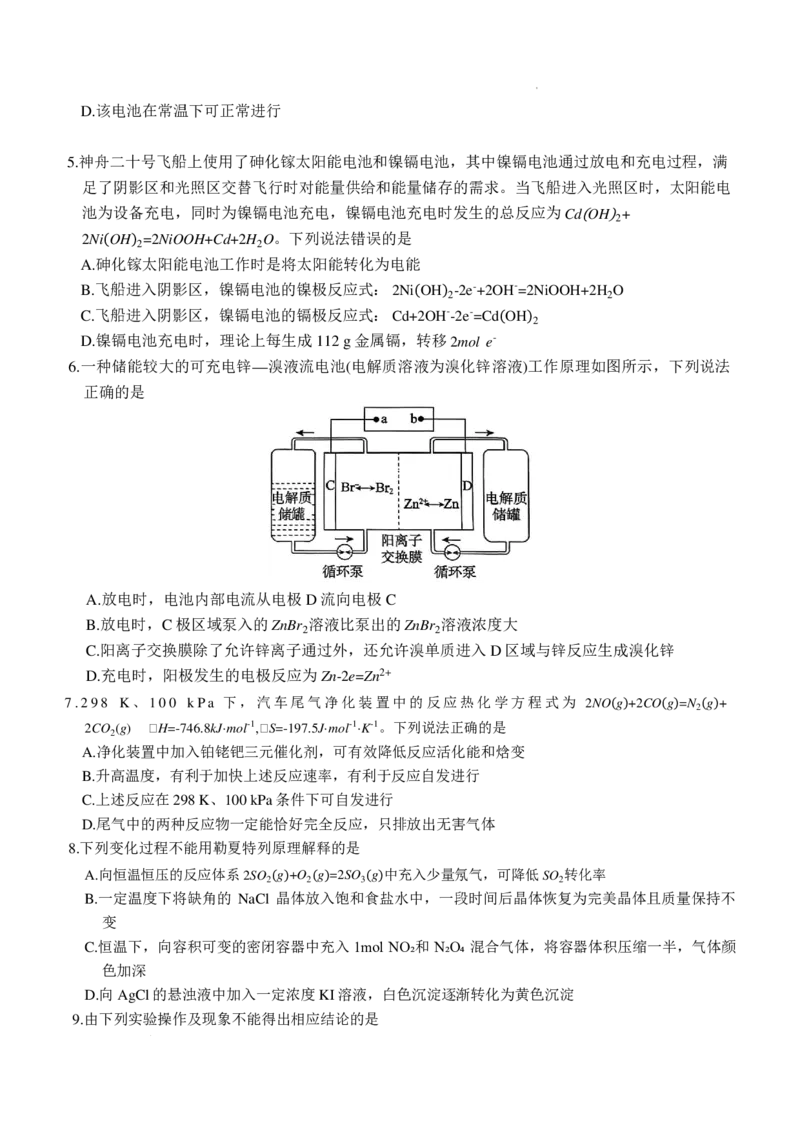
4.热激活电池(又称热电池)可用于火箭和导弹。一种热激活电池的基本结构如图所示,其中作为电解
质的无水 LiCl—KCl 混合物一旦受热熔融,电池瞬间即可输出电能,该电池总反应式为
PbSO +2LiCl+Ca=CaCl +Li SO +Pb。 关于该电池的说法正确的是
4 2 2 4
A.负极的电极反应式: Ca-2e-=Ca2+
B.放电过程中,Cl⁻向硫酸铅电极移动
C.该电池充分反应后,熔融物增重167 g
学科网(北京)股份有限公司D.该电池在常温下可正常进行
5.神舟二十号飞船上使用了砷化镓太阳能电池和镍镉电池,其中镍镉电池通过放电和充电过程,满
足了阴影区和光照区交替飞行时对能量供给和能量储存的需求。当飞船进入光照区时,太阳能电
池为设备充电,同时为镍镉电池充电,镍镉电池充电时发生的总反应为 Cd OH +
2
2Ni OH =2NiOOH+Cd+2H O。下列说法错误的是
2 2 ( )
A.砷化镓太阳能电池工作时是将太阳能转化为电能
( )
B.飞船进入阴影区,镍镉电池的镍极反应式: 2Ni OH -2e-+2OH-=2NiOOH+2H O
2 2
C.飞船进入阴影区,镍镉电池的镉极反应式: Cd+2OH--2e-=Cd OH
( ) 2
D.镍镉电池充电时,理论上每生成112 g金属镉,转移 2mol e-
( )
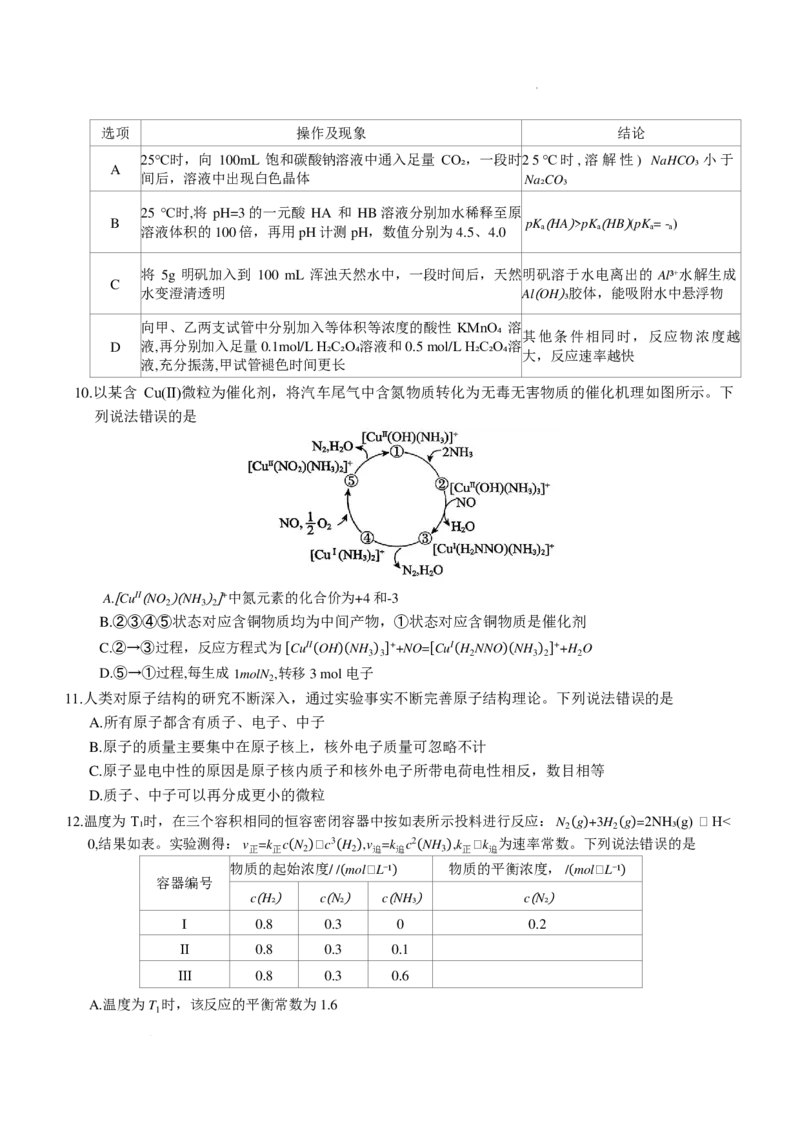
6.一种储能较大的可充电锌—溴液流电池(电解质溶液为溴化锌溶液)工作原理如图所示,下列说法
正确的是
A.放电时,电池内部电流从电极D流向电极C
B.放电时,C极区域泵入的 ZnBr 溶液比泵出的 ZnBr 溶液浓度大
2 2
C.阳离子交换膜除了允许锌离子通过外,还允许溴单质进入D区域与锌反应生成溴化锌
D.充电时,阳极发生的电极反应为 Zn-2e=Zn2+
7.298 K、100 kPa 下,汽车尾气净化装置中的反应热化学方程式为 2NO g +2CO g =N g +
2
2CO 2 (g) �H=-746.8kJ·mol-1,�S=-197.5J·mol-1·K-1。下列说法正确的是 ( ) ( ) ( )
A.净化装置中加入铂铑钯三元催化剂,可有效降低反应活化能和焓变
B.升高温度,有利于加快上述反应速率,有利于反应自发进行
C.上述反应在 298 K、100 kPa条件下可自发进行
D.尾气中的两种反应物一定能恰好完全反应,只排放出无害气体
8.下列变化过程不能用勒夏特列原理解释的是
A.向恒温恒压的反应体系 2SO g +O g =2SO g 中充入少量氖气,可降低 SO 转化率
2 2 3 2
B.一定温度下将缺角的 NaCl 晶体放入饱和食盐水中,一段时间后晶体恢复为完美晶体且质量保持不
( ) ( ) ( )
变
C.恒温下,向容积可变的密闭容器中充入1mol NO₂和 N₂O₄ 混合气体,将容器体积压缩一半,气体颜
色加深
D.向AgCl的悬浊液中加入一定浓度KI溶液,白色沉淀逐渐转化为黄色沉淀
9.由下列实验操作及现象不能得出相应结论的是
学科网(北京)股份有限公司选项 操作及现象 结论
25℃时,向 100mL 饱和碳酸钠溶液中通入足量 CO₂,一段时25℃时,溶解性) NaHCO₃小于
A
间后,溶液中出现白色晶体 Na₂CO₃
25 ℃时,将 pH=3的一元酸 HA 和 HB溶液分别加水稀释至原
B pKₐ HA >pKₐ HB (pKₐ= -ₐ)
溶液体积的100倍,再用pH计测pH,数值分别为4.5、4.0
( ) ( )
将 5g 明矾加入到 100 mL 浑浊天然水中,一段时间后,天然明矾溶于水电离出的 Al³⁺水解生成
C
水变澄清透明 Al OH ₃胶体,能吸附水中悬浮物
向甲、乙两支试管中分别加入等体积等浓度的酸性 KMnO₄ 溶( )
其他条件相同时,反应物浓度越
D 液,再分别加入足量0.1mol/L H₂C₂O₄溶液和0.5 mol/L H₂C₂O₄溶
大,反应速率越快
液,充分振荡,甲试管褪色时间更长
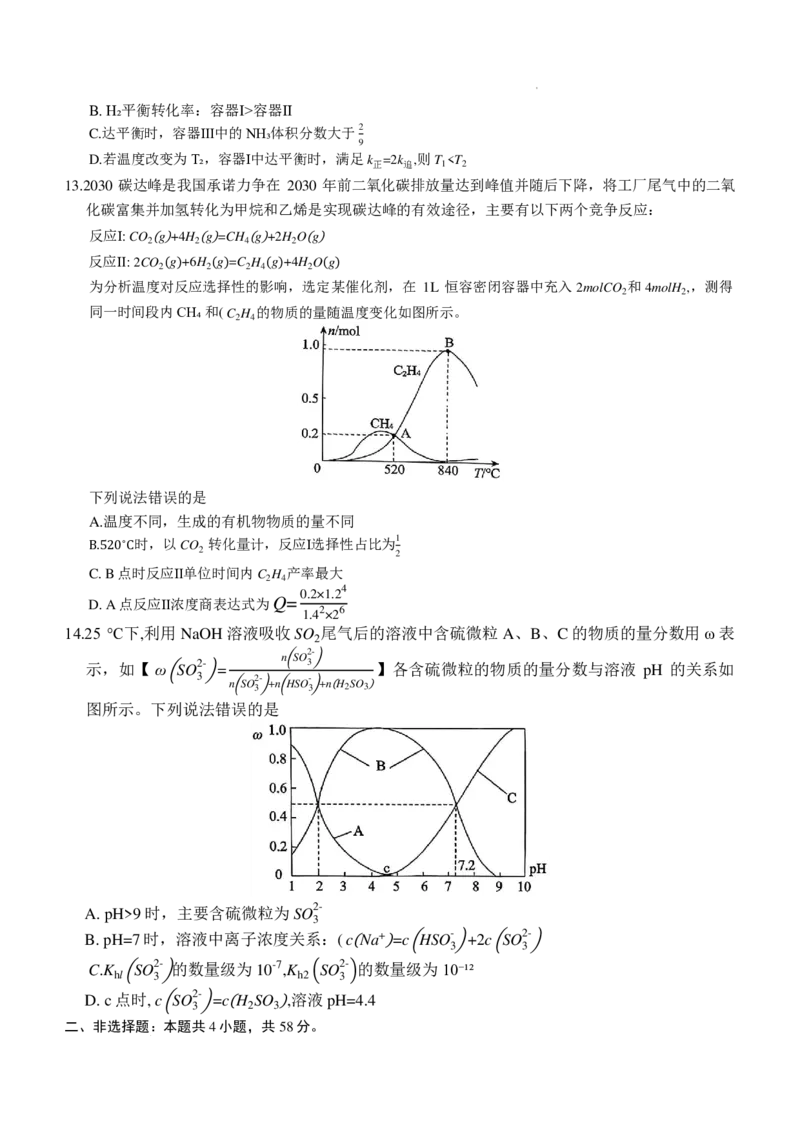
10.以某含 Cu(Ⅱ)微粒为催化剂,将汽车尾气中含氮物质转化为无毒无害物质的催化机理如图所示。下
列说法错误的是
A. CuII NO NH +中氮元素的化合价为+4和-3
2 3 2
B.②③④⑤状态对应含铜物质均为中间产物,①状态对应含铜物质是催化剂
[ ( )( )]
C.②→③过程,反应方程式为 CuII OH NH ++NO= CuI H NNO NH ++H O
3 3 2 3 2 2
D.⑤→①过程,每生成 1molN 2 ,转 [ 移3 ( mo ) l ( 电子 ) ] [ ( )( ) ]
11.人类对原子结构的研究不断深入,通过实验事实不断完善原子结构理论。下列说法错误的是
A.所有原子都含有质子、电子、中子
B.原子的质量主要集中在原子核上,核外电子质量可忽略不计
C.原子显电中性的原因是原子核内质子和核外电子所带电荷电性相反,数目相等
D.质子、中子可以再分成更小的微粒
12.温度为 T₁时,在三个容积相同的恒容密闭容器中按如表所示投料进行反应: N g +3H g =2NH₃(g) �H<
2 2
0,结果如表。实验测得: v =k c N �c3 H ,v =k c2 NH ,k �k 为速率常数。下列说法错误的是
正 正 2 2 追 追 3 正 追 ( ) ( )
物质的起始浓度/ / mol�L⁻¹ 物质的平衡浓度, / mol�L⁻¹
( ) ( ) ( )
容器编号
c H₂ c N(₂ c)NH₃ c N₂ ( )
I (0.)8 (0.)3 ( 0 ) (0.)2
Ⅱ 0.8 0.3 0.1
Ⅲ 0.8 0.3 0.6
A.温度为 T 时,该反应的平衡常数为1.6
1
学科网(北京)股份有限公司B. H₂平衡转化率:容器Ⅰ>容器Ⅱ
C.达平衡时,容器Ⅲ中的 NH₃体积分数大于 2
9
D.若温度改变为 T₂,容器Ⅰ中达平衡时,满足 k =2k ,则 T 9时,主要含硫微粒为 SO 2-
3
B. pH=7时,溶液中离子浓度关系:( c Na+ =c HSO - +2c SO 2-
3 3
C.K hl SO 3 2- 的数量级为 10 -7 ,K h2 SO 3 2 ( - 的 ) 数量 � 级为1 � 0⁻¹² � �
D. c
�
点时,
�
c SO
3
2- =c H
2
SO
3
,溶液
�
pH=
�
4.4
二、非选择题:本题共4小题,共58分。
� � ( )
学科网(北京)股份有限公司15.(14分)某实验小组用标准 NaOH 溶液滴定未知浓度的盐酸。
实验用品:
滴定管夹、50mL 酸式滴定管、50 mL 碱式滴定管、锥形瓶、胶头滴管,未知浓度盐酸、0.1000 mol/L
标准 NaOH溶液、酚酞溶液。
实验步骤:
①洗涤仪器:用蒸馏水洗涤酸式滴定管和碱式滴定管。
②检查仪器:在使用滴定管前,首先要 。
③润洗仪器:从滴定管上口加入 3~5mL 所要盛装的酸或碱溶液,倾斜着转动滴定管,使液
体润湿全部滴定管内壁,然后,一手控制酸式滴定管的活塞(或轻轻挤压碱式滴定管中的玻
璃球),将液体从滴定管下部放入预置的烧杯中。
④加入反应液:分别将酸、碱溶液加入润洗过的酸式滴定管、碱式滴定管中,使液面位于“0”
刻度以上2~3mL处,将滴定管垂直固定在滴定管夹上。
⑤排气泡,记录读数:将酸式滴定管活塞拧开,排出气泡,记录滴定管初始读数恰好为“0”,
将盐酸放入锥形瓶中,记录滴定管读数为25.00 mL,再向锥形瓶内滴加2滴酚酞溶液;将碱
式滴定管的 ,排出气泡,记录读数为“V。”,备用。
⑥中和滴定:右手食指和拇指握住锥形瓶并不断摇动,左手控制碱式滴定管下端橡胶管内玻
璃球,将标准NaOH 溶液逐滴滴入锥形瓶,眼睛观察 ,直至滴入最后半滴 NaOH溶液
后,锥形瓶内溶液变为 色,且30秒内颜色不恢复,停止滴加,记录所用碱式滴定管读
数为V₁。
⑦重复上述实验④⑤⑥步骤2 次。
数据处理:
标准液体积/mL
编号 盐酸的体积mL
V₀ V₁
1 25.00 0.00 24.90
2 25.00 0.00 25.00
3 25.00 0.00 23.00
回答下列问题:
(1)将以上操作①~⑥步骤排序 。将实验步骤空格处补充完整:
步骤②在使用滴定管前,首先要
步骤⑤将碱式滴定管的 ,排出气泡。
步骤⑥眼睛观察 ,锥形瓶内溶液变为 色。
(2)盐酸的浓度为 mol/L。
(3)如果用标准的 AgNO₃溶液滴定未知浓度的KI溶液,盛装标准液的滴定管可用 式滴定管,也
可改用棕色聚四氟乙烯滴定管盛装标准液,用棕色滴定管的原因是 。
(4)如果用标准 NaOH 溶液滴定未知浓度的乙酸溶液,所选指示剂为 (填“甲基橙”或“酚
酞”)。
(5)如果不慎多滴加 2滴标准 NaOH溶液(1滴溶液体积为 0.05mL),计算反应后溶液的 pH约
为 (反应后溶液总体积按50.00 mL计算,lg5=0.7)。
16.(14 分)碳单质包含多种同素异形体,如金刚石、石墨、富勒烯(C₆₀)、碳纳米管、木炭等,其
学科网(北京)股份有限公司微观结构如下:
(1)金刚石是自然界中最硬的物质,可用于切割玻璃,是由于碳原子在空间排列 (填“规则”
或“不规则”),结合 (填“牢固”或“不牢固”),每个碳原子周围最近且距离相等的碳原子
有 个。
(2)可以切断富勒烯骨架上的部分化学键进行开孔,开孔后可以把一些小分子装入碳球中,
C₆₀的相对分子质量为 。
(3)石墨可以导电是因为内部结构中包含自由移动的 (填“原子”“电子”或“离子”),石墨可
作润滑剂,是因为碳原子形成的平面网状结构层层重叠,层与层之间引力微 (填“强”
或“弱”),可以滑动。
(4)碳纳米管可用于柔性显示屏是由于弹性 (填“好”或“不好”),强度 (填“高”或“低”)。
(5)木炭又称为无定形碳,常用于高炉炼铁,碳原子排列 (填“规则”或“不规则”)。
17.(15 分)硫酸钡和碳酸钡是两种常见的钡盐,在进行胃部透视时,为取得良好的检查效果,需要在检查
前服用“钡餐”,“钡餐”的主要成分是硫酸钡。25 ℃时,饱和硫酸钡溶液中硫酸钡含量为
2.33×10-3g�L-1,碳酸钡的 K =2.6×10-9。回答下列问题:
sp
(1)25 ℃时, K BaSO K BaCO (填“>”“<”或“=”)。
sp 4 sp 3
¯
(2)25 ℃时,当钡(离子浓)度 ≤1(.0×10-4m)ol�L-1,对人体无害,胃酸主要成分为盐酸(pH为 1),则用硫酸钡
作为“钡餐”的理由是 ,某患者不慎误服了可溶性钡盐溶液,医生用较大浓度硫酸
钠溶液为患者洗胃,洗胃后胃液中硫酸根最小浓度维持 mol·L⁻¹,才可解除钡离子毒性。
(3)25 ℃时,用过量饱和Na₂CO₃溶液处理重晶石(主要成分为 BaSO₄),可将重晶石部分溶解,所得混
合悬浊液中 c CO 2- :c SO 2- =
3 4
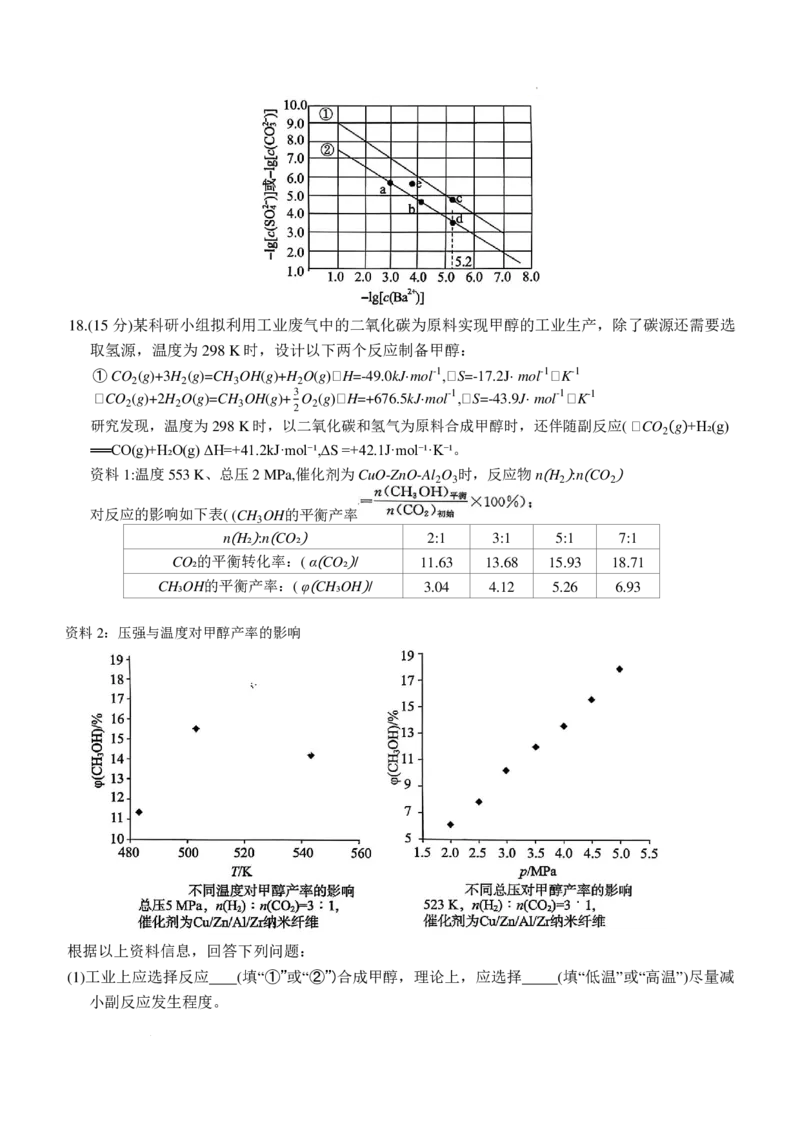
(4)下图是两种钡
�
盐饱
�
和
�
溶液阴
�
阳离子浓度关系,代表碳酸钡饱和溶液中阴阳离子关系的是
(填“①”或“②”)线,c点的坐标为 ,e点时的碳酸钡溶液是 (填“过饱和溶液”或
“不饱和溶液”),要实现②线上的a点到b点,可向原饱和难溶盐溶液中加入含 (填“阳
离子”或“阴离子”)的溶液。
学科网(北京)股份有限公司18.(15分)某科研小组拟利用工业废气中的二氧化碳为原料实现甲醇的工业生产,除了碳源还需要选
取氢源,温度为298 K时,设计以下两个反应制备甲醇:
① CO (g)+3H (g)=CH OH(g)+H O(g)�H=-49.0kJ·mol -1 ,�S=-17.2J· mol -1 �K-1
2 2 3 2
�CO (g)+2H O(g)=CH OH(g)+ 3 O (g)�H=+676.5kJ·mol -1 ,�S=-43.9J· mol -1 �K-1
2 2 3 2
2
研究发现,温度为298 K时,以二氧化碳和氢气为原料合成甲醇时,还伴随副反应( �CO g +H₂(g)
2
══CO(g)+H₂O(g) ΔH=+41.2kJ·mol⁻¹,ΔS =+42.1J·mol⁻¹·K⁻¹。
( )
资料1:温度 553 K、总压 2 MPa,催化剂为 CuO-ZnO-Al O 时,反应物 n H :n CO
2 3 2 2
( ) ( )
对反应的影响如下表( (CH OH的平衡产率
3
n H₂ :n CO₂ 2:1 3:1 5:1 7:1
CO₂的平衡转化率:( α CO₂ / 11.63 13.68 15.93 18.71
( ) ( )
CH₃OH的平衡产率:( φ CH₃OH / 3.04 4.12 5.26 6.93
( )
( )
资料2:压强与温度对甲醇产率的影响
根据以上资料信息,回答下列问题:
(1)工业上应选择反应 (填“①”或“②”)合成甲醇,理论上,应选择 (填“低温”或“高温”)尽量减
小副反应发生程度。
学科网(北京)股份有限公司(2)根据资料1信息,当反应温度、总压、催化剂等条件相同时,增加 (填“氢气”或“二氧化碳”)所占
比例,可提高二氧化碳利用率, n H :n CO 为7:1与2:1时甲醇选择性比为 (列出代数式即
2 2
可,选择性=生成甲醇消耗的二氧化碳的量/反应消耗的二氧化碳的总量)。
( ) ( )
(3)根据资料2信息,523 K时,总压5 MPa,催化剂为 Cu/ Zn/ Al/ Zr纳米纤维条件下,充入H₂ 300 mol,CO₂ 10
0 mol,反应用时 40 min,①、③均达平衡时,生成 18 mol 甲醇和 34 mol CO,则 H₂的反应速率·
v H = mol�min
-1。
2
¯
(4)( 根据 ) 资料2信息,当反应总压、催化剂、投料比等条件固定时,选择523 K温度的原因为
(至少答出两条)。
(5)温度 553 K、催化剂为 CuO-ZnO-Al O 、总压2MPa下,向起始容器体积为1000 L 的密闭容器中,充
2 3
入 n H =700mol,n CO =100mol,同时发生反应①和③,以下说法能说明反应①达到平衡状态的是
2 2
(填标号)。
( ) ( )
a.气体密度不再变化
b. v(H₂,消耗)=3v(CH₃OH,消耗)
c.混合气体平均摩尔质量不再变化
d. CO浓度不再变化
计算达到平衡时反应③的压强平衡常数 K =_(列出代数式即可;分压=总压×物质的量分数)。
p
学科网(北京)股份有限公司