文档内容
常德市一中 2025 届高三第一次月水平检测
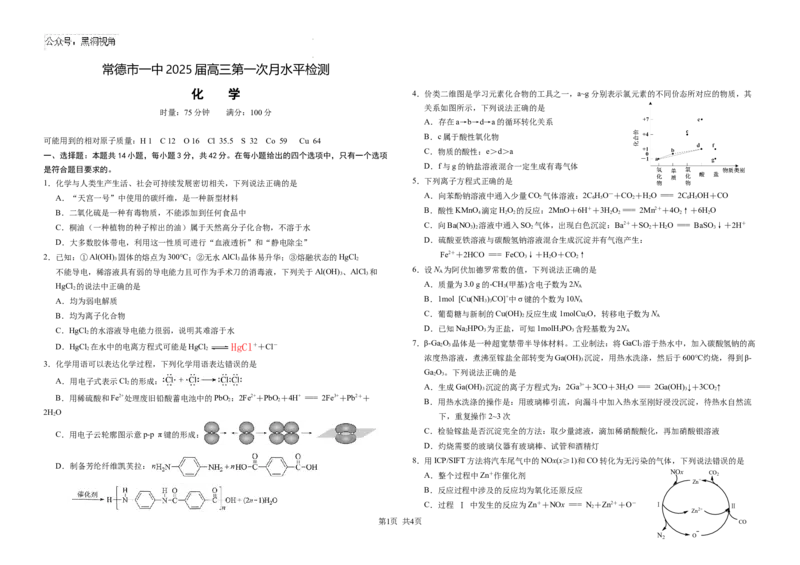
化 学 4.价类二维图是学习元素化合物的工具之一,a~g分别表示氯元素的不同价态所对应的物质,其
关系如图所示,下列说法正确的是
时量:75分钟 满分:100分
A.存在a→b→d→a的循环转化关系
B.c属于酸性氧化物
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 S 32 Co 59 Cu 64
C.物质的酸性:e>d>a
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个选项
D.f与g的钠盐溶液混合一定生成有毒气体
是符合题目要求的。
1.化学与人类生产生活、社会可持续发展密切相关,下列说法正确的是 5.下列离子方程式正确的是
A.“天宫一号”中使用的碳纤维,是一种新型材料 A.向苯酚钠溶液中通入少量CO 2 气体溶液:2C 6 H 5 O—+CO 2 +H 2 O === 2C 6 H 5 OH+CO
B.二氧化硫是一种有毒物质,不能添加到任何食品中 B.酸性KMnO 4 滴定H 2 O 2 的反应:2MnO+6H++3H 2 O 2 === 2Mn2++4O 2 ↑+6H 2 O
C.桐油(一种植物的种子榨出的油)属于天然高分子化合物,不溶于水 C.向Ba(NO 3 ) 2 溶液中通入SO 2 气体,出现白色沉淀:Ba2++SO 2 +H 2 O === BaSO 3 ↓+2H+
D.大多数胶体带电,利用这一性质可进行“血液透析”和“静电除尘” D.硫酸亚铁溶液与碳酸氢钠溶液混合生成沉淀并有气泡产生:
2.已知:①Al(OH) 3 固体的熔点为300℃;②无水AlCl 3 晶体易升华;③熔融状态的HgCl 2 Fe2++2HCO === FeCO 3 ↓+H 2 O+CO 2 ↑
不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于Al(OH) 3 、AlCl 3 和 6.设N A 为阿伏加德罗常数的值,下列说法正确的是
HgCl 2 的说法中正确的是 A.质量为3.0 g的-CH 3 (甲基)含电子数为2N A
A.均为弱电解质 B.1mol [Cu(NH 3 ) 3 CO]+中σ键的个数为10N A
B.均为离子化合物 C.葡萄糖与新制的Cu(OH) 2 反应生成1molCu 2 O,转移电子数为N A
C.HgCl 2 的水溶液导电能力很弱,说明其难溶于水 D.已知Na 2 HPO 3 为正盐,可知1molH 3 PO 3 含羟基数为2N A
D.HgCl 在水中的电离方程式可能是HgCl HgCl++Cl- 7.β-Ga 2 O 3 晶体是一种超宽禁带半导体材料。工业制法:将GaCl 3 溶于热水中,加入碳酸氢钠的高
2 2
浓度热溶液,煮沸至镓盐全部转变为Ga(OH) 沉淀,用热水洗涤,然后于600℃灼烧,得到β-
3
3.化学用语可以表达化学过程,下列化学用语表达错误的是
GaO。下列说法正确的是
2 3
A.用电子式表示Cl 的形成:
2 A.生成Ga(OH) 沉淀的离子方程式为:2Ga3++3CO+3HO === 2Ga(OH) ↓+3CO↑
3 2 3 2
B.用稀硫酸和Fe2+处理废旧铅酸蓄电池中的PbO :2Fe2++PbO +4H+ === 2Fe3++Pb2++
2 2 B.用热水洗涤的操作是:用玻璃棒引流,向漏斗中加入热水至刚好浸没沉淀,待热水自然流
2HO
2 下,重复操作2~3次
C.检验镓盐是否沉淀完全的方法:取少量滤液,滴加稀硝酸酸化,再加硝酸银溶液
C.用电子云轮廓图示意p-p π键的形成:
D.灼烧需要的玻璃仪器有玻璃棒、试管和酒精灯
8.用ICP/SIFT方法将汽车尾气中的NOx(x≥1)和CO转化为无污染的气体,下列说法错误的是
D.制备芳纶纤维凯芙拉:
A.整个过程中Zn+作催化剂 NOx CO2
Zn+
B.反应过程中涉及的反应均为氧化还原反应
C.过程 Ⅰ 中发生的反应为Zn++NOx === N 2 +Zn2++O- Ⅰ Ⅱ
Zn2+
第1页 共4页 CO
学科网(北京)股份有限公司
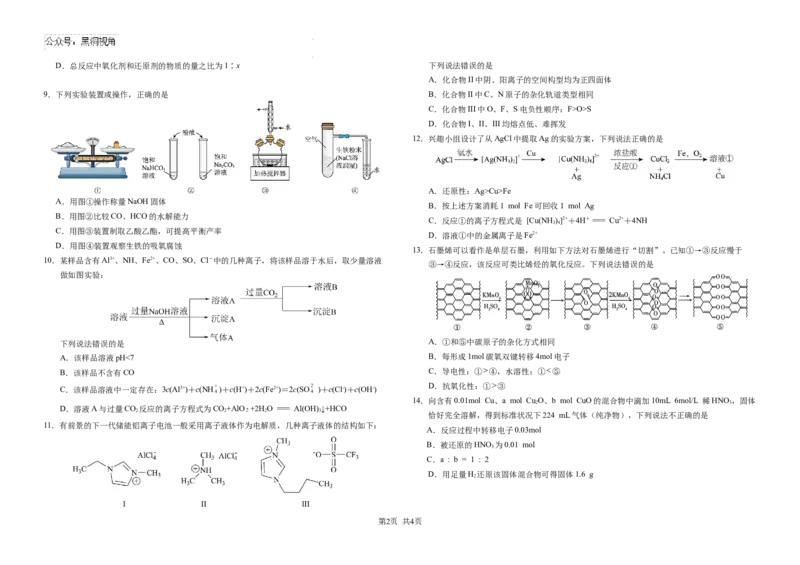
N 2 OD.总反应中氧化剂和还原剂的物质的量之比为1∶x 下列说法错误的是
A.化合物II中阴、阳离子的空间构型均为正四面体
9.下列实验装置或操作,正确的是 B.化合物II中C、N原子的杂化轨道类型相同
C.化合物III中O、F、S电负性顺序:F>O>S
D.化合物I、II、III均熔点低、难挥发
12.兴趣小组设计了从AgCl中提取Ag的实验方案,下列说法正确的是
A.还原性:Ag>Cu>Fe
A.用图①操作称量NaOH固体
B.按上述方案消耗1 mol Fe可回收1 mol Ag
B.用图②比较CO、HCO的水解能力
C.反应①的离子方程式是 [Cu(NH )]2++4H+ === Cu2++4NH
3 4
C.用图③装置制取乙酸乙酯,可提高平衡产率
D.溶液①中的金属离子是Fe2+
D.用图④装置观察生铁的吸氧腐蚀
13.石墨烯可以看作是单层石墨,利用如下方法对石墨烯进行“切割”。已知①→③反应慢于
10.某样品含有Al3+、NH、Fe2+、CO、SO、Cl-中的几种离子,将该样品溶于水后,取少量溶液
③→④反应,该反应可类比烯烃的氧化反应。下列说法错误的是
做如图实验:
下列说法错误的是 A.①和⑤中碳原子的杂化方式相同
A.该样品溶液pH<7 B.每形成1mol碳氧双键转移4mol电子
B.该样品不含有CO C.导电性:① ④,水溶性:① ⑤
D.抗氧化性:① ③
C.该样品溶液中一定存在:3c(Al3+)+c(NH )+c(H+)+2c(Fe2+)=2c(SO )+c(Cl-)+c(OH-)
14.向含有0.01mol Cu、a mol Cu O、b mol CuO的混合物中滴加10mL 6mol/L 稀HNO,固体
2 3
D.溶液A与过量CO 反应的离子方程式为CO+AlO +2H O === Al(OH) ↓+HCO
2 2 2 3
恰好完全溶解,得到标准状况下224 mL气体(纯净物),下列说法不正确的是
11.有前景的下一代储能铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下:
A.反应过程中转移电子0.03mol
B.被还原的HNO 为0.01 mol
3
C.a : b = 1 : 2
D.用足量H 还原该固体混合物可得固体1.6 g
2
第2页 共4页
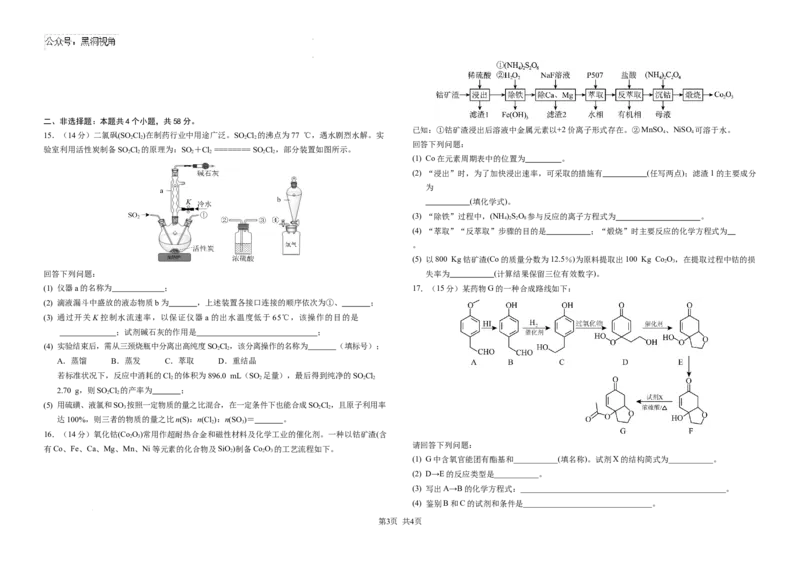
学科网(北京)股份有限公司二、非选择题:本题共4个小题,共58分。
已知:①钴矿渣浸出后溶液中金属元素以+2价离子形式存在。②MnSO 、NiSO 可溶于水。
15.(14分)二氯砜(SO Cl)在制药行业中用途广泛。SO Cl 的沸点为77 ℃,遇水剧烈水解。实 4 4
2 2 2 2
回答下列问题:
验室利用活性炭制备SO Cl 的原理为:SO +Cl ======== SO Cl,部分装置如图所示。
2 2 2 2 2 2
(1) Co在元素周期表中的位置为 。
(2) “浸出”时,为了加快浸出速率,可采取的措施有 (任写两点);滤渣1的主要成分
为
(填化学式)。
(3) “除铁”过程中,(NH )SO 参与反应的离子方程式为 。
4 2 2 8
(4) “萃取”“反萃取”步骤的目的是 ;“煅烧”时主要反应的化学方程式为
。
(5) 以800 Kg钴矿渣(Co的质量分数为12.5%)为原料提取出100 Kg Co O,在提取过程中钴的损
2 3
回答下列问题: 失率为 (计算结果保留三位有效数字)。
(1) 仪器a的名称为 ; 17.(15分)某药物G的一种合成路线如下:
(2) 滴液漏斗中盛放的液态物质b为 ,上述装置各接口连接的顺序依次为①、 ;
(3) 通过开关K控制水流速率,以保证仪器a的出水温度低于65℃,该操作的目的是
;试剂碱石灰的作用是 ;
(4) 实验结束后,需从三颈烧瓶中分离出高纯度SO Cl,该分离操作的名称为 (填标号);
2 2
A.蒸馏 B.蒸发 C.萃取 D.重结晶
若标准状况下,反应中消耗的Cl 的体积为896.0 mL(SO 足量),最后得到纯净的SO Cl
2 2 2 2
2.70 g,则SO Cl 的产率为 ;
2 2
(5) 用硫磺、液氯和SO 按照一定物质的量之比混合,在一定条件下也能合成SO Cl,且原子利用率
3 2 2
达100%,则三者的物质的量之比n(S):n(Cl ):n(SO )= 。
2 3
16.(14分)氧化钴(Co O)常用作超耐热合金和磁性材料及化学工业的催化剂。一种以钴矿渣(含
2 3
请回答下列问题:
有Co、Fe、Ca、Mg、Mn、Ni等元素的化合物及SiO)制备Co O 的工艺流程如下。
2 2 3
(1) G中含氧官能团有酯基和___________(填名称)。试剂X的结构简式为___________。
(2) D→E的反应类型是___________。
(3) 写出A→B的化学方程式:___________________________________________________。
(4) 鉴别B和C的试剂和条件是________________________________。
第3页 共4页
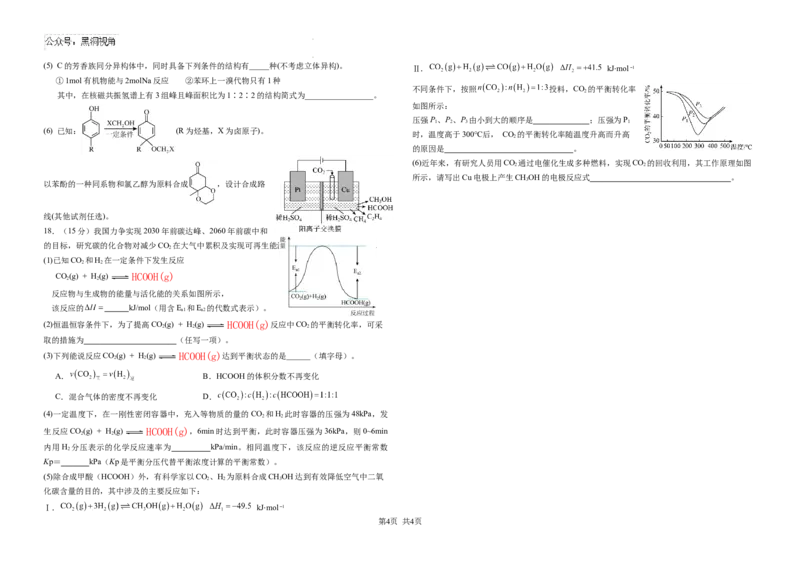
学科网(北京)股份有限公司(5) C的芳香族同分异构体中,同时具备下列条件的结构有_____种(不考虑立体异构)。
Ⅱ. kJmol
①1mol有机物能与2molNa反应 ②苯环上一溴代物只有1种
⋅
不同条件下,按照 投料,CO 的平衡转化率
2
其中,在核磁共振氢谱上有3组峰且峰面积比为1∶2∶2的结构简式为_________________。
如图所示:
压强P、P、P 由小到大的顺序是 ;压强为P
1 2 3 1
(6) 已知: (R为烃基,X为卤原子)。
时,温度高于300℃后, CO 的平衡转化率随温度升高而升高
2
的原因是 。
(6)近年来,有研究人员用CO 通过电催化生成多种燃料,实现CO 的回收利用,其工作原理如图
2 2
所示,请写出Cu电极上产生CHOH的电极反应式 。
3
以苯酚的一种同系物和氯乙醇为原料合成 ,设计合成路
线(其他试剂任选)。
18.(15分)我国力争实现2030年前碳达峰、2060年前碳中和
的目标,研究碳的化合物对减少CO 在大气中累积及实现可再生能源的有效利用具有重要意义。
2
(1)已知CO 和H 在一定条件下发生反应
2 2
CO(g) + H(g) HCOOH(g)
2 2
反应物与生成物的能量与活化能的关系如图所示,
该反应的 kJ/mol(用含E 和E 的代数式表示)。
a1 a2
(2)恒温恒容条件下,为了提高CO(g) + H(g) HCOOH(g)反应中CO 的平衡转化率,可采
2 2 2
取的措施为 (任写一项)。
(3)下列能说反应CO(g) + H(g) HCOOH(g)达到平衡状态的是______(填字母)。
2 2
A. B.HCOOH的体积分数不再变化
C.混合气体的密度不再变化 D.
(4)一定温度下,在一刚性密闭容器中,充入等物质的量的CO 和H 此时容器的压强为48kPa,发
2 2
生反应CO(g) + H(g) HCOOH(g),6min时达到平衡,此时容器压强为36kPa,则0~6min
2 2
内用H 分压表示的化学反应速率为 kPa/min。相同温度下,该反应的逆反应平衡常数
2
Kp= kPa(Kp是平衡分压代替平衡浓度计算的平衡常数)。
(5)除合成甲酸(HCOOH)外,有科学家以CO、H 为原料合成CHOH达到有效降低空气中二氧
2 2 3
化碳含量的目的,其中涉及的主要反应如下:
Ⅰ. kJmol
第4页 共4页
⋅
学科网(北京)股份有限公司