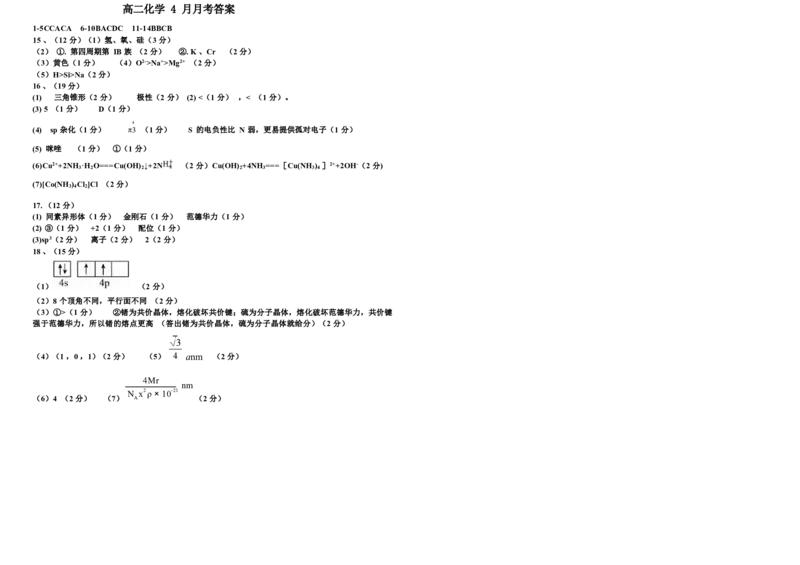文档内容
高二化学 4 月月考试卷
本试卷满分 100 分,考试时间:75 分钟
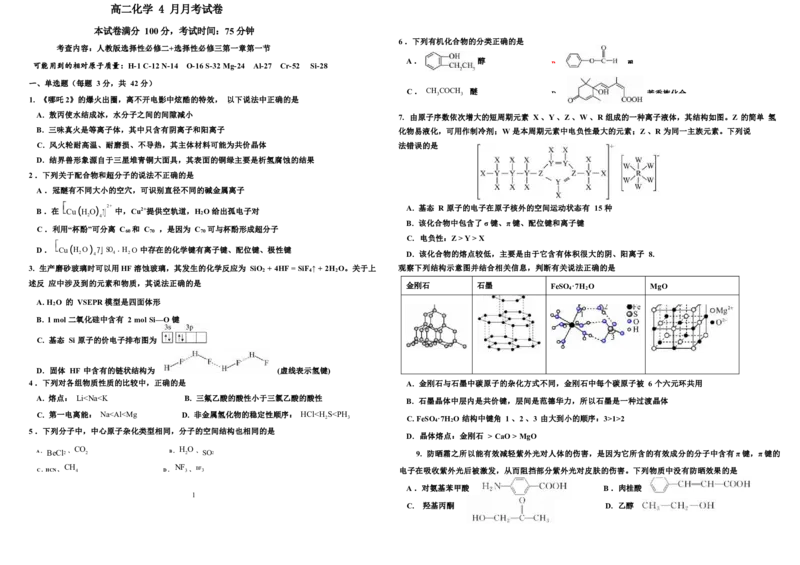
6 .下列有机化合物的分类正确的是
考查内容:人教版选择性必修二+选择性必修三第一章第一节
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Mg-24 Al-27 Cr-52 Si-28 A . 醇 B 酯
一、单选题(每题 3 分,共 42 分)
C . CH 3 COCH 3 醚 D 芳香族化合
1. 《哪吒2》的爆火出圈,离不开电影中炫酷的特效, 以下说法中正确的是
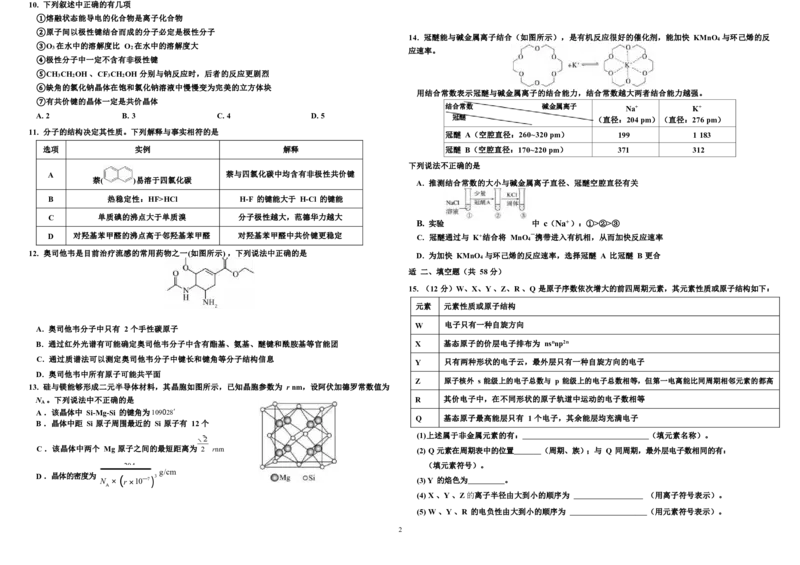
A. 敖丙使水结成冰,水分子之间的间隙减小 7. 由原子序数依次增大的短周期元素 X 、Y 、Z 、W 、R 组成的一种离子液体,其结构如图。Z 的简单 氢
B. 三味真火是等离子体,其中只含有阴离子和阳离子 化物易液化,可用作制冷剂;W 是本周期元素中电负性最大的元素;Z 、R 为同一主族元素。下列说
C. 风火轮耐高温、耐磨损、不导热,其主体材料可能为共价晶体 法错误的是
D. 结界兽形象源自于三星堆青铜大面具,其表面的铜绿主要是析氢腐蚀的结果
2 .下列关于配合物和超分子的说法不正确的是
A .冠醚有不同大小的空穴,可识别直径不同的碱金属离子
B .在 Cu (H 2 O) 4 7」 2+ 中,Cu2+提供空轨道,H 2 O 给出孤电子对 A. 基态 R 原子的电子在原子核外的空间运动状态有 15 种
B. 该化合物中包含了σ键、π键、配位键和离子键
C .利用“杯酚”可分离 C 和 C ,是因为 C 可与杯酚形成超分子
60 70 70
C. 电负性:Z > Y > X
D . Cu (H O ) 7」SO . H O 中存在的化学键有离子键、配位键、极性键
2 4 4 2 D. 该化合物的熔点较低,主要是由于它含有体积很大的阴、阳离子 8.
3. 生产磨砂玻璃时可以用HF 溶蚀玻璃,其发生的化学反应为 SiO + 4HF = SiF ↑ + 2H O。关于上 观察下列结构示意图并结合相关信息,判断有关说法正确的是
2 4 2
述反 应中涉及到的元素和物质,其说法正确的是 金刚石 石墨 FeSO ·7H O MgO
4 2
A. H O 的 VSEPR 模型是四面体形
2
B. 1 mol 二氧化硅中含有 2 mol Si—O 键
C. 基态 Si 原子的价电子排布图为
D. 固体 HF 中含有的链状结构为 (虚线表示氢键)
4 .下列对各组物质性质的比较中,正确的是 A. 金刚石与石墨中碳原子的杂化方式不同,金刚石中每个碳原子被 6 个六元环共用
A. 熔点: Li1>2
4 2
5 .下列分子中,中心原子杂化类型相同,分子的空间结构也相同的是
D. 晶体熔点:金刚石 > CaO > MgO
CO HO
A . BeCl2 、 2 B . 2 、 SO2 9. 防晒霜之所以能有效减轻紫外光对人体的伤害,是因为它所含的有效成分的分子中含有π键,π键的
CH NF
C .HCN 、 4 D . 3 、 BF3 电子在吸收紫外光后被激发,从而阻挡部分紫外光对皮肤的伤害。下列物质中没有防晒效果的是
A .对氨基苯甲酸 B .肉桂酸
1
C. 羟基丙酮 D. 乙醇10. 下列叙述中正确的有几项
熔融状态能导电的化合物是离子化合物
原子间以极性键结合而成的分子必定是极性分子
① 14. 冠醚能与碱金属离子结合(如图所示),是有机反应很好的催化剂,能加快 KMnO 与环己烯的反
4
O 在水中的溶解度比 O 在水中的溶解度大
② 3 2 应速率。
极性分子中一定不含有非极性键
③
CH CH OH 、CF CH OH 分别与钠反应时,后者的反应更剧烈
④ 3 2 3 2
缺角的氯化钠晶体在饱和氯化钠溶液中慢慢变为完美的立方体块
⑤ 用结合常数表示冠醚与碱金属离子的结合能力,结合常数越大两者结合能力越强。
有共价键的晶体一定是共价晶体
⑥ 结合常数 碱金属离子 Na+ K+
A ⑦ . 2 B. 3 C. 4 D. 5 冠醚 (直径:204 pm)(直径:276 pm)
11. 分子的结构决定其性质。下列解释与事实相符的是 冠醚 A(空腔直径:260~320 pm) 199 1 183
选项 实例 解释 冠醚 B(空腔直径:170~220 pm) 371 312
下列说法不正确的是
A 萘与四氯化碳中均含有非极性共价键
萘( )易溶于四氯化碳
A. 推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关
B 热稳定性:HF>HCl H-F 的键能大于 H-Cl 的键能
C 单质碘的沸点大于单质溴 分子极性越大,范德华力越大
B. 实验 中 c(Na+ ):①>②>③
D 对羟基苯甲醛的沸点高于邻羟基苯甲醛 对羟基苯甲醛中共价键更稳定 C. 冠醚通过与 K+结合将 MnO —携带进入有机相,从而加快反应速率
4
12. 奥司他韦是目前治疗流感的常用药物之一(如图所示) ,下列说法中正确的是 D. 为加快 KMnO 与环己烯的反应速率,选择冠醚 A 比冠醚 B 更合
4
适 二、填空题(共 58 分)
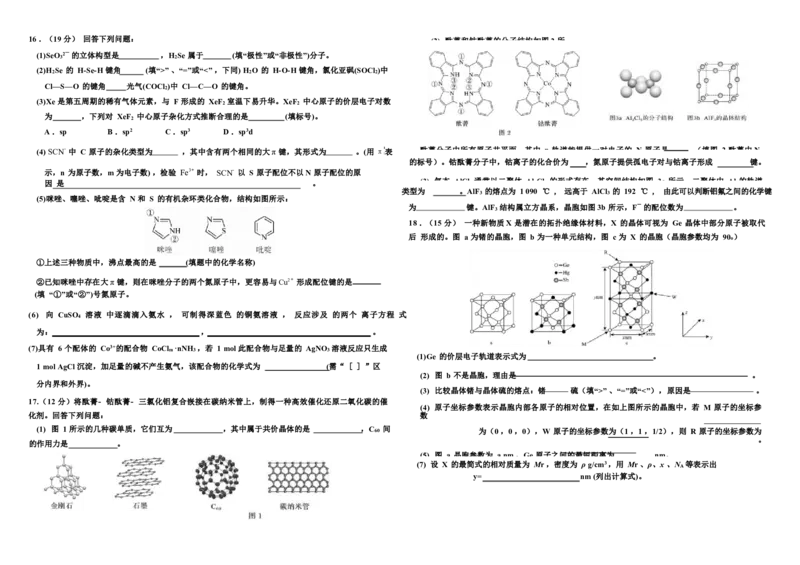
15. (12 分)W、X、Y 、Z、R 、Q 是原子序数依次增大的前四周期元素,其元素性质或原子结构如下:
元素 元素性质或原子结构
W 电子只有一种自旋方向
A. 奥司他韦分子中只有 2 个手性碳原子
B. 通过红外光谱有可能确定奥司他韦分子中含有酯基、氨基、醚键和酰胺基等官能团 X 基态原子的价层电子排布为 nsnnp2n
C. 通过质谱法可以测定奥司他韦分子中键长和键角等分子结构信息 Y 只有两种形状的电子云,最外层只有一种自旋方向的电子
D. 奥司他韦中所有原子可能共平面
Z 原子核外 s 能级上的电子总数与 p 能级上的电子总数相等,但第一电离能比同周期相邻元素的都高
13. 硅与镁能够形成二元半导体材料,其晶胞如图所示,已知晶胞参数为 r nm,设阿伏加德罗常数值为
N 。下列说法中不正确的是 R 其价电子中,在不同形状的原子轨道中运动的电子数相等
A
A .该晶体中 Si-Mg-Si 的键角为109028’
Q 基态原子最高能层只有 1 个电子,其余能层均充满电子
B .晶体中距 Si 原子周围最近的 Si 原子有 12 个
(1)上述属于非金属元素的有: (填元素名称)。
C .该晶体中两个 Mg 原子之间的最短距离为 rnm (2) Q 元素在周期表中的位置 (周期、族);与 Q 同周期,最外层电子数相同的有:
304 (填元素符号)。
g/cm
D .晶体的密度为 N × ( r ×10—7 )3 (3) Y 的焰色为 。
A
(4) X 、Y 、Z的离子半径由大到小的顺序为 (用离子符号表示)。
(5) W 、Y 、R 的电负性由大到小的顺序为 (用元素符号表示)。
216 .(19 分) 回答下列问题: (2) 酞菁和钴酞菁的分子结构如图2 所
(1)SeO 2— 的立体构型是 ,H Se 属于 (填“极性”或“非极性”)分子。
3 2
(2)H Se 的 H-Se-H 键角 (填“>” 、“=”或“<” ,下同) H O 的 H-O-H 键角,氯化亚砜(SOCl )中
2 2 2
Cl—S—O 的键角 光气(COCl )中 Cl—C—O 的键角。
2
(3)Xe 是第五周期的稀有气体元素,与 F 形成的 XeF 室温下易升华。XeF 中心原子的价层电子对数
2 2
为 ,下列对 XeF 中心原子杂化方式推断合理的是 (填标号)。
2
A .sp B .sp2 C .sp3 D .sp3d
(4) SCN- 中 C 原子的杂化类型为 ,其中含有两个相同的大π 键,其形式为 。(用π表 酞菁分子中所有原子共平面,其中 p 轨道能提供一对电子的 N 原子是 (填图 2 酞菁中N
的标号)。钴酞菁分子中,钴离子的化合价为 ,氮原子提供孤电子对与钴离子形成 键。
示,n 为原子数,m 为电子数) ,检验 Fe3+ 时, SCN- 以 S 原子配位不以N 原子配位的原
因 是 。 (3) 气态 AlCl 3 通常以二聚体 Al 2 Cl 6 的形式存在,其空间结构如图 3a 所示,二聚体中 Al 的轨道
类型为 。AlF 的熔点为 1 090 ℃ , 远高于 AlCl 的 192 ℃ , 由此可以判断铝氟之间的化学键
3 3
(5)咪唑、噻唑、呲啶是含 N 和 S 的有机杂环类化合物,结构如图所示:
为 键。AlF 结构属立方晶系,晶胞如图3b 所示,F— 的配位数为 。
3
18 .(15 分) 一种新物质X 是潜在的拓扑绝缘体材料,X 的晶体可视为 Ge 晶体中部分原子被取代
后 形成的。图 a 为锗的晶胞,图 b 为一种单元结构,图 c 为 X 的晶胞(晶胞参数均为 90o )
①上述三种物质中,沸点最高的是 (填题中的化学名称)
②已知咪唑中存在大π 键,则在咪唑分子的两个氮原子中,更容易与Cu2+ 形成配位键的是
(填 “①”或“②”)号氮原子。
(6) 向 CuSO 溶液 中逐滴滴入氨水 , 可制得深蓝色 的铜氨溶液 , 反应涉及 的两个 离子方程 式
4
为: , 。
(7)具有 6 个配体的 Co3+的配合物 CoCl ·nNH ,若 1 mol 此配合物与足量的 AgNO 溶液反应只生成
m 3 3
(1)Ge 的价层电子轨道表示式为 。
1 mol AgCl 沉淀,加足量的碱不产生氨气,该配合物的化学式为 (需“ [ ] ”区
(2) 图 b 不是晶胞,理由是 。
分内界和外界)。
(3) 比较晶体锗与晶体硫的熔点:锗 硫(填“>” 、“=”或“<”),原因是 。
17.(12 分)将酞菁- 钴酞菁- 三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催
(4) 原子坐标参数表示晶胞内部各原子的相对位置,在如上图所示的晶胞中,若 M 原子的坐标参
化剂。回答下列问题: 数
(1) 图 1 所示的几种碳单质,它们互为 ,其中属于共价晶体的是 ,C 60 间 为(0 ,0 ,0),W 原子的坐标参数为(1 ,1 ,1/2),则 R 原子的坐标参数为
。
的作用力是 。
(5) 图 a 晶胞参数为 a nm ,Ge 原子之间的最短距离为 nm。
(7) 设 X 的最简式的相对质量为 Mr ,密度为 ρ g/cm3 ,用 Mr 、ρ、x 、N 等表示出
A
y= nm (列出计算式)。高二化学 4 月月考答案
1-5CCACA 6-10BACDC 11-14BBCB
15 、(12 分)(1)氢、氧、硅(3 分)
(2) ①. 第四周期第 IB 族 (2 分) ②. K 、Cr (2 分)
(3)黄色(1 分) (4)O2->Na+>Mg2+ (2 分)
(5)H>Si>Na(2 分)
16 、(19 分)
(1) 三角锥形(2 分) 极性(2 分) (2) <(1 分) ,< (1 分)。
(3) 5 (1 分) D(1 分)
4
(4) sp 杂化(1 分) π3 (1 分) S 的电负性比 N 弱,更易提供孤对电子(1 分)
(5) 咪唑 (1 分) ①(1 分)
(6)Cu2++2NH ·H O===Cu(OH) ↓+2N (2 分)Cu(OH) +4NH ===[Cu(NH ) ]2++2OH-(2 分)
3 2 2 2 3 3 4
(7)[Co(NH ) Cl ]Cl (2 分)
3 4 2
17. (12 分)
(1) 同素异形体(1 分) 金刚石(1 分) 范德华力(1 分)
(2) ③(1 分) +2(1 分) 配位(1 分)
(3)sp3(2 分) 离子(2 分) 2(2 分)
18 、(15 分)
(1) (2 分)
(2)8 个顶角不同,平行面不同 (2 分)
(3)①>(1 分) ②锗为共价晶体,熔化破坏共价键;硫为分子晶体,熔化破坏范德华力,共价键
强于范德华力,所以锗的熔点更高 (答出锗为共价晶体,硫为分子晶体就给分)(2 分)
(4)(1 ,0 ,1)(2 分) (5) anm (2 分)
4Mr
nm
N x2 ρ × 10-21
(6)4 (2 分) (7) A (2 分)