文档内容
红岭中学(红岭教育集团)2025 届高三第二次统一考
试
化学试卷
(说明:考试时间为75分钟,满分为100分)
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 S 32 Cu 64
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,
每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 中华文明源远流长,化学与文化传承密不可分。下列物质主要由合金材料制成的是
B.《孙子兵法》竹
A.薄胎玉壶 C.唐三彩俑 D.曾侯乙青铜编钟
简
2. 神舟十六号载人飞船展示了中国航天事业的强大实力和技术水平。下列叙述不正确的是
A.空间站使用的电池所含238Pu和244Pu互为同位素
B.飞船使用的Si N 隔热层材料属于硅酸盐
3 4
C.空间站存储器所用的材料石墨烯与C 互为同素异形体
60
D.飞船核心器件之一的石英晶体属于共价晶体
3.侯德榜联合制碱法的原理之一是 。下列
说法正确的是
A.基态N原子的轨道表示式若写为 ,则违背了洪特规则
B.NH 、CO 和HO均为非电解质
3 2 2
C.氯化钠的电子式为
D.CO 、NH +和HO的中心原子均为sp3杂化
2 4 2
4.化学之美随处可见。下列叙述正确的是
A.环己烷(CH )呈现对称美,在水溶液中有较大的溶解度
6 12
B.五光十色的霓虹灯发光变色过程属于化学变化
C.密封在玻璃管内的碘单质受热产生紫色碘蒸气,破坏了非极性共价键
D.锌片在AgNO 溶液中生成“银树”,Zn的金属性大于Ag
3
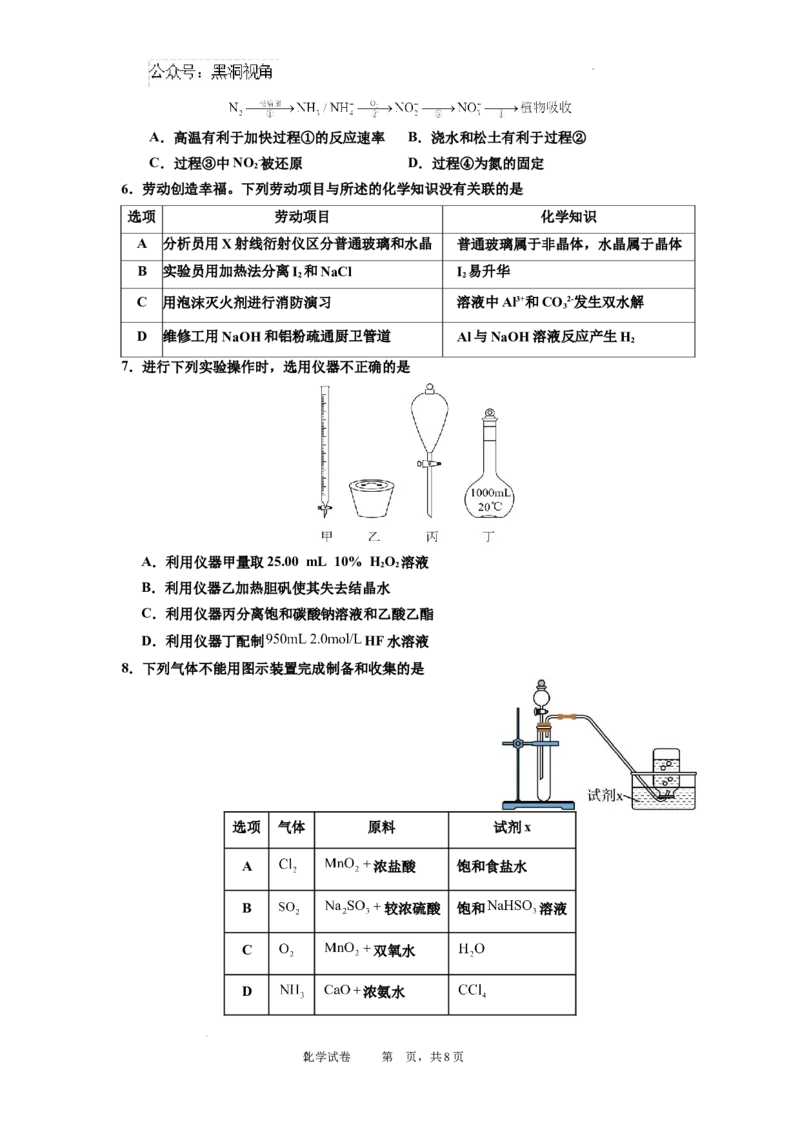
5. 植物对氮元素的吸收过程如下,下列说法正确的是
化1 学试卷 第 页,共8页
学科网(北京)股份有限公司A.高温有利于加快过程①的反应速率 B.浇水和松土有利于过程②
C.过程③中NO -被还原 D.过程④为氮的固定
2
6.劳动创造幸福。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 分析员用X射线衍射仪区分普通玻璃和水晶 普通玻璃属于非晶体,水晶属于晶体
B 实验员用加热法分离I 和NaCl I 易升华
2 2
C 用泡沫灭火剂进行消防演习 溶液中Al3+和CO 2-发生双水解
3
D 维修工用NaOH和铝粉疏通厨卫管道 Al与NaOH溶液反应产生H
2
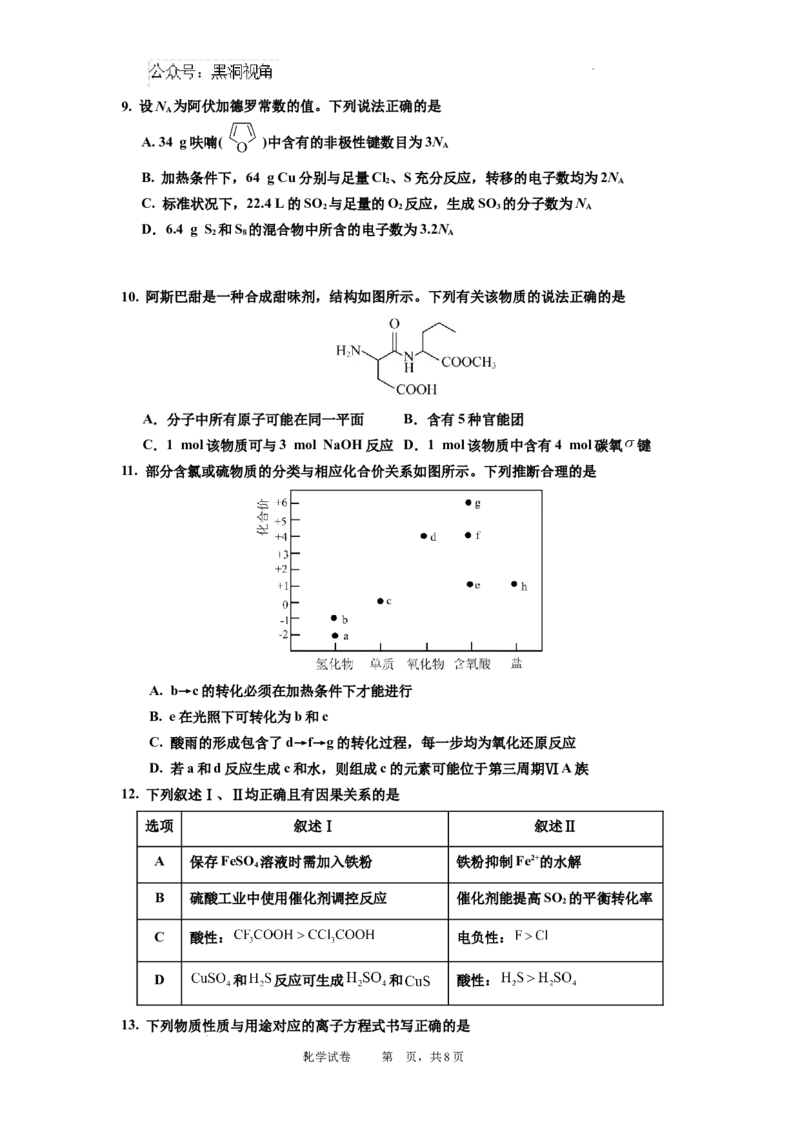
7.进行下列实验操作时,选用仪器不正确的是
A.利用仪器甲量取25.00 mL 10% HO 溶液
2 2
B.利用仪器乙加热胆矾使其失去结晶水
C.利用仪器丙分离饱和碳酸钠溶液和乙酸乙酯
D.利用仪器丁配制 HF水溶液
8.下列气体不能用图示装置完成制备和收集的是
选项 气体 原料 试剂x
A 浓盐酸 饱和食盐水
B 较浓硫酸 饱和 溶液
C 双氧水
D 浓氨水
化2 学试卷 第 页,共8页
学科网(北京)股份有限公司9. 设N 为阿伏加德罗常数的值。下列说法正确的是
A
A. 34 g呋喃( )中含有的非极性键数目为3N
A
B. 加热条件下,64 g Cu分别与足量Cl、S充分反应,转移的电子数均为2N
2 A
C. 标准状况下,22.4 L的SO 与足量的O 反应,生成SO 的分子数为N
2 2 3 A
D.6.4 g S 和S 的混合物中所含的电子数为3.2N
2 8 A
10. 阿斯巴甜是一种合成甜味剂,结构如图所示。下列有关该物质的说法正确的是
A.分子中所有原子可能在同一平面 B.含有5种官能团
C.1 mol该物质可与3 mol NaOH反应 D.1 mol该物质中含有4 mol碳氧 键
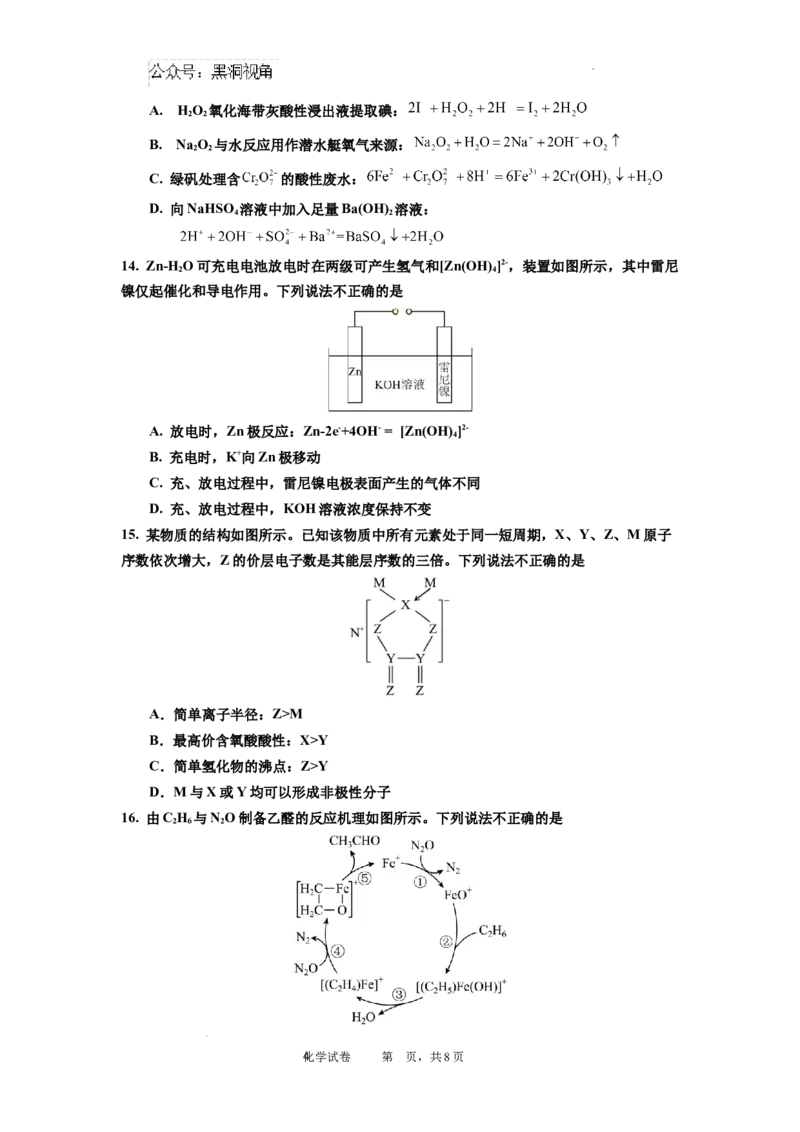
11. 部分含氯或硫物质的分类与相应化合价关系如图所示。下列推断合理的是
A. b→c的转化必须在加热条件下才能进行
B. e在光照下可转化为b和c
C. 酸雨的形成包含了d→f→g的转化过程,每一步均为氧化还原反应
D. 若a和d反应生成c和水,则组成c的元素可能位于第三周期ⅥA族
12. 下列叙述Ⅰ、Ⅱ均正确且有因果关系的是
选项 叙述Ⅰ 叙述Ⅱ
A 保存FeSO 溶液时需加入铁粉 铁粉抑制Fe2+的水解
4
B 硫酸工业中使用催化剂调控反应 催化剂能提高SO 的平衡转化率
2
C 酸性: 电负性:
D 和 反应可生成 和 酸性:
13. 下列物质性质与用途对应的离子方程式书写正确的是
化3 学试卷 第 页,共8页
学科网(北京)股份有限公司A. HO 氧化海带灰酸性浸出液提取碘:
2 2
B. Na O 与水反应用作潜水艇氧气来源:
2 2
C. 绿矾处理含 的酸性废水:
D. 向NaHSO 溶液中加入足量Ba(OH) 溶液:
4 2
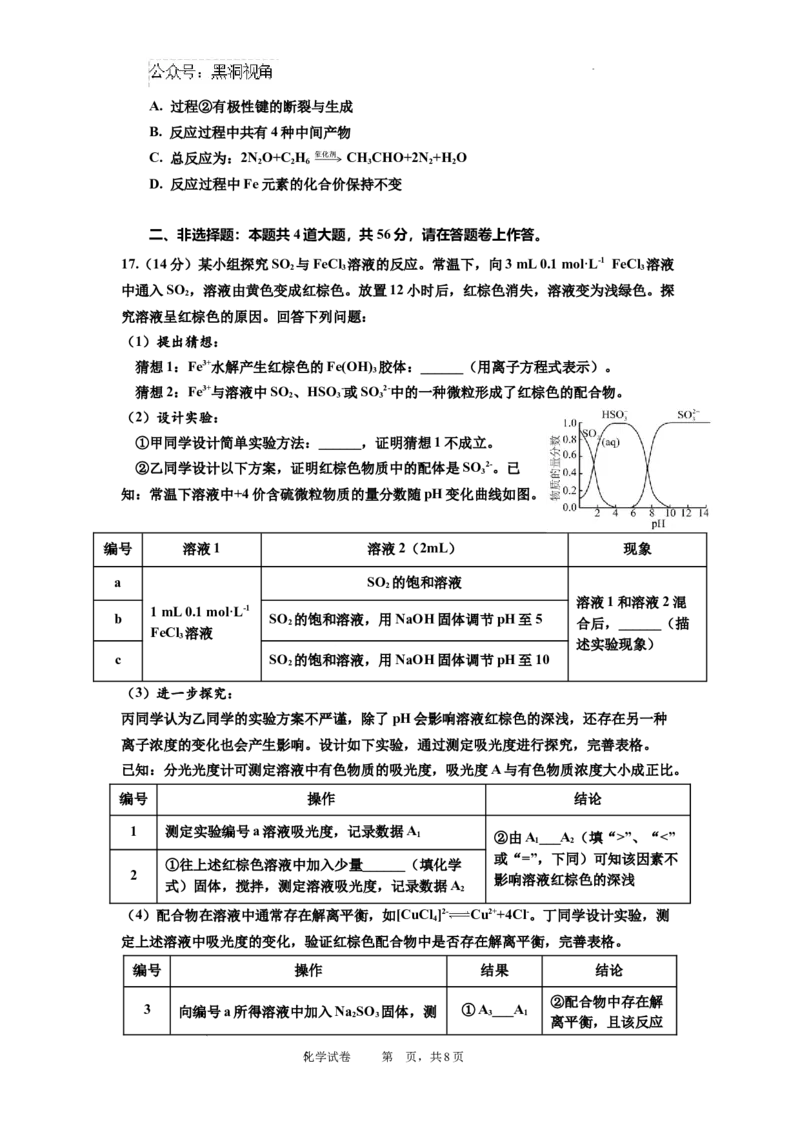
14. Zn-H O可充电电池放电时在两级可产生氢气和[Zn(OH) ]2-,装置如图所示,其中雷尼
2 4
镍仅起催化和导电作用。下列说法不正确的是
A. 放电时,Zn极反应:Zn-2e-+4OH- = [Zn(OH) ]2-
4
B. 充电时,K+向Zn极移动
C. 充、放电过程中,雷尼镍电极表面产生的气体不同
D. 充、放电过程中,KOH溶液浓度保持不变
15. 某物质的结构如图所示。已知该物质中所有元素处于同一短周期,X、Y、Z、M原子
序数依次增大,Z的价层电子数是其能层序数的三倍。下列说法不正确的是
A.简单离子半径:Z>M
B.最高价含氧酸酸性:X>Y
C.简单氢化物的沸点:Z>Y
D.M与X或Y均可以形成非极性分子
16. 由CH 与NO制备乙醛的反应机理如图所示。下列说法不正确的是
2 6 2
化4 学试卷 第 页,共8页
学科网(北京)股份有限公司A. 过程②有极性键的断裂与生成
B. 反应过程中共有4种中间产物
C. 总反应为:2NO+CH CH CHO+2N+H O
2 2 6 3 2 2
D. 反应过程中Fe元素的化合价保持不变
二、非选择题:本题共4道大题,共56分,请在答题卷上作答。
17.(14分)某小组探究SO 与FeCl 溶液的反应。常温下,向3 mL 0.1 mol·L-1 FeCl 溶液
2 3 3
中通入SO ,溶液由黄色变成红棕色。放置12小时后,红棕色消失,溶液变为浅绿色。探
2
究溶液呈红棕色的原因。回答下列问题:
(1)提出猜想:
猜想1:Fe3+水解产生红棕色的Fe(OH) 胶体:______(用离子方程式表示)。
3
猜想2:Fe3+与溶液中SO 、HSO -或SO 2-中的一种微粒形成了红棕色的配合物。
2 3 3
(2)设计实验:
①甲同学设计简单实验方法:______,证明猜想1不成立。
②乙同学设计以下方案,证明红棕色物质中的配体是SO 2-。已
3
知:常温下溶液中+4价含硫微粒物质的量分数随pH变化曲线如图。
编号 溶液1 溶液2(2mL) 现象
a SO 的饱和溶液
2
溶液1和溶液2混
1 mL 0.1 mol·L-1
b SO 2 的饱和溶液,用NaOH固体调节pH至5 合后,______(描
FeCl 溶液
3
述实验现象)
c SO 的饱和溶液,用NaOH固体调节pH至10
2
(3)进一步探究:
丙同学认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还存在另一种
离子浓度的变化也会产生影响。设计如下实验,通过测定吸光度进行探究,完善表格。
已知:分光光度计可测定溶液中有色物质的吸光度,吸光度A与有色物质浓度大小成正比。
编号 操作 结论
1 测定实验编号a溶液吸光度,记录数据A
1 ②由A___A(填“>”、“<”
1 2
或“=”,下同)可知该因素不
①往上述红棕色溶液中加入少量______(填化学
2
影响溶液红棕色的深浅
式)固体,搅拌,测定溶液吸光度,记录数据A
2
(4)配合物在溶液中通常存在解离平衡,如[CuCl ]2- Cu2++4Cl-。丁同学设计实验,测
4
定上述溶液中吸光度的变化,验证红棕色配合物中是否存在解离平衡,完善表格。
编号 操作 结果 结论
②配合物中存在解
3 向编号a所得溶液中加入Na 2 SO 3 固体,测 ①A 3 ___A 1
离平衡,且该反应
化5 学试卷 第 页,共8页
学科网(北京)股份有限公司定溶液吸光度,记录数据A
3
的ΔH___0
加热编号a所得溶液,测定溶液吸光度,
4 A<A
4 1
记录数据A
4
(5)写出FeCl 溶液在生产或生活中的一种用途______。
3
18.(14分)某化工厂利用废旧锂离子电池正极材料(含有LiCoO 以及少量Ca、Mg、
2
Fe、Al等)制备Co O 和LiCO 。工艺流程如下:
2 3 2 3
已知:①常温下,部分金属离子(Mn+)形成氢氧化物沉淀的pH范围如下:
Mn+ Fe2+ Al3+ Mg2+ Ca2+ Co2+
开始沉淀 6.3 3.8 9.6 10.6 6.6
完全沉淀c(Mn+)≤10-6 8.3 5.4 12.0 12.6 9.1
②K [Mg(OH) ]=10-10
sp 2
回答下列问题:
(1)基态Co原子的价层电子中,未成对电子与成对电子数目的比值为______。
(2)“酸浸”时发生反应: 。
①补充上述离子方程式中的缺项______;
②若用盐酸代替草酸进行“酸浸”,可能带来的影响是______。
(3)①滤液2中c(Mg2+)______mol·L-1;
②向滤液2中加入NH F固体的目的除了沉淀Mg2+外,还有______。
4
(4)滤液3中含金属元素的离子主要是[Co(NH )]2+,通入空气发生催化氧化反应过程中,
3 6
氧化剂和还原剂的物质的量之比为______。
(5)已知沉锂过程中有气体生成,写出“沉锂”过程中的离子方程式______。
(6)由LiCO 可进一步制备LiO,LiO的某一种晶胞具有如图所示结构。
2 3 2 2
①晶胞中O2-的配位数为______;
②设阿伏加德罗常数的值为N ,LiO晶胞的密度为b ,则晶胞参数(棱长)
A 2
化6 学试卷 第 页,共8页
学科网(北京)股份有限公司为______pm。(列出含有字母的表达式)
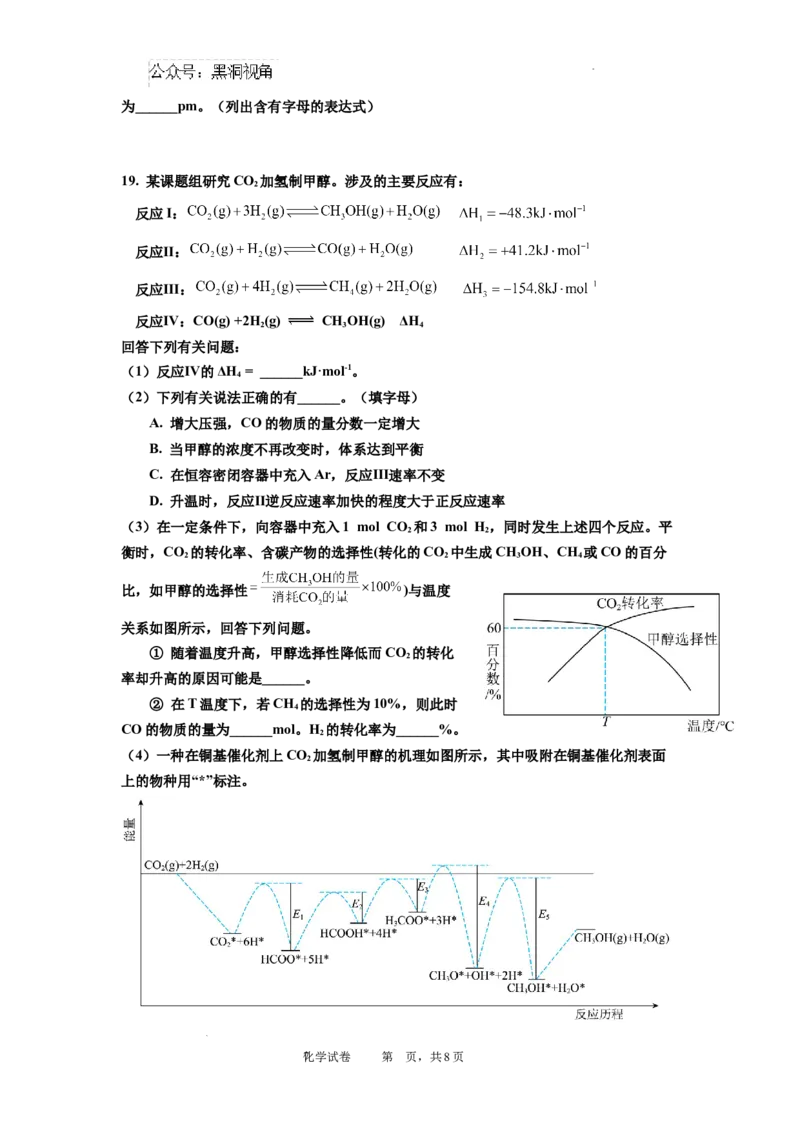
19. 某课题组研究CO 加氢制甲醇。涉及的主要反应有:
2
反应I:
反应Ⅱ:
反应Ⅲ:
反应Ⅳ:CO(g) +2H (g) CH OH(g) ΔH
2 3 4
回答下列有关问题:
(1)反应Ⅳ的ΔH = ______kJ·mol-1。
4
(2)下列有关说法正确的有______。(填字母)
A. 增大压强,CO的物质的量分数一定增大
B. 当甲醇的浓度不再改变时,体系达到平衡
C. 在恒容密闭容器中充入Ar,反应Ⅲ速率不变
D. 升温时,反应Ⅱ逆反应速率加快的程度大于正反应速率
(3)在一定条件下,向容器中充入1 mol CO 和3 mol H,同时发生上述四个反应。平
2 2
衡时,CO 的转化率、含碳产物的选择性(转化的CO 中生成CH OH、CH 或CO的百分
2 2 3 4
比,如甲醇的选择性 )与温度
关系如图所示,回答下列问题。
① 随着温度升高,甲醇选择性降低而CO 的转化
2
率却升高的原因可能是______。
② 在T温度下,若CH 的选择性为10%,则此时
4
CO的物质的量为______mol。H 的转化率为______%。
2
(4)一种在铜基催化剂上CO 加氢制甲醇的机理如图所示,其中吸附在铜基催化剂表面
2
上的物种用“*”标注。
化7 学试卷 第 页,共8页
学科网(北京)股份有限公司① 该化学反应的反应历程分______步进行。
② 对总反应速率影响较大的关键步骤(决速步)的基元反应方程式为______。
20.(14分)某酮酸化合物F是一种药物合成的重要中间体,其合成路线如下(部分反应条
件及过程已省略) :
已知:
△
ⅰ. ;
ⅱ. 。
回答下列问题:
(1)化合物D的分子式为______。化合物F中所含官能团的名称有______、______。
(2)核磁共振氢谱显示化合物A的分子中仅有两种不同化学环境的氢原子,则A的化学
名称为______ (用系统命名法命名)。
(3)写出A→B的化学方程式______;其反应类型为______。
(4)E的结构简式为______;E分子中含有______个手性碳原子。
(5)化合物I是D的同系物,相对分子质量比D小14,分子结构中仍然含有2个羧基,
则I可能的结构有______种(不考虑空间异构)。其中,核磁共振氢谱有三组峰,且峰面积
之比为3:1:1的结构简式为______。
化8 学试卷 第 页,共8页
学科网(北京)股份有限公司