文档内容
惠州市 2025 届高三第一次调研考试试题
化 学
本试卷共8页,20道小题 考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 N-14 O-16 Fe-56 Co-59
一、选择题:本题共16小题,共44分。第1~10题,每小题2分;第11~16题,每小
题4分。在每小题给出的四个选项中,只有一个选项符合题意。
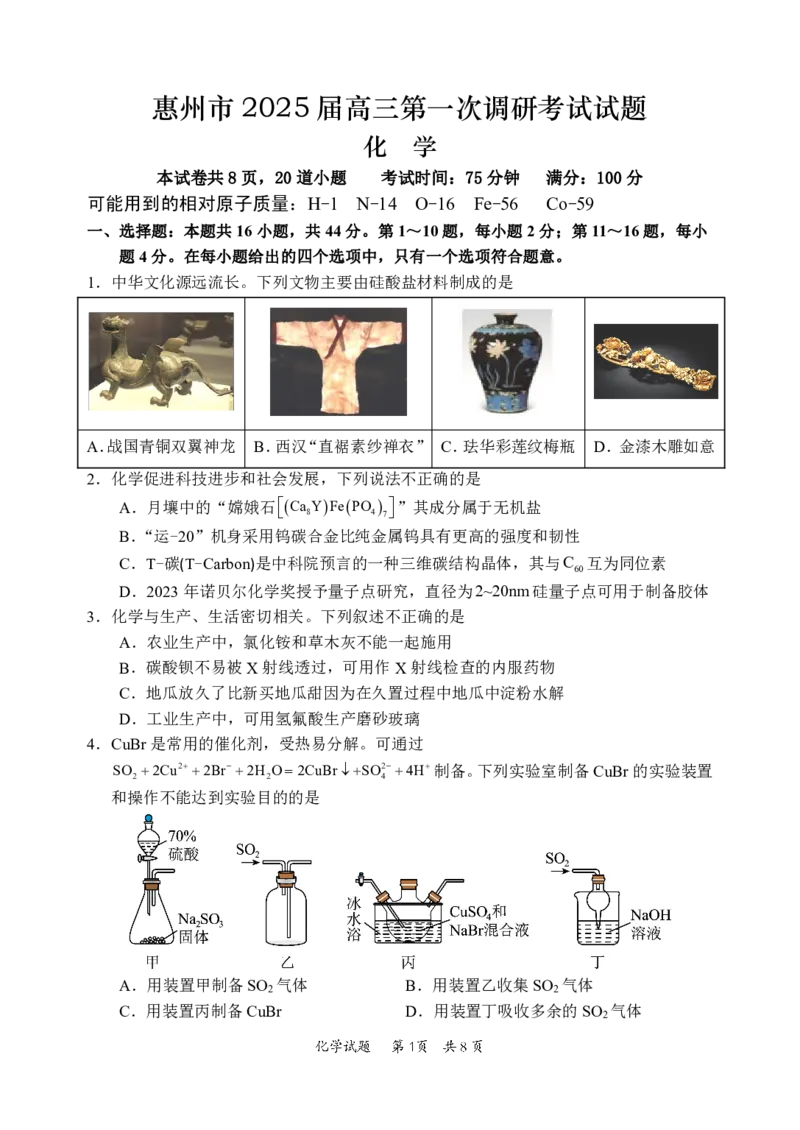
1.中华文化源远流长。下列文物主要由硅酸盐材料制成的是
A.战国青铜双翼神龙 B.西汉“直裾素纱禅衣” C.珐华彩莲纹梅瓶 D.金漆木雕如意
2.化学促进科技进步和社会发展,下列说法不正确的是
A.月壤中的“嫦娥石
Ca
8
YFePO
4
7
”其成分属于无机盐
B.“运-20”机身采用钨碳合金比纯金属钨具有更高的强度和韧性
C.T-碳(T-Carbon)是中科院预言的一种三维碳结构晶体,其与C 互为同位素
60
D.2023年诺贝尔化学奖授予量子点研究,直径为2~20nm硅量子点可用于制备胶体
3.化学与生产、生活密切相关。下列叙述不正确的是
A.农业生产中,氯化铵和草木灰不能一起施用
B.碳酸钡不易被X射线透过,可用作X射线检查的内服药物
C.地瓜放久了比新买地瓜甜因为在久置过程中地瓜中淀粉水解
D.工业生产中,可用氢氟酸生产磨砂玻璃
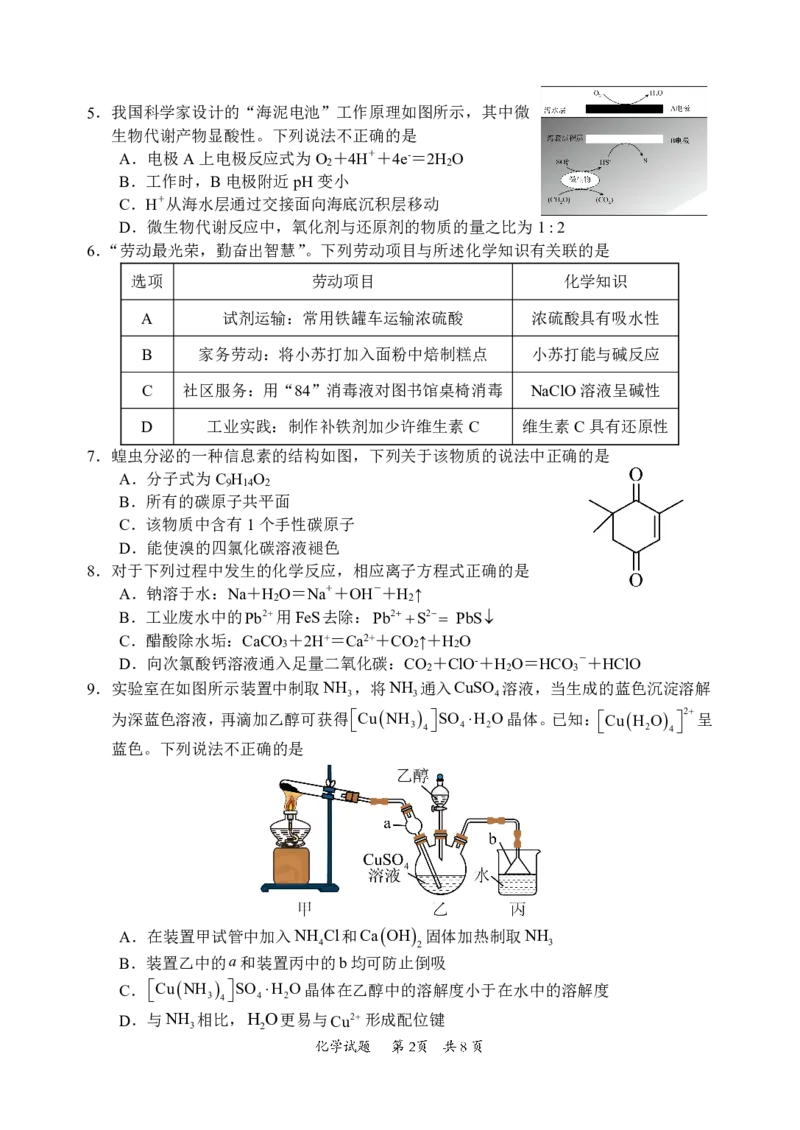
4.CuBr是常用的催化剂,受热易分解。可通过
SO 2Cu22Br2H O 2CuBrSO24H制备。下列实验室制备CuBr的实验装置
2 2 4
和操作不能达到实验目的的是
A.用装置甲制备SO 气体 B.用装置乙收集SO 气体
2 2
C.用装置丙制备CuBr D.用装置丁吸收多余的SO 气体
25.我国科学家设计的“海泥电池”工作原理如图所示,其中微
生物代谢产物显酸性。下列说法不正确的是
A.电极A上电极反应式为O +4H++4e-=2H O
2 2
B.工作时,B电极附近pH变小
C.H+从海水层通过交接面向海底沉积层移动
D.微生物代谢反应中,氧化剂与还原剂的物质的量之比为1:2
6.“劳动最光荣,勤奋出智慧”。下列劳动项目与所述化学知识有关联的是
选项 劳动项目 化学知识
A 试剂运输:常用铁罐车运输浓硫酸 浓硫酸具有吸水性
B 家务劳动:将小苏打加入面粉中焙制糕点 小苏打能与碱反应
C 社区服务:用“84”消毒液对图书馆桌椅消毒 NaClO溶液呈碱性
D 工业实践:制作补铁剂加少许维生素C 维生素C具有还原性
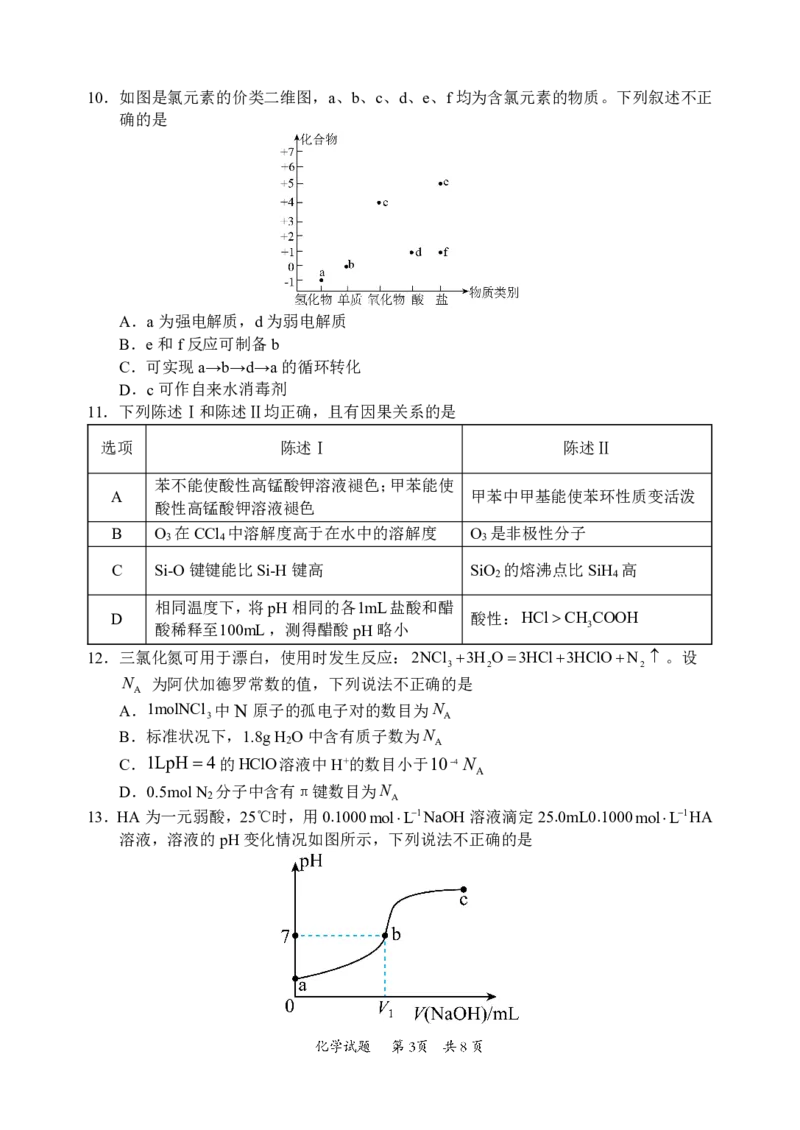
7.蝗虫分泌的一种信息素的结构如图,下列关于该物质的说法中正确的是
A.分子式为C H O
9 14 2
B.所有的碳原子共平面
C.该物质中含有1个手性碳原子
D.能使溴的四氯化碳溶液褪色
8.对于下列过程中发生的化学反应,相应离子方程式正确的是
A.钠溶于水:Na+H O=Na++OH-+H ↑
2 2
B.工业废水中的Pb2用FeS去除:Pb2S2 PbS
C.醋酸除水垢:CaCO +2H+=Ca2++CO ↑+H O
3 2 2
D.向次氯酸钙溶液通入足量二氧化碳:CO +ClO-+H O=HCO -+HClO
2 2 3
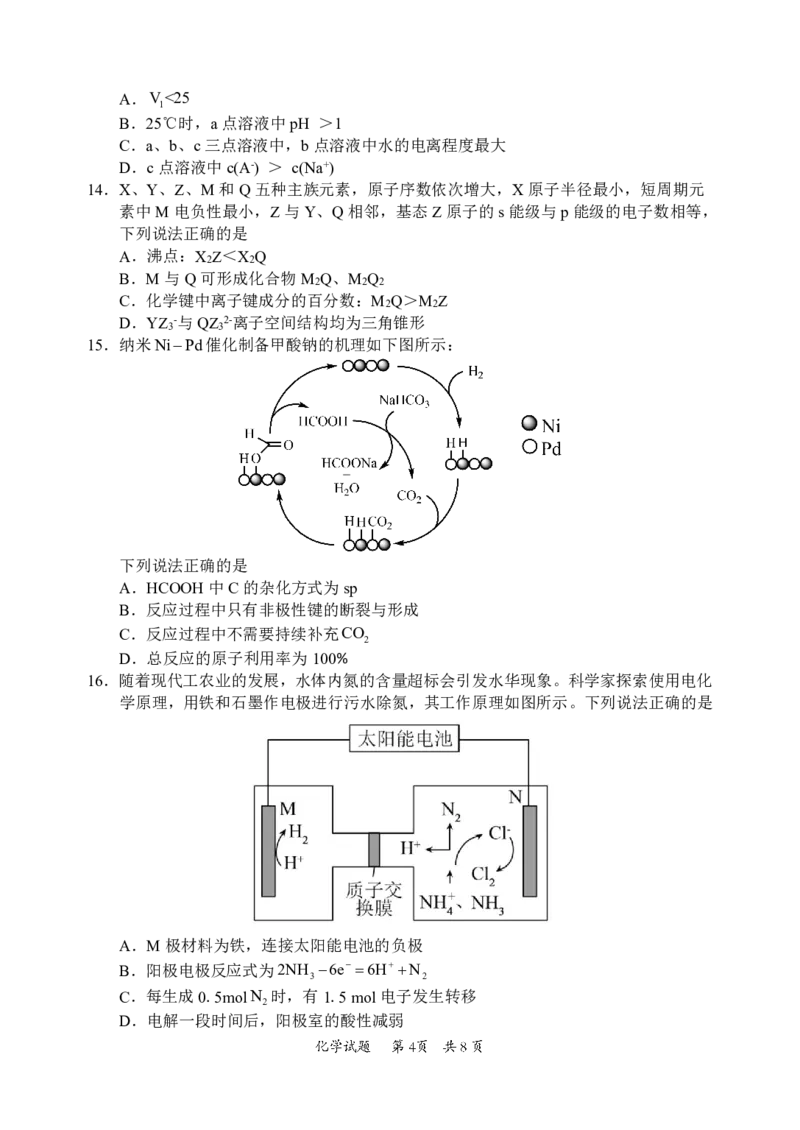
9.实验室在如图所示装置中制取NH ,将NH 通入CuSO 溶液,当生成的蓝色沉淀溶解
3 3 4
为深蓝色溶液,再滴加乙醇可获得
CuNH
3
4
SO
4
H
2
O晶体。已知:
CuH
2
O
4
2 呈
蓝色。下列说法不正确的是
A.在装置甲试管中加入NH Cl和CaOH 固体加热制取NH
4 2 3
B.装置乙中的a和装置丙中的b均可防止倒吸
C.
CuNH
3
4
SO
4
H
2
O晶体在乙醇中的溶解度小于在水中的溶解度
D.与NH 相比,H O更易与Cu2形成配位键
3 210.如图是氯元素的价类二维图,a、b、c、d、e、f均为含氯元素的物质。下列叙述不正
确的是
A.a为强电解质,d为弱电解质
B.e和f反应可制备b
C.可实现a→b→d→a的循环转化
D.c可作自来水消毒剂
11.下列陈述Ⅰ和陈述Ⅱ均正确,且有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
苯不能使酸性高锰酸钾溶液褪色;甲苯能使
A 甲苯中甲基能使苯环性质变活泼
酸性高锰酸钾溶液褪色
B O 在CCl 中溶解度高于在水中的溶解度 O 是非极性分子
3 4 3
C Si-O键键能比Si-H键高 SiO 的熔沸点比SiH 高
2 4
相同温度下,将pH相同的各1mL盐酸和醋
D 酸性:HClCH COOH
酸稀释至100mL,测得醋酸pH略小 3
12.三氯化氮可用于漂白,使用时发生反应:2NCl 3H O3HCl3HClON 。设
3 2 2
N 为阿伏加德罗常数的值,下列说法不正确的是
A
A.1molNCl 中N原子的孤电子对的数目为N
3 A
B.标准状况下,1.8gH O中含有质子数为N
2 A
C.1LpH4的HClO溶液中H+的数目小于104N
A
D.0.5molN 分子中含有π键数目为N
2 A
13.HA为一元弱酸,25℃时,用0.1000molL1NaOH溶液滴定25.0mL0.1000molL1HA
溶液,溶液的pH变化情况如图所示,下列说法不正确的是A.V<25
1
B.25℃时,a点溶液中pH >1
C.a、b、c三点溶液中,b点溶液中水的电离程度最大
D.c点溶液中c(A-) > c(Na+)
14.X、Y、Z、M和Q五种主族元素,原子序数依次增大,X原子半径最小,短周期元
素中M电负性最小,Z与Y、Q相邻,基态Z原子的s能级与p能级的电子数相等,
下列说法正确的是
A.沸点:X Z<X Q
2 2
B.M与Q可形成化合物M Q、M Q
2 2 2
C.化学键中离子键成分的百分数:M Q>M Z
2 2
D.YZ -与QZ 2-离子空间结构均为三角锥形
3 3
15.纳米NiPd催化制备甲酸钠的机理如下图所示:
下列说法正确的是
A.HCOOH中C的杂化方式为sp
B.反应过程中只有非极性键的断裂与形成
C.反应过程中不需要持续补充CO
2
D.总反应的原子利用率为100%
16.随着现代工农业的发展,水体内氮的含量超标会引发水华现象。科学家探索使用电化
学原理,用铁和石墨作电极进行污水除氮,其工作原理如图所示。下列说法正确的是
A.M极材料为铁,连接太阳能电池的负极
B.阳极电极反应式为2NH 6e 6HN
3 2
C.每生成0.5molN 时,有1.5mol电子发生转移
2
D.电解一段时间后,阳极室的酸性减弱二、非选择题:本题共4小题,共56分。
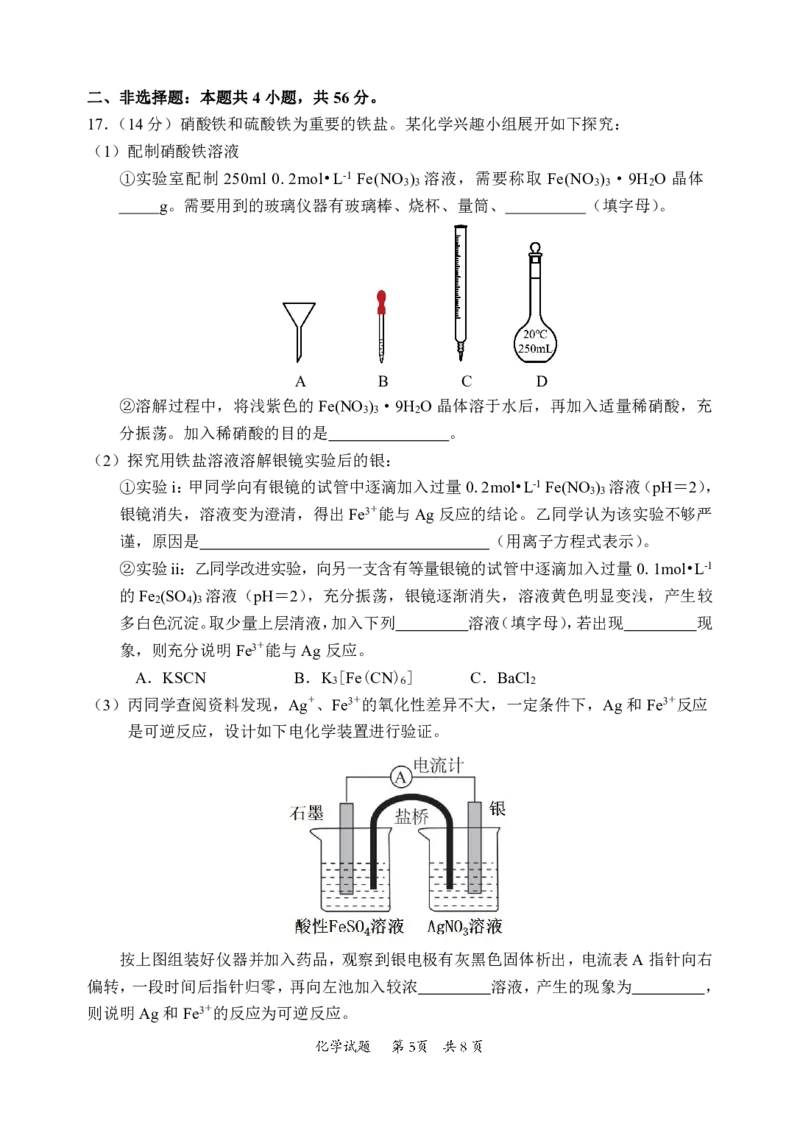
17.(14分)硝酸铁和硫酸铁为重要的铁盐。某化学兴趣小组展开如下探究:
(1)配制硝酸铁溶液
①实验室配制 250ml 0.2mol•L-1 Fe(NO ) 溶液,需要称取 Fe(NO ) ·9H O 晶体
3 3 3 3 2
g。需要用到的玻璃仪器有玻璃棒、烧杯、量筒、 (填字母)。
A B C D
②溶解过程中,将浅紫色的Fe(NO ) ·9H O晶体溶于水后,再加入适量稀硝酸,充
3 3 2
分振荡。加入稀硝酸的目的是 。
(2)探究用铁盐溶液溶解银镜实验后的银:
①实验i:甲同学向有银镜的试管中逐滴加入过量0.2mol•L-1Fe(NO ) 溶液(pH=2),
3 3
银镜消失,溶液变为澄清,得出Fe3+能与Ag反应的结论。乙同学认为该实验不够严
谨,原因是 (用离子方程式表示)。
②实验ii:乙同学改进实验,向另一支含有等量银镜的试管中逐滴加入过量0.1mol•L-1
的Fe (SO ) 溶液(pH=2),充分振荡,银镜逐渐消失,溶液黄色明显变浅,产生较
2 4 3
多白色沉淀。取少量上层清液,加入下列 溶液(填字母),若出现 现
象,则充分说明Fe3+能与Ag反应。
A.KSCN B.K [Fe(CN) ] C.BaCl
3 6 2
(3)丙同学查阅资料发现,Ag+、Fe3+的氧化性差异不大,一定条件下,Ag和Fe3+反应
是可逆反应,设计如下电化学装置进行验证。
按上图组装好仪器并加入药品,观察到银电极有灰黑色固体析出,电流表A指针向右
偏转,一段时间后指针归零,再向左池加入较浓 溶液,产生的现象为 ,
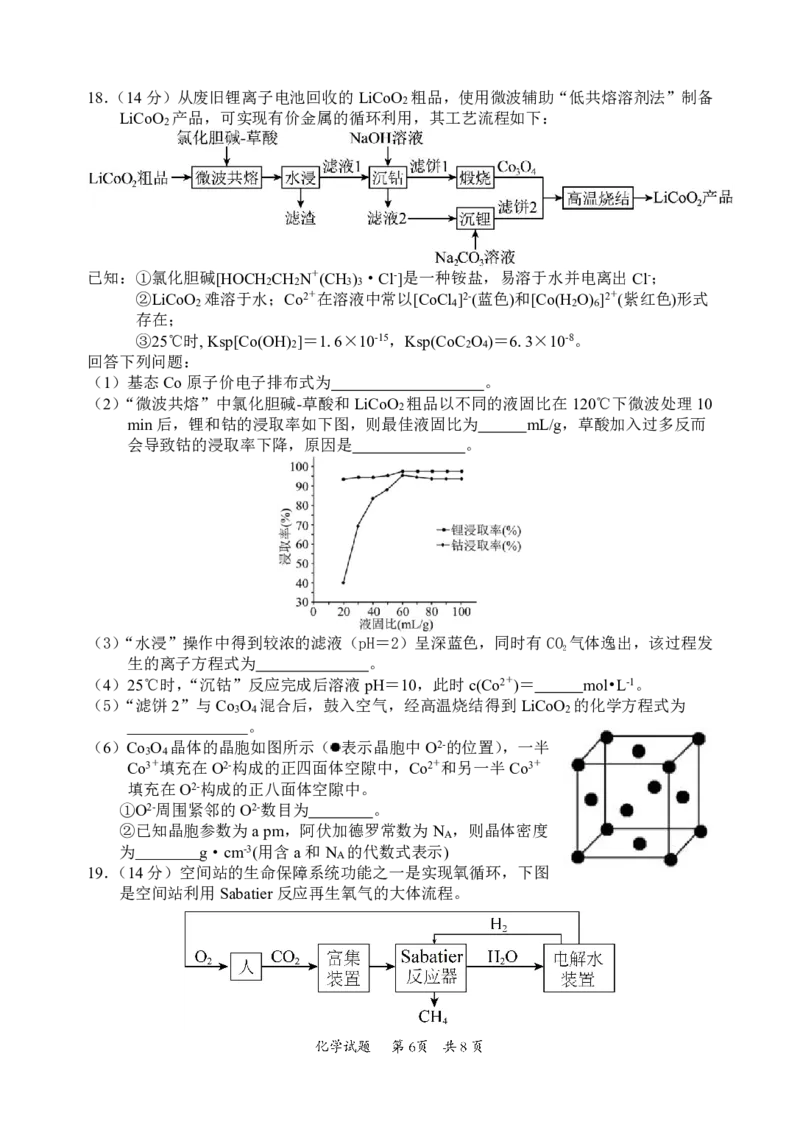
则说明Ag和Fe3+的反应为可逆反应。18.(14分)从废旧锂离子电池回收的LiCoO 粗品,使用微波辅助“低共熔溶剂法”制备
2
LiCoO 产品,可实现有价金属的循环利用,其工艺流程如下:
2
已知:①氯化胆碱[HOCH CH N+(CH ) ·Cl-]是一种铵盐,易溶于水并电离出Cl-;
2 2 3 3
②LiCoO 难溶于水;Co2+在溶液中常以[CoCl ]2-(蓝色)和[Co(H O) ]2+(紫红色)形式
2 4 2 6
存在;
③25℃时,Ksp[Co(OH) ]=1.6×10-15,Ksp(CoC O )=6.3×10-8。
2 2 4
回答下列问题:
(1)基态Co原子价电子排布式为 。
(2)“微波共熔”中氯化胆碱-草酸和LiCoO 粗品以不同的液固比在120℃下微波处理10
2
min后,锂和钴的浸取率如下图,则最佳液固比为 mL/g,草酸加入过多反而
会导致钴的浸取率下降,原因是 。
(3)“水浸”操作中得到较浓的滤液(pH=2)呈深蓝色,同时有CO 气体逸出,该过程发
2
生的离子方程式为 。
(4)25℃时,“沉钴”反应完成后溶液pH=10,此时c(Co2+)= mol•L-1。
(5)“滤饼2”与Co O 混合后,鼓入空气,经高温烧结得到LiCoO 的化学方程式为
3 4 2
。
(6)Co O 晶体的晶胞如图所示( 表示晶胞中O2-的位置),一半
3 4
Co3+填充在O2-构成的正四面体空隙中,Co2+和另一半Co3+
填充在O2-构成的正八面体空隙中。
①O2-周围紧邻的O2-数目为 。
②已知晶胞参数为apm,阿伏加德罗常数为N ,则晶体密度
A
为 g·cm-3(用含a和N 的代数式表示)
A
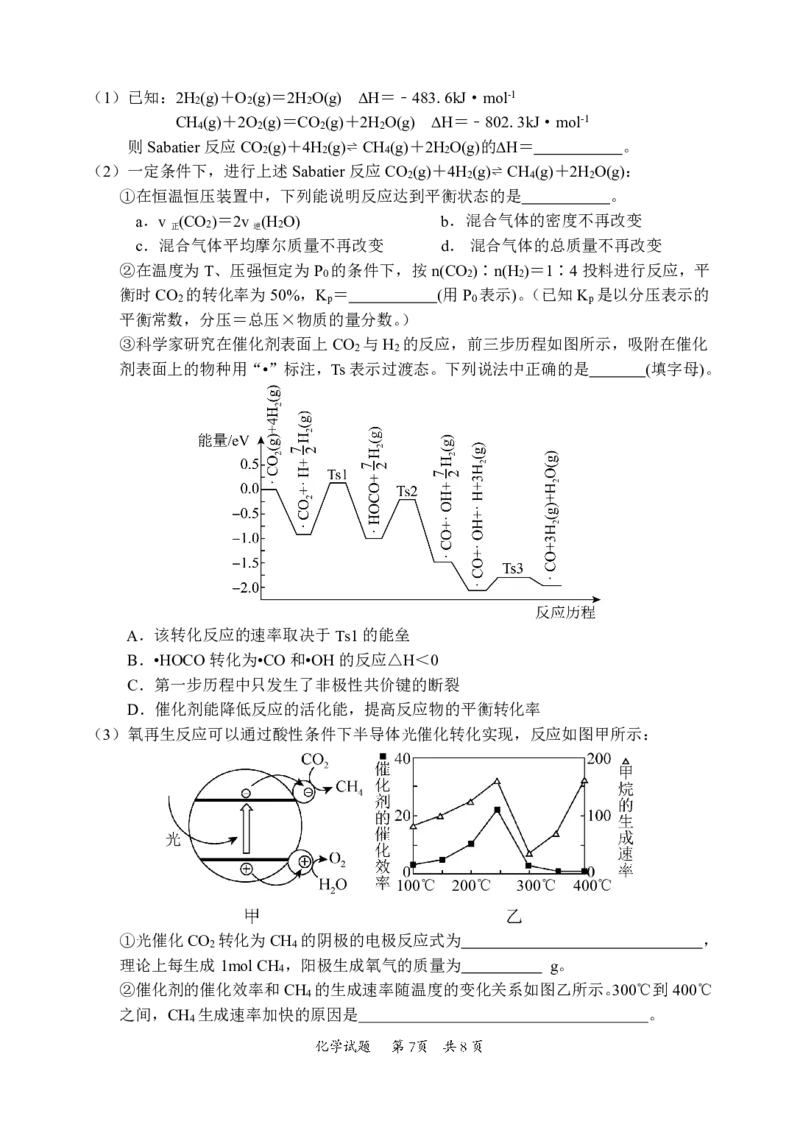
19.(14分)空间站的生命保障系统功能之一是实现氧循环,下图
是空间站利用Sabatier反应再生氧气的大体流程。(1)已知:2H (g)+O (g)=2H O(g) ∆H=﹣483.6kJ·mol-1
2 2 2
CH (g)+2O (g)=CO (g)+2H O(g) ∆H=﹣802.3kJ·mol-1
4 2 2 2
则Sabatier反应CO (g)+4H (g)⇌ CH (g)+2H O(g)的∆H= 。
2 2 4 2
(2)一定条件下,进行上述Sabatier反应CO (g)+4H (g)⇌ CH (g)+2H O(g):
2 2 4 2
①在恒温恒压装置中,下列能说明反应达到平衡状态的是 。
a.v (CO )=2v (H O) b.混合气体的密度不再改变
正 2 逆 2
c.混合气体平均摩尔质量不再改变 d.混合气体的总质量不再改变
②在温度为T、压强恒定为P 的条件下,按n(CO )∶n(H )=1∶4投料进行反应,平
0 2 2
衡时CO 的转化率为50%,K = (用P 表示)。(已知K 是以分压表示的
2 p 0 p
平衡常数,分压=总压×物质的量分数。)
③科学家研究在催化剂表面上CO 与H 的反应,前三步历程如图所示,吸附在催化
2 2
剂表面上的物种用“•”标注,Ts表示过渡态。下列说法中正确的是 (填字母)。
A.该转化反应的速率取决于Ts1的能垒
B.•HOCO转化为•CO和•OH的反应△H<0
C.第一步历程中只发生了非极性共价键的断裂
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
(3)氧再生反应可以通过酸性条件下半导体光催化转化实现,反应如图甲所示:
100℃ 200℃ 300℃ 400℃
①光催化CO 转化为CH 的阴极的电极反应式为 ,
2 4
理论上每生成1molCH ,阳极生成氧气的质量为 g。
4
②催化剂的催化效率和CH 的生成速率随温度的变化关系如图乙所示。300℃到400℃
4
之间,CH 生成速率加快的原因是 。
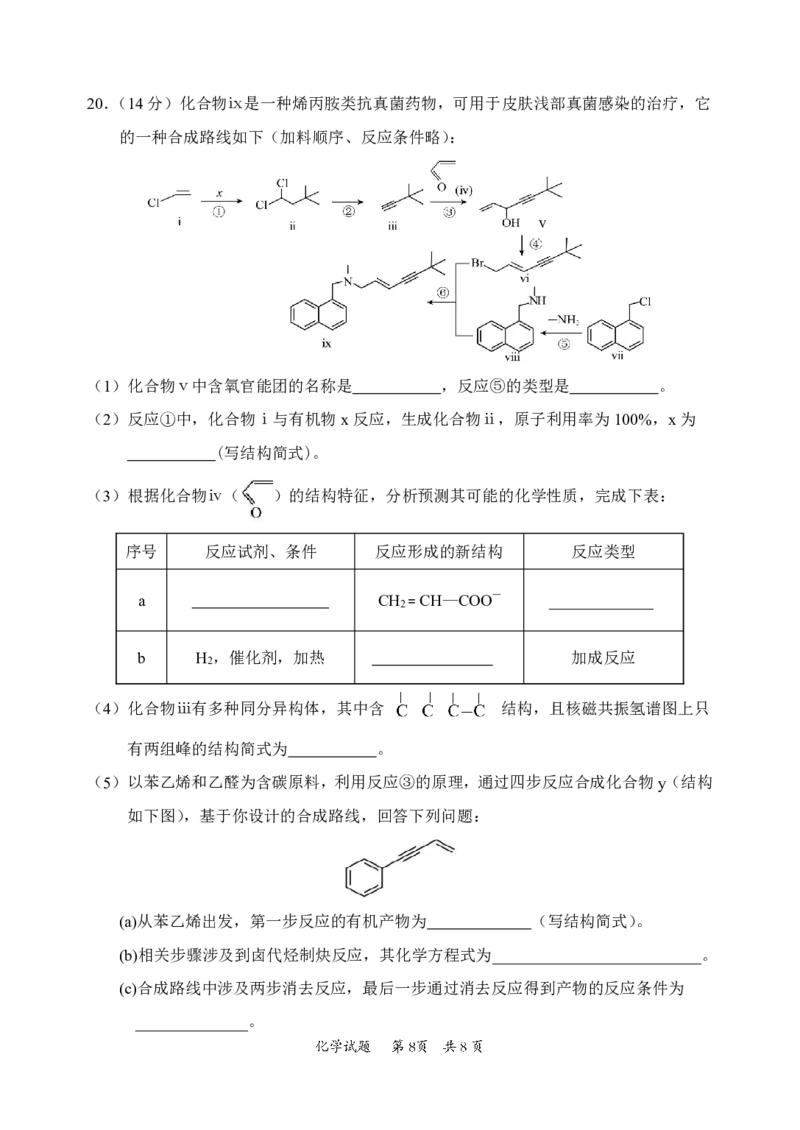
420.(14分)化合物ⅸ是一种烯丙胺类抗真菌药物,可用于皮肤浅部真菌感染的治疗,它
的一种合成路线如下(加料顺序、反应条件略):
v
(1)化合物ⅴ中含氧官能团的名称是 ,反应⑤的类型是 。
(2)反应①中,化合物ⅰ与有机物x反应,生成化合物ⅱ,原子利用率为100%,x为
(写结构简式)。
(3)根据化合物ⅳ( )的结构特征,分析预测其可能的化学性质,完成下表:
序号 反应试剂、条件 反应形成的新结构 反应类型
a CH =CH—COO— _____________
2
b H ,催化剂,加热 加成反应
2
(4)化合物ⅲ有多种同分异构体,其中含 结构,且核磁共振氢谱图上只
有两组峰的结构简式为 。
(5)以苯乙烯和乙醛为含碳原料,利用反应③的原理,通过四步反应合成化合物y(结构
如下图),基于你设计的合成路线,回答下列问题:
(a)从苯乙烯出发,第一步反应的有机产物为 (写结构简式)。
(b)相关步骤涉及到卤代烃制炔反应,其化学方程式为__________________________。
(c)合成路线中涉及两步消去反应,最后一步通过消去反应得到产物的反应条件为
______________。