文档内容
1. 答案:D
解析:A中的牛油属于油脂,不是有机高分子材料。B项,淀粉和纤维素的n值不同,不是同分异构体。
C项酱油是混合物,不是弱电解质。青砖属于硅酸盐材料,是传统无机非金属材料
2. 答案:B
解析:A中的H O 球棍模型不是直线型分子。C项,气态团簇分子的化学式为E F
2 2 4 4
3. 答案:C
解析:A应该是阴极反应式,B项硫代硫酸钠中加入稀硝酸要发生氧化还原反应,而不是硫代硫酸钠的
歧化。D项,少量的AgNO 溶液不能反应內界的氯离子。
3
4. 答案:A
解析:A应该是加成反应。
5. 答案:D
解析:A Al(OH) 结合H的能力比CO2强,B项的FeCl 溶液过量,无法说明该反应存在一定限度。
4 3 3
C项亚硫酸氢钠呈酸性,电离大于水解, >
−14
6. 答案:C 1⋅ 2 10
解析:根据题意,X:H Y:C R:O M:Na 。第一电离能:O>C,Na最外层只有一个电子,容易
失去电子,O>C>Na,A项错误。B项中两种元素电负性相差越大,化学键中离子键成分的百分数越大,因
为O的电负性大于H,所以离子键成分的百分数:Na O>NaH。
2
7. 答案:B
解析:根据题意,B项中有H-H键断开和C-O键断开,有N-H键和H-O键生成,有极性键、非极性键断
开和极性键生成,没有非极性键的形成,B错误。
8. 答案:A
解析:A:A是(NH ) S或NH HS ,A错误 ;B项,X是强酸时,C是S单质,X是强碱,C为N ,B正
4 2 4 2
确;C项,当X是强酸时,D是SO ,SO 使得石蕊溶液变红,但不能褪色,C错误;D项在强酸和强碱条
2 2
件下生成的气体B在等质量时的体积比为1:2
9. 答案:C
解析:A:1mol化合物I中含有的σ键数目为17NA,B项Ⅱ中Ga的配体数为2,
C. x1;D.Ⅱ中的N原子是利用的了sp2杂化的p轨道中的一对孤电子对形成的配位键
10. 答案:A
解析:A:Ka=c2(H+)/(0.1-c(H+)),解出H+的浓度约为0.062mol/L ,由于氨基磺酸可以形成內盐+H NSO -所
3 3
以熔点大小关系:H NSO H>H SO ;C项该反应生成1molH 时转移电子数为3NA
2 3 2 4 2
D项不能用BaNO 溶液检验分解所得混合气体中是否含有SO ,因为体系中还有SO 会干扰。
3 2 3 211. 答案:B
解析:A项GaAs中,As提供孤电子对,Ga提供空轨道,两者形成配位键,平均1个GaAs中的配位键数
目为1,则1molGaAs中配位键的数目是N ,A正确;B项由晶胞结构可知,Ga和As的最近距离是 ,
A
B项错误;C项c位于侧面的面心,沿体对角线方向投影,则As的位置为7、9、11、13,C正确,由乙晶
胞结构可知,和Mn最近且等距离的As的数目为4
12.答案:C
解析:该电解装置中的阴极为电极①和电极③,其余两个电极为阳极。故AB项正确,互换后的电极④发生
电极反应式为:LiFePO -e-=FePO +Li+;锂离子的回收率为(6.73×10-3-5×10-4)/7.19×10-3≈86.6%
4 4
13. 答案:D
解析:A.由图可知:温度升高,lgK1减小,即平衡常数K1减小,说明温度升高,化学平衡逆向移动,逆
向是吸热反应,则该反应的正反应是放热反应,所以a<0,A错误;
B.X点对应反应温度为400K,由图可知:X点乙醇物质的量分数小于平衡时乙醇的物质的量分数,说明
此时反应未达平衡状态,反应正向进行,v正>v逆,B错误;
C.由图1可知,反应Ⅰ、Ⅱ均为放热反应,升高温度,化学平衡均逆向移动,由图2可知升高温度后乙酸甲
酯的物质的量分数降低速率大于甲醇的降低速率,所以600K后升高温度对反应Ⅰ的影响程度大于反应Ⅱ,C
错误;
D.B曲线随温度升高,物质的量分数升高,当温度高于600K时,乙醇或甲醇的物质的量分数很小,以反
应Ⅰ为主,温度升高,反应Ⅰ平衡逆向移动,一氧化碳或甲醚物质的量分数升高,故曲线B表示一氧化碳或甲
醚的物质的量分数随温度的变化,D正确;
故选D。
14. 答案:D
解析:A项0.5molL1NaHCO 溶液中存在质子守恒关系:c(H+)+c(H2CO3)=c(OH-)+c(CO32-),A错误
3
a点溶液中溶质有NaHCO3和CaCl2,水的电离被促进,b点溶液中溶质有NaCl 和H2CO3,水的电离被抑
制,对比之下发现,a到b的过程中,水的电离程度不断减小,B错误;
a点时溶液中存在电荷守恒2c
Ca2+
+c
Na+
+c
H+
=c
HCO-
+2c
CO2-
+c
Cl-
+c
OH-
,a点溶液显碱性,
3 3
所以c(OH—)>c(H+),则可得到2c
Ca2+
+c
Na+
>c
HCO-
+2c
CO2-
+c
Cl-
,C不正确;
3 3
c CO2- c H+ c Ca2+ Ksp CaCO c H+
D.b点pH=7.2,K = 3 = 3 ,
a2 c HCO- c Ca2+ c HCO- c Ca2+
3 3
KspCaCO c H+
c HCO- c Ca2+ = 3 ,代入题中给出的数据K H CO =4.710-11,
3 K a2 2 3
a2
K CaCO =3.3610-9,c HCO- ·c Ca2+ =
10-7.2
3.3610-9 4.510-6,D正确;
sp 3 3 4.710-1115.(13分)(1) (1分) +6(1分)
高温
(2) (2分)
(3)2 T C eOr2 2 ++ 3 2 + SO 3 + 2 3 + H 4 ON=a2 T C e O + 3 2SO 42-N+a2 6 C H rO+ 4+(42C分O2 ) (4)酸浸(1分) (5)aedc(2分)
2 2 4
电解
(6) (2分) 12.2%(2分)
4K2CrO4+4H2O 4KOH+2H2 ↑+ 2 ↑+2K2Cr2O7
15.解析:(5)同一温度下,溶解度小的物质优先析出,要从溶液中析出K Cr O 粗产品,从溶解性表可得
2 2 7
出,温度低于50℃后K Cr O 的溶解度最小,故将混合溶液加热到50℃析出晶膜后进行降温结晶、过滤。
2 2 7
答案为aedc。(6)n(K CrO )=0.2mol由于转化率为80%,反应的K CrO 的物质的量为0.16mol,电解池中
2 4 2 4
转移的电子数为0.16mol,从右槽移动到左槽的K+为0.16mol,左槽生成0.08molH 逸出体系,所以左槽的
2
KOH的质量为100×4%+0.16×56=12.96g,溶液的质量为100+0.16×38=106.08,溶液的质量分数为:
12.96/106.08≈12.2%
16.(15分)(1) +115.1 (2分) 高温 (1分) (2)BD (2分)
(3) 42.9%或3/7 (2分) 16.9(16.6~16.9均给分)(2分)
C H HO C H H O
(4) 3 7 2 3 6 2 2 (2分) O 与热裂解的H 反应生成水,使平衡正向进行,反应趋势
2 2
增大。(2分)
(5) O 氧化性强,易氧化C H 和C H ,使产率下降。(2分)(或CO 是一种温和的氧化剂,不会氧化
2 3 8 3 6 2
C H 和C H )
3 8 3 6
16.解析:(2)恒温恒容下,向体系中加入惰性气体,未改变反应体系种各物质的浓度,速率不变,A错误;
反应Ⅰ为正向进行的气体物质的量增加的反应,恒温恒压下,只有平衡时气体的体积不变,气体的密度不变,
故B 选项正确;C H 的消耗速率与C H 的生成速率均为正反应速率,两者速率始终相等,不能判断反应
3 8 3 6
达平衡,选项C错误;反应Ⅰ为正向进行的气体物质的量增加的反应,恒压条件下反应正向进行程度更高,
丙烷的转化率更高。故BD正确。
( 3 ) 体 系 中 发 生 C H (g) C H (g)+H (g) 和 C H (g) C H (g)+CH (g) 反 应 ,
3 8 3 6 2 3 8 2 4 4
nC H %=nCH %=4%,又由于nC H %=40%,所以nC H %=nH %=26%,C H 的转化率为:(4%+26%)
2 4 4 3 8 3 6 2 3 8
/70%=42.9%;K =(0.26)2×100/0.4=16.9
p
17.(15分)(1)CuSO 试纸由蓝色变为黑色(2分) NaHCO 、NaHS (2分)
4 3
(2)H S与醋酸亚铜氨溶液作用(H S与亚铜离子结合),使醋酸亚铜氨溶液与CO结合能力减弱(2分)
2 2
(3)长颈漏斗 (1分)
(4)Cu+2H SO (浓)==CuSO +SO ↑+2H O (加热条件)(2分) (5)ad(2分)
2 4 4 2 2
(6)80% (2分) AD(2分)
17.解析:(5)乙装置的作用为平衡气压,防止倒吸,故溶液不吸收SO 即可,答案为浓硫酸和饱和NaHSO
2 3
溶液;(6)根据得失电子守恒:Cr O 2-~6e-~6S O 2-,所以c(S O 2-)=20.00×0.01×6/18.60=0.2/3.1,样
2 7 2 3 2 3
品中Na S O ·5H O的纯度为:0.2×0.1×248/3.1×2=80%;配制100mL溶液时,仰视容量瓶的刻度线,使
2 2 3 2配制溶液的浓度偏低,故A选项正确;装K Cr O 标准液的酸式滴定管洗涤后若未润洗,使K Cr O 溶液浓
2 2 7 2 2 7
度偏低,消耗的Na S O 溶液体积偏小,测定浓度偏大;量取K Cr O 标准液时,开始有气泡,终点无气泡,
2 2 3 2 2 7
使量取体积小于20.00mL,消耗的Na S O 溶液体积偏小,测定浓度偏大;滴定阶段,开始平视刻度线,终
2 2 3
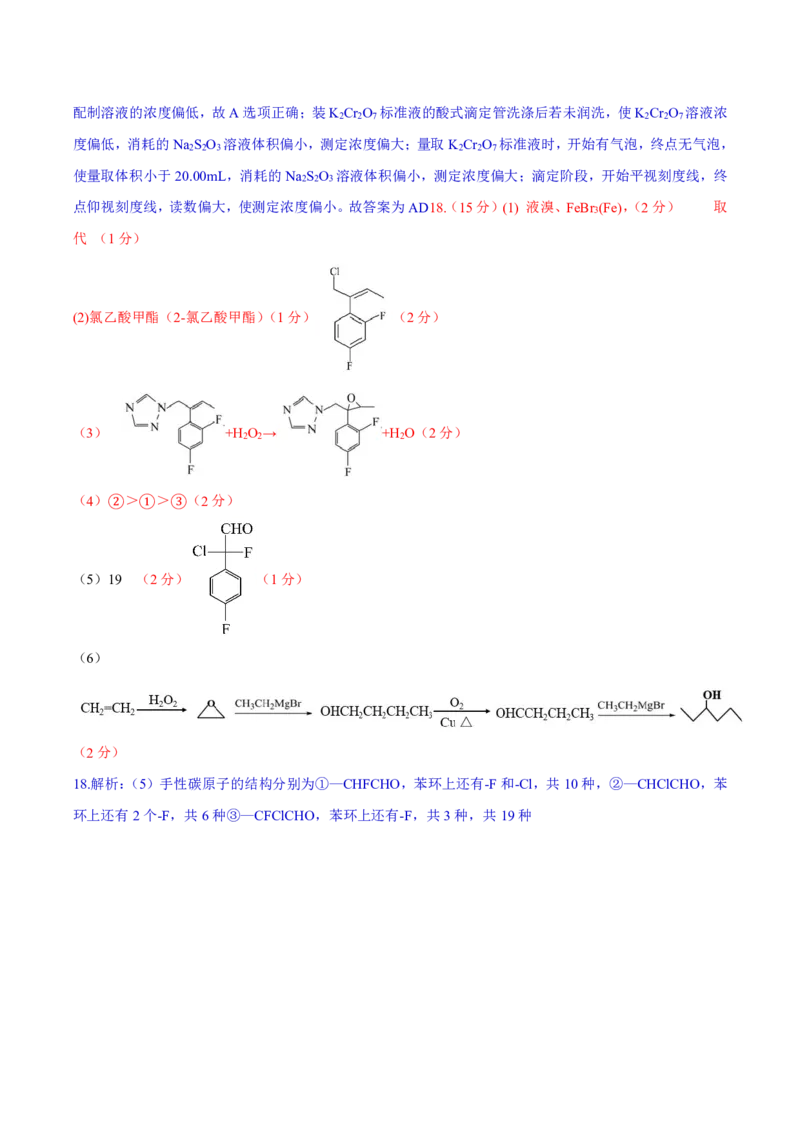
点仰视刻度线,读数偏大,使测定浓度偏小。故答案为AD18.(15分)(1) 液溴、FeBr (Fe),(2分) 取
3
代 (1分)
(2)氯乙酸甲酯(2-氯乙酸甲酯)(1分) (2分)
(3) +H O → +H O(2分)
2 2 2
(4) > > (2分)
② ① ③
(5)19 (2分) (1分)
(6)
(2分)
18.解析:(5)手性碳原子的结构分别为①—CHFCHO,苯环上还有-F和-Cl,共10种,②—CHClCHO,苯
环上还有2个-F,共6种③—CFClCHO,苯环上还有-F,共3种,共19种