文档内容
泸县五中高2023级高二下学期开学考试
化学
满分:100分。考试时间:75分钟。
相对原子质量:H-1 O-16 S-32 Fe-56 Cu-64 Cl-35.5 Ag-108
第一部分 选择题(共42分)
一、选择题:本题共14小题,每小题3分,共42分。每小题给出的四个选项中,只有一项是
符合题目要求。
1.化学与科技、生活密切相关。下列叙述中正确的是
A.GaN具有半导体的性质,常用作LED灯的芯片,属于新型无机非金属材料
B.从石墨中剥离出的石墨烯薄片能导电,因此是电解质
C.宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
D.杭州亚运会吉祥物“江南忆”机器人所采用芯片的主要成分为二氧化硅
2.以下方法可用于工业冶炼金属的是
A.电解熔融AlCl 获取金属铝 B.电解MgCl 溶液获取金属镁
3 2
C.用CO还原铁矿石来获取金属铁 D.电解饱和食盐水来获取金属钠
3.物质的性质决定用途,下列两者对应关系不正确的是
A. 溶液呈碱性,其热溶液可用于去除厨房油渍
B. 难溶于水和酸且不能被X射线穿透,可用作人体造影剂
C. 具有强氧化性,可用作自来水消毒剂
D.钠、钾具有很强还原性,钠钾合金可用作核反应堆的传热介质
4.下列关于有效碰撞理论的说法一定正确的是
A.增大反应物浓度,活化分子百分数增大,反应速率加快
B.催化剂在化学反应过程中参与了反应,使用正催化剂,活化分子数增大,反应速率加快
C.升高温度,所有反应的活化能增大,反应速率加快
D.增大压强,所有反应的有效碰撞概率增大,反应速率加快
5.下列说法正确的是
A. 和 均是非极性分子
B.基态钯原子的价电子排布式为 ,位于第5周期 区
C. 热稳定性比 高的原因是水分子之间存在氢键
D.由金属活动性顺序表可推出钙的第一电离能小于钠的第一电离能
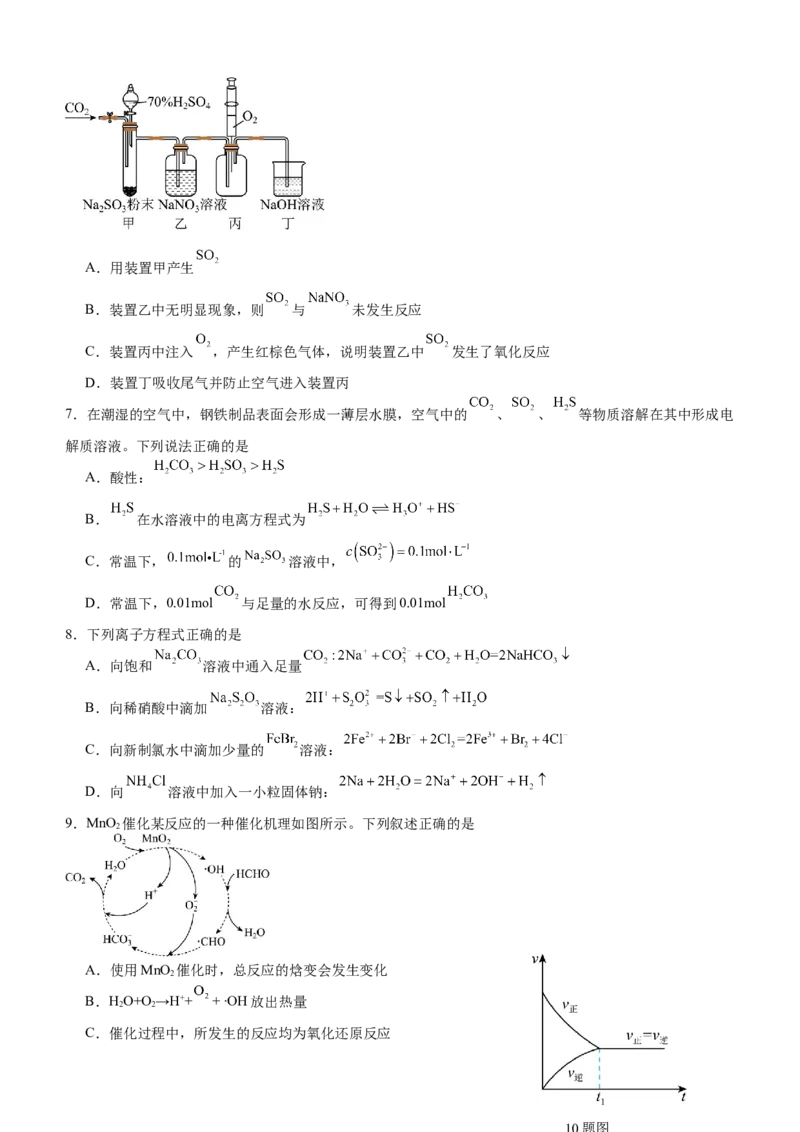
6.实验室用如下图所示装置探究 与 溶液的反应(实验前先通入 排除装置中的空气)。下列说法
不正确的是A.用装置甲产生
B.装置乙中无明显现象,则 与 未发生反应
C.装置丙中注入 ,产生红棕色气体,说明装置乙中 发生了氧化反应
D.装置丁吸收尾气并防止空气进入装置丙
7.在潮湿的空气中,钢铁制品表面会形成一薄层水膜,空气中的 、 、 等物质溶解在其中形成电
解质溶液。下列说法正确的是
A.酸性:
B. 在水溶液中的电离方程式为
C.常温下, 的 溶液中,
D.常温下,0.01mol 与足量的水反应,可得到0.01mol
8.下列离子方程式正确的是
A.向饱和 溶液中通入足量
B.向稀硝酸中滴加 溶液:
C.向新制氯水中滴加少量的 溶液:
D.向 溶液中加入一小粒固体钠:
9.MnO 催化某反应的一种催化机理如图所示。下列叙述正确的是
2
A.使用MnO 催化时,总反应的焓变会发生变化
2
B.HO+O→H++ + ∙OH放出热量
2 2
C.催化过程中,所发生的反应均为氧化还原反应
10题图D.1molHCHO参加反应转移4mol电子
10.观察图:对合成氨反应中,下列叙述错误的是
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
C.反应到达t 时,正反应速率与逆反应速率相等,反应停止
1
D.反应在t 之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
1
11.在硫酸工业中,通过下列反应: ,下表列出了在不同温
度和压强下,反应达到平衡时 的转化率。下列说法正确的是
温度/ 平衡时 的转化率
0.1MPa 0.5MPa 1MPa 5MPa 10MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
A.工业上通入过量空气的主要目的是加快反应速率
B.回收尾气中的 仅为了防止空气污染
C.采用常压条件是因为常压下 的转化率足够高,增大压强会增加设备成本
D.选择 的较高温度既提高反应速率也提高平衡转化率
12.下列各组离子在指定溶液中一定不能大量共存的是
A.含有Al3+的溶液中:K+、Na+、HCO 、Cl-
B. =1.0×10﹣12的溶液:Na+、AlO 、NO 、S2﹣、SO
C.使甲基橙显黄色的溶液:Fe2+、Cl﹣、Mg2+、SO
D.常温下,由水电离产生c(H+)=10﹣12mol L﹣1的溶液中:Na+、Cl﹣、CO 、SO
13.25℃时,用NaOH溶液分别滴定HX、 、 三种溶液,pM[p表示负对数,M表示 、
、 ]随pH变化的关系如图所示,已知: (不考虑二价铁的氧
化)。下列说法正确的是
A.曲线①表示滴定 溶液的pM变化关系
B.HX的电离常数
C.a点对应的pH=9
D. 不易溶于HX溶液中,而 易溶于HX溶液中
13题图
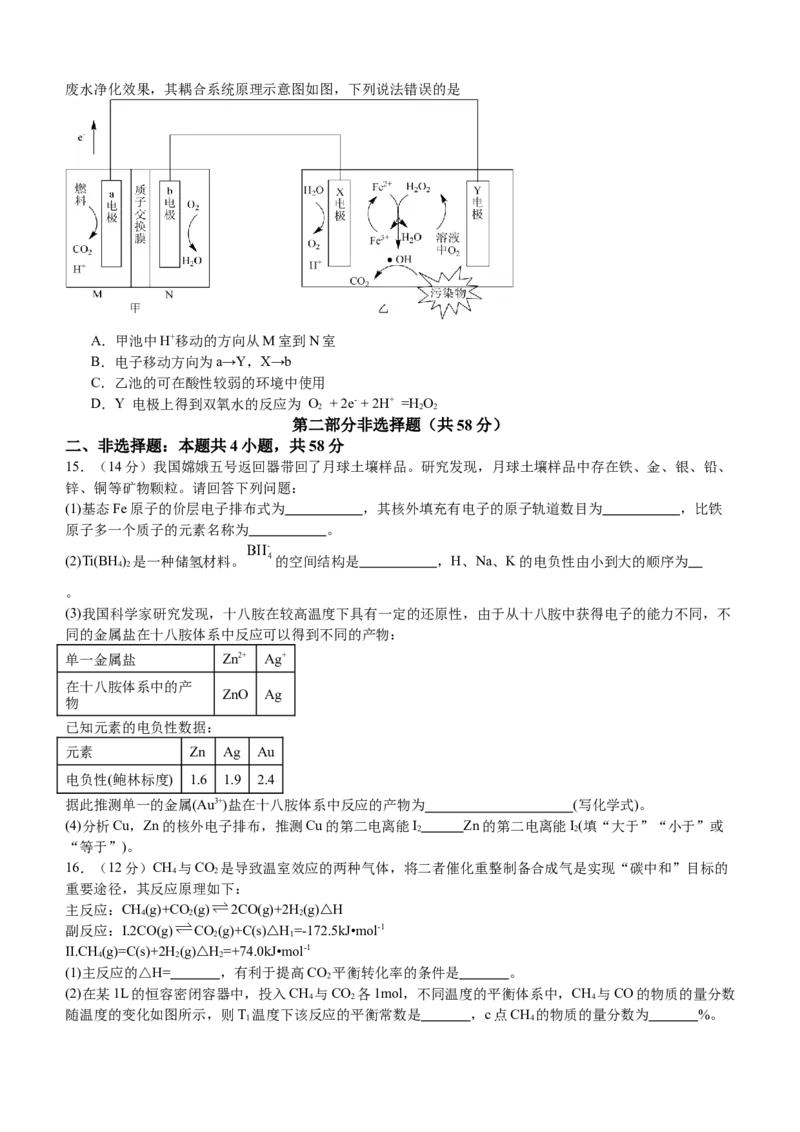
14.MFC-电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果,其耦合系统原理示意图如图,下列说法错误的是
A.甲池中H+移动的方向从M室到N室
B.电子移动方向为a→Y,X→b
C.乙池的可在酸性较弱的环境中使用
D.Y 电极上得到双氧水的反应为 O + 2e- + 2H+ =H O
2 2 2
第二部分非选择题(共58分)
二、非选择题:本题共4小题,共58分
15.(14分)我国嫦娥五号返回器带回了月球土壤样品。研究发现,月球土壤样品中存在铁、金、银、铅、
锌、铜等矿物颗粒。请回答下列问题:
(1)基态Fe原子的价层电子排布式为 ,其核外填充有电子的原子轨道数目为 ,比铁
原子多一个质子的元素名称为 。
(2)Ti(BH) 是一种储氢材料。 的空间结构是 ,H、Na、K的电负性由小到大的顺序为
4 2
。
(3)我国科学家研究发现,十八胺在较高温度下具有一定的还原性,由于从十八胺中获得电子的能力不同,不
同的金属盐在十八胺体系中反应可以得到不同的产物:
单一金属盐 Zn2+ Ag+
在十八胺体系中的产
ZnO Ag
物
已知元素的电负性数据:
元素 Zn Ag Au
电负性(鲍林标度) 1.6 1.9 2.4
据此推测单一的金属(Au3+)盐在十八胺体系中反应的产物为 (写化学式)。
(4)分析Cu,Zn的核外电子排布,推测Cu的第二电离能I Zn的第二电离能I(填“大于”“小于”或
2 2
“等于”)。
16.(12分)CH 与CO 是导致温室效应的两种气体,将二者催化重整制备合成气是实现“碳中和”目标的
4 2
重要途径,其反应原理如下:
主反应:CH(g)+CO (g) 2CO(g)+2H(g)△H
4 2 2
副反应:I.2CO(g) CO(g)+C(s)△H =-172.5kJ•mol-1
2 1
II.CH (g)=C(s)+2H (g)△H=+74.0kJ•mol-1
4 2 2
(1)主反应的△H= ,有利于提高CO 平衡转化率的条件是 。
2
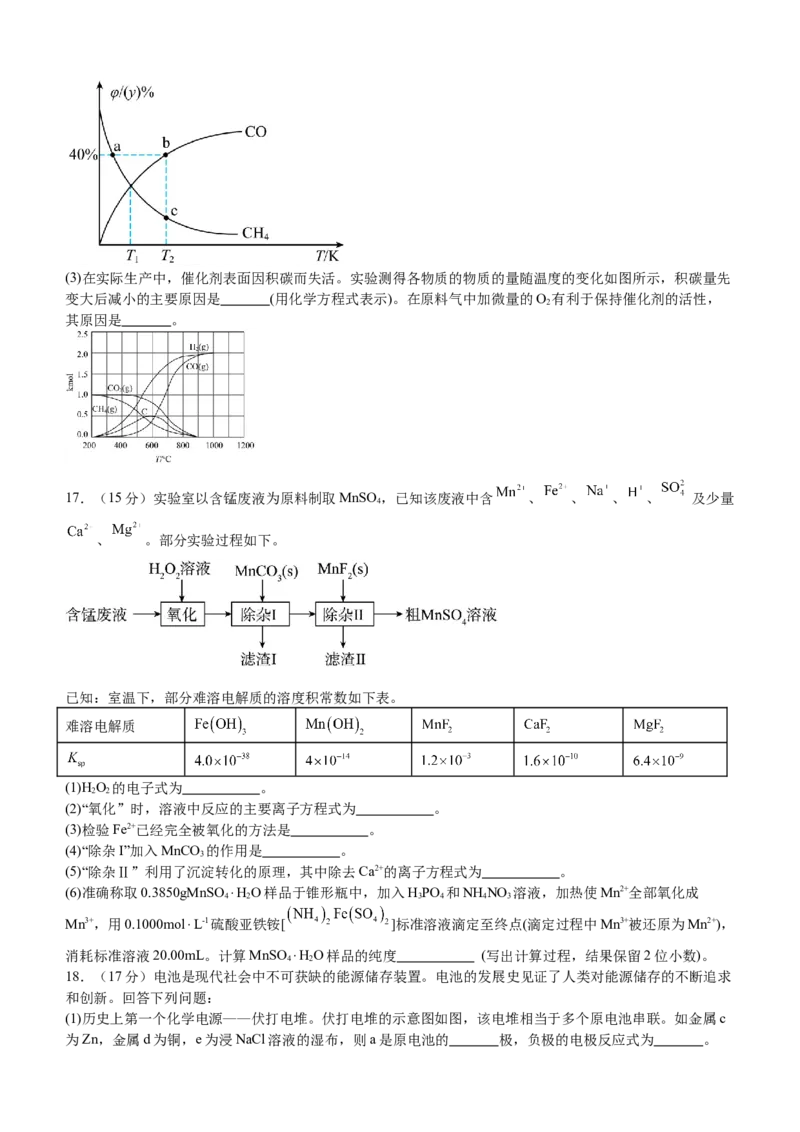
(2)在某1L的恒容密闭容器中,投入CH 与CO 各1mol,不同温度的平衡体系中,CH 与CO的物质的量分数
4 2 4
随温度的变化如图所示,则T 温度下该反应的平衡常数是 ,c点CH 的物质的量分数为 %。
1 4(3)在实际生产中,催化剂表面因积碳而失活。实验测得各物质的物质的量随温度的变化如图所示,积碳量先
变大后减小的主要原因是 (用化学方程式表示)。在原料气中加微量的O 有利于保持催化剂的活性,
2
其原因是 。
17.(15分)实验室以含锰废液为原料制取MnSO ,已知该废液中含 、 、 、 、 及少量
4
、 。部分实验过程如下。
已知:室温下,部分难溶电解质的溶度积常数如下表。
难溶电解质
(1)H O 的电子式为 。
2 2
(2)“氧化”时,溶液中反应的主要离子方程式为 。
(3)检验Fe2+已经完全被氧化的方法是 。
(4)“除杂I”加入MnCO 的作用是 。
3
(5)“除杂Ⅱ”利用了沉淀转化的原理,其中除去Ca2+的离子方程式为 。
(6)准确称取0.3850gMnSO⋅HO样品于锥形瓶中,加入HPO 和NH NO 溶液,加热使Mn2+全部氧化成
4 2 3 4 4 3
Mn3+,用0.1000mol⋅L-1硫酸亚铁铵[ ]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),
消耗标准溶液20.00mL。计算MnSO ⋅HO样品的纯度 (写出计算过程,结果保留2位小数)。
4 2
18.(17分)电池是现代社会中不可获缺的能源储存装置。电池的发展史见证了人类对能源储存的不断追求
和创新。回答下列问题:
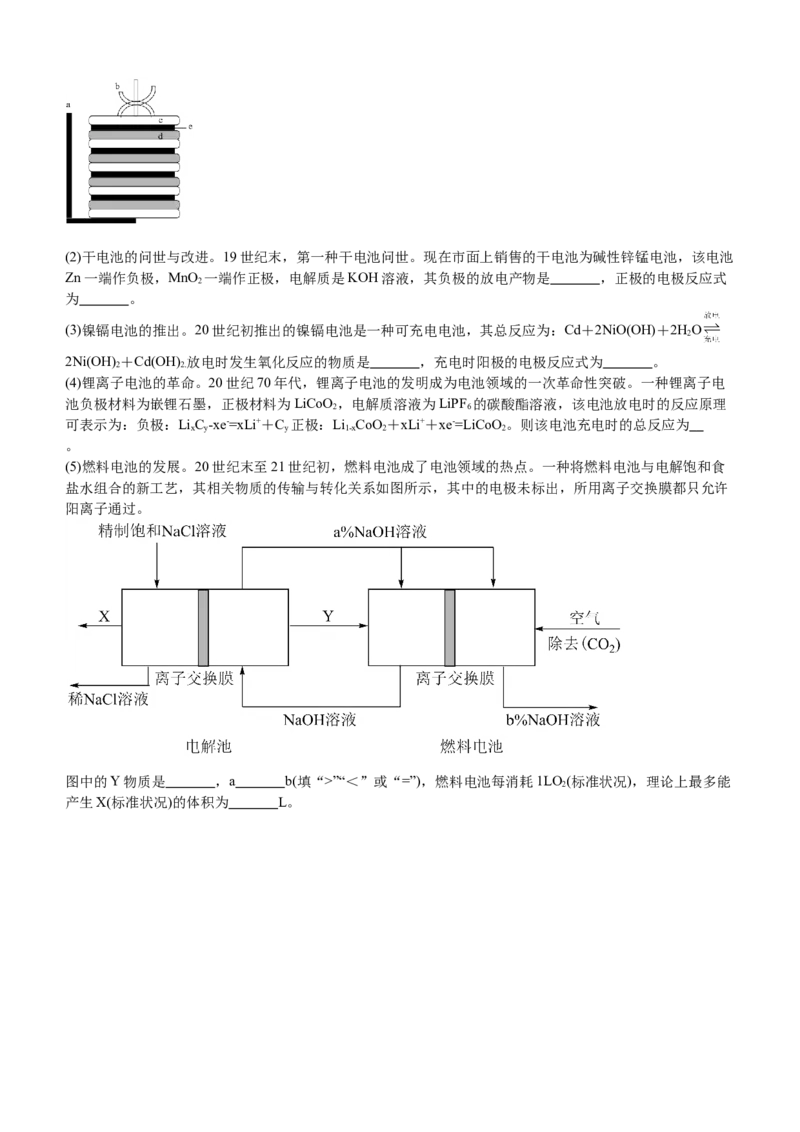
(1)历史上第一个化学电源——伏打电堆。伏打电堆的示意图如图,该电堆相当于多个原电池串联。如金属c
为Zn,金属d为铜,e为浸NaCl溶液的湿布,则a是原电池的 极,负极的电极反应式为 。(2)干电池的问世与改进。19世纪末,第一种干电池问世。现在市面上销售的干电池为碱性锌锰电池,该电池
Zn一端作负极,MnO 一端作正极,电解质是KOH溶液,其负极的放电产物是 ,正极的电极反应式
2
为 。
(3)镍镉电池的推出。20世纪初推出的镍镉电池是一种可充电电池,其总反应为:Cd+2NiO(OH)+2HO
2
2Ni(OH) +Cd(OH) 放电时发生氧化反应的物质是 ,充电时阳极的电极反应式为 。
2 2.
(4)锂离子电池的革命。20世纪70年代,锂离子电池的发明成为电池领域的一次革命性突破。一种锂离子电
池负极材料为嵌锂石墨,正极材料为LiCoO ,电解质溶液为LiPF 的碳酸酯溶液,该电池放电时的反应原理
2 6
可表示为:负极:LiC -xe-=xLi++C 正极:Li CoO+xLi++xe-=LiCoO。则该电池充电时的总反应为
x y y 1-x 2 2
。
(5)燃料电池的发展。20世纪末至21世纪初,燃料电池成了电池领域的热点。一种将燃料电池与电解饱和食
盐水组合的新工艺,其相关物质的传输与转化关系如图所示,其中的电极未标出,所用离子交换膜都只允许
阳离子通过。
图中的Y物质是 ,a b(填“>”“<”或“=”),燃料电池每消耗1LO(标准状况),理论上最多能
2
产生X(标准状况)的体积为 L。