文档内容
配套《高中必刷题 化学 选择性必修3 有机化学基础 LK》使用
第1章 有机化合物的结构与性质 烃
第3节 烃
课时2 烯烃和炔烃及其性质
一、烯烃的结构和性质
1.烯烃的结构
烯烃的官能团是碳碳双键。烯烃只含有一个碳碳双键时,其通式一般表示为C H ( n ≥ 2) 。
n 2n
(1)乙烯的结构
分子中的碳原子均采取 sp 2 杂化,碳原子与氢原子之间均以 单键 (σ 键 )相连接,碳原子与碳
原子之间以双键(1个 σ 键 ,1个 π 键 )相连接,键角约为120°,分子中所有原子都位于同一
平面。
(2)烯烃的结构
①碳碳双键两端的碳原子采取 sp 2 杂化;其余具有四条单键的碳原子采取 sp 3 杂化。
②碳碳双键两端的碳原子以及与之相连的四个原子一定在一个平面内。
2.物理性质
(1)乙烯:纯净的乙烯为无色、稍有气味的气体,难溶于水,密度比空气的略小。
(2)烯烃:烯烃物理性质的递变规律与烷烃的相似。
①烯烃的沸点随分子中碳原子数的递增而逐渐升高,状态由气态(常温下,碳原子数 ≤ 4 时)
到液态、固态。
②烯烃均难溶于水,液态烯烃的密度均比水小。
3.化学性质——与乙烯相似
(1)氧化反应
①烯烃能使酸性高锰酸钾溶液褪色。
②可燃性
燃烧通式为C H + O ――→ n CO + n H O。
n 2n 2 2 2
因烯烃中碳元素的质量分数较大,燃烧时常伴有黑烟。
(2)加成反应
烯烃可以发生类似乙烯的加成反应。
写出乙烯与下列物质反应的化学方程式。
①溴:CH = = CH + B r ― → CH BrCHBr。
2 2 2 2 2
②氯化氢:CH = = CH + HC l ――→ CH CHCl。
2 2 3 2
③水:CH = = CH + H O ――――→ C HOH。
2 2 2 2 5
(3)加聚反应
含有碳碳双键的有机化合物在一定条件下能发生类似乙烯的加聚反应
二、烯烃的立体异构
1.顺反异构现象
通过碳碳双键连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反
异构现象。
2.结构特点
(1)碳碳双键两端的碳原子均连接不同的原子和原子团。
(2)相同的原子或原子团位于双键同一侧为顺式结构;而位于双键两侧为反式结构。
3.性质特点
顺反异构体的化学性质基本相同,物理性质有一定的差异。
三、炔烃
1.炔烃
炔烃的官能团是碳碳三键,只含有一个碳碳三键时通式为C H ( n ≥ 2) 。炔烃的命名方法
n 2n-2配套《高中必刷题 化学 选择性必修3 有机化学基础 LK》使用
与烯烃相同,如 的名称为4-甲基-1-戊炔。炔烃物理性质的递变规律与烷
烃和烯烃的相似,沸点随分子中碳原子数的递增而逐渐升高,常温下,碳原子数不大于4
的炔烃为气态。
2.乙炔的物理性质
乙炔(俗称电石气)是最简单的炔烃。乙炔是无色、无臭的气体,微溶于水,易溶于有机溶
剂。
3.乙炔的结构
(1)乙炔的表示方法
分子式:C H ,电子式: ,结构式: H—C ≡ C—H ,结构简式:
2 2
CH ≡ CH ,键线式:≡,球棍模型: ,空间填充模型: 。
(2)乙炔的结构特点
乙炔分子为直线形结构,相邻两个键之间的夹角为180°。碳原子均采取sp 杂化,C、H之
间均以单键(σ 键)相连接,碳原子与碳原子之间以三键(1个σ 键和2个π 键)相连接。
4.乙炔的化学性质
(1)实验探究
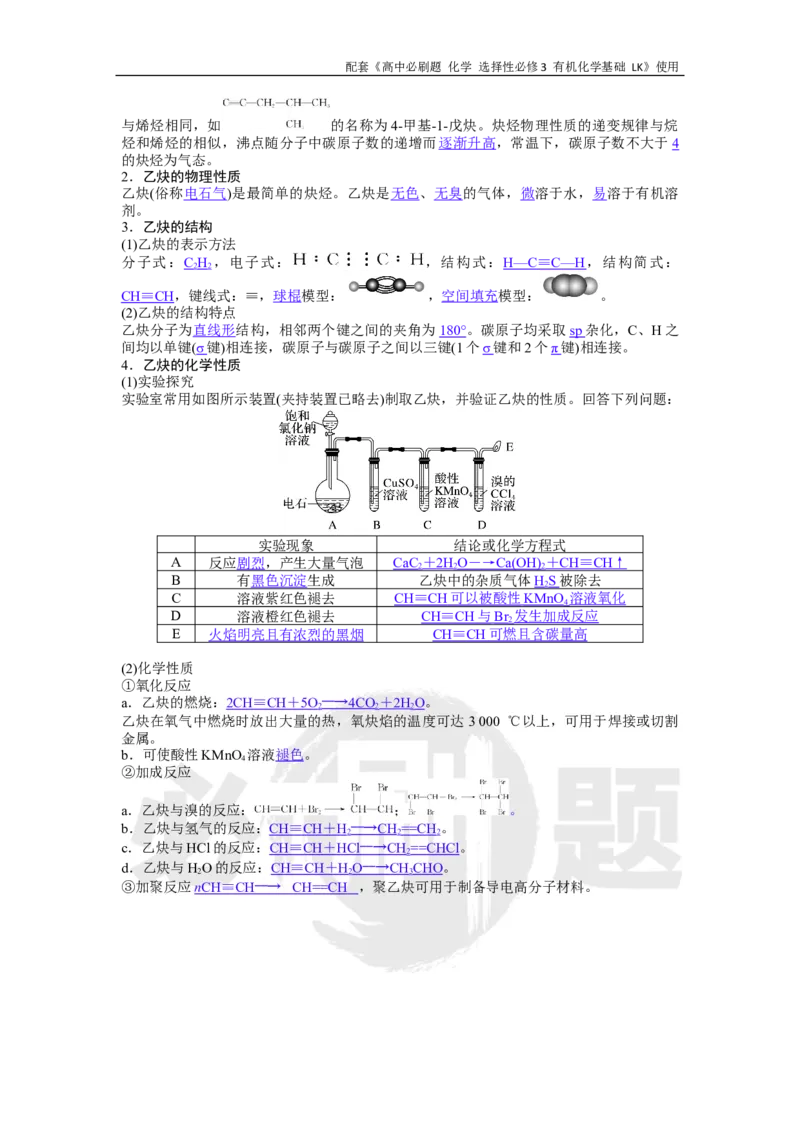
实验室常用如图所示装置(夹持装置已略去)制取乙炔,并验证乙炔的性质。回答下列问题:
实验现象 结论或化学方程式
A 反应剧烈,产生大量气泡 CaC + 2H O ― → Ca(OH) + CH ≡ CH ↑
2 2 2
B 有黑色沉淀生成 乙炔中的杂质气体HS 被除去
2
C 溶液紫红色褪去 CH ≡ CH 可以被酸性 KMnO 溶液氧化
4
D 溶液橙红色褪去 CH ≡ CH 与 Br 发生加成反应
2
E 火焰明亮且有浓烈的黑烟 CH ≡ CH 可燃且含碳量高
(2)化学性质
①氧化反应
a.乙炔的燃烧: 2CH ≡ CH + 5O ――→ 4CO + 2H O。
2 2 2
乙炔在氧气中燃烧时放出大量的热,氧炔焰的温度可达3 000 ℃以上,可用于焊接或切割
金属。
b.可使酸性KMnO 溶液褪色。
4
②加成反应
a.乙炔与溴的反应: ; 。
b.乙炔与氢气的反应: CH ≡ CH + H ――→ CH = = CH 。
2 2 2
c.乙炔与HCl的反应: CH ≡ CH + HCl ――→ CH = = CHCl 。
2
d.乙炔与HO的反应: CH ≡ CH + H O ――→ CH CHO。
2 2 3
③加聚反应 n CH ≡ CH ――→ CH = = CH ,聚乙炔可用于制备导电高分子材料。