文档内容
2020年长沙市初中学业水平考试试卷
化学
一、选择题(本大题共15小题,每小题3分,共45分。每小题只有1个选项符合题意。
请将符合题意的选项用2B铅笔填涂在答题卡相应位置)
1.酒精是一种常用的消毒剂,在抗疫期间被广泛使用。下列有关酒精性质的描述属于化
学性质的是( )
A.具有可燃性 B.易挥发 C.有特殊气味 D.易溶于水
2.今年,长沙的空气质量明显改善,空气是一种宝贵的自然资源。下列说法正确的是(
)
A.洁净的空气是纯净物
B.空气中体积分数最大的是氮气
C.氧气有助燃性,常用作燃料
D.空气中臭氧(O )含量少,属于稀有气体
3
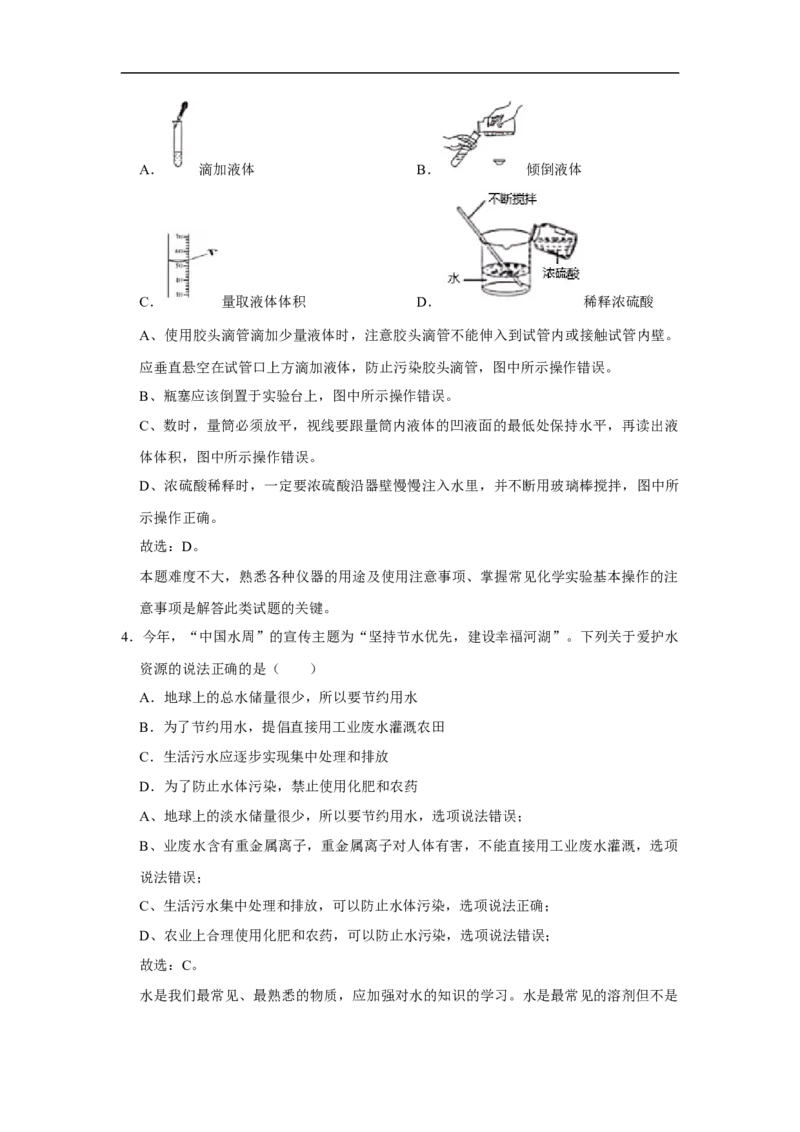
3.化学是一门以实验为基础的科学,取用液体药品时应注意安全、规范操作。下列操作正
确的是( )
A. 滴加液体 B. 倾倒液体
C. 量取液体体积 D. 稀释浓硫酸
4.今年,“中国水周”的宣传主题为“坚持节水优先,建设幸福河湖”。下列关于爱护水
资源的说法正确的是( )
A.地球上的总水储量很少,所以要节约用水
B.为了节约用水,提倡直接用工业废水灌溉农田
C.生活污水应逐步实现集中处理和排放
D.为了防止水体污染,禁止使用化肥和农药
5.“宏观﹣﹣微观﹣﹣符号”是学习化学的重要内容和方法。如图是几种分子的模型,请由图分析,下列说法正确的是( )
A.氧气含有氧元素,属于氧化物
B.氢气由2个氢原子构成
C.1个氨分子由1个氮原子和3个氢原子构成
D.二氧化碳含有碳元素,属于有机物
6.工业上常用煅烧石灰石的方法制取 CO ,反应的化学方程式为:CaCO
2 3
CaO+CO ↑.该反应所属的基本反应类型是( )
2
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
7.两位英国科学家因在石墨烯材料方面的开创性研究获得 2020年诺贝尔奖。石墨烯是由
碳元素组成的单质,下列关于碳单质的说法正确的是( )
A.金刚石是天然存在的最硬的物质,可用来裁玻璃
B.石墨有金属光泽,有导电性,所以是一种金属
C.活性炭具有吸附性,可以吸附所有物质
D.金刚石、石墨和足球烯(C )都是由碳原子直接构成的
60
8.2020年6月13日,浙江温岭的槽罐车爆炸事故造成了重大人员伤亡和财产损失。下列
有关易燃物和易爆物的生产、运输、使用和贮存的说法正确的是( )
A.生产:面粉加工厂应标有“严禁烟火”字样或图标
B.运输:为方便运输,将烟花厂建在市中心
C.使用:家用天然气泄漏时,用打火机检测泄露位置
D.贮存:为节约空间,应将易燃物和易爆物紧密堆积
9.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。下列
有关金属材科的说法正确的是( )
A.合金中一定只含金属元素
B.纯铜比黄铜的硬度更大
C.生锈的钢铁制品没有回收价值
D.钛和钛合金被广泛用于火箭、导弹等10.在“停课不停学”期间,小兰同学通过网课学习了溶液的形成后,将少量下列物质分
别放入水中并充分搅拌,其中不能形成溶液的是( )
A.白砂糖 B.食盐 C.纯碱 D.植物油
11.通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小
兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是( )
A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生
B.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
C.向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀
D.向氢氧化钙溶液中加入几滴紫色石蕊溶液,石蕊溶液由紫色变成红色
12.疫情期间,国家采取了有力的防控措施,我们也要加强个人防护,注重营养均衡。下
列有关营养素的说法正确的是( )
A.蛋白质在牛奶、米饭、豆腐中含量丰富
B.糖类和油脂都能为人体提供能量
C.人体需要的维生素全部可在人体内合成,不需要从外界摄入
D.无机盐和水不属于营养素
13.鉴别是利用物质的性质不同,采用合理的方法进行区分。下列鉴别物质的方法正确的
是( )
A.用水鉴别NaCl、NaOH、NH NO 三种固体
4 3
B.用燃着的木条鉴别O 、CO 、N 三种气体
2 2 2
C.用Ba(OH) 溶液鉴别KCl、K SO 、KNO 三种溶液
2 2 4 3
D.用CO 鉴别NaOH、KOH、Ca(OH) 三种溶液
2 2
14.“证据推理与模型认知”是化学学科核心素养的重要组成部分。下列推理合理的是(
)
A.活泼金属与稀盐酸反应产生气泡,则与稀盐酸反应产生气泡的物质一定是活泼金属
B.碱溶液能使酚酞溶液变成红色,则能使酚酞溶液变成红色的溶液一定显碱性
C.氢氧化钠可与盐酸反应,则能用氢氧化钠治疗胃酸过多
D.必需元素摄入不足不利于人体健康,则对于必需元素的摄入越多越好
15.总结归纳是化学学习的一种重要方法。请你判断下列除杂方法正确的是( )
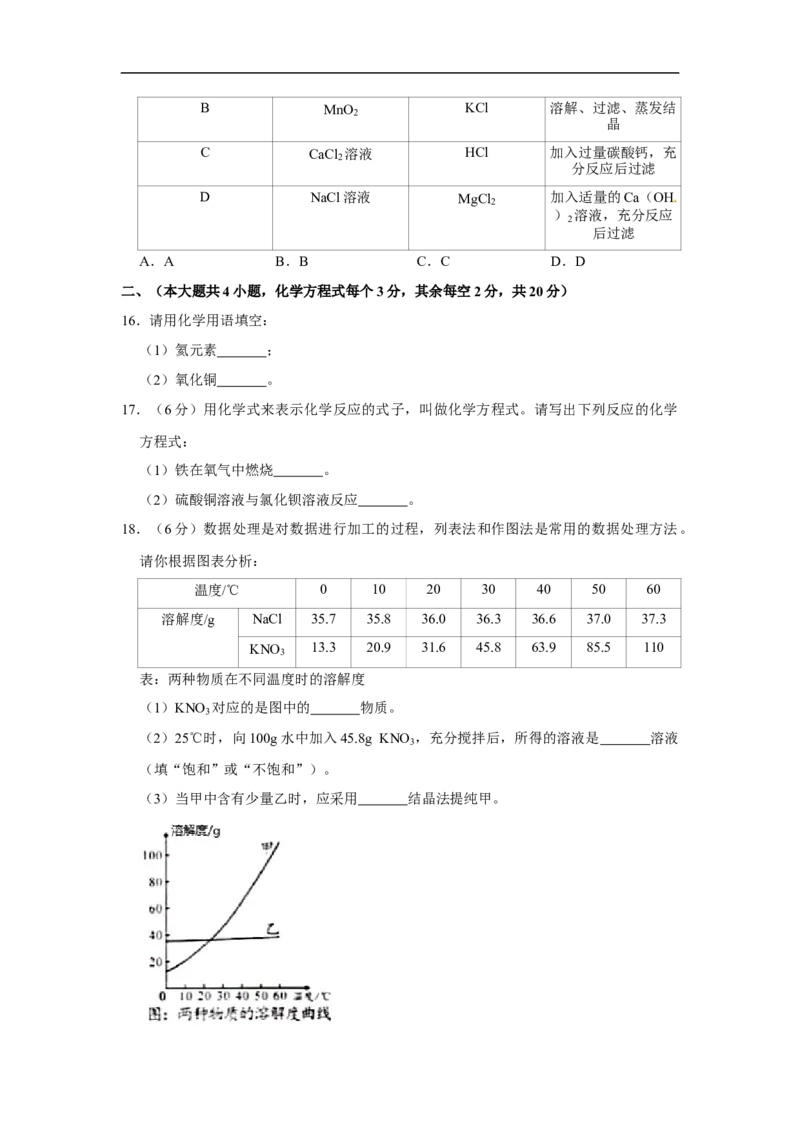
选项 物质 杂质(少量) 除杂方法
A CO CO 通过灼热的氧化铜
2B MnO KCl 溶解、过滤、蒸发结
2
晶
C CaCl 溶液 HCl 加入过量碳酸钙,充
2
分反应后过滤
D NaCl溶液 MgCl 加入适量的Ca(OH
2
) 溶液,充分反应
2
后过滤
A.A B.B C.C D.D
二、(本大题共4小题,化学方程式每个3分,其余每空2分,共20分)
16.请用化学用语填空:
(1)氦元素 ;
(2)氧化铜 。
17.(6分)用化学式来表示化学反应的式子,叫做化学方程式。请写出下列反应的化学
方程式:
(1)铁在氧气中燃烧 。
(2)硫酸铜溶液与氯化钡溶液反应 。
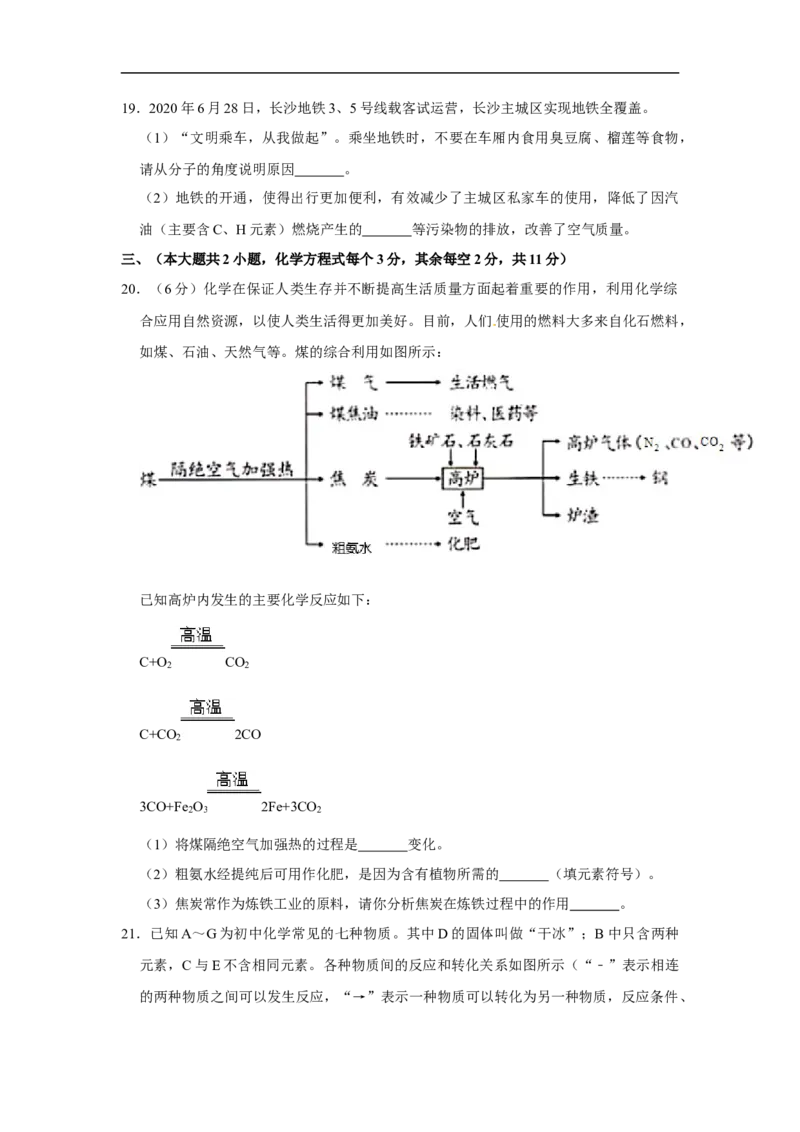
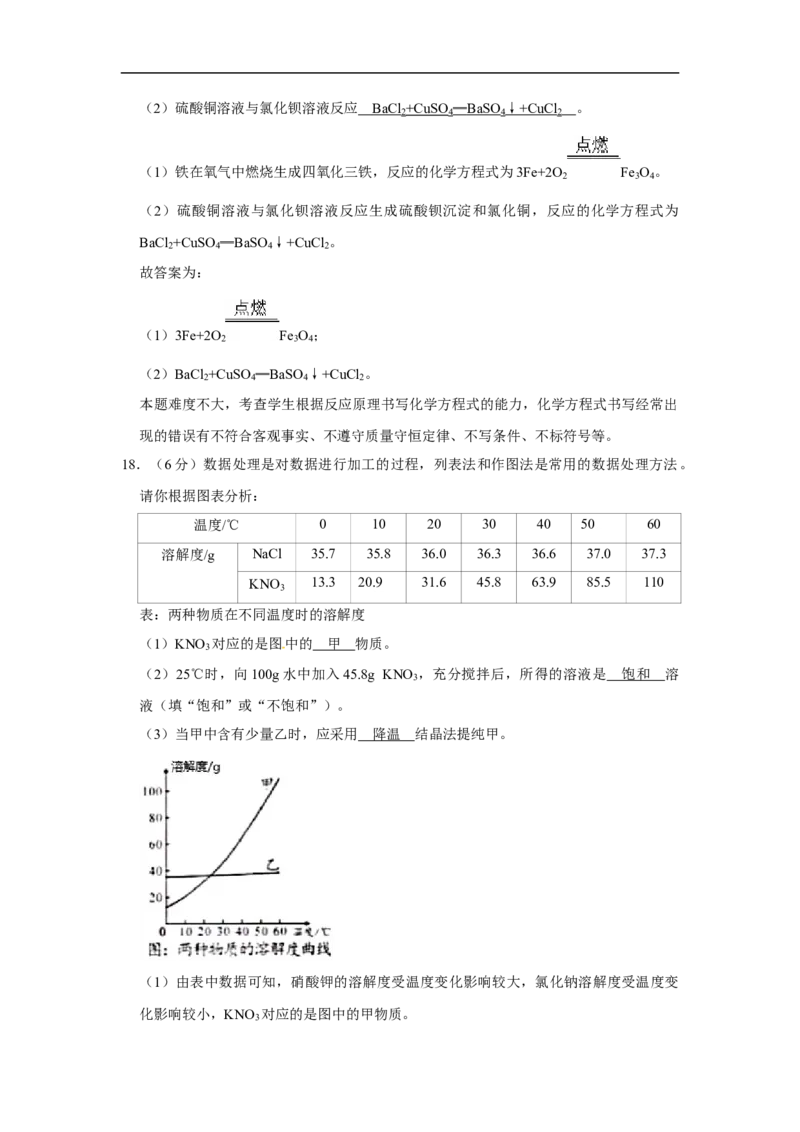
18.(6分)数据处理是对数据进行加工的过程,列表法和作图法是常用的数据处理方法。
请你根据图表分析:
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO 13.3 20.9 31.6 45.8 63.9 85.5 110
3
表:两种物质在不同温度时的溶解度
(1)KNO 对应的是图中的 物质。
3
(2)25℃时,向100g水中加入45.8g KNO ,充分搅拌后,所得的溶液是 溶液
3
(填“饱和”或“不饱和”)。
(3)当甲中含有少量乙时,应采用 结晶法提纯甲。19.2020年6月28日,长沙地铁3、5号线载客试运营,长沙主城区实现地铁全覆盖。
(1)“文明乘车,从我做起”。乘坐地铁时,不要在车厢内食用臭豆腐、榴莲等食物,
请从分子的角度说明原因 。
(2)地铁的开通,使得出行更加便利,有效减少了主城区私家车的使用,降低了因汽
油(主要含C、H元素)燃烧产生的 等污染物的排放,改善了空气质量。
三、(本大题共2小题,化学方程式每个3分,其余每空2分,共11分)
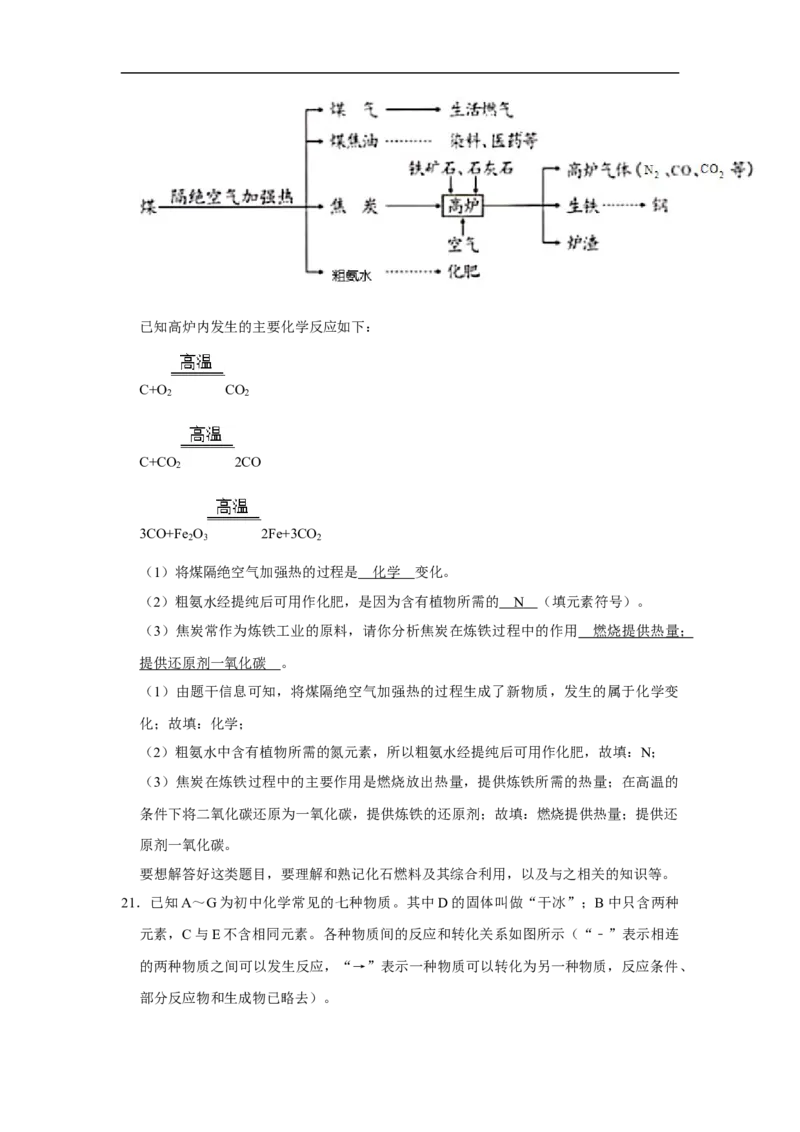
20.(6分)化学在保证人类生存并不断提高生活质量方面起着重要的作用,利用化学综
合应用自然资源,以使人类生活得更加美好。目前,人们使用的燃料大多来自化石燃料,
如煤、石油、天然气等。煤的综合利用如图所示:
已知高炉内发生的主要化学反应如下:
C+O CO
2 2
C+CO 2CO
2
3CO+Fe O 2Fe+3CO
2 3 2
(1)将煤隔绝空气加强热的过程是 变化。
(2)粗氨水经提纯后可用作化肥,是因为含有植物所需的 (填元素符号)。
(3)焦炭常作为炼铁工业的原料,请你分析焦炭在炼铁过程中的作用 。
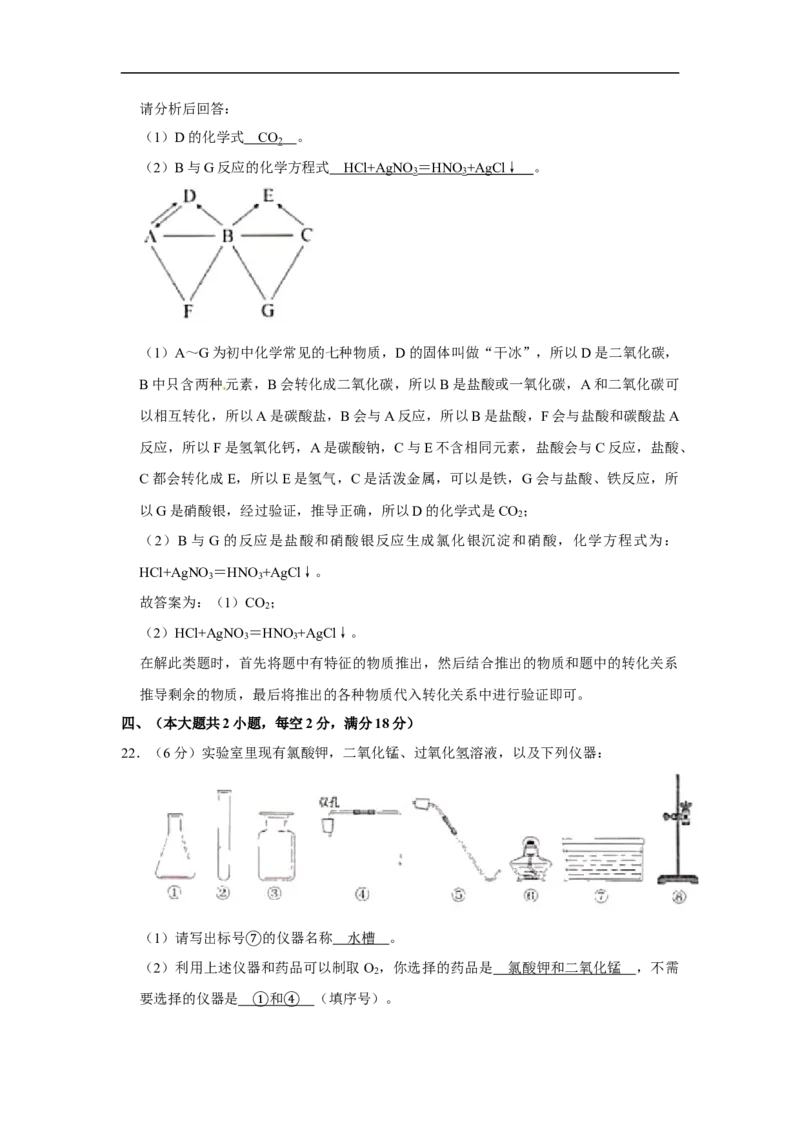
21.已知A~G为初中化学常见的七种物质。其中D的固体叫做“干冰”;B中只含两种
元素,C与E不含相同元素。各种物质间的反应和转化关系如图所示(“﹣”表示相连
的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。
请分析后回答:
(1)D的化学式 。
(2)B与G反应的化学方程式 。
四、(本大题共2小题,每空2分,满分18分)
22.(6分)实验室里现有氯酸钾,二氧化锰、过氧化氢溶液,以及下列仪器:
(1)请写出标号 的仪器名称 。
(2)利用上述仪⑦器和药品可以制取O
2
,你选择的药品是 ,不需要选择的仪器是
(填序号)。
23.在学习复分解反应发生的条件后,同学们利用已学知识,对稀硫酸与下表中的四种化
合物的溶液之间能否发生反应作出判断,并进行实验验证:
物质 NaOH溶液 NaCl溶液 K CO 溶液 Ba(NO ) 溶液
2 3 3 2
能否反应 能 不能 能 能
实验现象 无明显现象 无明显现象 产生气泡 产生白色沉淀
(1)判断NaOH溶液与稀硫酸能发生反应的依据是生成物中有 生成。
【提出问题】对于没有明显现象的反应,如何设计实验进行证明?
【设计实验】在老师的指导下,同学们向少量稀硫酸中逐滴加入过量NaOH溶液,并进
行了如下分组实验:
组号 操作 实验现象 结论
1 用pH试纸测定实验前后溶液的 pH由1变至9 能反应
pH2 向反应后的溶液中加入适量Ba 溶液产生白色沉淀 不能反应
(NO ) 溶液
3 2
3 向反应后的溶液中加入适量 能反应
K CO 溶液
2 3
(2)若开始时将pH试纸用蒸馏水润湿。则测得的稀硫酸的pH将 (填“偏大”、
“偏小”或“不变”)。
(3)请你判断第2小组同学得出的结论是否正确,井说明理由 。
(4)第3小组的实验现象为 。
【实验结论】对于无明显现象的反应,我们可以分析比较反应物和生成物的性质,从多
个角度设计实验进行证明。
【实验反思】向NaOH溶液中通入少量CO .再向其中加入 ,有气泡产生,即
2
可证明NaOH与CO 发生了反应。
2
【拓展提升】稀硫酸与NaCl溶液不能发生反应,请你设计实验进行证明 (写出
实验操作与现象)。
五、(本大题共1小题,共6分)可能用到的相对原子质量:H-1O-16Na-23S-32
24.(6分)为了测定某小苏打样品中碳酸氢钠的质量分数,小兰同学进行了如下实验:
向盛有10g样品的烧杯中加入稀硫酸,恰好完全反应时,加入稀硫酸的质量为 90g,反
应后烧杯内物质的总质量为95.6g。(杂质不溶于水也不与酸发生反应)
已知反应的化学方程式如下:2NaHCO +H SO ═Na SO +2CO ↑+2H O
3 2 4 2 4 2 2
(1)该反应生成二氧化碳的质量为 g。
(2)求该样品中碳酸氢钠的质量分数(写出计算过程)。2020年长沙市初中学业水平考试试卷
化学
一、选择题(本大题共15小题,每小题3分,共45分。每小题只有1个选项符合题意。
请将符合题意的选项用2B铅笔填涂在答题卡相应位置)
1.酒精是一种常用的消毒剂,在抗疫期间被广泛使用。下列有关酒精性质的描述属于化学
性质的是( )
A.具有可燃性 B.易挥发 C.有特殊气味 D.易溶于水
A、酒精具有可燃性,可燃性属于化学性质;故选项正确;
B、酒精易挥发,挥发性属于物理性质;故选项错误;
C、酒精有特殊气味,气味属于物理性质;故选项错误;
D、酒精易溶于水,属于物理性质;故选项错误;
故选:A。
本考点考查了物理性质和化学性质的区分,要记忆酒精的性质,并能够在比较的基础上
进行应用,本考点的基础性比较强,主要出现在选择题和填空题中。
2.今年,长沙的空气质量明显改善,空气是一种宝贵的自然资源。下列说法正确的是(
)
A.洁净的空气是纯净物
B.空气中体积分数最大的是氮气
C.氧气有助燃性,常用作燃料
D.空气中臭氧(O )含量少,属于稀有气体
3
A、空气含有多种物质,属于混合物,选项错误;
B、氮气大约占空气体积的78%,空气中体积分数最大的是氮气,选项正确;
C、氧气有助燃性,不具有可燃性,不能用作燃料,选项错误;
D、空气中臭氧(O )含量少,但不属于稀有气体,选项错误;
3
故选:B。
本题较为简单,了解成分及各成分的性质、特点等知识即可分析解答。
3.化学是一门以实验为基础的科学,取用液体药品时应注意安全、规范操作。下列操作正
确的是( )A. 滴加液体 B. 倾倒液体
C. 量取液体体积 D. 稀释浓硫酸
A、使用胶头滴管滴加少量液体时,注意胶头滴管不能伸入到试管内或接触试管内壁。
应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误。
B、瓶塞应该倒置于实验台上,图中所示操作错误。
C、数时,量筒必须放平,视线要跟量筒内液体的凹液面的最低处保持水平,再读出液
体体积,图中所示操作错误。
D、浓硫酸稀释时,一定要浓硫酸沿器壁慢慢注入水里,并不断用玻璃棒搅拌,图中所
示操作正确。
故选:D。
本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注
意事项是解答此类试题的关键。
4.今年,“中国水周”的宣传主题为“坚持节水优先,建设幸福河湖”。下列关于爱护水
资源的说法正确的是( )
A.地球上的总水储量很少,所以要节约用水
B.为了节约用水,提倡直接用工业废水灌溉农田
C.生活污水应逐步实现集中处理和排放
D.为了防止水体污染,禁止使用化肥和农药
A、地球上的淡水储量很少,所以要节约用水,选项说法错误;
B、业废水含有重金属离子,重金属离子对人体有害,不能直接用工业废水灌溉,选项
说法错误;
C、生活污水集中处理和排放,可以防止水体污染,选项说法正确;
D、农业上合理使用化肥和农药,可以防止水污染,选项说法错误;
故选:C。
水是我们最常见、最熟悉的物质,应加强对水的知识的学习。水是最常见的溶剂但不是唯一的溶剂。
5.“宏观﹣﹣微观﹣﹣符号”是学习化学的重要内容和方法。如图是几种分子的模型,请
由图分析,下列说法正确的是( )
A.氧气含有氧元素,属于氧化物
B.氢气由2个氢原子构成
C.1个氨分子由1个氮原子和3个氢原子构成
D.二氧化碳含有碳元素,属于有机物
A.氧气是由一种元素组成的纯净物,属于单质,而不是氧化物,选项说法错误;
B.氢气是由氢分子构成的,每个氢分子是由2个氢原子构成的,选项说法错误;
C.由分子结构模型可知,1个氨分子由1个氮原子和3个氢原子构成,选项说法正确;
D.二氧化碳中虽然含有碳元素,但是其组成与性质与无机物类似,习惯上还是将其看
做无机物,选项说法错误。
故选:C。
本题主要分子结构模型的知识,解题的关键是认识物质的组成与结构、分子结构模型的
意义、物质的分类等,难度不大。
6.工业上常用煅烧石灰石的方法制取 CO ,反应的化学方程式为:CaCO
2 3
CaO+CO ↑.该反应所属的基本反应类型是( )
2
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应;
故选:B。
掌握四种基本反应类型的特征是正确解答本题的关键。
7.两位英国科学家因在石墨烯材料方面的开创性研究获得 2020年诺贝尔奖。石墨烯是由
碳元素组成的单质,下列关于碳单质的说法正确的是( )
A.金刚石是天然存在的最硬的物质,可用来裁玻璃
B.石墨有金属光泽,有导电性,所以是一种金属
C.活性炭具有吸附性,可以吸附所有物质
[来源:学科网]D.金刚石、石墨和足球烯(C )都是由碳原子直接构成的
60
A、金刚石是天然存在的最硬的物质,可以做钻头,切割玻璃大理石等,正确;
B、石墨有金属光泽,有导电性,但不是金属,选项错误;
C、活性炭具有吸附性,但不可以吸附所有物质,选项错误;
D、金刚石、石墨是由碳原子直接构成的,但足球烯(C )是由碳分子构成的,选项错
60
误;
故选:A。
明确物质的组成与结构决定性质,碳的几种单质组成元素相同,但碳原子排列方式不同,
决定了物理性质不同。
8.2020年6月13日,浙江温岭的槽罐车爆炸事故造成了重大人员伤亡和财产损失。下列
有关易燃物和易爆物的生产、运输、使用和贮存的说法正确的是( )
A.生产:面粉加工厂应标有“严禁烟火”字样或图标
B.运输:为方便运输,将烟花厂建在市中心
C.使用:家用天然气泄漏时,用打火机检测泄露位置
D.贮存:为节约空间,应将易燃物和易爆物紧密堆积
A、面粉加工厂内含有可燃性粉尘,遇明火可能会发生爆炸,应标有“严禁烟火”字样
或图标,选项正确;
B、由于易燃和易爆物品只要接触明火,或温度达到着火点与氧气接触,就会产生燃烧
和爆炸的危险,所以运输时,避开人口稠密区,防止爆炸时带来的灾难性后果,选项错
误;
C、家用天然气泄漏时,遇明火可能会发生爆炸,不能用打火机检测泄露位置,选项错
误;
D、存放易燃物和易爆物时,不能堆放得过高过密,防止缓慢氧化放热达到其着火点,
而发生燃烧或爆炸,选项错误;
故选:A。
化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也
是重要的中考热点之一。
9.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。下列
有关金属材科的说法正确的是( )
A.合金中一定只含金属元素
B.纯铜比黄铜的硬度更大C.生锈的钢铁制品没有回收价值
D.钛和钛合金被广泛用于火箭、导弹等
A.合金中一定含有金属元素,还可以含有非金属元素,如生铁中含有非金属元素碳等,
选项说法错误;
B.一般合金的硬度大于其组成中纯金属的硬度,所以纯铜比黄铜的硬度小,选项说法
错误;
C.生锈的钢铁制品可以回收重新利用,这样既可以节约能源,又可以减少环境污染,
选项说法错误;
D.钛和钛合金具有优良的性能,被广泛用于火箭、导弹、航天飞机和通信设备等,选
项说法正确。
故选:D。
合金相对于组成它的金属来说,一般具有熔点较低、耐腐蚀性强、硬度大、机械强度大
等方面的特点。
10.在“停课不停学”期间,小兰同学通过网课学习了溶液的形成后,将少量下列物质分
别放入水中并充分搅拌,其中不能形成溶液的是( )
A.白砂糖 B.食盐 C.纯碱 D.植物油
A、白砂糖易溶于水,形成均一、稳定的混合物,属于溶液,故A错;
B、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故B错;
C、纯碱易溶于水,形成均一、稳定的混合物,属于溶液,故C错误;
D、植物油不溶于水,与水混合形成乳浊液,不属于溶液,故D正确。
故选:D。
应熟悉溶液是一种均一稳定的混合物,在不改变条件时,溶液的组成和浓度都不会发生
变化,要与悬浊液和乳浊液区分。
11.(3分)通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。
下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是
( )
A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生
B.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
C.向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀
D.向氢氧化钙溶液中加入几滴紫色石蕊溶液,石蕊溶液由紫色变成红色
A、浓盐酸具有挥发性,打开浓盐酸的瓶塞,瓶口出现白雾,而不是白烟,故选项说法错误。
B、向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成黄色,故选项说法
错误。
C、向氯化铜溶液中加入几滴氢氧化钠溶液,生成氢氧化铜蓝色沉淀和氯化钠,会观察
到产生蓝色沉淀,故选项说法正确。
D、氢氧化钙溶液显碱性,向氢氧化钙溶液中加入几滴紫色石蕊溶液,石蕊溶液由紫色
变成蓝色,故选项说法错误。
故选:C。
本题难度不大,掌握酸和碱的化学性质、浓盐酸具有挥发性等即可正确解答,在描述实
验现象时,需要注意烟和雾的区别、物质颜色的变化。
12.疫情期间,国家采取了有力的防控措施,我们也要加强个人防护,注重营养均衡。下
列有关营养素的说法正确的是( )
A.蛋白质在牛奶、米饭、豆腐中含量丰富
B.糖类和油脂都能为人体提供能量
C.人体需要的维生素全部可在人体内合成,不需要从外界摄入
D.无机盐和水不属于营养素
A.牛奶和豆腐中富含蛋白质,米饭中富含糖类,选项说法错误;
B.蛋白质、糖类和油脂都能为人体提供能量,选项说法正确;
C.人体需要的维生素大多数在人体内不能合成,需从外界摄入,选项说法错误;
D.无机盐和水是人体必需的六大营养素中的两种,选项说法错误。
故选:B。
本题难度不大,了解六大营养素的相关知识是正确解答本题的关键。
13.鉴别是利用物质的性质不同,采用合理的方法进行区分。下列鉴别物质的方法正确的
是( )
A.用水鉴别NaCl、NaOH、NH NO 三种固体
4 3
B.用燃着的木条鉴别O 、CO 、N 三种气体
2 2 2
C.用Ba(OH) 溶液鉴别KCl、K SO 、KNO 三种溶液
2 2 4 3
D.用CO 鉴别NaOH、KOH、Ca(OH) 三种溶液
2 2
A、NaOH、NH NO 固体溶于水分别放热、吸热,使温度分别升高、降低,NaCl溶于
4 3
水温度几乎无变化,可以鉴别,故选项正确。
B、把燃着的木条分别伸入三种气体中,若木条熄灭,则是CO 、N ;若木条燃烧更旺,
2 2则是氧气;无法鉴别CO 、N ,故选项错误。
2 2
C、Ba(OH) 溶液与K SO 反应生成硫酸钡白色沉淀,与KCl、KNO 溶液均不反应,
2 2 4 3
不能鉴别,故选项错误。
D、CO 能与Ca(OH) 反应生成碳酸钙白色沉淀,与NaOH、KOH反应生成碳酸钠和
2 2
水、碳酸钾和水,均无明显现象,不能鉴别,故选项错误。
故选:A。
[来源:Z.xx.k.Com]
本题有一定难度,解答物质的鉴别题时要熟练掌握鉴别的物质的性质,然后选择适当的
试剂或方法,出现不同的现象即可鉴别。
14.“证据推理与模型认知”是化学学科核心素养的重要组成部分。下列推理合理的是(
)
A.活泼金属与稀盐酸反应产生气泡,则与稀盐酸反应产生气泡的物质一定是活泼金属
B.碱溶液能使酚酞溶液变成红色,则能使酚酞溶液变成红色的溶液一定显碱性
C.氢氧化钠可与盐酸反应,则能用氢氧化钠治疗胃酸过多
D.必需元素摄入不足不利于人体健康,则对于必需元素的摄入越多越好
A、活泼金属与稀盐酸反应产生气泡,能与稀盐酸反应产生气泡的物质不一定是活泼金
属,也可能是碳酸钠等盐溶液,故选项推理错误。
B、无色酚酞溶液遇酸性溶液不变色,遇中性溶液不变色,遇碱性溶液变红,碱溶液能
使酚酞溶液变成红色,则能使酚酞溶液变成红色的溶液一定显碱性,故选项推理正确。
C、氢氧化钠可与盐酸反应,但具有腐蚀性,不能用氢氧化钠治疗胃酸过多,故选项说
法错误。
D、必需元素摄入不足不利于人体健康,但对于必需元素并不是摄入越多越好,摄入不
足或过多均不利于人体健康,故选项说法错误。
故选:B。
本题难度不大,解答此类题时要根据不同知识的特点类推,不能盲目类推,并要注意知
识点与方法的有机结合,做到具体问题能具体分析。
15.总结归纳是化学学习的一种重要方法。请你判断下列除杂方法正确的是( )
选项 物质 杂质(少量) 除杂方法
A CO CO 通过灼热的氧化铜
2
B MnO KCl 溶解、过滤、蒸发结
2
晶C CaCl 溶液 HCl 加入过量碳酸钙,充
2
分反应后过滤
D NaCl溶液 MgCl 加入适量的Ca
2
(OH) 溶液,充分
2
反应后过滤
A.A B.B C.C D.D
A、CO能与灼热的氧化铜反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂
原则,故选项所采取的方法错误。
B、KCl易溶于水,MnO 难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分
2
离除杂,故选项所采取的方法错误。
C、HCl能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,
能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、MgCl 能与适量的Ca(OH) 溶液反应生成氢氧化镁沉淀和氯化钙,能除去杂质但
2 2
引入了新的杂质氯化钙,不符合除杂原则,故选项所采取的方法错误。
故选:C。
物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件
(加入的试剂一般只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。
二、(本大题共4小题,化学方程式每个3分,其余每空2分,共20分)
16.请用化学用语填空:
(1)氦元素 H e ;
(2)氧化铜 CuO 。
(1)书写元素符号注意“一大二小”,氦的元素符号是He。
(2)氧化铜中铜元素显+3价,氧元素显﹣2价,其化学式为:CuO。
故答案为:
(1)He;
(2)CuO。
本题难度不大,掌握常见化学用语(元素符号、化学式等)的书写方法是正确解答此类
题的关键。
17.(6分)用化学式来表示化学反应的式子,叫做化学方程式。请写出下列反应的化学
方程式:
(1)铁在氧气中燃烧 3Fe+2O Fe O 。
2 3 4(2)硫酸铜溶液与氯化钡溶液反应 BaC l +CuSO ═ BaSO ↓ +CuC l 。
2 4 4 2
(1)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O Fe O 。
2 3 4
(2)硫酸铜溶液与氯化钡溶液反应生成硫酸钡沉淀和氯化铜,反应的化学方程式为
BaCl +CuSO ═BaSO ↓+CuCl 。
2 4 4 2
故答案为:
(1)3Fe+2O Fe O ;
2 3 4
(2)BaCl +CuSO ═BaSO ↓+CuCl 。
2 4 4 2
本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出
现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等。
18.(6分)数据处理是对数据进行加工的过程,列表法和作图法是常用的数据处理方法。
请你根据图表分析:
温度/℃ 0 10 20 30 40 50 60
[来源:Z*xx*k.Com]
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO 13.3 20.9 31.6 45.8 63.9 85.5 110
3 [来源:学,科,网
Z,X,X,K]
表:两种物质在不同温度时的溶解度
(1)KNO 对应的是图中的 甲 物质。
3
(2)25℃时,向100g水中加入45.8g KNO ,充分搅拌后,所得的溶液是 饱和 溶
3
液(填“饱和”或“不饱和”)。
[来源:学,科,网]
(3)当甲中含有少量乙时,应采用 降温 结晶法提纯甲。
(1)由表中数据可知,硝酸钾的溶解度受温度变化影响较大,氯化钠溶解度受温度变
化影响较小,KNO 对应的是图中的甲物质。
3故填:甲。
(2)25℃时硝酸钾溶解度小于45.8g,向100g水中加入45.8g KNO ,充分搅拌后,不
3
能全部溶解,所得的溶液是饱和溶液。
故填:饱和。
(3)硝酸钾的溶解度受温度变化影响较大,氯化钠溶解度受温度变化影响较小,当硝
酸钾中含有少量氯化钠时,应采用降温结晶法提纯甲。
故填:降温。
溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不
同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度
对不同物质的溶解度影响不同。
19.2020年6月28日,长沙地铁3、5号线载客试运营,长沙主城区实现地铁全覆盖。
(1)“文明乘车,从我做起”。乘坐地铁时,不要在车厢内食用臭豆腐、榴莲等食物,
请从分子的角度说明原因 臭豆腐、榴莲等含有的分子是在不断的运动的,使人们闻到
臭味 。
(2)地铁的开通,使得出行更加便利,有效减少了主城区私家车的使用,降低了因汽
油(主要含C、H元素)燃烧产生的 一氧化碳 等污染物的排放,改善了空气质量。
(1)不要在车厢内食用臭豆腐、榴莲等食物,是因为臭豆腐、榴莲等含有的分子是在
不断的运动的,向四周扩散,使人们闻到臭味。
(2)汽油(主要含C、H元素)燃烧会产生一氧化碳、二氧化硫、二氧化氮等空气污
染物。
故答案为:
(1)臭豆腐、榴莲等含有的分子是在不断的运动的,使人们闻到臭味;
(2)一氧化碳。
本题难度不大,掌握分子的基本性质(可以简记为:“两小运间,同同不不”)、汽油
燃烧产生的空气污染物是解答此类题的关键。
三、(本大题共2小题,化学方程式每个3分,其余每空2分,共11分)
20.(6分)化学在保证人类生存并不断提高生活质量方面起着重要的作用,利用化学综
合应用自然资源,以使人类生活得更加美好。目前,人们使用的燃料大多来自化石燃料,
如煤、石油、天然气等。煤的综合利用如图所示:已知高炉内发生的主要化学反应如下:
C+O CO
2 2
C+CO 2CO
2
3CO+Fe O 2Fe+3CO
2 3 2
(1)将煤隔绝空气加强热的过程是 化学 变化。
(2)粗氨水经提纯后可用作化肥,是因为含有植物所需的 N (填元素符号)。
(3)焦炭常作为炼铁工业的原料,请你分析焦炭在炼铁过程中的作用 燃烧提供热量 ;
提供还原剂一氧化碳 。
(1)由题干信息可知,将煤隔绝空气加强热的过程生成了新物质,发生的属于化学变
化;故填:化学;
(2)粗氨水中含有植物所需的氮元素,所以粗氨水经提纯后可用作化肥,故填:N;
(3)焦炭在炼铁过程中的主要作用是燃烧放出热量,提供炼铁所需的热量;在高温的
条件下将二氧化碳还原为一氧化碳,提供炼铁的还原剂;故填:燃烧提供热量;提供还
原剂一氧化碳。
要想解答好这类题目,要理解和熟记化石燃料及其综合利用,以及与之相关的知识等。
21.已知A~G为初中化学常见的七种物质。其中D的固体叫做“干冰”;B中只含两种
元素,C与E不含相同元素。各种物质间的反应和转化关系如图所示(“﹣”表示相连
的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、
部分反应物和生成物已略去)。请分析后回答:
(1)D的化学式 CO 。
2
(2)B与G反应的化学方程式 HCl+AgNO = HNO +AgCl ↓ 。
3 3
(1)A~G为初中化学常见的七种物质,D的固体叫做“干冰”,所以D是二氧化碳,
B中只含两种元素,B会转化成二氧化碳,所以B是盐酸或一氧化碳,A和二氧化碳可
以相互转化,所以A是碳酸盐,B会与A反应,所以B是盐酸,F会与盐酸和碳酸盐A
反应,所以F是氢氧化钙,A是碳酸钠,C与E不含相同元素,盐酸会与C反应,盐酸、
C都会转化成E,所以E是氢气,C是活泼金属,可以是铁,G会与盐酸、铁反应,所
以G是硝酸银,经过验证,推导正确,所以D的化学式是CO ;
2
(2)B与G的反应是盐酸和硝酸银反应生成氯化银沉淀和硝酸,化学方程式为:
HCl+AgNO =HNO +AgCl↓。
3 3
故答案为:(1)CO ;
2
(2)HCl+AgNO =HNO +AgCl↓。
3 3
在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系
推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
四、(本大题共2小题,每空2分,满分18分)
22.(6分)实验室里现有氯酸钾,二氧化锰、过氧化氢溶液,以及下列仪器:
(1)请写出标号 的仪器名称 水槽 。
(2)利用上述仪⑦器和药品可以制取O
2
,你选择的药品是 氯酸钾和二氧化锰 ,不需
要选择的仪器是 和 (填序号)。
① ④(1)标号 的仪器名称是水槽;
(2)可以⑦通过 组装成实验室制取氧气的实验装置,该装置属于固、固
加热型,试管口②没③有⑤棉花⑥,⑦适⑧合用氯酸钾和二氧化锰混合加热制取氧气;不需要的仪器
有: 和 。
故答①案为:④
(1)水槽;
(2)氯酸钾和二氧化锰; 和 。
本题主要考查了实验室气体①的制④取,熟练掌握气体的制取原理,了解确定发生装置、收
集装置的因素和注意事项等知识是解答本题的关键。
23.在学习复分解反应发生的条件后,同学们利用已学知识,对稀硫酸与下表中的四种化
合物的溶液之间能否发生反应作出判断,并进行实验验证:
物质 NaOH溶液 NaCl溶液 K CO 溶液 Ba(NO ) 溶液
2 3 3 2
能否反应 能 不能 能 能
实验现象 无明显现象 无明显现象 产生气泡 产生白色沉淀
(1)判断NaOH溶液与稀硫酸能发生反应的依据是生成物中有 硫酸钠 生成。
【提出问题】对于没有明显现象的反应,如何设计实验进行证明?
【设计实验】在老师的指导下,同学们向少量稀硫酸中逐滴加入过量NaOH溶液,并进
行了如下分组实验:
组号 操作 实验现象 结论
1 用pH试纸测定实验前后溶液的 pH由1变至9 能反应
pH
2 向反应后的溶液中加入适量Ba 溶液产生白色沉淀 不能反应
(NO ) 溶液
3 2
3 向反应后的溶液中加入适量 能反应
K CO 溶液
2 3
(2)若开始时将pH试纸用蒸馏水润湿。则测得的稀硫酸的pH将 偏大 (填“偏
大”、“偏小”或“不变”)。
(3)请你判断第2小组同学得出的结论是否正确,井说明理由 不正确,硫酸钠也可
以与硝酸钡生成硫酸钡白色沉淀 。
(4)第3小组的实验现象为 无明显现象 。
【实验结论】对于无明显现象的反应,我们可以分析比较反应物和生成物的性质,从多
个角度设计实验进行证明。【实验反思】向NaOH溶液中通入少量CO .再向其中加入 稀盐酸 ,有气泡产生,
2
即可证明NaOH与CO 发生了反应。
2
【拓展提升】稀硫酸与NaCl溶液不能发生反应,请你设计实验进行证明 取混合后溶
液,加入少量碳酸钠,有气泡产生,然后再加入氯化钡溶液,有白色固体产生 (写出
实验操作与现象)。
(1)氢氧化钠和稀硫酸反应生成硫酸钠和水,水本身存在,因此需要通过生成物中有
硫酸钠的存在,从而验证反应的发生;
故答案为:硫酸钠。
(2)pH试纸被蒸馏水湿润后,再滴加硫酸,相当于将硫酸稀释,溶液氢离子浓度降低,
因此测得pH偏大;
故答案为:偏大。
(3)硫酸根与硝酸钡反应生成硫酸钡沉淀,因此不管反应是否发生,溶液中都存在硫
酸根,产生沉淀,因此无法得出是否发生反应;
故答案为:不正确,硫酸钠也可以与硝酸钡生成硫酸钡白色沉淀。
(4)少量稀硫酸加入过量氢氧化钠后,溶液中存在硫酸钠和氢氧化钠,加入碳酸钾不
会发生反应,因此无明显现象发生;
故答案为:无明显现象。
【实验反思】根据实验结论氢氧化钠与二氧化碳发生了反应,则有碳酸钠存在,碳酸钠
可与稀盐酸反应生成二氧化碳,看到气泡,则证明二氧化碳与氢氧化钠发生了反应;
故答案为:稀盐酸。
【拓展提升】稀硫酸和氯化钠不发生反应,则存在硫酸,因此可以根据硫酸与碳酸钠反
应生成硫酸钠、水和二氧化碳的性质,观察有无气泡证明氢离子的存在,加入氯化钡溶
液,硫酸根与钡离子生成硫酸钡沉淀,证明硫酸根存在,从而结合两者现象证明含有硫
酸;
故答案为:取混合后溶液,加入少量碳酸钠,有气泡产生,然后再加入氯化钡溶液,有
白色固体产生。
在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
五、(本大题共1小题,共6分)可能用到的相对原子质量:H-1O-16Na-23S-32
24.(6分)为了测定某小苏打样品中碳酸氢钠的质量分数,小兰同学进行了如下实验:
向盛有10g样品的烧杯中加入稀硫酸,恰好完全反应时,加入稀硫酸的质量为 90g,反
应后烧杯内物质的总质量为95.6g。(杂质不溶于水也不与酸发生反应)已知反应的化学方程式如下:2NaHCO +H SO ═Na SO +2CO ↑+2H O
3 2 4 2 4 2 2
(1)该反应生成二氧化碳的质量为 4. 4 g。
(2)求该样品中碳酸氢钠的质量分数(写出计算过程)。
(1)该反应生成二氧化碳的质量为:10g+90g﹣95.6g=4.4g。
故填:4.4。
(2)设碳酸氢钠质量为x,
2NaHCO +H SO ═Na SO +2CO ↑+2H O,
3 2 4 2 4 2 2
168 88
x 4.4g
= ,
x=8.4g,
该样品中碳酸氢钠的质量分数是: ×100%=84%,
答:该样品中碳酸氢钠的质量分数是84%。
本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确
性。