文档内容
2022年山东省济宁市中考化学试卷
一、选择题:下列各题只有一个正确选项。其中,1~4小题各1分,5~10小题各2分,
本大题共16分。
1.(1分)“早起开门七件事,柴米油盐酱醋茶”。家庭生活中厨房常备的花生油、食盐、
食醋、蔗糖等物质,属于无机物的是( )
A.花生油 B.食盐 C.食醋 D.蔗糖
2.(1分)下列现象或事实,一定发生化学变化的是( )
A.固体石蜡受热融化
B.酒精与水混合后总体积减小
C.块状生石灰受潮粉化
D.浓硫酸敞口放置质量增加
3.(1分)下列四组物质中,同一种元素的化合价都相同的是( )
A.NO 、N O B.Na O、Na O
2 2 4 2 2 2
C.Fe(OH) 、Fe(OH) D.KClO 、KClO
2 3 3 4
4.(1分)用化学方程式对下列事实作出的解释,错误的是( )
A.铝制品有良好的耐腐蚀性4Al+3O ═2Al O
2 2 3
点燃
B.铁制品在潮湿环境中锈蚀3Fe+2O 2 ¯ Fe 3 O 4
❑
C.氢氧化钠溶液因敞口放置发生变质2NaOH+CO ═Na CO +H O
2 2 3 2
D.碳酸氢铵因储存不当肥效降低NH HCO ═CO ↑+NH ↑+H O
4 3 2 3 2
5.(2分)对下面实验过程及实验现象的解释与评价,错误的是( )
选项 实验过程及实验现象 解释与评
价
A 品红在热水中比在冷水中 温度越
扩散速度快 高,分子
运动速率
越大
B 双氧水中加入少量二氧化 二氧化锰
锰,迅速产生大量气泡 能加快双
(O ) 氧水的分
2
解速率,
为催化剂
C 收集满二氧化碳气体的塑 二氧化碳
料瓶,迅速倒入一定量的 能溶于水
第1页(共24页)
学科网(北京)股份有限公司水,密封、振荡,塑料瓶
变瘪
D 氢氧化钠溶液中滴加稀盐 二者没有
酸无明显现象 发生化学
反应
A.A B.B C.C D.D
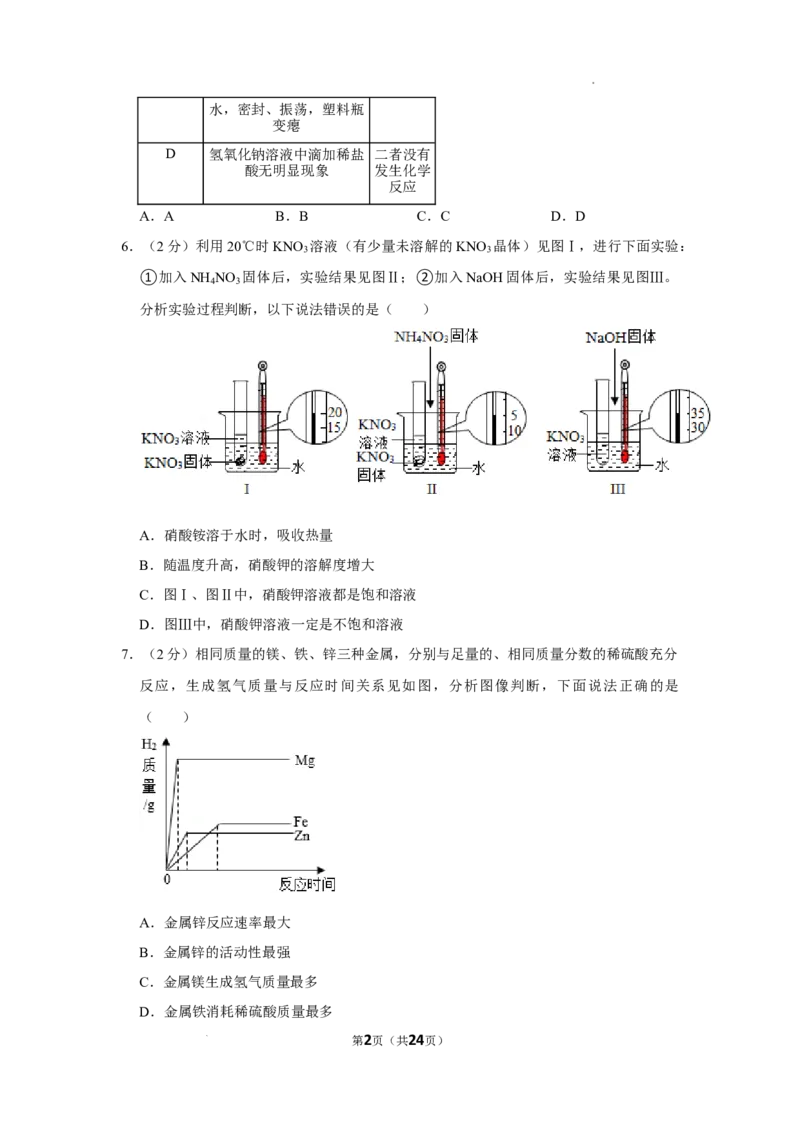
6.(2分)利用20℃时KNO 溶液(有少量未溶解的KNO 晶体)见图Ⅰ,进行下面实验:
3 3
①加入NH NO 固体后,实验结果见图Ⅱ;②加入NaOH固体后,实验结果见图Ⅲ。
4 3
分析实验过程判断,以下说法错误的是( )
A.硝酸铵溶于水时,吸收热量
B.随温度升高,硝酸钾的溶解度增大
C.图Ⅰ、图Ⅱ中,硝酸钾溶液都是饱和溶液
D.图Ⅲ中,硝酸钾溶液一定是不饱和溶液
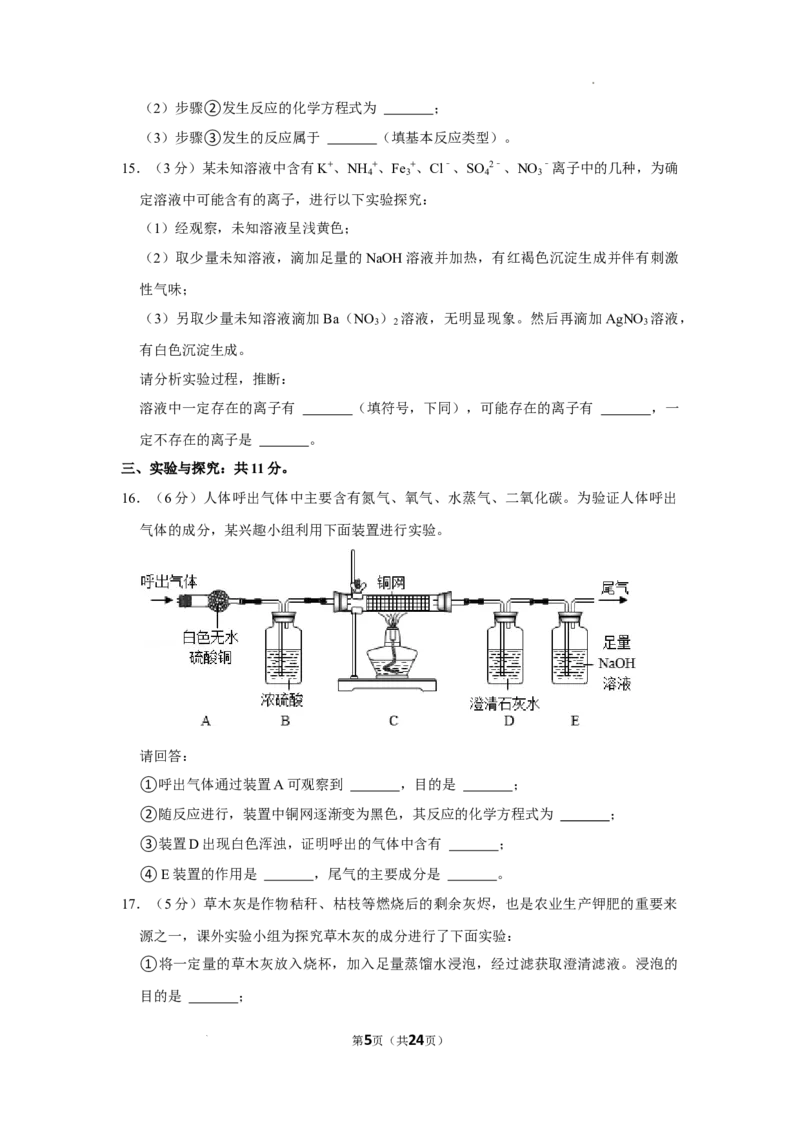
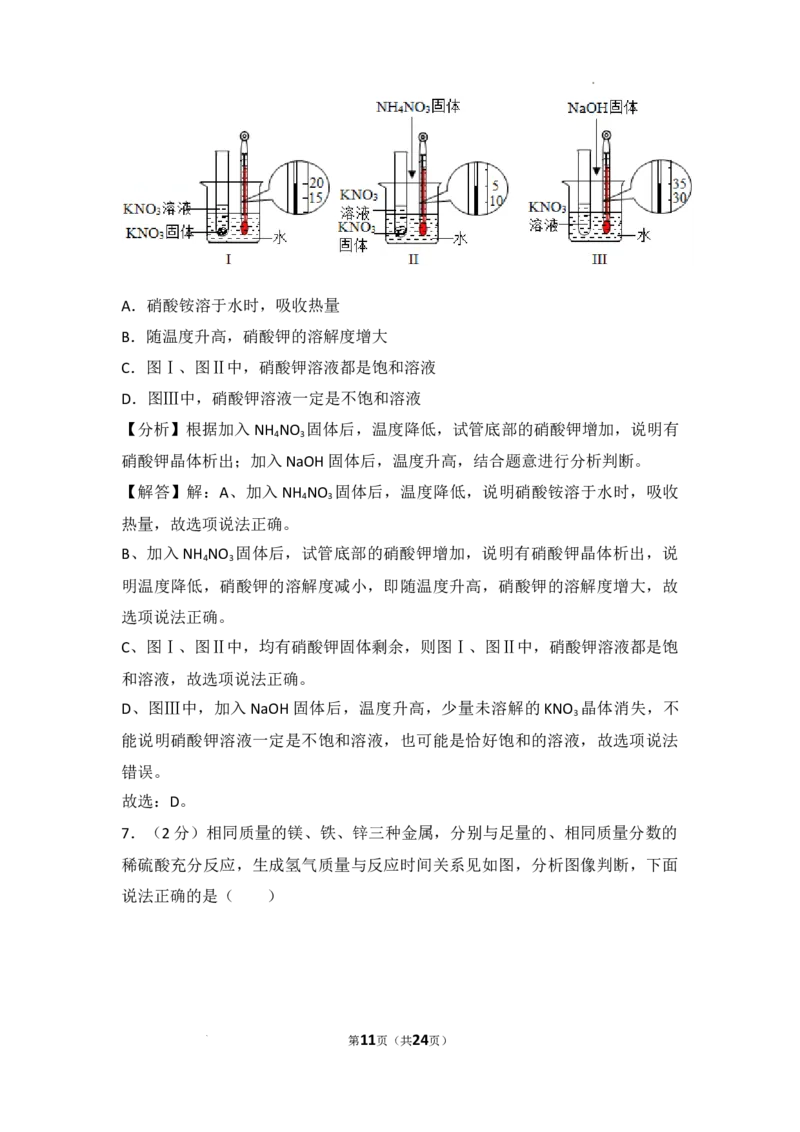
7.(2分)相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分
反应,生成氢气质量与反应时间关系见如图,分析图像判断,下面说法正确的是
( )
A.金属锌反应速率最大
B.金属锌的活动性最强
C.金属镁生成氢气质量最多
D.金属铁消耗稀硫酸质量最多
第2页(共24页)
学科网(北京)股份有限公司8.(2分)下列物质间转化仅通过一步化学反应就能实现的是( )
稀H SO
A.Cu 2 4CuSO
→ 4
Na CO
2 3
B.SiO → Na SiO
2 2 3
高温
NaNO
C.KCl 3KNO
→ 3
MgCl
D.BaSO 2MgSO
4 → 4
9.(2分)某溶液中大量存在着四种离子。对这四种离子的判断,正确的是( )
A.K+、Cu +、SO 2﹣、NO ﹣ B.H+、Ca +、Cl﹣、OH﹣
2 4 3 2
C.Fe +、Na+、OH﹣、SO 2﹣ D.H+、Ag+、CO 2﹣、NO ﹣
3 4 3 3
10.(2分)某白色固体是由NaCl、MgCl 、BaCl 和NaOH中的一种或几种物质组成。为
2 2
确定其成分,进行实验:取样品放入烧杯,加入足量的水,搅拌、静置,烧杯底部有白
色不溶物;取上层清液,滴加足量稀硫酸,出现白色沉淀,滴加稀硝酸后,沉淀未溶解。
下面对白色固体混合物组成的判断,正确的是( )
A.一定同时含有NaCl、MgCl 、BaCl 、NaOH
2 2
B.一定含有MgCl 、BaCl 、NaOH,不含有NaCl
2 2
C.一定含有MgCl 、BaCl 、NaOH,可能含有NaCl
2 2
D.一定含有MgCl 、BaCl ,可能含有NaCl、NaOH
2 2
二、填空与简答:共17分
11.(4分)以氯元素为例,按要求用符号回答下面问题:
(1)氯元素的元素符号 ;
(2)由氯元素组成气体单质的化学式 ;
(3)由氯元素组成的一种酸的化学式 ;
(4)由氯元素组成的一种盐的化学式 。
12.(3分)如表是三种原子的基本构成,请根据表中信息回答:
名称 符号 质子数 中子数 最外层电子数
碳﹣12 C﹣12 6 6 4
碳﹣13 C﹣13 6 7 4
碳﹣14 C﹣14 6 8 4
(1)这三种原子都属于 (填名称);
第3页(共24页)
学科网(北京)股份有限公司(2)决定元素种类的是 ,决定元素化学性质的是 (填序号)。
①质子数
②中子数
③质子数和中子数
④最外层电子数
13.(3分)饼干口感独特、舒适爽口,深受同学们喜爱,某同学准备用饼干作午餐,请
回答:
(1)饼干的营养素中富含蛋白质的是 ,富含糖类的是 (填序号);
①新鲜鸡蛋
②精选小麦粉
③优质奶粉
④优质花生油
(2)从摄入营养素均衡的角度分析,他还应该补充 等营养成分。
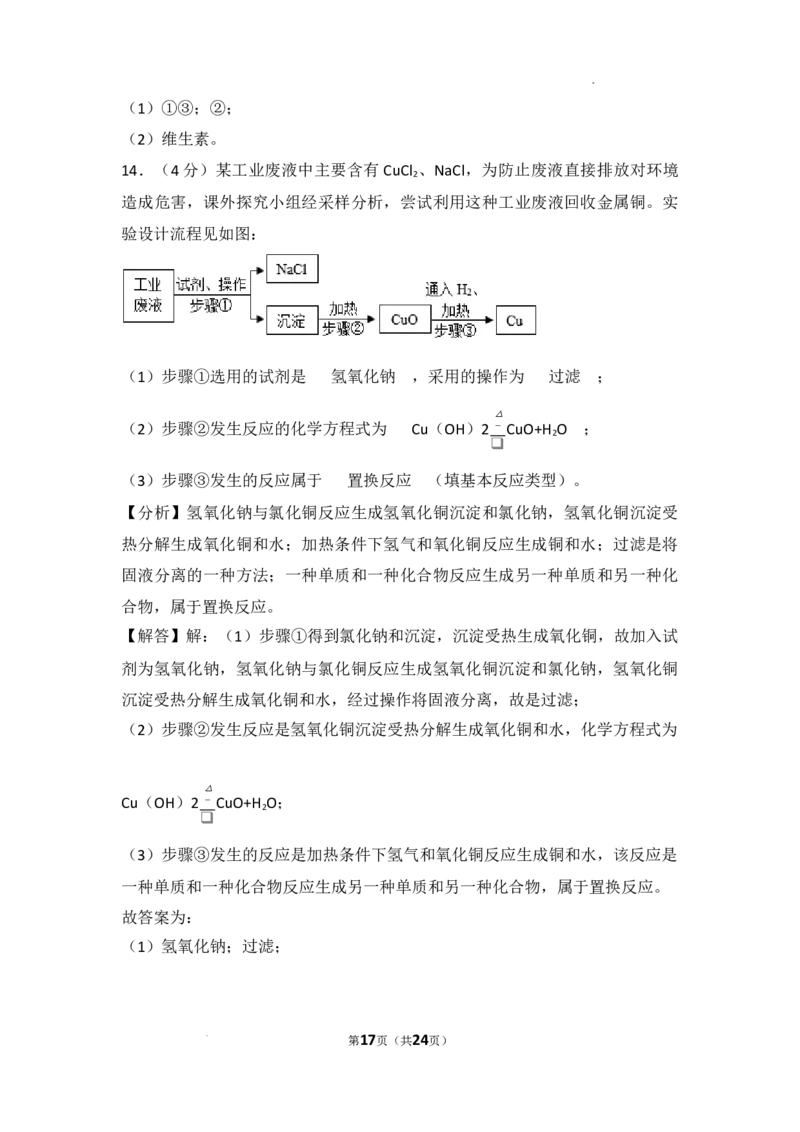
14.(4分)某工业废液中主要含有CuCl 、NaCl,为防止废液直接排放对环境造成危害,
2
课外探究小组经采样分析,尝试利用这种工业废液回收金属铜。实验设计流程见如图:
(1)步骤①选用的试剂是 ,采用的操作为 ;
第4页(共24页)
学科网(北京)股份有限公司(2)步骤②发生反应的化学方程式为 ;
(3)步骤③发生的反应属于 (填基本反应类型)。
15.(3分)某未知溶液中含有K+、NH +、Fe +、Cl﹣、SO 2﹣、NO ﹣离子中的几种,为确
4 3 4 3
定溶液中可能含有的离子,进行以下实验探究:
(1)经观察,未知溶液呈浅黄色;
(2)取少量未知溶液,滴加足量的NaOH溶液并加热,有红褐色沉淀生成并伴有刺激
性气味;
(3)另取少量未知溶液滴加Ba(NO ) 溶液,无明显现象。然后再滴加AgNO 溶液,
3 2 3
有白色沉淀生成。
请分析实验过程,推断:
溶液中一定存在的离子有 (填符号,下同),可能存在的离子有 ,一
定不存在的离子是 。
三、实验与探究:共11分。
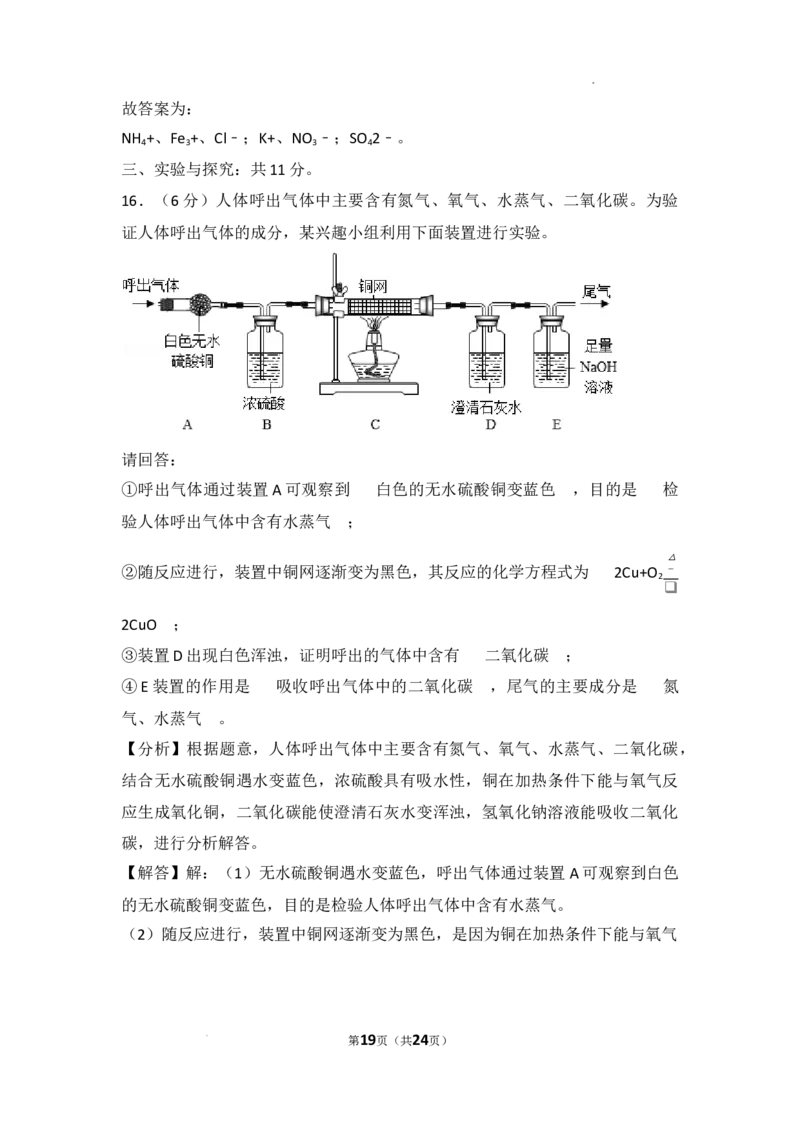
16.(6分)人体呼出气体中主要含有氮气、氧气、水蒸气、二氧化碳。为验证人体呼出
气体的成分,某兴趣小组利用下面装置进行实验。
请回答:
①呼出气体通过装置A可观察到 ,目的是 ;
②随反应进行,装置中铜网逐渐变为黑色,其反应的化学方程式为 ;
③装置D出现白色浑浊,证明呼出的气体中含有 ;
④E装置的作用是 ,尾气的主要成分是 。
17.(5分)草木灰是作物秸秆、枯枝等燃烧后的剩余灰烬,也是农业生产钾肥的重要来
源之一,课外实验小组为探究草木灰的成分进行了下面实验:
①将一定量的草木灰放入烧杯,加入足量蒸馏水浸泡,经过滤获取澄清滤液。浸泡的
目的是 ;
第5页(共24页)
学科网(北京)股份有限公司②取少量上述滤液,滴加氯化钡试剂,有白色沉淀生成,初步判定滤液中可能含有
(填符号);继续滴加稀盐酸,沉淀全部溶解,将产生的气体通入澄清石灰水出现白色
浑浊。分析实验可知,草木灰提供钾肥的主要成分是 (填化学式);
③已知滤液呈碱性,请设计实验证明:
实验步骤 现象与结论
四、分析与计算:共6分。
18.(2分)我们在享受夏日阳光的同时还饱受蚊虫的侵扰。为此,不少家庭都备有杀虫
剂,其中最常用的是气雾剂,这些气雾剂中往往含有二甲醚(化学式为C H O)。
2 6
请回答:
(1)二甲醚的相对分子质量为 ;
(2)二甲醚中C、H、O三种元素的质量比为 。
19.(4分)为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯中倒入 50g
废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数据见如表:
第一组 第二组 第三组
反应前加入铁粉质量/g 5.6 8.4 11.2
反应后剩余固体的质 3.2 3.2 6.0
量/g
反应后质量(H )损 0.1 0.2 0.2
2
失/g
请回答:
(1)对比第一、二组数据,第一组实验结束后,废液中的 (填化学式)已全
部参加反应;
(2)通过分析第二、三组数据,50g废液与铁粉反应生成氢气质量最多为 ;
(3)经计算,50g废液中所含硫酸的质量为 ,硫酸铜的质量分数为 。
第6页(共24页)
学科网(北京)股份有限公司第7页(共24页)
学科网(北京)股份有限公司2022年山东省济宁市中考化学试卷
参考答案与试题解析
一、选择题:下列各题只有一个正确选项。其中,1~4小题各1分,5~10小
题各2分,本大题共16分。
1.(1分)“早起开门七件事,柴米油盐酱醋茶”。家庭生活中厨房常备的花
生油、食盐、食醋、蔗糖等物质,属于无机物的是( )
A.花生油 B.食盐 C.食醋 D.蔗糖
【分析】根据有机化合物是含有碳元素的化合物,简称有机物;无机化合物是
不含碳元素的化合物;碳的氧化物、碳酸盐、碳酸虽含碳元素,但其性质与无
机物类似,因此把它们看作是无机物;进行分析判断。
【解答】解:A、花生油的主要成分是不饱和脂肪酸,另外还含有软脂酸、硬脂
酸等,属于混合物,不属于有机物,故选项错误。
B、食盐是氯化钠的俗称,是不含碳元素的化合物,属于无机物,故选项正确。
C、食醋的主要成分是醋酸,还含有水等,属于混合物,不属于有机物,故选项
错误。
D、蔗糖是含碳元素的化合物,属于有机物,故选项错误。
故选:B。
2.(1分)下列现象或事实,一定发生化学变化的是( )
A.固体石蜡受热融化
B.酒精与水混合后总体积减小
C.块状生石灰受潮粉化
D.浓硫酸敞口放置质量增加
【分析】有新物质生成的变化叫化学变化;没有新物质生成的变化叫物理变化。
化学变化的特征是:有新物质生成。判断物理变化和化学变化的依据是:是否
有新物质生成。
【解答】解:A、固体石蜡受热融化,只是状态的改变,没有新物质生成,属于
物理变化,故A错误;
B、酒精与水混合后总体积减小,没有新物质生成,属于物理变化,故B错误;
C、块状生石灰受潮粉化是生石灰与水反应生成氢氧化钙,氢氧化钙是新物质,
属于化学变化,故C正确;
第8页(共24页)
学科网(北京)股份有限公司D、浓硫酸敞口放置质量增加是浓硫酸吸水,没有新物质生成,属于物理变化,
故D错误;
故选:C。
3.(1分)下列四组物质中,同一种元素的化合价都相同的是( )
A.NO 、N O B.Na O、Na O
2 2 4 2 2 2
C.Fe(OH)2、Fe(OH)3 D.KClO 、KClO
3 4
【分析】根据常见元素在化合物中的化合价、化合物中各元素正负化合价的代
数和为0来计算各组物质中同种元素的化合价,若相同的即为答案.
【解答】解:A、在化合物中氧元素显﹣2价,则NO 中氮元素显+4价;N O 中
2 2 4
氮元素也显+4价,符合题意;
B、Na O中,钠元素显+1价,氧元素显﹣2价;Na O 中,钠元素显+1价,氧元
2 2 2
素显﹣1价,不合题意;
C、氢氧根显﹣1价,则Fe(OH)2中,铁元素显+2价,Fe(OH)3中,铁元素
显+3价,不合题意;
D、在化合物中,钾元素显+1价,氧元素显﹣2价,则KClO 中,氯元素显+5价,
3
KClO 中,钾元素显+7价,不合题意。
4
故选:A。
4.(1分)用化学方程式对下列事实作出的解释,错误的是( )
A.铝制品有良好的耐腐蚀性4Al+3O ═2Al O
2 2 3
点燃
B.铁制品在潮湿环境中锈蚀3Fe+2O 2 ¯ Fe 3 O 4
❑
C.氢氧化钠溶液因敞口放置发生变质2NaOH+CO ═Na CO +H O
2 2 3 2
D.碳酸氢铵因储存不当肥效降低NH HCO ═CO ↑+NH ↑+H O
4 3 2 3 2
【分析】根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学
式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确。
【解答】解:A、该化学方程式书写完全正确,故选项错误。
B、铁制品在潮湿环境中锈蚀,是因为铁跟空气中的氧气、水蒸气共同作用生成
铁锈,铁锈的主要成分是氧化铁,其化学式为Fe O ,故选项正确。
2 3
C、该化学方程式书写完全正确,故选项错误。
第9页(共24页)
学科网(北京)股份有限公司D、该化学方程式书写完全正确,故选项错误。
故选:B。
5.(2分)对下面实验过程及实验现象的解释与评价,错误的是( )
选项 实验过程及实验现象 解释与评价
A 品红在热水中比在冷水中扩散速度快 温度越高,分子运动速率越大
B 双氧水中加入少量二氧化锰,迅速产生大量二氧化锰能加快双氧水的分解
气泡(O ) 速率,为催化剂
2
C 收集满二氧化碳气体的塑料瓶,迅速倒入一二氧化碳能溶于水
定量的水,密封、振荡,塑料瓶变瘪
D 氢氧化钠溶液中滴加稀盐酸无明显现象 二者没有发生化学反应
A.A B.B C.C D.D
【分析】A、根据分子的基本性质,进行分析判断。
B、根据催化剂的特征,进行分析判断。
C、根据二氧化碳的物理性质,进行分析判断。
D、根据中和反应的原理,进行分析判断。
【解答】解:A、品红在热水中比在冷水中扩散速度快,是因为热水中温度高,
温度越高,分子运动速率越大,故选项说法正确。
B、双氧水中加入少量二氧化锰,迅速产生大量气泡,说明二氧化锰能加快双氧
水的分解速率,为催化剂,故选项说法正确。
C、收集满二氧化碳气体的塑料瓶,迅速倒入一定量的水,密封、振荡,塑料瓶
变瘪,说明二氧化碳能溶于水,使瓶内压强减小,故选项说法正确。
D、氢氧化钠溶液中滴加稀盐酸无明显现象,不能说明二者没有发生化学反应,
事实上氢氧化钠和盐酸反应生成氯化钠和水,无明显现象,故选项说法错误。
故选:D。
6.(2分)利用20℃时KNO 溶液(有少量未溶解的KNO 晶体)见图Ⅰ,进行
3 3
下面实验:①加入NH NO 固体后,实验结果见图Ⅱ;②加入 NaOH固体后,实
4 3
验结果见图Ⅲ。分析实验过程判断,以下说法错误的是( )
第10页(共24页)
学科网(北京)股份有限公司A.硝酸铵溶于水时,吸收热量
B.随温度升高,硝酸钾的溶解度增大
C.图Ⅰ、图Ⅱ中,硝酸钾溶液都是饱和溶液
D.图Ⅲ中,硝酸钾溶液一定是不饱和溶液
【分析】根据加入NH NO 固体后,温度降低,试管底部的硝酸钾增加,说明有
4 3
硝酸钾晶体析出;加入NaOH固体后,温度升高,结合题意进行分析判断。
【解答】解:A、加入NH NO 固体后,温度降低,说明硝酸铵溶于水时,吸收
4 3
热量,故选项说法正确。
B、加入NH NO 固体后,试管底部的硝酸钾增加,说明有硝酸钾晶体析出,说
4 3
明温度降低,硝酸钾的溶解度减小,即随温度升高,硝酸钾的溶解度增大,故
选项说法正确。
C、图Ⅰ、图Ⅱ中,均有硝酸钾固体剩余,则图Ⅰ、图Ⅱ中,硝酸钾溶液都是饱
和溶液,故选项说法正确。
D、图Ⅲ中,加入NaOH固体后,温度升高,少量未溶解的KNO 晶体消失,不
3
能说明硝酸钾溶液一定是不饱和溶液,也可能是恰好饱和的溶液,故选项说法
错误。
故选:D。
7.(2分)相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的
稀硫酸充分反应,生成氢气质量与反应时间关系见如图,分析图像判断,下面
说法正确的是( )
第11页(共24页)
学科网(北京)股份有限公司A.金属锌反应速率最大
B.金属锌的活动性最强
C.金属镁生成氢气质量最多
D.金属铁消耗稀硫酸质量最多
【分析】A、根据金属的活动性越强,与酸反应的速率越快,进行分析判断。
B、根据金属的活动性越强,与酸反应的速率越快,进行分析判断。
C、根据纵坐标表示生成氢气的质量,进行分析判断。
D、根据质量守恒定律,生成的氢气中氢元素的质量来自于硫酸中氢元素的质
量,进行分析判断。
【解答】解:A、由图象可知,至完全反应,镁用的时间最短,则金属镁反应速
率最大,故选项说法错误。
B、由图象可知,至完全反应,镁用的时间最短,则金属镁的活动性最强,故选
项说法错误。
C、纵坐标表示生成氢气的质量,则金属镁生成氢气质量最多,故选项说法正确。
D、由质量守恒定律,生成的氢气中氢元素的质量来自于硫酸中氢元素的质量,
金属镁与稀硫酸反应生成氢气质量最多,则金属镁消耗稀硫酸质量最多,故选
项说法错误。
故选:C。
8.(2分)下列物质间转化仅通过一步化学反应就能实现的是( )
稀H SO
A.Cu 2 4CuSO
→ 4
Na CO
2 3
B.SiO → Na SiO
2 2 3
高温
NaNO
C.KCl 3KNO
→ 3
第12页(共24页)
学科网(北京)股份有限公司MgCl
D.BaSO 2MgSO
4 → 4
【分析】一步反应实现即所涉及物质只发生一个反应即可转化为目标物质,根
据所涉及物质的性质,分析能否只通过一个反应而实现转化即可。
【解答】解:A、在金属活动性顺序中,铜的位置排在氢的后面,不能与稀硫酸
反应,故选项错误。
B、二氧化硅和碳酸钠反应生成硅酸钠和二氧化碳,能通过一步化学反应实现,
故选项正确。
C、氯化钾和硝酸钠交换成分没有沉淀或气体或水生成,不能发生复分解反应,
不能通过一步化学反应实现,故选项错误。
D、硫酸钡难溶于水,不能与氯化镁发生复分解反应,不能通过一步化学反应
实现,故选项错误。
故选:B。
9.(2分)某溶液中大量存在着四种离子。对这四种离子的判断,正确的是(
)
A.K+、Cu +、SO 2﹣、NO ﹣ B.H+、Ca +、Cl﹣、OH﹣
2 4 3 2
C.Fe +、Na+、OH﹣、SO 2﹣ D.H+、Ag+、CO 2﹣、NO ﹣
3 4 3 3
【分析】根据复分解反应的条件,离子间若能互相结合成沉淀或气体或水,则
离子不能共存,据此进行分析判断即可。
【解答】解:A、四种离子间不能结合生成沉淀或气体或水,能大量共存,故选
项正确。
B、H+、OH﹣两种离子能结合生成水,不能大量共存,故选项错误。
C、Fe +、OH﹣两种离子能结合生成氢氧化铁沉淀,不能大量共存,故选项错误。
3
D、H+、CO 2﹣两种离子能结合生成水和二氧化碳,Ag+、CO 2﹣两种离子能结
3 3
合生成碳酸银沉淀,不能大量共存,故选项错误。
故选:A。
10.(2分)某白色固体是由NaCl、MgCl 、BaCl 和NaOH中的一种或几种物质
2 2
组成。为确定其成分,进行实验:取样品放入烧杯,加入足量的水,搅拌、静
置,烧杯底部有白色不溶物;取上层清液,滴加足量稀硫酸,出现白色沉淀,
滴加稀硝酸后,沉淀未溶解。
第13页(共24页)
学科网(北京)股份有限公司下面对白色固体混合物组成的判断,正确的是( )
A.一定同时含有NaCl、MgCl 、BaCl 、NaOH
2 2
B.一定含有MgCl 、BaCl 、NaOH,不含有NaCl
2 2
C.一定含有MgCl 、BaCl 、NaOH,可能含有NaCl
2 2
D.一定含有MgCl 、BaCl ,可能含有NaCl、NaOH
2 2
【分析】四种物质中,氢氧化钠和氯化镁反应生成氢氧化镁白色沉淀和氯化钠,
稀硫酸和氯化钡反应生成硫酸钡沉淀和氯化氢,据此分析。
【解答】解:取样品放入烧杯,加入足量的水,搅拌、静置,烧杯底部有白色
不溶物,则样品中含有氯化镁和氢氧化钠,取上层清液,滴加足量稀硫酸,出
现白色沉淀,滴加稀硝酸后,沉淀未溶解,说明产生的沉淀是稀硫酸和氯化钡
反应生成的硫酸钡沉淀,由此可以得出白色固体中一定含有氯化镁、氢氧化钠
和氯化钡,氯化钠没有参与反应,因此是可能含有,故选:C。
二、填空与简答:共17分
11.(4分)以氯元素为例,按要求用符号回答下面问题:
(1)氯元素的元素符号 Cl ;
(2)由氯元素组成气体单质的化学式 Cl ;
2
(3)由氯元素组成的一种酸的化学式 HCl ;
(4)由氯元素组成的一种盐的化学式 NaCl(合理即可) 。
【分析】书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由
两个字母表示的元素符号,第一个字母大写,第二个字母小写。
首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学式
的方法和步骤写出物质的化学式即可。
【解答】解:(1)书写元素符号注意“一大二小”,氯的元素符号是Cl。
(2)由氯元素组成气体单质是氯气,其化学式为Cl 。
2
(3)盐酸是由氯元素组成的一种酸,其化学式为HCl。
(4)氯化钠是由氯元素组成的一种盐,其化学式为NaCl(合理即可)。
故答案为:
(1)Cl;
(2)Cl ;
2
(3)HCl;
第14页(共24页)
学科网(北京)股份有限公司(4)NaCl(合理即可)。
12.(3分)如表是三种原子的基本构成,请根据表中信息回答:
名称 符号 质子数 中子数 最外层电子数
碳﹣12 C﹣12 6 6 4
碳﹣13 C﹣13 6 7 4
碳﹣14 C﹣14 6 8 4
(1)这三种原子都属于 碳元素 (填名称);
(2)决定元素种类的是 ① ,决定元素化学性质的是 ④ (填序号)。
①质子数
②中子数
③质子数和中子数
④最外层电子数
【分析】(1)根据这三种原子的质子数相同,均为6,进行分析解答。
(2)元素是质子数(即核电荷数)相同的一类原子的总称,元素的化学性质跟
它的原子的最外层电子数目关系非常密切,进行分析解答。
【解答】解:(1)这三种原子的质子数相同,均为 6,这三种原子都属于碳元
素。
(2)元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是
质子数(即核电荷数)。
元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,决
定元素化学性质的是最外层电子数。
故答案为:
(1)碳元素;
(2)①;④。
13.(3分)饼干口感独特、舒适爽口,深受同学们喜爱,某同学准备用饼干
作午餐,请回答:
第15页(共24页)
学科网(北京)股份有限公司(1)饼干的营养素中富含蛋白质的是 ①③ ,富含糖类的是 ② (填序
号);
①新鲜鸡蛋
②精选小麦粉
③优质奶粉
④优质花生油
(2)从摄入营养素均衡的角度分析,他还应该补充 维生素 等营养成分。
【分析】(1)根据人体所需六大营养素的种类、食物来源,结合题中所给的食
物判断所含的营养素,进行分析解答。
(2)根据人体所需六大营养素的种类、食物来源和合理膳食的原则,结合题中
所给的食谱判断所含的营养素以及缺少的营养素,进行分析解答。
【解答】解:(1)①新鲜鸡蛋中富含蛋白质。
②精选小麦粉中富含淀粉,淀粉属于糖类。
③优质奶粉中富含蛋白质。
④优质花生油中富含油脂。
(2)人体需要的六大营养物质:蛋白质、糖类、油脂、维生素、无机盐和水;
结合题意,饼干中富含淀粉,淀粉属于糖类;新鲜鸡蛋、优质奶粉、优质花生
油中含有蛋白质、油脂、无机盐,可知食物中维生素含量较少;故为使营养搭
配更加合理,需要补充富含维生素的食物。
故答案为:
第16页(共24页)
学科网(北京)股份有限公司(1)①③;②;
(2)维生素。
14.(4分)某工业废液中主要含有CuCl 、NaCl,为防止废液直接排放对环境
2
造成危害,课外探究小组经采样分析,尝试利用这种工业废液回收金属铜。实
验设计流程见如图:
(1)步骤①选用的试剂是 氢氧化钠 ,采用的操作为 过滤 ;
△
(2)步骤②发生反应的化学方程式为 Cu(OH)2 ¯ CuO+H 2 O ;
❑
(3)步骤③发生的反应属于 置换反应 (填基本反应类型)。
【分析】氢氧化钠与氯化铜反应生成氢氧化铜沉淀和氯化钠,氢氧化铜沉淀受
热分解生成氧化铜和水;加热条件下氢气和氧化铜反应生成铜和水;过滤是将
固液分离的一种方法;一种单质和一种化合物反应生成另一种单质和另一种化
合物,属于置换反应。
【解答】解:(1)步骤①得到氯化钠和沉淀,沉淀受热生成氧化铜,故加入试
剂为氢氧化钠,氢氧化钠与氯化铜反应生成氢氧化铜沉淀和氯化钠,氢氧化铜
沉淀受热分解生成氧化铜和水,经过操作将固液分离,故是过滤;
(2)步骤②发生反应是氢氧化铜沉淀受热分解生成氧化铜和水,化学方程式为
△
Cu(OH)2 ¯ CuO+H 2 O;
❑
(3)步骤③发生的反应是加热条件下氢气和氧化铜反应生成铜和水,该反应是
一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应。
故答案为:
(1)氢氧化钠;过滤;
第17页(共24页)
学科网(北京)股份有限公司△
(2)Cu(OH)2 ¯ CuO+H 2 O;
❑
(3)置换反应。
15.(3分)某未知溶液中含有K+、NH +、Fe +、Cl﹣、SO 2﹣、NO ﹣离子中
4 3 4 3
的几种,为确定溶液中可能含有的离子,进行以下实验探究:
(1)经观察,未知溶液呈浅黄色;
(2)取少量未知溶液,滴加足量的NaOH溶液并加热,有红褐色沉淀生成并伴
有刺激性气味;
(3)另取少量未知溶液滴加 Ba(NO )2 溶液,无明显现象。然后再滴加
3
AgNO 溶液,有白色沉淀生成。
3
请分析实验过程,推断:
溶液中一定存在的离子有 NH +、Fe +、Cl﹣ (填符号,下同),可能存在
4 3
的离子有 K+、NO ﹣ ,一定不存在的离子是 SO 2﹣ 。
3 4
【分析】(1)经观察,未知溶液呈浅黄色,说明溶液中含有Fe +;
3
(2)取少量未知溶液滴加足量的NaOH溶液并加热,有红褐色沉淀生成,说明
生成了氢氧化铁沉淀,则溶液中含有Fe +;并伴有刺激性气味,说明生成了氨
3
气;
(3)另取少量未知溶液滴加Ba(NO )2溶液,无明显现象,说明溶液中不含
3
硫酸根离子。然后再滴加AgNO 溶液,有白色沉淀生成,说明生成了氯化银沉
3
淀;据此进行分析解答。
【解答】解:(1)经观察,未知溶液呈浅黄色,说明溶液中含有Fe +;
3
(2)取少量未知溶液滴加足量的NaOH溶液并加热,有红褐色沉淀生成,说明
生成了氢氧化铁沉淀,则溶液中含有Fe +;并伴有刺激性气味,说明生成了氨
3
气,则说明溶液中含有NH +;
4
(3)另取少量未知溶液滴加Ba(NO )2溶液,无明显现象,说明溶液中不含
3
硫酸根离子。然后再滴加AgNO 溶液,有白色沉淀生成,说明生成了氯化银沉
3
淀,说明溶液中含有Cl﹣;无法确定K+、NO ﹣是否存在,
3
故溶液中一定存在的离子有NH +、Fe +、Cl﹣;可能存在的离子有K+、NO ﹣,
4 3 3
一定不存在的离子是SO 2﹣。
4
第18页(共24页)
学科网(北京)股份有限公司故答案为:
NH +、Fe +、Cl﹣;K+、NO ﹣;SO 2﹣。
4 3 3 4
三、实验与探究:共11分。
16.(6分)人体呼出气体中主要含有氮气、氧气、水蒸气、二氧化碳。为验
证人体呼出气体的成分,某兴趣小组利用下面装置进行实验。
请回答:
①呼出气体通过装置A可观察到 白色的无水硫酸铜变蓝色 ,目的是 检
验人体呼出气体中含有水蒸气 ;
△
②随反应进行,装置中铜网逐渐变为黑色,其反应的化学方程式为 2Cu+O 2 ¯
❑
2CuO ;
③装置D出现白色浑浊,证明呼出的气体中含有 二氧化碳 ;
④E装置的作用是 吸收呼出气体中的二氧化碳 ,尾气的主要成分是 氮
气、水蒸气 。
【分析】根据题意,人体呼出气体中主要含有氮气、氧气、水蒸气、二氧化碳,
结合无水硫酸铜遇水变蓝色,浓硫酸具有吸水性,铜在加热条件下能与氧气反
应生成氧化铜,二氧化碳能使澄清石灰水变浑浊,氢氧化钠溶液能吸收二氧化
碳,进行分析解答。
【解答】解:(1)无水硫酸铜遇水变蓝色,呼出气体通过装置 A可观察到白色
的无水硫酸铜变蓝色,目的是检验人体呼出气体中含有水蒸气。
(2)随反应进行,装置中铜网逐渐变为黑色,是因为铜在加热条件下能与氧气
第19页(共24页)
学科网(北京)股份有限公司△
反应生成氧化铜,反应的化学方程式为2Cu+O
2 ¯
2CuO。
❑
(3)二氧化碳能使澄清石灰水变浑浊,装置D出现白色浑浊,证明呼出的气体
中含有二氧化碳。
(4)二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,E装置的作用是吸收呼
出气体中的二氧化碳,同时会带出水蒸气,尾气的主要成分是氮气和水蒸气。
故答案为:
(1)白色的无水硫酸铜变蓝色;检验人体呼出气体中含有水蒸气;
△
(2)2Cu+O
2 ¯
2CuO;
❑
(3)二氧化碳;
(4)吸收呼出气体中的二氧化碳;氮气、水蒸气。
17.(5分)草木灰是作物秸秆、枯枝等燃烧后的剩余灰烬,也是农业生产钾
肥的重要来源之一,课外实验小组为探究草木灰的成分进行了下面实验:
①将一定量的草木灰放入烧杯,加入足量蒸馏水浸泡,经过滤获取澄清滤液。
浸泡的目的是 将可溶性的物质全部溶解 ;
②取少量上述滤液,滴加氯化钡试剂,有白色沉淀生成,初步判定滤液中可能
含有 CO 2﹣ (填符号);继续滴加稀盐酸,沉淀全部溶解,将产生的气体
3
通入澄清石灰水出现白色浑浊。分析实验可知,草木灰提供钾肥的主要成分是
K CO (填化学式);
2 3
③已知滤液呈碱性,请设计实验证明:
实验步骤 现象与结论
取滤液加入试管,滴加无色酚酞试 溶液变为红色,滤液显碱性
液
【分析】①根据过滤的要求分析回答此题;
②根据实验现象和碳酸根离子的性质分析回答此题;
③根据酸碱指示剂变色规律设计实验。
【解答】解:①过滤需要将可溶性物质与不溶性物质分开,加入足量的蒸馏水,
将可溶性物质完全溶解,使过滤充分完成;
故答案为:将可溶性的物质全部溶解。
第20页(共24页)
学科网(北京)股份有限公司②此时加入氯化钡产生白色沉淀,而植物含有碳元素,因此推断此时为碳酸钡
沉淀,所以含有碳酸根离子;白色沉淀加入稀盐酸产生能使澄清石灰水变浑浊
的气体,说明沉淀为碳酸钙,而此时草木灰属于含有钾盐,则钾肥主要成分为
碳酸钾;
故答案为:CO 2﹣;K CO 。
3 2 3
③碱性溶液加入无色酚酞试剂后,溶液变红,即可证明其显碱性;
故答案为:取滤液加入试管,滴加无色酚酞试液;溶液变为红色,滤液显碱性。
四、分析与计算:共6分。
18.(2分)我们在享受夏日阳光的同时还饱受蚊虫的侵扰。为此,不少家庭
都备有杀虫剂,其中最常用的是气雾剂,这些气雾剂中往往含有二甲醚(化学
式为C H O)。
2 6
请回答:
(1)二甲醚的相对分子质量为 46 ;
(2)二甲醚中C、H、O三种元素的质量比为 12:3:8 。
【分析】(1)相对分子质量为构成分子的各原子的相对原子质量之和;
(2)化合物中各元素质量比=各原子的相对原子质量×原子个数之比。
【解答】解:(1)二甲醚的相对分子质量是 12×2+1×6+16=46;故答案为:
46;
(2)二甲醚中碳、氢、氧元素的质量比为(12×2):(1×6):(16×1)=
12:3:8,故答案为:12:3:8。
19.(4分)为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯
中倒入50g废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数
据见如表:
第21页(共24页)
学科网(北京)股份有限公司第一组 第二组 第三组
反应前加入铁粉质 5.6 8.4 11.2
量/g
反应后剩余固体的 3.2 3.2 6.0
质量/g
反应后质量(H )损 0.1 0.2 0.2
2
失/g
请回答:
(1)对比第一、二组数据,第一组实验结束后,废液中的 CuSO (填化学
4
式)已全部参加反应;
(2)通过分析第二、三组数据,50g 废液与铁粉反应生成氢气质量最多为
0.2g ;
(3)经计算,50g废液中所含硫酸的质量为 9.8g ,硫酸铜的质量分数为
16% 。
【分析】根据表格数据可知,第一组中加入 5.6g铁粉,生成0.1g氢气,剩余固
体的质量为3.2g;第二组中加入8.4g铁粉,生成0.2g氢气,剩余固体的质量为
3.2g,说明废液中的硫酸铜已完全反应;第三组加入 11.2g铁粉,生成0.2g氢气;
说明50g废液的稀硫酸能与铁粉反应生成0.2g氢气,进行分析解答。
【解答】解:(1)对比第一、二组数据,第一组中加入5.6g铁粉,生成0.1g
氢气,剩余固体的质量为3.2g;第二组中加入8.4g铁粉,生成0.2g氢气,剩余
固体的质量为3.2g;第一组、第二组实验结束后,剩余固体的质量相等,说明
第一组实验结束后,废液中的CuSO 已全部参加反应,生成铜的质量为3.2g。
4
(2)第二组中加入 8.4g铁粉,生成 0.2g氢气;第三组加入 11.2g铁粉,生成
0.2g氢气;通过分析第二、三组数据,50g废液与铁粉反应生成氢气质量最多
为0.2g。
(3)设参加反应的硫酸的质量为x,参加反应的硫酸铜的质量为y,
Fe+H SO ═FeSO +H ↑
2 4 4 2
98 2
x 0.2g
98 x
= x=9.8g
2 0.2g
第22页(共24页)
学科网(北京)股份有限公司Fe+CuSO ═FeSO +Cu
4 4
160 64
y 3.2g
160 y
= y=8g
64 3.2g
8g
硫酸铜的质量分数为 ×100%=16%。
50g
故答案为:(1)CuSO ;
4
(2)0.2g;
(3)9.8g;16%。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布日期:2022/7/20 17:06:21;用户:柯雨彤;邮箱:18898696593;学号:41112623
第23页(共24页)
学科网(北京)股份有限公司第24页(共24页)
学科网(北京)股份有限公司